„Vanishing bile duct syndróm“ ako prejav poliekového poškodenia pečene u pacienta po polytraume
Lucia Horniaková1, Miroslav Žigrai2, Silvia Žigraiová2, Xénia Faktorová2, Světlana Adamcová-Selčanová3, Roman Belica2, D. Guga2, Milan Vyskočil Orcid.org 2
+ Pracoviště
Souhrn
Syndróm miznúcich žlčovodov je typ liekmi indukovaného cholestatického poškodenia pečene, ktoré vzniká pri vystavení organizmu liekmi či inými cudzími látkami. 44-ročného, doteraz zdravého muža po ťažšej polytraume s užívaním komplexnej liečby (antibiotiká, antimykotiká, parenterálna výživa, LMWH), sme hospitalizovali pre postupne vzniknutý nebolestivý ikterus a pruritus celého tela. Laboratórnym vyšetrením sme zistili niekoľkonásobne zvýšenú hladinu celkového aj konjugovaného bilirubínu s 3-násobným zvýšením hladín ALP, bez výraznej elevácie transamináz, s poklesom protrombínového času a pozitivitou IgG4 protilátok. MRCP zobrazila nepravidelné intrahepatálne žlčové cesty, dilatovaný d. hepatocholedochus, s obrazom primárnej, resp. sekundárnej sklerotizujúcej cholangitídy. Vyšetreniami sme vylúčili infekčnú, metabolickú, toxickú a onkologickú etiológiu hepatopatie. Biopsia pečene vylúčila autoimunitnú hepatitídu aj IgG4 hepatopatiu a zobrazila „vanishing bile duct syndrome“ pri liekmi indukovanom poškodení pečene (DILI). Empirická liečba vysokými dávkami N-acetylcysteínom intravenózne a hepatoprotektívami viedla k postupnému poklesu bilirubínu, normalizácii koagulačných parametrov, ústupu ikteru a klinických ťažkostí. Kazuistika poukazuje na cholestatický typ poliekového poškodenia so syndrómom miznúcich žlčovodov potvrdený histologicky, a potrebu myslieť na DILI ako jednu z príčin inak neobjasnenej hepatopatie.
Klíčová slova
cholangitida, DILI, hepatopatia, IgG4, syndróm miznúcich žlčovodov
Úvod
Poliekové poškodenie pečene (drug induced liver injury – DILI) predstavuje nepredvídateľnú a potenciálne nebezpečnú nepriaznivú reakciu vyvolanú liekmi či inými cudzími látkami, ktorá môže vzniknúť pri vystavení organizmu toxickým dávkam určitého lieku, alebo ako idiosynkratická reakcia nezávislá od dávky [1].
Odhadovaná celosvetová ročná incidencia DILI sa pohybuje medzi 1,3 až 19,1 na 100 000 exponovaných osôb, pričom zodpovedá za približne 10 % všetkých prípadov akútnej hepatitídy [2]. Neexistujú jednoznačné rizikové faktory spájané so vznikom DILI, avšak predisponujúcimi faktormi môžu byť napríklad početné genetické polymorfizmy v izoenzýmoch CYP, určité HLA alely, abúzus alkoholu či poškodený parenchým pečene pri vírusových hepatitídach, steatóze a fibróze pečene. V závislosti od dĺžky pôsobenia toxickej noxy a histologickej lokalizácie je možno pečeňové poškodenie pri DILI deliť na akútne a chronické. Toxické látky a lieky môžu spôsobovať hepatocelulárne, cholestatické alebo kombinované poškodenie pečene. K vzniku DILI dochádza buď v dôsledku priamej toxicity podanej látky a jej metabolitov, alebo vplyvom imunologických mechanizmov. K najznámejším liekom spôsobujúcich DILI patria acetaminofén, anestetiká, nesteroidné antiflogistiká, antibiotiká a antimykotiká, niektoré perorálne antidiabetiká a statíny. Klinická symptomatológia DILI sa vo väčšine prípadov nelíši od poškodenia pečene inej etiológie a v laboratórnom náleze možno typicky pozorovať eleváciu hepatálnych enzýmov a hyperbilirubinémiu. Diagnostika sa opiera o rozpoznanie časovej následnosti medzi vystavením organizmu potenciálne hepatotoxickej látky a prejavov hepatálneho poškodenia. V liečebnom postupe zohráva najdôležitejšiu úlohu čo najrýchlejšie prerušenie pôsobenia škodlivej látky spolu s podpornou starostlivosťou v rámci prevencie chronického pečeňového ochorenia či hepatálneho zlyhania [3].
Vzhľadom na široké spektrum klinických príznakov so súčasnou absenciou špecifických biomarkerov predstavuje DILI jednu z najväčších výziev, ktorej čelia hepatológovia v klinickej praxi. Správna a rýchla diagnostika DILI sa preto opiera o starostlivé vylúčenie ochorení inej etiológie, a stáva sa tak často neistým procesom, vyžadujúci vysokú mieru povedomia [4].
Popis prípadu
Pacient (44 rokov), bez interného predchorobia po polytraume v máji 2021 (zrážka s kamiónom), od kedy bol kontinuálne hospitalizovaný na traumatologickom oddelení, bol preložený na internú kliniku v novembri 2021 za účelom diferenciálnej diagnostiky zvyšujúcich sa hepatálnych enzýmov, bilirubínu a postupne progredujúceho nebolestivého ikteru. Počas niekoľkomesačnej hospitalizácie na traumatologickom oddelení pacient absolvoval sériu operácií a zotavoval sa z početných zranení (kraniotrauma v zmysle zlomeniny bázy lebky s početnými fisúrami a kontúziou mozgu, sériová zlomenina rebier vľavo s hemotoraxom a kontúziou pľúc, ruptúra ľavej obličky, zlomenina lopaty ľavej bedrovej kosti, zlomenina rádia a ulny ľavej ruky, početné poranenia ciev a periférnych nervov bilaterálne vrátane plexus brachialis vpravo). Pri preklade na internú kliniku bol pacient parciálne imobilný, v intenzívnom rehabilitačnom procese. Subjektívne ťažkosti pacienta boli hlavne v zmysle svrbenia celého tela, celkovej slabosti a stuhnutia prstov na pravej ruke.
Z osobnej anamnézy pacient udával alergiu na penicilín (s prejavmi kožného výsevu až opuchu dýchacích ciest). Z abúzov udával fajčenie cca 15 cigariet denne od mladosti a alkohol (pivo) 1–2-krát za týždeň. Počas hospitalizácie na traumatologickom oddelení užíval antibiotikum (ciprofloxacín v dávke 400 mg 2-krát denne i.v. a antimykotikum fluconazol v dávke 150 mg denne p. o. podľa citlivosti pre nález Candida albicans, Acinetobacter baumannii a Enterococcus faecalis v moči). Pre zvýšenie CRP (zo 7,23 na 326,59 mg/l) a leukocytov (z 10,73 na 14,00 × 109/l) v.s. na podklade infikovaného hematómu brušnej dutiny (podľa CT vyšetrenia) sa horeuvedené antibiotikum empiricky zamenilo za vankomycín v dávke 1 g 2-krát denne i.v. a meropenem 1 g 3-krát denne i.v.
Vo vstupnom fyzikálnom vyšetrení pri preklade dominoval ikterus kože a sklér, početné exkoriácie kože bez hematómov, bez palpačnej bolestivosti brucha, bez hmatnej rezistencie či hepatomegálie. Objektívne bol pacient pri prijatí afebrilný, normostenik, kardiopulmonálne kompenzovaný, bez opuchov dolných končatín.
Laboratórne sme zaznamenali hyperbilirubinémiu (bilirubín celkový 350,5 μmol/l; bilirubín konjugovaný 338,9 μmol/l), zvýšené cholestatické enzýmy (GMT 1,15 μkat/l; ALP 4,71 μkat/l), bez zvýšenia aminotransferáz (AST 0,79 μkat/l; ALT 0,40 μkat/l) a hladiny amoniaku (27 μmol/l), iba s miernou pozitivitou CRP (7,16 mg/l). V krvnom obraze bola normocytová normochrómna anémia ľahkého stupňa (Hb 109 g/l), s leukocytózou (13,05 × 109/l) a trombocytózou (660 × 109/l). Koagulačné parametre boli v medziach normy (INR 0,92; P PT 114 %). Sérologickým a laboratórnym vyšetrením sme vylúčili akútnu vírusovú (HBV, HCV, HAV, CMV, EBV, VZV, HSV) a vrodenú metabolickú etiológiu ochorenia pečene (Wilsonova choroba, hereditárna hemochromatóza). Séropozitivita antiHSV IgG, antiVZV IgG, anti EBV IgG svedčili o prekonaní uvedených vírusových infekcií v minulosti.
U pacienta sme vysadili potenciálne hepatotoxickú antibiotickú a antimykotickú liečbu, vymenili sme preventívnu dávku enoxaparínu za fondaparín v dávke 2,5 ml denne ako prevenciu tromboembolickej choroby, nasadili silymarín v dávke 600 mg denne, ursodeoxycholovú kyselinu v dávke 1 000 mg denne a N-acetylcysteín (NAC) intravenózne v dávke 600 mg denne. Pre úporný pruritus sme pridali antihistaminikum levocetirizín (5 mg denne p.o) a v spolupráci so psychiatrom sme doplnili do liečby sertralín v dávke 100 mg denne p. o.
V rámci diferenciálnej diagnostiky sme realizovali MRCP vyšetrenie, ktoré zobrazilo výrazne nepravidelné intrahepatálne žlčové cesty v dif. dg. obraz primárnej sklerotizujúcej cholangitídy (PSC), resp. poliekové poškodenie typu SC-like, s nemožnosťou vylúčenia akútnej cholangitídy (CRP v čase vyšetrenia negatívne). Taktiež sa zobrazil mierne dilatovaný d. hepatocholedochus s nehomogénnym obsahom s početnými prevažne pruhovitými výpadkami signálu (obr. 1). ERCP nebolo vzhľadom k MRCP nálezu sklerotizujúcej cholangitídy bez prítomnosti tzv. dominantnej stenózy gastroenterológom indikované.
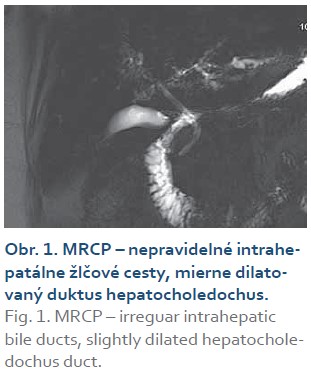
V rozšírených laboratórnych vyšetreniach sme zistili mierne zvýšenú hladinu IgG (16,50 g/l), bez zvýšenia hladiny ostatných imunoglobulínov. Z panelu autoprotilátok sme zistili pozitivitu IgG4, ostatné autoprotilátky (ANA, ANCA, AMA, AMA2, anti LKM-1, anti LC-1, Ro-52) boli negatívne. Genetickým vyšetrením sme vylúčili Gilbertov syndróm. Opakovaný PCR test na SARS-CoV-2 počas hospitalizácie bol negatívny.
Napriek hepatoprotektívnej terapii a vysadení všetkých potenciálne hepatotoxických liečiv sme pri opakovaných odberoch nezaznamenali ďalšie zvýšenie hladiny aminotransferáz (AST 0,75; 0,72; 0,74 μkat/l), (ALT 0,38; 0,37 μkat/l), a cholestatických enzýmov (GMT 1,01; 0,90; 0,91 μkat/l), (ALP 4,38; 4,18; 4,20 μkat/l), avšak pozorovali sme stále sa zvyšujúcu hladinu bilirubínu (bilirubín celkový 425,73 μmol/l; bilirubín konjugovaný 408,19 μmol/l), hypoalbuminémiu (22,90 g/l). V krvnom obraze sa prehĺbila anémia na stredne ťažký stupeň (97 g/l), so vzostupom leukocytov (17,03 × 109/l) a trombocytov (684,0 × 109/l) a so znížením protrombínového času pod 50 %.
Pacient bol počas celej hospitalizácie na internej klinike afebrilný, bez bolestí brucha, bez nauzey či vracania, bez krvácavých prejavov, so subjektívnym pocitom pruritu celého tela. Do liečby sme pridali 20 % albumín 1-krát denne, vitamín K v množstve 5 kvapiek denne a pre stále úporné svrbenie prothazin v dávke 25 mg 2-krát denne. Pre vznik bolestivého serómu v mieste zavedenia Kirschnerovho drôtu (diafýza rádia ľavej ruky) sme v spolupráci s traumatológom uskutočnili punkciu serómu s extrakciou drôtu a v rámci prevencie osteomyelitídy nasadili intravenózne clindamycín v redukovanej dávke 600 mg 2-krát denne.
Pre podozrenie z IgG4 cholangitídy, primárnej či sekundárnej sklerotizujúcej cholangitídy (v.s. poliekovo/posttraumaticky) resp. liekmi indukovaný syndróm miznúcich žlčovodov, sme v celkovej anestéze (pre nespoluprácu pacienta) realizovali necielenú biopsiu pečene. S výsledkom histológie (bez známok autoimunitnej hepatitídy či IgG4 hepatopatie, v.s. poliekové poškodenie (DILI), poliekový „vanishing bile duct syndróm“) a pre hroziace akútne zlyhanie pečene (INR 1,51) sme konzultovali hepato-gastroenterologicko-transplantačné pracovisko HEGITO za účelom ďalšieho managementu eventuálne potreby transplantácie pečene. U pacienta sa v spolupráci s hepatológmi zahájila terapia vysokými dávkami intravenózneho N-acetylcysteínu (1 200 mg denne) s navýšením dávky ursodeoxycholovej kyseliny (500 mg 3-krát denne) s pôvodnou dávkou silymarínu (300 mg 2-krát denne). Vzhľadom na neprítomnosť autoimunitného procesu nebola kortikoidná liečba zahájená. Zhruba 12 dní od potencovanej hepatoprotektívnej liečby sme zaznamenali pokles hladiny bilirubínu (bilirubín celkový 301,87 μmol/l; bilirubín konjugovaný 265,73 μmol/l), so stacionárnymi hladinami transamináz a cholestatických enzýmov a normalizáciou koagulačných parametrov, na základe čoho nebola indikovaná transplantácia pečene. O ďalších 5 dní bol pacient v zlepšenom stave prepustený do ambulantnej starostlivosti hepatológa na perorálnej liečbe N-acetylcysteínom v dávke 1 200 mg denne.
Mesiac po prepustení z internej kliniky v januári 2022 pri intenzívnej rehabilitácii a ambulantnej liečbe došlo u pacienta k úplnému ústupu pruritu, výraznému zmierneniu ikteru kože s opätovným zlepšením biochemických parametrov (bilirubín celkový 174,0 μmol/l; bilirubín konjugovaný 169,0 μmol/l), aj parametrov krvného obrazu (hemoglobín 102,0 g/l), (leukocyty 11,44 × 109/l), (trombocyty 436,0 × 109/l). Pri poslednej kontrole v 3/2022 bola hodnota celkového bilirubínu 78 μmol/l, pacient pokračuje v liečbe (silymarín 600 mg denne, redukcia dávky ursodeoxycholovej kyseliny na 1 000 mg denne, liečba N-acetylcysteínom bola ukončená) s odporučením pravidelných kontrol v hepatologickej ambulancii.
Diskusia
DILI, ako jedno z príčin hepatálneho poškodenia, môže vzniknúť po požití lieku, bylinných či potravinových doplnkov závisle alebo zriedkavejšie nezávisle od dávky. Závažnosť reakcie pri DILI sa líši od mierneho zvýšenia transamináz až po rozvoj akútneho zlyhanie pečene (ALF) s potrebou transplantácie pečene alebo s následkom smrti [5].
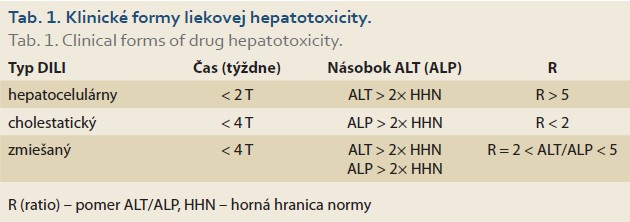
Diagnóza liekového poškodenia je náročná, pretože nejestvuje konkrétny klinický, laboratórny alebo histologický znak špecifický pre DILI. Poškodenie pečene v rámci DILI delíme na hepatocelulárne, cholestatické alebo zmiešané na základe biochemického modelu poškodenia, ktorý je určený pomerom (hodnota R – ratio) zvýšenej sérovej hladiny ALT k hladine ALP (tab. 1) [6,7].
Jin Hwa Park et al vo svojej štúdii analyzovali súbor hospitalizovaných pacientov z dôvodu zvýšenia hladiny hepatálnych enzýmov počas hospitalizácie za jeden rok. Vybraní pacienti mali viac ako 18 rokov a zvýšenú hladinu hepatálnych enzýmov viac ako 3-násobne od hornej hranice normy. Zo štúdie boli vylúčení tí pacienti, ktorých hladina hepatálnych enzýmov bola elevovaná aspoň jedným násobkom od hornej hranice normy. Celkovo bolo vyšetrených 166 pacientov priemerného veku 52 rokov, u ktorých sa vylúčila iná príčina hepatálneho ochorenia s predpokladom poliekového poškodenia užívanými liečivami počas hospitalizácie. Najčastejšími pôvodcami zvýšenia hepatálnych enzýmov boli antibiotiká (64 %), potom antireumatiká (11 %), doplnky stravy (5 %), bylinné lieky (4 %), antivirotiká, nesteroidné antiflogistiká, paracetamol a lieky znižujúce cholesterol (3 %) [8].
V spomínanej práci však nebola zmienka o subjektívnych ťažkostiach pacientov, o ich hladine bilirubínu či vážnejšom poškodení pečene v zmysle akútneho/subakútneho zlyhania pečene či nasadenia liečby hepatikami. Pacient v nami uvádzanej kazuistike mal 3-násobne zvýšenú hladinu ALP, zvýšený konjugovaný aj celkový bilirubín s obrazom subakútneho poškodenia pečene pri vylúčení infekčnej, metabolickej, toxickej a onkologickej etiológie hepatopatie, s poklesom týchto hladín po nasadení liečby N-acetylcysteínom a hepatikami.
U nášho pacienta sme mali prvotne podozrenie na choledocholitiázu vzhľadom na dilatovaný d. hepatocholedochus (11 mm), avšak chýbali typické bolesti pod pravým rebrovým oblúkom a túto možnosť vylúčil aj pokles biochemických parametrov po navýšení spomínanej liečby. MRCP popísala typický obraz pre primárnu sklerotizujúcu cholangitídu, avšak negativita viacerých autoprotilátok nepodporovala túto diagnózu. IgG4 hepatopatiu aj napriek pozitivite IgG a IgG4 vylúčila histologická analýza z biopsie pečene.
Nejestvujú žiadne diagnostické testy ani biomarkery pre idiosynkratické DILI. Diagnóza sa stanoví po prísnom vylúčení iných príčin a po posúdení časovej súvislosti medzi užívaním lieku, eleváciou hepatálnych enzýmov a poklesom týchto parametrov po vysadení podozrivého lieku [9]. Na rozdiel od dobre definovaných histologických obrazov pri chronických hepatitídach či tukových chorobách pečene, histologický obraz pri DILI vykazuje širokú škálu nálezov vrátane zápalu, nekrózy, cholestázy, fibrózy, nodulárnej regenerácie, vaskulárneho poškodenia a deštrukcie žlčovodov [10].
V prípade nášho pacienta sa jednalo s vysokou pravdepodobnosťou o liekmi vyvolané cholestatické poškodenie pečene s histologickým obrazom syndrómu miznúcich žlčovodov (z angl. vanishing bile duct syndrome).
Vinay Sundaram et al vo svojej práci opisujú niekoľko histologických typov liekmi vyvolanej cholestázy, od najčastejšieho obrazu cholestatickej hepatitídy, cez dilatáciu žlčových kanálikov so žlčovými zátkami až po syndróm miznúcich žlčovodov. Opisuje tiež kazuistiku 46-ročného muža s abnormálnymi pečeňovými testami a hodnotami bilirubínu po niekoľko dňovom požívaní doxycyklínu a viacerých vitamínov či bylinných produktov (lyzín, glycín, arginín, chlorofyl, kurkuma). Po vylúčení iných príčin hepatálneho poškodenia biopsia pečene preukázala znaky cholestatickej hepatitídy s potrebou liečby hepatoprotektívami s použitím plazmaferézy pre zvládnutie úporného pruritu pacienta. Po 3 mesiacoch liečby boli pacientove hladiny hepatálnych enzýmov a bilirubínu v medziach normy [11].
Syndróm miznúcich žlčovodov je diagnostikovaný, keď je v histologickej vzorke pozorovaných menej ako 50 % žlčových ciest. Ide o zriedkavý syndróm, ktorý sa vyskytuje iba v 0,5 % prípadov biliárnych ochorení a môže potenciálne viesť až k cirhóze pečene, keďže v neliečenom prípade vedie takmer k úplnej absencii žlčovodov. Vyskytuje sa hlavne u pacientov s dlhotrvajúcou cholestázou. Medzi najčastejšie, v publikáciách spomínané, antibiotiká spôsobujúce cholestatické poškodenie patria amoxicilín/klavulanát, azitromycín, tetracyklíny, makrolidy a meropenem [11,12].
Pacient v našej kazuistike užíval viacero druhov antibiotík (ciprofloxacín, vankomycín, meropenem, clindamycín), antimykotikum flukonazol a počas hospitalizácie podstúpil viaceré operácie v celkovej inhalačnej anestéze a v úvode liečby vyžadoval parenterálnu výživu. I keď je hepatálna toxicita po podaní flukonazolu zriedkavá, občas sa s ňou v klinickej praxi stretneme a je dokladovaná i v LiverTox databáze a vo viacerých kazuistikách.
V algoritme managementu pacientov s DILI dominuje vysadenie potenciálne škodlivého lieku či výživového doplnku. V súčasnosti stále neexistuje žiadne antidotum pre ALF (z angl. acute liver failure) spôsobeného idiosynkratickým DILI. V literatúre sa popisuje používanie symptomatickej liečby pruritu antihistaminikami a používanie ursodeoxycholovej kyseliny. Účinnosť kortikoidov podľa literatúry nepreukázala význam v liečbe DILI. N-acetylcysteín je osvedčený ako antidotum pri predávkovaní acetaminofénom, avšak v štúdiách liečby u pacientov s ALF pri DILI nedosiahol signifikantne významný účinok ani zvýšenie celkového prežívania pacientov s poškodením pečene. Štatisticky významné štúdie účinnosti N-acetylcysteínu v liečbe neparacetamolového poškodenia stále chýbajú [13–15].
V našej kazuistike sme pacientovi okrem hepatoprotektív podávali aj N-acetylcysteín: intravenózne v dávke 1 200 mg denne dva týždne s pokračujúcou rovnakou dávkou perorálne v domácom prostredí. Aj keď sme jednoznačne nevedeli preukázať etiologický faktor cholestatického pečeňového postihnutia, liečba hepatikami a NAC prispela k zlepšeniu laboratórnych parametrov a k celkovému klinickému zlepšeniu stavu pacienta.
Záver
Prípad opisuje zriedkavý syndróm miznúcich žlčovodov v prípade poliekového poškodenia cholestatického typu u pacienta bez akéhokoľvek predošlého hepatálneho ochorenia, po ťažkej polytraume. Po vylúčení iných príčin hepatopatie a pri nejednoznačnom náleze na MRCP hrala včasná biopsia pečene významnú úlohu. Včasná diagnostika DILI a podporná liečba hepatikami a NAC, ako aj vysadenie potenciálne hepatotoxických liečiv pomohla predísť akútnemu hepatálnemu zlyhaniu s potrebou transplantácie pečene. Kazuistika poukazuje na zriedkavý cholestatický typ DILI ako jednu z príčin inak neobjasnenej hepatopatie.
ORCID autorov
X. Faktorová ORCID 0000-0001-9666-2794,
M. Žigrai ORCID 0000-0003-2254-436X,
S. Adamcová Selčanová ORCID 0000-0001- 8181-1937.
Doručené/Submitted: 30. 4. 2022
Prijaté/Accepted: 20. 6. 2022
MUDr. Xénia Faktorová
Interná klinika SZU
Univerzitná nemocnica – Nemocnica svätého Michala, a. s.
Satinského 1
811 08 Bratislava
xenia.faktorova@gmail.com
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Andrade RJ, Chalasani N, Björnsson ES et al. Drug-induced liver injury. Nat Rev Dis Primers 2019; 5(1): 58. doi: https: //doi.org/10.1038/ s41572-019-0105-0.
2. Larson AM. Drug-induced liver injury. [online]. Dostupné z: https: //www.uptodate.com/contents/drug-induced-liver-injury.
3. David S, Hamilton JP. Drug-induced liver injury. US Gastroenterol Hepatol Rev 2010; 6: 73–80.
4. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: drug-induced liver injury. J Hepatol 2019; 70(6): 1222–1261. doi: 10.1016/j.jhep.2019.02.014.
5. Hassan A, Fontana RJ. The diagnosis and management of idiosyncratic drug-induced liver injury. Liver Int 2019; 39(1): 31–41. doi: 10.1111/liv.13931.
6. Fisher K, Vuppalanchi R, Saxena R. Drug-induced liver injury. Arch Pathol Lab Med 2015; 139(7): 876–887. doi: 10.5858/arpa.2014-0214-RA.
7. Szántová M. Hepatológia stručne, jasne, prehľadne. Bratislava: A-medi management 2019.
8. Park JH, Hong S, Jun DW et al. Prevalence and clinical characteristics of antibiotics associated drug induced liver injury. Ann Transl Med 2021; 9(8): 642. doi: 10.21037/atm-20-5144.
9. Katarey D, Verma S. Drug-induced liver injury. Clin Med (Lond) 2016; 16(6): 104–109. doi: 10.7861/clinmedicine.16-6-s104.
10. Kleiner DE. Drug-induced liver injury: the hepatic pathologist‘s approach. Gastroenterol Clin North Am 2017; 46(2): 273–296. doi: 10.1016/ j.gtc.2017.01.004.
11. Sundaram V, Björnsson ES. Drug-induced cholestasis. Hepatol Commun 2017; 1(8): 726–735. doi: 10.1002/hep4.1088.
12. Desmet VJ. Vanishing bile duct syndrome in drug-induced liver disease. J Hepatol 1997; 26(1): 31–35. doi: 10.1016/s0168-8278(97)823 30-6.
13. Chalasani NP, Maddur H, Russo MW et al. ACG Clinical Guideline: diagnosis and management of idiosyncratic drug-induced liver injury. Am J Gastroenterol 2021; 116(5): 878–898. doi: 10.14309/ajg. 0000000000001259.
14. Chughlay MF, Kramer N, Spearman CW et al. N-acetylcysteine for non-paracetamol drug-induced liver injury: a systematic review. Br J Clin Pharmacol 2016; 81(6): 1021–1029. doi: 10.1111/bcp.12880.
15. Siu JT, Nguyen T, Turgeon RD. N-acetylcysteine for non-paracetamol (acetaminophen) -related acute liver failure. Cochrane Database Syst Rev 2020; 12(12): CD012123. doi: 10.1002/14651858.