Smerom k personalizovanej liečbe alveolárnej echinokokózy: pilotná štúdia merania hladín albendazol-sulfoxidu u kohorty pacientov na Slovensku
Robert Rosoľanka Orcid.org 1, Martin Kertys2, Nela Žideková3, Daniela Antolová4, Katarína Šimeková1, Martin Súčik1, Lenka Nosáková5, Lukáš Špaňo1, Peter Bánovčin Jr6
+ Pracoviště
Souhrn
Úvod: Albendazol je stále považovaný za pilier v liečbe alveolárnej echinokokózy (AE). Jeho parazitostatický účinok spolu s variabilnou individuálnou plazmatickou koncentráciou môže byť považovaný za terapeutický problém. Z tohto dôvodu je meranie plazmatickej koncentrácie jeho aktívneho metabolitu albendazol-sulfoxidu dôležitý pri optimalizácii liečby a minimalizácii toxicity. Cieľ: Cieľom štúdie je prezentovať preliminárne dáta zo Slovenska a demonštrovať realizovateľnosť a využiteľnosť stanovenia hladín albendazol-sulfoxidu (ASOX) v klinickej praxi. Metodika: Stanovenie plazmatických koncentrácií ASOX bolo vykonané u 19 pacientov s potvrdenou AE. Dáta boli hodnotené prostredníctvom základnej štatistickej analýzy. Bol realizovaný literárny prehľad podporujúci využiteľnosť monitorovania terapeutických hladín ASOX (TDM). Výsledky: Koncentrácie ASOX sa pohybovali v rozmedzí od 1,18 do 12,10 µmol/ l (priemer 4,11 µmol/ l), pričom niektoré hodnoty prekračovali odporúčaný terapeutický interval. Záver: Naše závery potvrdzujú technickú a klinickú uskutočniteľnosť realizácie TDM pre ASOX a reflektujú krok k personalizovanej liečbe AE na Slovensku.
Klíčová slova
alveolárna echinokokóza, albendazol, albendazol-sulfoxid, TDM
Úvod
Alveolárna echinokokóza (AE) je závažné a potencionálne smrteľné parazitárne ochorenie, ktoré postihuje primárne pečeň. Infekciu spôsobuje parazit Echinococcus multilocularis (EM), ktorý je charakteristický tvorbou multicystických ložísk najčastejšie v pečeni. Tieto hepatálne ložiská môžu svojim rastom pripomínať malígny tumor, čo často spôsobuje diferenciálno-diagnostickú neistotu. Nebezpečenstvo ochorenia spočíva v potencionálnom metastatickom šírení do priľahlých tkanív a vzdialených orgánov. V prípade chirurgického riešenia ochorenia eventuálne pri absencii možnosti radikálneho chirurgického zákroku pri inoperabilite je u pacienta indikovaná dlhodobá alebo doživotná terapia albendazolom [1,2]. Benzoimidazolová zlúčenina albendazol sa v pečeni konvertuje na jeho aktívnu formu albendazol-sulfoxid (ASOX), ktorý vykazuje parazitostatický efekt. Avšak bioaviabilita a systémová expozícia liečiva má vysokú inter-individuálnu variabilitu. Táto variabilita môže byť ovplyvnená rôznymi faktormi, ako sú napr. nutričný status pacienta, liekové interakcie, ale aj samotná efektívnosť hepatálneho metabolizmu [3,4]. Monitorovanie terapeutických hladín (TDM – therapeutic drug monitoring) ASOX je preto vysoko odporúčané medzinárodnými postupmi [5].
Aj napriek zlepšeniu manažmentu AE v oblastiach strednej Európy nie je stanovenie hladín ASOX rutinne dostupné. Predkladaná práca preto predstavuje pilotnú štúdiu merania hladín ASOX u kohorty slovenských pacientov infikovaných AE, a takisto podporujú a ponúkajú širšiu implementáciu do klinickej praxe, čím vytvára predpoklad pre budúce budovanie TDM protokolov. Cieľom tejto štúdie je demonštrovať realizovateľnosť a zdôrazniť potenciál personalizovanej liečby AE na základe farmakokinetického monitorovania na Slovensku.
Materiál a metodika
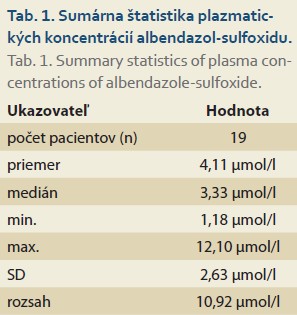
Analýza zahàňa 19 pacientov s potvrdenou diagnózou AE diagnostikovaných podľa kritérií WHO-IWGE a dispenzarizovaných na Klinike infektológie a cestovnej medicíny Univerzitnej nemocnice v Martine. U všetkých pacientov bola indikovaná liečba albendazolom v odporúčanom dávkovaní tzn. 10– 15 mg/ kg na deň, pričom štandardne bola celková dávka albendazolu 800 mg/ deň rozdelená do dvoch podaní v rozpätí 12 hod. Vzorky plazmy boli následne u pacientov typicky odoberané minimálne po mesiaci terapie, presnejšie 4 hod po užití rannej dávky s jedlom, čo koreluje s predpokladanou vrcholovou plazmatickou koncentráciou (cmax) aktívneho metabolitu albendazol-sulfoxidu (ASOX) a jeho plazmatickým eliminačným polčasom 7– 8 hod [6]. Na detekciu a analýzu plazmatických koncentrácií ASOX bola využitá kombinácia ultra-vysokoúčinnej kvapalinovej chromatografie (UHPLC) v online spojení s tandemovým hmotnostným spektrometrom (MS/ MS) na báze trojitého kvadrupólu XEVO TQ-S (Waters, Česká republika). Vzorky krvnej plazmy boli spracované pomocou metódy kombinujúcej precipitáciu proteínov a odstránenie plazmatických fosfolipidov pomocou platničky OSTROTM (Waters, Česká republika). Metóda bola optimalizovaná a následne validovaná podľa smernice Európskej liekovej agentúry – Guideline on bioanalytical method validation; version EMEA/ CHMP/ EWP/ 192217/ 2009 Rev. 1 Corr. 2**. Metóda spĺňa všetky požiadavky kladené smernicou, ako je selektivita, linearita kalibračných kriviek a dolný limit kvantifikácie, presnosť a správnosť, matricové efekty a výťažnosť metódy spracovania vzorky, prenos analytov medzi analýzami, integritu vzoriek po nariedení, ako aj stabilitu pri rôznych podmienkach skladovania. Výsledky sú vyjadrené v µmol/ l krvnej plazmy.
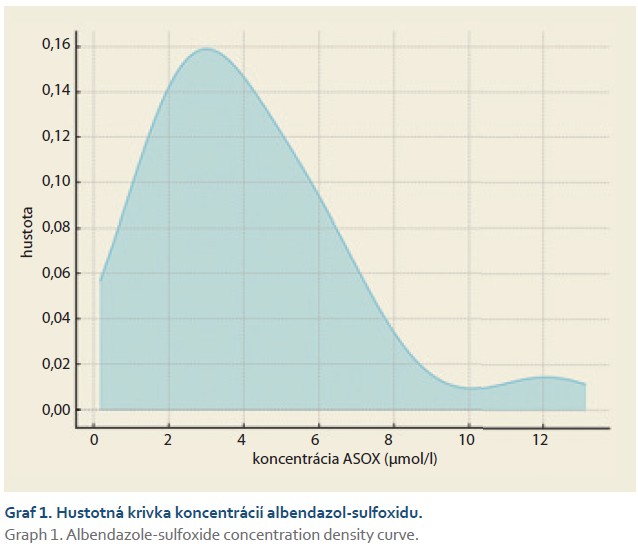
Na štatistické zhodnotenie súboru boli použité metódy základnej deskriptívnej štatistiky (priemer, medián, SD, rozsah). Na vizualizáciu distribúcie bola vyhotovená krivka denzity a histogram. Samotný výpočet a vytvorenie hustotnej krivky bol realizovaný prostredníctvom štatistických knižníc v jazyku Python.
Projekt bol schválený Etickou komisiou Jesseniovej lekárskej fakulty Univerzity Komenského v Martine pod číslom protokolu EK 27/ 2022.
Výsledky
Hladiny albendazol-sulfoxidu (ASOX) boli stanovené u 19 pacientov. Priemerná nameraná koncentrácia bola 4,11µmol/ l (SD 2,63) so stredovou hodnotou (medián) 3,33 µmol/ l. Hodnoty sa pohybovali v rozsahu od 1,18 do 12,10 µmol/ l (tab. 1). Aj napriek tomu, že viac ako polovica nameraných hodnôt sa nachádzala v rámci odporúčaného terapeutického rozmedzia (1– 3 µmol/ l) alebo mierne nad ním, u niektorých pacientov boli pozorované výrazne zvýšená koncentrácia ASOX, čo vyvoláva riziko z potencionálnej toxicity (graf 1). Distribučná krivka vykazovala pravostranný sklon s maximálnym koncentračným vrcholom medzi 2,5 a 4,5 µmol/ l. Vzhľad rozloženia dát koreluje s medzinárodnými skúsenosťami, kde sú plazmatické hladiny ASOX značne individuálne variabilné.
Diskusia
Štúdia predstavuje prvý publikovaný súbor pacientov s AE na Slovensku, u ktorých bolo realizované meranie plazmatických hladín ASOX, pričom vzhľadom na svoj pilotný charakter potvrdzuje realizovateľnosť merania a všeobecnú klinickú implementáciu, a zároveň vytvára základ pre ďalší výskum a rozvoj personalizovaných terapeutických protokolov. Toto úsilie zaradzuje Slovensko medzi rastúci počet európskych krajín s už zavedeným terapeutickým monitorovaním liečby AE, tzn. schopnosťou, ktorá je dlhodobo odporúčaná, ale jej implementácia naprieč krajinami je nejednotná [5,7,8]. Pozorovaná inter-individuálna variabilita vyzdvihuje jednoznačný prínos TDM v klinickej praxi. Štúdie ukázali, že nízka hladina ASOX môže byť spojená so zlyhaním liečby [9], a naopak excesívne vysoké plazmatické hladiny zvyšujú riziko závažných nežiadúcich účinkov typicky hepatotoxicitu a leukopéniu [10].
Zistenia našej štúdie tento problém zároveň odrážajú: u niektorých pacientov boli zaznamenané supra-terapeutické hladiny ASOX (> 6,0 µmol/ l), čo by si vyžadovalo úpravu dávkovania. Keďže ide o prierezovú štúdiu, nebolo možné posúdiť vývoj prípadnej toxicity v čase. U pacientov s najvyššími koncentráciami ASOX neboli pozorované klinické prejavy toxicity počas sledovaného obdobia. Tieto laboratórne nálezy zatiaľ slúžia ako iniciálne východisko pre ďalšie sledovanie a potencionálne úpravy dávkovania. Na druhej strane, sub-terapeutické hladiny by bez TDM mohli ostať nepovšimnuté, čo v konečnom dôsledku môže viesť k terapeutickému zlyhaniu. Podľa odbornej literatúry nie je jednoznačne stanovené terapeutické rozmedzie plazmatických hladín ASOX v priebehu liečby AE. Podľa konsenzu expertov WHO-IWGE z roku 2010 bol navrhnutý konzervatívny cieľ terapeutického rozpätia medzi 0,65 a 1,37 µmol/ l [1]. Novšie odporúčania podľa Alberta Precision Laboratories deklarujú lepšiu reflexiu z klinickej praxe a navrhujú širší interval medzi 1,6 a 6,0 µmol/ l [11]. Lídri v manažmente AE v Európe používajú interval 1– 3 µmol/ l, čo môžeme považovať za praktický kompromis založený na dlhodobých pozorovaniach klinických odpovedí a toxicity na liečbu AE u kohort pacientov vo Francúzku a Nemecku [12,13]. V našej štúdii sme preto zvolili ako referenčný interval hodnoty ASOX 1– 3 µmol/ l, čo je v súlade s aktuálnymi európskymi štandardami. Aj napriek tomu, že v niektorých oblastiach sveta boli navrhnuté širšie intervaly hladín ASOX (napr. 1,6– 6,0 µmol/ l), výber v tejto štúdii skôr podporuje harmonizáciu a možnú integráciu meraní na Slovensku s európskymi protokolmi. U pacientov s AE je podľa konsenzu expertov odporúčané meranie plazmatických hladín ASOX pri iniciácii liečby alebo pri zmene dávkovacieho režimu. Takisto u stabilizovaných pacientov je vhodné realizovať meranie aspoň jedenkrát ročne [1]. Okrem toho, farmakokinetické štúdie potvrdzujú, že plazmatické koncentrácie ASOX často nereflektujú jeho intra-cystické koncentrácie, čo ďalej podporuje individuálne monitorovanie oproti empirickému dávkovaniu [14– 16].Plazmatické hladiny ASOX môžu byť ovplyvnené rôznymi faktormi, ako sú enzymatické polymorfizmy alebo indukcia hepatálnych enzýmov. Preto je vysoký potenciál práve vo využití farmakogenetiky na lepšie pochopenie farmakokinetických parametrov liečiva [17].
Limitácie
Táto štúdia má niekoľko limitácií, ako je veľkosť analyzovanej skupiny pacientov a takisto absentuje korelácia s klinickými výstupmi. Typ stravy, ktorý môže vplývať na absorbciu liečiva, bol u každého pacienta variabilný, avšak odrážal reálne, a často neovplyvniteľné zloženie jedálnička každej osoby.
Záver
Táto pilotná štúdia prezentuje prvé preliminárne výsledky merania plazmatických koncentrácií ASOX u kohorty slovenských pacientov infikovaných alveolárnou echinokokózou. Údaje dokazujú významnú individuálnu variabilitu v expozícii liečiva. Naše výsledky však potvrdzujú realizovateľnosť a zároveň podporujú širšiu implementáciu monitorovania liečby AE v klinickej praxi s postupným prechodom k personalizovanej liečbe AE na Slovensku.
ORCID autorov
R. Rosoľanka 0000-0003-0429-6833,
M. Kertys 0000-0002-1095-6810,
N. Žideková 0009-0008-2878-5416,
D. Antolová 0000-0002-9358-2163,
L. Nosáková 0000-0003-0432-8575,
P. Bánovčin 0000-0001-6694-9364.
Doručené/ Submitted: 7. 7. 2025
Prijaté/ Accepted: 14. 7. 2025
Korespondenčný autor
MU Dr. Róbert Rosolanka, PhD.
Klinika infektológie a cestovnej medicíny
JLF UK a UN Martin
Kollárova 2
036 59 Martin
robert.rosolanka@uniba.sk
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Brunetti E, Kern P, Vuitton DA. Expert consensus for the diagnosis and treatment of cystic and alveolar echinococcosis in humans. Acta Trop 2010; 114(1): 1– 16. doi: 10.1016/ j. actatropica.2009.11.001.
2. Oksanen A, Siles-Lucas M, Karamon J et al. The geographical distribution and prevalence of Echinococcus multilocularis in animals in the European Union and adjacent countries: a systematic review and meta-analysis. Parasit Vectors 2016; 9(1): 519. doi: 10.1186/ s13071-016-1746-4.
3. Hemphill A, Stadelmann B, Rufener R et al. Treatment of echinococcosis: albendazole and mebendazole – what else? Parasite 2014; 21: 70. doi: 10.1051/ parasite/ 2014073.
4. Bardonnet K, Vuitton DA, Grenouillet F et al. 30-year course and favorable outcome of alveolar echinococcosis despite multiple metastatic organ involvement in a non-immune suppressed patient. Ann Clin Microbiol Antimicrob 2013; 12: 1 doi: 10.1186/ 1476-0711-12-1.
5. Autier B, Dion S, Millon L. Chemotherapy for the treatment of alveolar echinococcosis: where are we? Parasite 2024; 31: 56. doi: 10.1051/ parasite/ 2024055.
6. Schulz JD, Neodo A, Coulibaly JT et al. Pharmacokinetics of albendazole, albendazole sulfoxide, and albendazole sulfone determined from plasma, blood, dried-blood spots, and Mitra samples of hookworm-infected adolescents. Antimicrob Agents Chemother 2019; 63(4): e02489-18. doi: 10.1128/ AAC.02489-18.
7. Steiger U, Cotting J, Reichen J. Albendazole treatment of echinococcosis in humans: effects on microsomal metabolism and drug tolerance. Clin Pharmacol Ther 1990; 47(3): 347– 353. doi: 10.1038/ clpt.1990.38.
8. Reuter S, Jensen B, Buttenschoen K et al. Benzimidazoles in the treatment of alveolar echinococcosis: a comparative study and review of the literature. J Antimicrob Chemother 2000; 46(3): 451– 456. doi: 10.1093/ jac/ 46.3.451.
9. Plum PE, Ausselet N, Kidd F et al. EchiNam: multicenter retrospective study on the experience, challenges, and pitfalls in the diagnosis and treatment of alveolar echinococcosis in Belgium. Eur J Clin Microbiol Infect Dis 2025; 44(2): 263– 275. doi: 10.1007/ s10096-024-04996-4.
10. Chauchet A, Grenouillet F, Knapp J et al. Increased incidence and characteristics of alveolar echinococcosis in patients with immunosuppression-associated conditions. Clin Infect Dis 2014; 59(8): 1095– 1104. doi: 10.1093/ cid/ ciu520.
11. Alberta Precision Laboratories. Albendazole level monitoring in treatment of AE. 2022 [online]. Dostupné z: chrome-extension:/ / efaidnbmnnnibpcajpcglclefindmkaj/ https:/ / www.albertahealthservices.ca/ assets/ wf/ lab/ if-lab-hp-bulletin-albendazole-level-monitoring-in-treatment-of-ae-alveolar-echinococcosis.pdf.
12. Bresson-Hadni S, Spahr L, Chappuis F. Hepatic alveolar echinococcosis. Semin Liver Dis 2021; 41(4): 387– 408. doi: 10.1055/ s-0041-1730925.
13. Bresson-Hadni S, Montange D, Richou C et al. Tobacco, cannabis, and liquorice: hidden players altering albendazole metabolism in patients with hepatic alveolar echinococcosis. J Hepatol 2021; 74(2): 469– 471. doi: 10.1016/ j. jhep.2020. 10.032.
14. Lötsch F, Naderer J, Skuhala T et al. Intra-cystic concentrations of albendazole-sulphoxide in human cystic echinococcosis: a systematic review and analysis of individual patient data. Parasitol Res 2016; 115(8): 2995– 3001. doi: 10.1007/ s00436-016-5054-x.
15. Xu X, Qian X, Gao C et al. Advances in the pharmacological treatment of hepatic alveolar echinococcosis: from laboratory to clinic. Front Microbiol 2022; 13: 953846. doi: 10.3389/ fmicb.2022.953846.
16. Ingold K, Bigler P, Thormann W et al. Efficacies of albendazole sulfoxide and albendazole sulfone against in vitro-cultivated Echinococcus multilocularis metacestodes. Antimicrob Agents Chemother 1999; 43(5): 1052– 1061. doi: 10.1128/ AAC.43.5.1052.
17. Hemphill A, Spicher M, Stadelmann B et al. Innovative chemotherapeutical treatment options for alveolar and cystic echinococcosis. Parasitology 2007; 134(13): 1657– 1670. doi: 10.1017/ S0031182007003198.