Teduglutid, analog glukagonu podobného peptidu-2 (REVESTIVE), v léčbě syndromu krátkého střeva se závislostí na domácí parenterální výživě
František Novák1
+ Pracoviště
Teduglutid (REVESTIVE) je indikován k léčbě pacientů se syndromem krátkého střeva (SBS – short bowel syndrome), kteří jsou závislí na domácí parenterální výživě (DPV). Jedná se o analog glukagonu podobného peptidu-2 (GLP-2 – glucagon like peptid-2), peptidového hormonu, který přirozeně uvolňují střevní L-buňky v tlustém střevě. Teduglutid je vyroben technologií rekombinantní DNA v buňkách Escherichia coli. Tento analog aktivuje po subkutánním podání GLP-2 receptory ve střevě a zprostředkovává uvolnění inzulinu podobného růstového faktoru 1, oxidu dusnatého a růstového faktoru keratinocytů. Dále zvyšuje střevní a portální průtok krve, inhibuje sekreci žaludečních kyselin a snižuje střevní motilitu. Teduglutid udržuje integritu střevní mukózy tím, že podporuje regeneraci a růst střevní sliznice díky zvětšení výšky klků a hloubky krypt. Poločas eliminace u nativního GLP-2 je 7 minut. Teduglutid se skládá z řetězce 33 aminokyselin podobně jako GLP-2, pouze aminokyselina alanin je nahrazena glycinem na druhé pozici od N-koncové části. Ve srovnání s přirozeně se vyskytujícím GLP-2, vede náhrada jedné aminokyseliny k odolnosti vůči in vivo degradaci, a tak se prodlouží poločas rozpadu na 2 hodiny.
Hlavní mechanizmus účinku teduglutidu je zvýšení absorpční plochy tenkého střeva, které vede ke snížení potřeby DPV až k jejímu úplnému ukončení.
Bezpečnost a účinnost subkutánního podání teduglutidu byla ověřena ve dvou multicentrických, randomizovaných, dvojitě zaslepených, placebem kontrolovaných klinických studiích. Těchto studií se účastnili pacienti, kteří byli závislí na podávání parenterální výživy > 12 měsíců s frekvencí její aplikace minimálně 3krát týdně. Cílem studií bylo snížení jejich závislosti na parenterální výživě. První z obou ověřovacích studií byla 24týdenní studie STEPS u 86 dospělých pacientů. Primárního cíle studie, tj. snížení objemu parenterální výživy alespoň o 20 % od začátku léčby, bylo při podávání teduglutidu (0,05 mg/kg/den) dosaženo u 63 % pacientů ve srovnání s 30 % ve skupině s placebem. Po 24 týdnech léčby došlo k poklesu objemu parenterální výživy u pacientů na teduglutidu v průměru o 4,4 l/týden a ve skupině s placebem pouze o 2,3 l/týden. Podobně ve skupině na teduglutidu v porovnání s placebem dosáhlo redukce počtu dnů na parenterální podpoře alespoň o jeden den v průběhu týdne více pacientů (54 % vs. 23 %) [1].
V následné odslepené pokračovací studii STEPS II byla účinnost teduglutidu v dlouhodobé léčbě hodnocena u pacientů, kteří absolvovali studii STEPS. V rámci této studie dosáhlo 89 % pacientů příznivé klinické odpovědi při pokračování léčby teduglutidem (rameno TED/TED, n = 37), tj. redukce objemu PV nejméně o 20 % oproti výchozímu stavu. V porovnání s tím, dosáhlo podobné výsledky pouhých 46 % pacientů, kteří přešli na teduglutid z placeba (rameno PBO/TED, n = 39) a 50 % pacienti, kteří do studie vstoupili nově bez předchozí účasti ve STEPS (rameno NT/TED, n = 12). Pacienti, kteří studii STEPS II dokončili, dosáhli výše uvedené příznivé klinické odpovědi podle skupin dokonce: 93 % (28/30) v TED/TED, 55 % (16/29) v PBO/TED a 67 % (8/12) v NT/TED. Po každodenní aplikaci teduglutidu, která trvala celkem 30 měsíců, bylo u deseti pacientů ze studie STEPS II možné parenterální podporu zcela ukončit (kompletní weaning). Studie ovšem nebyla dostatečně robustní pro hodnocení signifikance dosažených výsledků [2].
Druhá ověřovací 24týdenní randomizovaná studie, které se účastnilo 83 pacientů, srovnávala léčbu teduglutidem v různém denním dávkování buď 0,05mg/kg, nebo 0,1 mg/kg a placebo. Podíl pacientů s příznivou odpovědí ve skupině s dávkou 0,05 mg/kg byl významně vyšší než ve skupině s placebem (46 vs. 6 %; p = 0,005). Ve skupině s vyšší dávkou teduglutidu 0,1mg/kg byl sice podíl příznivých odpovědí ve srovnání s placebem také vyšší, ale tento rozdíl nebyl statisticky významný (25 vs. 6 %; p = 0,17) [3]. Pacienti, kteří se účastnili následné 28týdenní prodlužovací studie, dosáhli při pokračování v léčbě denní dávkou 0,05 mg/kg příznivé odpovědi v 68 % (17/25). Naopak u jedinců, u kterých byla léčba teduglutidem přerušena, bylo po čtyřech týdnech nutné opět týdenní parenterální podporu navýšit [4].
V post hoc analýze výše uvedených studií STEP a STEPS II byla hodnocena účinnost léčby teduglutidem pomocí stratifikace pacientů do skupin podle:
a) absolutního objemu podávané parenterální výživy na začátku studie (< 1 500 vs. ≥ 1 500 ml/den);
b) anatomie reziduálního střeva:
• skupina 1: pacienti s jejunostomií nebo ileostomií (SBS typ I);
• skupina 2: pacienti bez stomie s > 50 % tlustého střeva v kontinuitě s anastomózou;
• skupina 3: ostatní pacienti s < 50 % tlustého střeva v kontinuitě s anastomózou nebo s kolostomií nebo jinou anatomií tlustého střeva;
c) etiologické příčiny SBS, resp. základního onemocnění (pacienti s Crohnovou chorobou vs. pacienti se SBS z vaskulární příčiny vs. pacienti s jinou etiologií SBS).
Výsledky této podskupinové analýzy ukázaly lepší přínos léčby teduglutidem:
1. u pacientů s vyšším objemem PV na začátku léčby, kteří dosáhli větší redukce podávané PV;
2. pro pacienty při SBS typ I s jejunostomií (PV ≥ 1 500 ml/den) ve smyslu větší redukce objemu PV než ostatní anatomické skupiny;
3. u pacientů se SBS v důsledku Crohnovy nemoci, kteří také dosáhli větší redukce objemu PV ve srovnání s ostatními etiologickými skupinami.
Bezpečnostní data z ověřovacích studií ukazují, že léčba teduglutidem byla bezpečná a dobře tolerovaná. Pouze šest pacientů léčených teduglutidem (14 %) vyvinulo protilátky proti teduglutidu. Avšak tyto protilátky nebyly neutralizující, neměly vliv na účinnost, systémovou hypersenzitivitu a neměly klinicky významné následky. Četnost nežádoucích příhod, závažných nežádoucích příhod a nežádoucích příhod souvisejících s léčbou (TEAE – treatment emergent adverse event) nebo přerušení léčby v důsledku závažných TEAE byla srovnatelná v obou skupinách pacientů (teduglutid, placebo). Výskyt závažných TEAE byl 36 % ve skupině léčené teduglutidem a 28 % ve skupině léčené placebem. Četnost TEAE vedoucí k přerušení léčby byla 5 % u skupiny léčené teduglutidem a 7 % u skupiny léčené placebem. V průběhu klinických studií došlo k jednomu úmrtí na metastazující adenokarcinom jater, které bylo dáváno do souvislosti s podáváním teduglutidu. Běžnými nežádoucími účinky v rámci studie s teduglutidem byly bolesti břicha (28 %), nauzea (26 %), reakce v místě injekce (26 %), abdominální distenze (17 %), stomické komplikace (16 %), bolesti hlavy (16 %) a zvracení (14 %). Výskyt těchto událostí byl ve skupině s placebem vždy nižší. Poruchy spánku a anxieta byly na teduglutidu rovněž častější. Jiné nežádoucí události zahrnovaly střevní obstrukci, biliární obtíže (cholecystitidu, cholangoitidu a cholelitiázu), pankreatitidu a stenózu pankreatického vývodu [1].
Před zahájením léčby teduglutidem a v jejím průběhu je třeba monitorovat hladiny bilirubinu, alkalické fosfatázy, lipázy a amylázy. Podávání analogů GLP-2 je kontraindikováno u pacientů s gastrointestinální malignitou nebo s jejím anamnestickým výskytem. Před zahájením léčby teduglutidem se doporučuje provedení koloskopie, potom po 1–2 letech léčby a následně každých 5 let. Rovněž před zahájením léčby je třeba odstranit detekované kolorektální polypy. Bezpečnost podávání a účinnost teduglutidu byla kromě dospělých ověřena i u dětí od 1 do 17 let.
Teduglutid potenciálně zvyšuje absorpci současně podávaných perorálních léčiv, a proto je třeba věnovat pozornost zejména v případě léků s úzkým terapeutickým rozmezím nebo potřebou titrace jejich dávky (např. benzodiazepiny, opiáty, digoxin a antihypertenzní léky). Podle výsledků in vitro studií se zdá, že teduglutid neovlivňuje enzymy z řady cytochromů P450. U teduglutidu nejsou předpokládány lékové interakce zprostředkované p-glykoproteinem.
Doporučovaná dávka teduglutidu je 0,05 mg/kg jednou denně. Podává se subkutánně do pravidelně střídaných míst v abdominální oblasti. Alternativně lze injekce aplikovat i do podkoží stehna nebo paže. Po aplikaci je maximální plazmatická hladina léčiva dosažena za 3–5 hodin. Biologický poločas teduglutidu jsou 2 hodiny a eliminace léčiva se předpokládá v ledvinách. U pacientů se středně těžkou až těžkou renální insuficiencí (kreatininová clearence < 50 ml/min) nebo u pacientů na dialýze je třeba dávku redukovat na polovinu. Dávky není třeba redukovat u mírné nebo středně těžké jaterní dysfunkce. U těžkých poruch jaterních funkcí nebylo podávání teduglutidu zatím testováno.
Státní ústav pro kontrolu léčiv stanovil podmínky úhrady léčivého přípravku teduglutid (REVESTIVE) s platností od 1. 2. 2021 s přispěním Společného stanoviska Všeobecné zdravotní pojišťovny a Společnosti klinické výživy a intenzivní metabolické péče ČLS JEP o doporučených podmínkách použití léčivých prostředků s obsahem účinné látky teduglutid v léčbě pacientů se syndromem krátkého střeva a o síti indikujících specializovaných center [5]. Léčba se provádí na určených specializovaných pracovištích, a to v rámci smluvně zajištěné centrové péče. Teduglutid je tímto způsobem hrazen k nepaliativní léčbě syndromu krátkého střeva s chronickým střevním selháním (SBS-CIF):
1. U dospělých pacientů se SBS-CIF, kteří splňují kritéria Evropské společnosti klinické výživy a metabolizmu (ESPEN) dle Pironiho z roku 2018 (PN1–PN4), kdy adaptace střeva probíhá alespoň 6 měsíců, parenterální výživa je optimalizována, stabilizována a užívána alespoň 12 měsíců, minimálně 3 dny v týdnu a není již jiná možnost dosáhnout zlepšení funkce střeva (schéma 1). Léčba teduglutidem je vždy hrazena u dospělých pacientů s možným rizikem nežádoucích účinků parenterální výživy:
• progresivní hepatopatie F3 a méně a/nebo;
• zbývají nejvíce tři centrální žilní vstupy a/nebo;
• metabolická kostní choroba.
U pacientů s Crohnovou nemocí musí být při nasazení léčby toto onemocnění v klinické remisi nejméně 12 týdnů.
2. Pediatrickým pacientům od 1 roku, kdy adaptace střeva probíhá alespoň 6 měsíců a parenterální výživa je optimalizována a stabilizována [6].
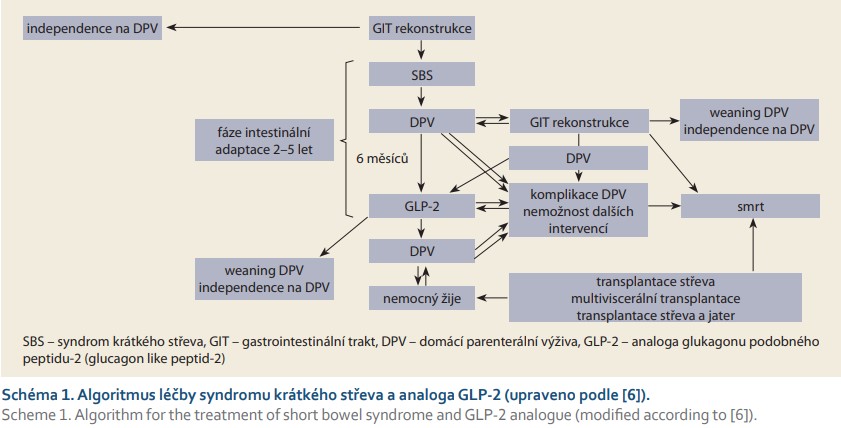
Léčba teduglutidem je kontraindikována u pacientů s aktivním maligním onemocněním nebo s podezřením na malignitu a u pacientů s anamnézou výskytu maligního onemocnění gastrointestinálního traktu včetně hepatobiliárního systému a pankreatu v posledních 5 letech. Léčba se ukončí kdykoli z důvodu neakceptovatelné toxicity nebo pokud není po 52 týdnech dosaženo alespoň 20% redukce v objemu parenterální výživy. Závěrem lze uvést, že podávání teduglutidu snižuje potřebu parenterální výživy u pacientů se SBS-CIF. Dlouhodobá léčba teduglutidem je indikována zejména u pacientů, u kterých jeho podávání vede k ukončení podávání parenterální výživy nebo k jeho významné redukci. Pacienti na terapii teduglutidem jsou pravidelně monitorováni z hlediska výskytu gastrointestinálních tumorů.
doc. MUDr. František Novák, Ph.D.
IV. interní klinika
1. LF UK a VFN v Praze
U nemocnice 2
128 08 Praha 2
Fnova@lf1.cuni.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Jeppesen PB, Pertkiewicz M, Messing B et al. Teduglutide reduces need for parenteral support among patients with short bowel syndrome with intestinal failure. Gastroenterology 2012; 143(6): 1473–1481. doi: 10.1053/j.gastro.2012.09.007.
2. Schwartz LK, O’Keefe SJD, Fujioka K et al. Long-term teduglutide for the treatment of patients with intestinal failure associated with short bowel syndrome. Clin Transl Gastroenterol 2016; 7(2): e142. doi: 10.1038/ctg.2015.69.
3. Jeppesen PB, Gilroy R, Pertkiewicz M et al. Randomised placebo-controlled trial of teduglutide in reducing parenteral nutrition and/or intravenous fl uid requirements in patients with short bowel syndrome. Gut 2011; 60: 902–914. doi: 10.1136/gut.2010.218271.
4. O’Keefe SJD, Jeppesen PB, Gilroy R et al. Safety and effi cacy of teduglutide after 52 weeks of treatment in patients with short bowel intestinal failure. Clin Gastroenterol Hepatol 2013: 11: 815–823. doi: 10.1016/j.cgh.2012.12. 029.
5. Společné stanovisko VZP ČR a SKVIMP ČLS JEP. 2020 [online]. Dostupné z: https://media. vzpstatic.cz/media/Default/dokumenty/spolecna-stanoviska/2020_06_10_spolecne-stanovisko_lp-revestive.pdf.
6. Wohl P, Šenkyřík M, Těšínský P et al. Konsenzus odborníků v léčbě SBS. 2019 [online]. Dostupné na: http://www.skvimp.cz/soubory/Advisory-Board-Revestive-Consensus-Praha-14.10.2019.pdf.