Péče o pacienty po transplantaci jater a kdo ji má provádět?
Pavel Trunečka1
+ Pracoviště
Souhrn
Transplantace jater v současnosti představuje léčebnou metodu volby pro pacienty s nevratným selháním jater u chronických chorob, některých poruch metabolizmu, případů akutního selhání jater a některých nádorových onemocnění. Tato léčba je v České republice široce dostupná pro potřebné nemocné a přežívání pacientů v závislosti na indikaci a věku dosahuje výborných výsledků. Dlouhodobé přežívání však závisí také na kvalitní doživotní péči o příjemce transplantovaného orgánu. Tato péče je v současnosti z velké části poskytována transplantačními centry, často v celém rozsahu, tedy i v oblastech, které patří do kompetencí primární péče. S ohledem k narůstajícímu počtu příjemců, jejich stárnutí a rostoucí polymorbiditě je tento stav dlouhodobě obtížně udržitelný. Z tohoto důvodu je nezbytné nalézat správnou míru kooperace mezi lékaři primární péče a lékaři transplantačního centra. Je zřejmé, že problematika specifických komplikací transplantace – technických, imunologických a rekurence základního onemocnění – bude trvale řešena lékaři transplantačního centra, stejně jako řízení jejich imunosupresivní léčby. Lékaři primární péče by ale měli mít základní přehled o charakteru nejběžnějších komplikací, se kterými se mohou v průběhu sledování pacientů setkat. Komunitní nemoci nebo řešení různých akutních stavů bez souvislosti s transplantací jsou přirozeně léčeny v místě bydliště. Ale i běžná onemocnění, která se často v souvislosti s transplantací a imunosupresivní léčbou vyskytují (obezita, arteriální hypertenze, diabetes, dyslipidemie, kostní choroba), by mohly být řešeny praktickým lékařem či internistou v místě bydliště pacienta. Stejně tak preventivní péče, nádorový screening a vakcinace by mohly být prováděny lékaři primární péče. Vzájemná domluva, edukace a koordinace činností lékařem transplantačního centra jsou nezbytnou podmínkou udržitelnosti vysoké kvality potransplantační péče o zvětšující se populaci příjemců jaterního štěpu.
Klíčová slova
transplantace jater, komplikace transplantace jater, imunosuprese, primární péče
Úvod
Od 80. let minulého století je transplantace jater považována za standardní metodu léčby akutního selhání jater, konečného stadia chronických jaterních onemocnění, některých nádorů a metabolických vad [1]. Její dostupnost v České republice se začala zvyšovat od druhé poloviny 90. let a postupem času jsme se v počtu provedených transplantací jater na počet obyvatel dostali nad evropský průměr. V současnosti se v ČR ve dvou transplantačních centrech (TC) provádí přibližně 200 transplantací jater ročně, v loňském roce to bylo 206 transplantací (https:/ / kst.cz/ statistiky). V současnosti žije v ČR přibližně 2 500 pacientů s funkčním jaterním štěpem.
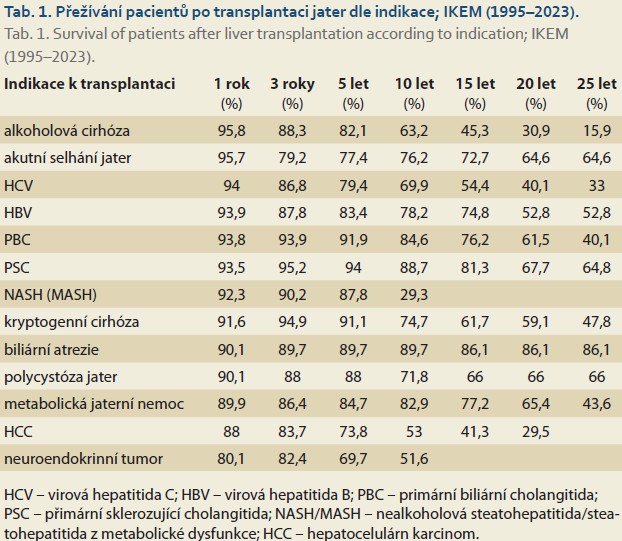
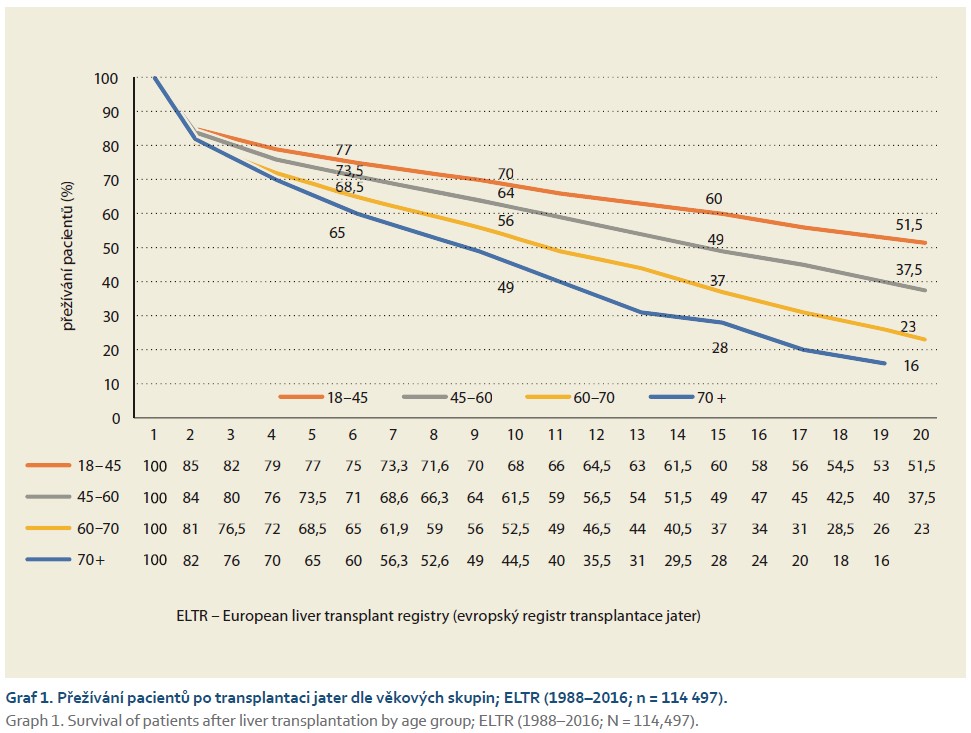
Přes svou náročnost představuje transplantace jater velmi úspěšnou léčebnou metodu, která poskytuje správně vybraným pacientům dlouhodobé přežití s kvalitou života, která se neliší od hodnot naměřených u běžného chronického onemocnění, kterým je například arteriální hypertenze. Dlouhodobé přežívání závisí do značné míry na onemocnění, pro které byla transplantace jater provedena (tab. 1), a velmi významně též na věku příjemce (graf 1). Přežívání štěpů rovněž ovlivňují faktory, které se stavem příjemce nesouvisí, především kvalita přeneseného orgánu. Ta se v posledních dvou dekádách celosvětově významně zhoršuje, též v souvislosti s nárůstem počtu obézních kadáverů, s nutností používat štěpy od zemřelých dárců vyšších věkových skupin i s častějším využití štěpů od ECD dárců (dárci indikovaní dle rozšířených kritérií; např. orgány získané od dárců po smrti oběhu nebo dárců s virovou hepatitidou C a další). Tyto faktory se budou propisovat do zhoršování výsledků dlouhodobého přežívání v budoucích letech, mírného poklesu jsme ale svědkem již nyní. O to více vyvstává potřeba zajistit adekvátní a dostupnou dlouhodobou péči o příjemce jater, což nemusí být snadné jak z důvodu jejich rostoucího počtu, tak i z důvodu jejich stárnutí a častějších polymorbidit [2].
Nejvíce jsou příjemci jater ohroženi bezprostředně po transplantaci a následně i v průběhu prvého roku od transplantace. V té době jsou buď hospitalizováni, nebo jsou dostatečně často sledováni v transplantačním centru. V následujících letech jsou ale jejich kontroly v TC méně časté, typicky se jedná o 3– 6měsíční intervaly. Je logické, že část zdravotní péče se odehrává mimo TC, a to z důvodu limitované kapacity, z důvodu pohodlí pacienta snížením dojezdových vzdáleností, případně i pro potřebu další specializované péče, kterou TC není schopno vlastními silami zajistit.
Sledování stavu jaterního štěpu a řešení případné dysfunkce či ostatních komplikací specifických pro příjemce jater ať již technických, nebo imunologických probíhá v transplantačním centru doživotně, neboť tyto oblasti péče vyžadují specifické znalosti, které lékař mimo TC může jen obtížně získat. Naproti tomu většinu ostatní zdravotní péče může efektivně poskytnout pracoviště blíže bydliště pacienta, a vyvstává tak potřeba správného rozdělení oblastí, o kterou se trvale bude starat transplantační specialita a kterou bude lépe poskytovat lékař primární péče v místě bydliště. Do současnosti se ale značná část péče o příjemce jaterního štěpu, již bychom mohli považovat za péči primární, odehrává v TC. Důvody jsou různé, počínaje očekáváním pacientů získávat trvale kompletní péči od lékařů TC přes nedostatečnou vzájemnou komunikaci mezi TC a lékaři primární péče až po případné obavy lékařů mimo centrum zasahovat do péče o imunosuprimované pacienty. Přesné hodnocení situace není k dispozici a existuje jen málo prací, které se zabývají rozdělením péče o příjemce jater mezi specialisty TC a lékaře primární péče. Ve většině případů se týkají severoamerické reality. Přitom zkušenosti z organizace péče v zámoří lze jen obtížně transponovat do prostředí ČR, jednak pro nesrovnatelné dojezdové vzdálenosti, jednak pro zcela odlišné financování lékařské péče [3]. Z dostupných prací vyplývá heterogenita rozdělení kompetencí mezi TC a periferní lékaře.
Zajímavé výsledky přineslo dotazníkové šetření provedené v transplantačních centrech a mezi spolupracujícími lékaři v USA. Celkem 40 % transplantačních specialistů soudí, že primární péči po transplantaci jater by měl zajišťovat rodinný lékař, podle 35 % by to měl být transplantační hepatolog, podle 11 % transplantační chirurg, podle 14 % hepatolog a nikdo z dotázaných neočekával, že by primární péči mohl poskytovat doporučující gastroenterolog. Dotázaní rodinní lékaři se cítili komfortně při péči o nemocné po transplantaci jater ve 73 %; 55 % z nich by si přálo řešit zdravotní stav pacienta kompletně s výjimkou problematiky jaterního štěpu, 36 % pouze otázky, které řeší zcela běžně u jiných pacientů, a 9 % rodinných lékařů si přálo, aby se veškerá péče odehrávala v TC [4].
Novější dotazníková studie týkající se péče po transplantaci jater pochází rovněž z USA a zahrnula 280 transplantačních hepatologů. Dle výsledku šetření byl za primární péči u pacientů po transplantaci jater v 66 % zodpovědný hepatolog, ve 24 % rodinný lékař a v 9 % transplantační chirurg. Lékař primární péče by se měl ideálně postarat o oblast hypertenze 78,8 %; diabetu 63,2 %; dyslipidemie 78,3 % a kostní choroby 72,5 %. Dle zkušeností lékařů centra ale byla péče v těchto oblastech prováděna správně jen u 45,4 %; 51,4 %; 44,6 %; resp. 38 % [5].
Podobné práce z evropského prostředí chybí, nicméně z různých odborných doporučení je patrno, že při dlouhodobé péči o pacienty se předpokládá spolupráce především s praktickými lékaři, internisty, případně s hepatology, a to především při léčbě běžných akutních i chronických onemocnění, pravidelných preventivních prohlídkách a vakcinaci.
Koordinace zdravotní péče o příjemce jater transplantačním centrem je jistě velmi žádoucí. Sledování funkce jaterního štěpu, udržování optimální úrovně imunosuprese a léčba komplikací specifických pro transplantační výkon budou pravděpodobně trvalou doménou specialistů transplantačních center. Zdravotní péči o onemocnění, která s transplantací přímo nesouvisejí, vyskytují se v populaci běžně a jejichž objem jasně přesahuje možnosti provádět ji v TC, by měli poskytnout lékaři primární péče. S narůstajícím počtem pacientů po transplantaci jater, s jejich stárnutím a menší schopností cestovat tak bude narůstat pravděpodobnost, že lékař primární péče bude mít ve své praxi příjemce transplantovaného orgánu. Měl by tedy rozumět základním principům jejich sledování a být seznámen s nejběžnějšími komplikacemi, aby se mohl efektivně zapojit do jejich léčby, která se ve většině případů nijak zvlášť neliší od péče, kterou poskytuje pro běžnou populaci.
Komplikace po transplantaci jater
V následujícím textu se vyhneme popisu komplikací typických pro časné pooperační období, tedy primární afunkci, časným rejekcím jaterního štěpu a infekcím pooperačního období, neboť vznikají téměř výlučně v období, kdy je pacient hospitalizován. Komplikace vyplývající z vlastního chirurgického výkonu, ačkoli jsou rovněž ponejvíce časné, se však mohou projevit i později po transplantaci. Jedná se především o komplikace technické (cévní, biliární, rané), komplikace imunologické (odhojování štěpu – rejekce), rekurence základního onemocnění, některé infekce (cytomegalovirus, připadně EB viróza) a lymfoproliferativní a nádorová onemocnění. Tyto stavy budou velmi pravděpodobně i v budoucnosti řešit specialisté TC a podrobnější diferenciální diagnostika těchto stavů přesahuje rozsah článku. Lékař primární péče by však o nich měl mít alespoň obecné povědomí a stejně tak i o základech imunosupresivní léčby [6]. Její komplikace jsou velmi běžné a jejich diagnostika a léčba představují podstatnou část potransplantačního sledování.
Hlavní technické komplikace transplantace jater
Trombóza jaterní arterie vznikne asi u 1– 5 % pacientů, většinou těsně po transplantaci. V tom případě často vede k těžké dysfunkci štěpu. Řešením je chirurgická trombektomie, endovaskulární výkon nebo i retransplantace. V pozdějším období nemusí být její příznaky dramatické, může se projevit jen mírnou dysfunkcí štěpu, která nemusí být vůbec zaznamenána, a stav je zjištěn až při zobrazovacím vyšetření nebo při hledání příčin biliární komplikace, k níž často vede. Trombóza porty je mnohem vzácnější a vyskytuje se téměř výhradně časně po transplantaci. Trombózou jaterních žil se projevuje recidiva Budd-Chiariho syndromu nebo nádor jater. Diagnostika cévních komplikací spočívá v dopplerovském sonografickém vyšetření a angiografii (CT nebo MR). Na přímou angiografii může navázat endovaskulární výkon. Léčbu stanoví TC a při podezření na cévní komplikaci by měl být další postup konzultován bezodkladně [7,8].
Biliární komplikace vznikají buď technickou chybou při operaci, nebo později v důsledku konzervačních nebo ischemických změn žlučovodů. Prvé z nich bývají v anastomóze a dají se léčit endoskopickou či transkutánní balonkovou dilatací nebo zavedením stentu. Výjimečně je nutná operační revize a změna typu biliodigestivní anastomózy. Neanastomotické striktury bývají často vícečetné, mohou souviset s konzervačním poškozením, ischemií štěpu nebo recidivou základního onemocnění, především PSC. V těchto případech je nechirurgická léčba obtížnější a stav si po určité době vyžádá retransplantaci. Na biliární komplikaci upozorní vzestup laboratorní známky cholestázy, ikterus, tekutinové ložisko poblíž jaterní hilu, cholangitida nebo i septický stav. I zde je další postup nutno koordinovat s TC, neboť pro úspěch technického řešení je důležitá zkušenost s pacienty po transplantaci [9,10].
Vzhledem k velikosti jizvy i často velmi špatnému stavu břišní stěny před transplantací jsou kýly v jizvě častou komplikací. Rozhodně se nejedná o triviální záležitost a i zde je s výhodou vyšetření a operační řešení v transplantačním centru.
Infekce
Příjemce jater je infekcí nejvíce ohrožen v časném období po transplantaci, následně potom v prvých 6 měsících, kdy se mohou objevit tzv. oportunní infekce typické pro pacienty s vyšší úrovní imunosuprese. V následujících měsících a letech jsou pacienti vystaveni většinou jen běžným komunitním infekcím.
Z infekcí, které vyžadují u transplantovaných zvláštní pozornost, je to především cytomegalovirus (CMV), který se vyskytuje až u desítek procent pacientů. Protože v prvých 3– 6 měsících po transplantaci jater jsou příjemci chráněni antivirovou profylaxí, projevuje se infekce většinou později. Hlavním příznakem je teplota (CMV nemoc), případně se mohou objevit i známky orgánového postižení, nejčastěji hepatitida nebo kolitida. V diagnostice se uplatňuje přímé stanovení viru metodou kvantitativní PCR v plné krvi, orgánové postižení je však třeba prokázat biopticky. V léčbě se uplatňují virostatika, především ganciclovir. Léčba je prováděna většinou v TC [11].
Další velmi významnou chorobou u transplantovaných je tuberkulóza (TB), na niž je třeba myslet u nevysvětlitelných teplot. U imunosuprimovaných je až 50krát častější ve srovnání s běžnou populací a léčba je komplikována pro četné lékové interakce antituberkulotik s blokátory kalcineurinu (CNI), jejich hepatotoxicitou i případnou rezistencí TB. Diagnostika je nesnadná a spolupráce s plicním specialistou orientovaným v transplantační problematice je nezbytná [12].
Virová hepatitida E u imunosuprimovaných vede, na rozdíl od obecné populace, k chronické infekci, vývoji fibrózy, cirhózy, případně i k jaternímu selhání. To je v poslední době častější a vyšetření HEV RNA musí být součástí vyšetření každé nejasné jaterní dysfunkce s hepatitickým obrazem. Léčba ribavirinem bývá úspěšná, i když zdlouhavá, a má být prováděna zkušeným specialistou, neboť účinná dávka se pohybuje okolo hranice toxicity a bývá dosti pravidelně provázena klinicky významnou anemií [13].
Imunologické komplikace transplantace jater a imunosupresivní léčba
Buňkami zprostředkovaná rejekce (dříve celulární rejekce) se většinou dostavuje v prvních měsících po transplantaci, může se však objevit i později v souvislosti se snížením intenzity imunosuprese z důvodu vysazení léku, nespolupráce pacienta nebo snížením krevních koncentrací z důvodu lékové interakce. Stav se projeví vzestupem jaterních testů, vzácně klinickými projevy, jako jsou slabost, horečka nebo i ikterus. Léčí-li se časně, nevede k trvalému poškození štěpu. Neléčená ale progreduje do jaterního selhání. Pozdní celulární rejekce bývají hůře léčitelné a často se kombinují s rejekcí zprostředkovanou protilátkami. Ta může vzniknout kdykoli po transplantaci, příznaky bývají velmi pozvolné, zvýšení aminotransferáz není obligatorní, běžná je cholestáza. V séru se objevují donor specifické protilátky. Vede k fibróze štěpu a jeho selhání. Ve většině případů probíhá roky, je obtížně léčitelná. Nejčastější příčinou je inadekvátní imunosuprese, kolísání hladin a předchozí imunizace příjemce. Hlavním diagnostickým nástrojem u rejekcí štěpu je biopsie [14]. Chronická rejekce je ve většině případů výsledkem dlouhodobě inadekvátní imunosuprese. Vede k fibrotizaci štěpu, zániku žlučovodů i změnám cév. Je nevratná [15,16].
Imunosupresivní léčba je pro většinu příjemců celoživotní nezbytností, její intenzita se ale s dobou od transplantace snižuje. Dávkování vyžaduje expertizu v oboru a úpravy lze provádět jen na základě znalosti krevních koncentrací léků. Hlavní skupinou imunosupresiv jsou tzv. blokátory kalcineurinu, tj. skupina látek blokujících produkci interleukinu-2 v T-lymfocytech, která brání iniciaci imunitní odpovědi na cizí antigen. Hlavním představitelem je tacrolimus (Tac), lék, který dnes užívá více než 90 % příjemců jater. V ČR převažuje léčba preparáty s pozvolným uvolňováním (Advagraf®, Tacforius®, Envarsus®), jež se podávají v jedné ranní dávce. Léčba je individualizovaná podle minimální krevní koncentrace, která se stanoví z odebrané krve těsně před podáním dávky (tedy 24 hod po podání dávky předchozí). Druhým zástupcem je cyklosporin A (CyA) (Sandimmun Neoral®, Equoral®), který se podává ve 12hodinových intervalech a jeho dávkování se řídí rovněž dle minimální koncentrace. Oba léky jsou určeny k léčbě specialisty v TC. Podstatnou vlastností obou těchto léků je jejich odbourávání cytochromy P450A3. Vzhledem k tomu, že celá řada běžně užívaných léků aktivitu tohoto cytochromu ovlivňuje ve smyslu indukce nebo inhibice, může dojít k ovlivnění výsledných koncentrací imunosupresiv o desítky procent, ale i násobně. Proto je zcela nezbytné před podáváním nového léku u pacientů po transplantaci zkontrolovat případnou interakci, a není-li možné se jeho podání vyhnout, diskutovat úpravu dávky imunosuprese s příslušným transplantačním centrem. Blokátory kalcinuerinu mají rovněž celou řadu nežádoucích účinků metabolických, zvyšují výskyt diabetu, hypertenze, hyperlipidemie, zvyšují pravděpodobnost vzniku kostní choroby a jsou významně nefrotoxické. Imunosupresiva rovněž zvyšují výskyt některých nádorových onemocnění. Snaha o používání nejnižších možných účinných dávek je tedy namístě. Mezi další imunosupresiva, běžně používaná po transplantaci jater, patří antiproliferativní látky: mykofenolová kyselina (MMF) – Cell Cept®, Myfenax®, azatioprin. Tyto léky mnohou významně ovlivňovat krvetvorbu, vedou především k leukopenii. Mívají též časté gastrointestinální vedlejší účinky, především průjmy. M-TOR (mammalian target of rapamycin) inhibitory (sirolimus – Rapamune®, everolimus – Certican®) zvyšují pravděpodobnost vzniku otoků, vedou ke kožním a slizničním projevům (ulcerace) a zvyšují hladinu triglyceridů. Část pacientů po transplantaci jater užívá malé dávky steroidů, ve většině případů se jedná o pacienty po transplantaci jater pro autoimunitní onemocnění. Obecně lze říct, že imunosupresiva jsou skupinou léků s úzkým terapeutickým oknem a jejich indikace i úpravy dávek spadají do kompetence transplantačních specialistů (tab. 2) [17,18].
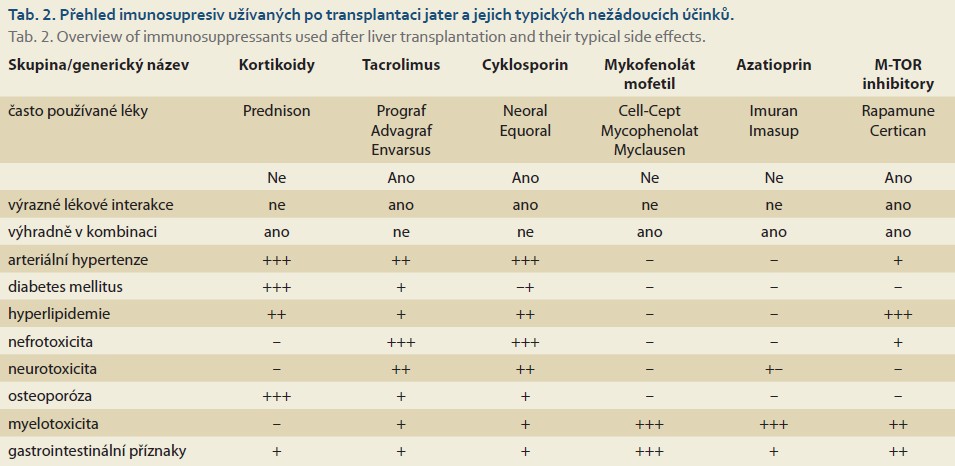
Kromě vedlejších účinků uvedených v tabulce je běžná porucha hojení ran, pneumonitida, nitro ústní ulcerace při podávání M-TOR inhibitorů, hirsutizmus a gingivální hyperplazie po cyklosporinu. Kortikoidy jsou spojovány s psychiatrickými nežádoucími účinky. Alopecii působí tacrolimus, slábnutí vlasů azatioprin a MMF.
Renální komplikace po transplantaci jater
Renální onemocnění u cirhotiků a následně i u pacientů po transplantaci jater se vyskytují často, přibližně 50 % příjemců 10 let po transplantaci trpí chronickým onemocněním ledvin (CKD – chronic kidney disease) [19]. Na zhoršení funkce ledvin se podílí celá řada faktorů již před transplantací (glomerulonefritidy u virových hepatitid, glomerulopatie u MASLD a dalších metabolických chorob, obecně i hepatorenální syndrom v pokročilé fázi jaterní insuficience). Ledviny poškozuje i vlastní transplantační výkon, který je spojen s hypoperfuzí ledvin. Pooperační péče se nemusí obejít bez podávání toxických antibiotik, iniciální dávky imunosuprese, zejména CNI, jsou vyšší. S výjimkou pacientů po transplantaci tenkého střeva trpí příjemci jater z dlouhodobého hlediska poruchu funkce ledvin ze všech orgánových transplantací nejčastěji [20]. Přítomnost renálního selhání významně zvyšuje mortalitu pacientů a zhoršuje přežívání jaterního štěpu.
Z dlouhodobého hlediska jsou u příjemců jater ledviny poškozovány především podáváním CNI (CyA je horší jež Tac). Při akutní intoxikaci (nevhodné dávkování, lékové interakace) dochází k vazokonstrikci v ledvinách, při chronickém poškození pak i k ireverzibilním změnám charakterizovaným hyalinizací aferentní i eferentní arterioly, glomeruloskleróze i k intersticiální fibróze. S ohledem k celkově nižším hladinám CNI jsou v současnosti tyto změny málo frekventní. K poškození ledvin však vedou i velmi časté metabolické komplikace, které imunosupresiva zhoršují, především diabetes, arteriální hypertenze i obezita [21].
Pečlivé sledování renálních funkcí je u pacientů před transplantací i po ní nezbytné, zároveň je třeba si uvědomit, že u sarkopenických pacientů clearance creatininu aktuální glomerulární filtraci nadhodnocuje. Vyšetření glomerulárná filtrace na základě clearance cystatinu C je přesnější. Z praktického hlediska je podstatná prevence – podávání nejnižších možných dávek CNI např. kombinací s MMF či M-TOR inhibitorem, pečlivá korekce hypertenze (ideálně systolický TK < 130 mmHg), prevence obezity a léčba diabates mellitus a maximální omezení zbytné nefrotoxické medikace (např. nesteroidních antirevmatik). V případě pokročilé fáze onemocnění (CKD 4– 5) je jistě namístě zvážit transplantaci ledviny, která vede k prodloužení přežívání pacientů po transplantaci jater.
Kardiovaskulární onemocnění
Kardiovaskulární mortalita je druhou nejčastější příčinou úmrtí příjemců jater. Podle většiny studií včetně metaanalýz je její celkový výskyt do 10 let od transplantace 11– 14 % [22], což přibližně odpovídá výskytu v běžné populaci. Časná kardiovaskulární mortalita je většinou vázána na preexistující onemocnění, klesá díky systematickému vyšetřování před transplantací a možnosti cílených invazivních intervencí. Pozdější kardiovaskulární mortalita je často svázána s výskytem metabolického syndromu, který se objevuje v populaci transplantovaných přibližně v 40– 60 %, častěji u pacientů po transplantaci pro MASH nebo kryptogenní cirhózu [23].
Metabolický syndrom u příjemců jater
Metabolický syndrom v současnosti postihuje značnou část všeobecné populace a je spojen s vyšším kardiovaskulárním rizikem. Příjemci jater s metabolickým syndromem mají přibližně 4násobnou kardiovaskulární morbiditu ve srovnání se zbytkem populace transplantovaných [24].
Velká část pacientů, zejména indikovaných pro selhávání jater, trpí před transplantací poruchou výživy. Po transplantaci se jaterní funkce normalizují a příjemci mají tendenci zvyšovat tělesnou hmotnost do té míry, že dochází ke vzniku poruch výživy v opačném smyslu. U velké části těchto nemocných se pak projevují známky metabolického syndromu. Přírůstek hmotnosti je téměř pravidlem a steatóza jaterního štěpu se do 10 let od transplantace týká téměř poloviny nemocných [25]. U pacientů indikovaných pro MASH nebo kryptogenní cirhózu je pak výskyt obezity a steatózy ještě vyšší. Imunosupresivní terapie podstatnou měrou přispívá k vývoji jednotlivých komponent metabolického syndromu: zejména steroidy a CNI přispívají k hypertenzi, poruchám glukózové tolerance a hyperlipidemii, M-TOR inhibitory nejsou nefrotoxické, dyslipidemie při jejich podávání však může být velmi výrazná. Léčba obezity po transplantaci jater zůstává velmi obtížná a málo úspěšná. Jedinou opravdu efektivní metodu představuje bariatrická chirurgie, ideálně v jedné době s vlastní transplantací. Nově se prosazují metody endoskopické bariatrie, které jsou ale méně účinné. V poslední době se na trhu objevují první vysoce účinné léky ze skupiny agonistů receptoru pro glucagon-like peptid 1 (GLP-1 RA), které se již delší dobu užívají u diabetu 2. typu, kratší dobu též k léčbě obezity i u pacientů po transplantaci jater. V nevelké studii vedlo podávání GLP-1 RA ke ztrátě 7,87 % tělesné hmotnosti po 1 roce podávání [26], dlouhodobé zkušenosti ale chybí. Vzhledem k tomu, že léčba obezity zůstává obtížnou disciplínou, je důležité příjemce edukovat a motivovat k udržování zdravého životního stylu od počátku a vytrvale.
Hyperlipidemie
Poruchy metabolizmu tuků jsou po transplantaci časté. Imunosupresiva potencují vznik hypercholesterolemie i hypertriacylglycerolemie. Ischemická choroba srdeční je druhou nejčastější příčinou úmrtí po transplantaci jater a dyslipidemie je velmi významným rizikovým faktorem jejího vzniku. Pacienti mají být vedeni k racionální výživě a v případě malého efektu mají být energicky léčeni účinnými hypolipidemiky. Podávání statinů je po transplantaci jater bezpečné a lékové interakce nehrozí. Obecná pravidla pro farmakoterpii dyslipidemií platí i u příjemců jater [27].
Hypertenze po transplantaci jater
Arteriální hypertenzí po transplantaci jater trpí až polovina příjemců. Pro léčbu platí obecná pravidla, za horní hranici normálního systolického krevního tlaku je třeba považovat 130 mmHg. S ohledem k vazokonstrikčnímu působení CNI jsou lékem první volby blokátory kalciového kanálu (amlodipin má menší interakci s metabolizmem CNI než verapamil). Druhou volbou jsou inhibitory angiotenzin konvertujícího enzymu, blokátory receptorů angiotenzinu II, sartany. S výhodou lze do terapie dále přidávat thiazidová diuretika nebo malou dávku spironolactonu. Betablokátory mají poměrně malý efekt. Léky je často třeba podávat v kombinaci a účinná farmakoterapie by měla vést k normalizaci TK při většině měření [28].
Diabetes mellitus
Pacienti s jaterní cirhózou mají často poruchu glukozové tolerance, a to i bez souvislosti s metabolickým onemocněním a obezitou, a velká část z nich zůstává v průběhu léčby jaterní cirhózy nerozpoznaná. Přítomnost diabetu je spojena s vyšší mortalitou transplantovaných. Po transplantaci dochází ke zlepšení stavu výživy, frekventně se objevuje nadváha i obezita. Zároveň jsou pacienti vystaveni účinkům diabetogenních léků, zejména steroidům a tacrolimu. Pacienti po transplantaci by měli být periodicky vyšetřováni na přítomnost diabetu (glykemie, glykovaný hemoglobin – HbA1c) a v případě pozitivního nálezu adekvátně léčeni diabetologem. Moderní léky ze skupiny GLP-1 RA nabízejí řadu výhod včetně redukce hmotnosti, která může bránit rekurenci MASH, a nemají žádnou významnou lékovou interakci s imunosupresivy [29].
Rekurence základního onemocnění
V minulosti významným způsobem snižovala přežití štěpu a byla častým důvodem k retransplantaci. Na zhoršování přežívání štěpu se podílely především rekurence virových hepatitid, které mají v současnosti efektivní řešení. V případě hepatitidy B je třeba rekurenci zabránit vhodnou profylaxí, nejlépe kombinací vysokých dávek imunoglobulinu anti-HBs spolu s účinným virostatikem. Vzhledem k integraci viru a dlouhodobé imunosupresi musí být profaxe trvalá. Při dodržení pravidel je její selhání velmi vzácné. V případě virové hepatitidy C, která se nyní vyskytuje ponejvíce u pacientů indikovaných pro HCC, lze příjemce velmi úspěšně léčit po transplantaci přímo působícími virostatiky a docílit eliminace viru, po níž je možno virostatickou léčbu ukončit [30,31].
Autoimunitní onemocnění po transplantaci jater běžně recidivují. Asi největší problém představují rekurence PSC (rPSC), které mohou životnost štěpu výrazně zkrátit. Vyskytnou se asi u 9– 27 % v průběhu 5 let od transplantace. Diagnóza nemusí být snadná, neboť obdobný radiologický nález na žlučovodech se vyskytuje i u biliárních komplikací vznikajících zejména po prezervačním poškození nebo ischemii. Léčba je obdobná jako před transplantací, prognóza štěpu je nejistá a rPSC vede často k retransplantaci [32].
Recidiva primární biliární cholangitidy je častá (18 % během 4 let od transplantace) a může ohrozit funkci štěpu během delšího sledování. Tento průběh je však velmi vzácný a ve většině případů není štěp ani dlouhodobě ohrožen. Je dost možné, že nové léky proti PBC budou účinné i v léčbě rekurence.
Rekurence autoimunitní hepatitidy je rovněž častá, výskyt je udáván u 7– 42 % příjemců. Lze ji obtížně odlišit od rejekčních změn, sérologie není podstatná, neboť autoprotilátky běžně perzistují i u pacientů bez rekurence. Závažnější průběh rekurence lze pozorovat u dětí, u dospělých je ztráta štěpu vzácná [33]. V případě prokázané rekurence autoimunitní hepatitidy je nezbytné podávat vyšší dávky imunosupresiv, podobně jako před transplantací se v léčbě uplatní steroidy, mykofenolová kyselina nebo azatioprin [34].
Rekurence MASH je rovněž častá, postihuje až 50 % příjemců. Podstatná je léčba obezity metodami bariatrické chirurgie, popřípadě endoskopie, velmi pravděpodobně zde najdou uplatnění léky ze skupiny GLP-1 RA [35]. Rekurence alkoholového poškození není častá, díky pečlivému výběru kandidátů se ke škodlivému pití vrací jen zlomek transplantovaných, problematika však vyžaduje trvalou pozornost a požadavek plné abstinence je vysoce relevantní [36]. Selhání štěpu pro recidivu alkoholové nemoci jater je vzácné.
Diagnostika rekurence základního onemocnění není vždy snadná, je založena především na expertním posouzení biopsie jaterního štěpu a zhodnocení klinického průběhu. Léčba rekurentního onemocnění by měla být v kompetenci transplantačního centra, rozhodování o retransplantaci je často nesnadné, přežívání štěpů retransplantovaných z důvodu rekurence onemocnění bývá s výjimkou časných retransplantací horší [37].
Nádory u příjemců jater
Nádorová onemocnění představují v současnosti hlavní problém transplantační hepatologie, a to jak z hlediska indikací, tak i během sledování pro nutnost řešit recidivy nádorů i nádory vzniklé u příjemců de novo. Rozvolňující se kritéria pro zařazení pacientů s HCC na čekací listinu, jakož i akceptace dalších onkologických indikací (cholangiocelulární karcinom, metastázy kolorektálního karcinomu, metastázy neuroendokrinních karcinomů) vedou k častější rekurenci nádorového onemocnění a zároveň se u onkologických pacientů častěji vyskytují nádorové duplicity. Obojí pak vede ke zvyšující se incidenci nádorů u příjemců orgánů [38].
Ve srovnání s běžnou populací se některé nádory u příjemců jater diagnostikují násobně častěji. Zejména to jsou nádory, v jejichž patogenezi hrají roli viry, alkohol nebo kouření, které je u příjemců jater pro alkoholovou jaterní cirhózu velmi časté. Lze předpokládat, že imunosuprese může snížit imunologický dohled nad procesem kancerogeneze. Nádorová onemocnění pak jsou hlavní příčinou úmrtí příjemců jater po 1 roce od transplantace [39].
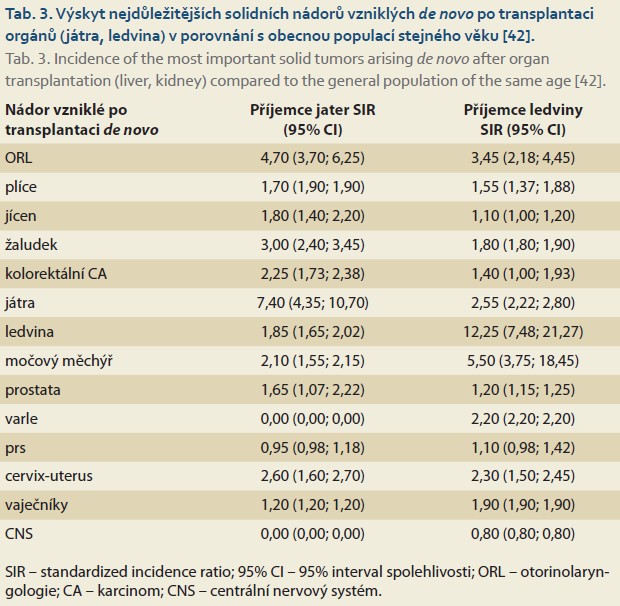
Tab. 3 uvádí relativní riziko výskytu nejběžnějších solidních nádorů u příjemců jater i ledviny. Zcela obecně lze říct, že se možnosti chirurgické i onkologické léčby solidních nádorů po transplantaci jater v poslední dekádě významně zlepšily. Úspěšná léčba většiny nádorů po transplantaci však i nadále závisí na časné detekci, proto se ve většině programů standardně doporučuje pravidelný screening onkologických onemocnění a programy mají vypracovanou efektivní spolupráci s onkologickým pracovištěm (tab. 4).
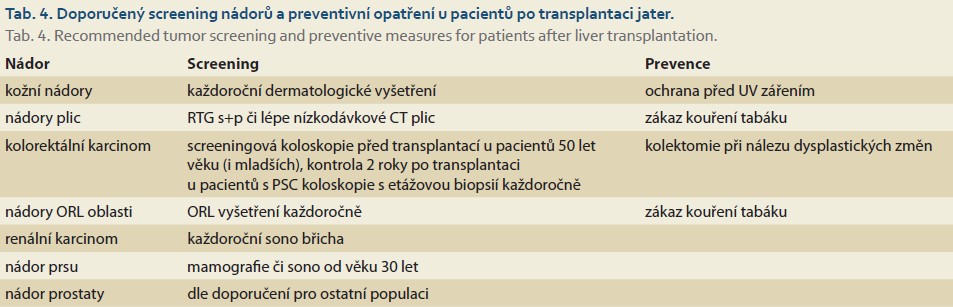
Krom solidních nádorů se velmi často vyskytují nádory kůže, a to jak maligní melanom, tak především nemelanomové nádory kůže, které vznikají hlavně na sluncem exponovaných místech u pacientů vyšších věkových skupin a delší dobu po transplantaci. Nejčastější je basocelulární karcinom kůže, který se ve srovnání s běžnou populací vyskytuje až 20krát častěji [40].
Až 50krát častěji oproti běžné populaci se vyskytuje Kaposiho sarkom, angioproliferativní nádor indukovaný HPV 8 (herpes virus 8).
Zvláštní kapitolu tvoří lymfoproliferativní onemocnění, které je po transplantaci jater častější než po transplantaci ostatních orgánů, postihne přibližně u 1– 3 % pacientů všech věkových skupin, častější je u dětí. Až v 80 % případů je spojeno s infekcí EB virem, často s vysokou replikací. Klinicky se krom nespecifických projevů, jako jsou teplota a únava, vyskytuje nález zvětšených lymfatických uzlin, popř. i solidní tumorózní ložisko, např. ve stěně střeva, hilu jater nebo i jinde. Z morfologického hlediska se jedná o kontinuum onemocnění od polyklonální polymorfní lymfoprolilferace, která většinou odezní po významné redukci imunosuprese až po lymfoproliferaci monoformní monoklonálního charakteru maligního lymfomu, které vyžaduje krom omezení imunosuprese na nezbytné minimum i specifickou léčbu, dnes většinou protilátku anti-CD20, často doplněnou o cytostatika obvyklá u léčby non-hodgkinských lymfomů. Prognóza je nejistá, opakované recidivy onemocnění jsou běžné [41].
Obecná preventivní opatření a očkování
Je běžnou praxí TC vyhledávat komplikace, které příjemce jater ohrožují stejně nebo více, než je běžné v obecné populaci. Krom nabádání k obecně zdravému životnímu stylu (zákaz kouření, konzumace alkoholu, udržení správné tělesné hmotnosti a zdatnosti) je vhodné i vyhledávání metabolických komplikací (diabetes, dyslipidemie, hyperurikemie, arteriální hypertenze, nádorový screening zaměřený na frekventní nádorová onemocnění), ale i vakcinace jako prevence závažných infekčních onemocnění. Očkování může probíhat v TC, s výhodou ale může být provedeno i v ordinaci praktického lékaře. Očkování se doporučuje ideálně před transplantací nebo s odstupem 3– 6 měsíců od transplantace. Zcela obecně je možno říct, že pacient má být vakcinován ve stejném rozsahu jako běžná populace příslušné věkové skupiny. Kontraindikovány jsou veškeré živé vakcíny. Ostatní lze aplikovat v běžném schématu, protilátková odpověď může být ale nižší vzhledem k imunosupresi. Běžně je doporučováno očkování proti virové hepatitidě A, hepatitidě B, lidskému papilomaviru, viru varicela zoster, proti chřipce – každoročně dle sezóny (možno již 1 měsíc po transplantaci), proti covidu-19 dle aktualizovaných doporučení. Vakcinace proti pneumokokům (různých skupin), hemofilům a meningokokům je indikováno u splenektomovaných. Indikováno je očkování proti tetanu, případně černému kašli. Různé vakcinace pro cestovatele je třeba individuálně projednat s vakcinačním centrem [3].
Závěr
Transplantace jater je v současnosti standardním výkonem s dobrou dostupností. Výsledky přežívání jsou ovlivněny věkem příjemce i základním onemocněním. Pro dlouhodobé kvalitní přežívání je nezbytné celoživotní sledování pacientů, které je organizováno a z velké části prováděno prostředky transplantačního centra. S ohledem k narůstajícímu počtu příjemců, jejich stárnutí a polymorbiditě je zapotřebí systematická spolupráce s lékaři primární péče i s dalšími odborníky v místě bydliště, zejména při řešení naléhavých stavů, běžných komunitních onemocnění i při léčbě chronických metabolických komplikací vyplývajících z dlouhodobé imunosupresivní léčby. Významný přínos by představovalo provádění preventivních prohlídek a očkování v ordinacích praktických lékařů či spádových internistů.
Péče o komplikace, které jsou specifické pro stav po transplantaci jater (rejekce, technické komplikace, rekurence základního onemocnění), a řízení imunosupresivní léčby pak trvale zůstane v kompetenci transplantačního centra.
Zlepšení stavu péče o příjemce jater předpokládá spolupráci, komunikaci a edukaci příjemců i jejich praktických lékařů.
ORCID autora
P. Trunečka 0000-0002-4753-4419.
Doručeno/ Submitted: 11. 7. 2025
Přijato/ Accepted: 28. 7. 2025
Korespondenční autor
MU Dr. Pavel Trunečka, CSc.
Klinika hepatogastroenterologie
Institut klinické a experimentální medicíny
Vídeňská 1958/ 9
140 21 Praha 4
patr@ikem.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. National Institutes of Health Consensus Development Conference: liver transplantation. R I Med J 1984; 67(2): 73– 76.
2. Adam R, Karam V, Cailliez V et al. 2018 annual report of the European Liver Transplant Registry (ELTR) – 50-year evolution of liver transplantation. Transpl Int 2018; 31(12): 1293– 1317. doi: 10.1111/ tri.13358.
3. Herzer K, Sterneck M, Welker MW et al. Current challenges in the post‐transplant care of liver transplant recipients in germany. J Clin Med 2020; 9(11): 3570. doi: 10.3390/ jcm9113570.
4. McCashland TM. Posttransplantation care: role of the primary care physician versus transplant center. Liver Transpl 2001; 7(Suppl 1): S2– S12. doi: 10.1053/ jlts.2001.28513.
5. Heller JC, Prochazka AV, Everson GT et al. Long-term management after liver transplantation: primary care physician versus hepatologist. Liver Transpl 2009; 15(10): 1330– 1335. doi: 10.1002/ lt.21786.
6. Singh S, Watt KD. Long-term medical management of the liver transplant recipient: what the primary care physician needs to know. Mayo Clin Proc 2012; 87(8): 779– 790. doi: 10.1016/ j. mayocp.2012.02.021.
7. Astarcıoglu I, Egeli T, Gulcu A et al. Vascular complications after liver transplantation. Exp Clin Transplant 2023; 21(6): 504– 511. doi: 10.6002/ ect.2018.0240.
8. Delgado-Moraleda JJ, Ballester-Vallés C, Marti-Bonmati L. Role of imaging in the evaluation of vascular complications after liver transplantation. Insights Imaging 2019; 10(1): 78. doi: 10.1186/ s13244-019-0759-x.
9. Seehofer D, Eurich D, Veltzke-Schlieker W et al. Biliary complications after liver transplantation: old problems and new challenges. Am J Transpl 2013; 13(2): 253– 265. doi: 10.1111/ ajt. 12034.
10. Moy BT, Birk JW. A review on the management of biliary complications after orthotopic liver transplantation. J Clin Transl Hepatol 2019; 7(1): 61– 71. doi: 10.14218/ JCTH.2018.00028.
11. Ossami Saidy RR, Kollar S, Czigany Z et al. Detrimental impact of immunosuppressive burden on clinical course in patients with Cytomegalovirus infection after liver transplantation. Transpl Infect Dis 2024; 26(1): e14196. doi: 10.1111/ tid.14196.
12. Abad CL, Razonable RR. Mycobacterium tuberculosis after solid organ transplantation: a review of more than 2000 cases. Clin Transplant 2018; 32(6): e13259. doi: 10.1111/ ctr.13259.
13. Te H, Doucette K. Viral hepatitis: Guidelines by the American Society of Transplantation Infectious Disease Community of Practice. Clin Transplant 2019; 33(9): e13514. doi: 10.1111/ ctr.13514.
14. Lee BT, Fiel MI, Schiano TD. Antibody-mediated rejection of the liver allograft: an update and a clinico-pathological perspective. J Hepatol 2021; 75(5): 1203– 1216. doi: 10.1016/ j. jhep.2021.07.027.
15. Levitsky J, Goldberg D, Smith AR et al. Acute rejection increases risk of graft failure and death in recent liver transplant recipients. Clin Gastroenterol Hepatol 2017; 15(4): 584.e2– 593.e2. doi: 10.1016/ j. cgh.2016.07.035.
16. Demetris AJ, Bellamy C, Hübscher SG et al. 2016 comprehensive update of the Banff working group on liver allograft pathology: introduction of antibody-mediated rejection. Am J Transpl 2016; 16(10): 2816– 2835. doi: 10.1111/ ajt.13909.
17. Barshes NR, Goodpastor SE, Goss JA. Pharmacologic immunosuppression. Front Biosci 2004; 9: 411– 420. doi: 10.2741/ 1249.
18. Oka T, Yoshimura N. Immunosuppression in organ transplantation. Jpn J Pharmacol 1996; 71(2): 89– 100. doi: 10.1254/ jjp.71.89.
19. Weber ML, Ibrahim HN, Lake JR. Renal dysfunction in liver transplant recipients: evaluation of the critical issues. Liver Transplant 2012; 18(11): 1290– 1301. doi: 10.1002/ lt.23522.
20. Ojo AO, Held PJ, Port FK et al. Chronic renal failure after transplantation of a nonrenal organ. N Engl J Med 2003; 349(10): 931– 940. doi: 10.1056/ NEJMoa021744.
21. Sharma P, Bari K. Chronic kidney disease and related long-term complications after liver transplantation. Adv Chronic Kidney Dis 2015; 22(5): 404– 411. doi: 10.1053/ j. ackd.2015.06.001.
22. Konerman MA, Fritze D, Weinberg RL et al. Incidence of and risk assessment for adverse cardiovascular outcomes after liver transplantation: a systematic review. Transplantation 2017; 101(7): 1645– 1657. doi: 10.1097/ TP.0000000000001710.
23. Anastácio LR, Diniz KG, Ribeiro HS et al. Prospective evaluation of metabolic syndrome and its components among long-term liver recipients. Liver Int 2014; 34(7): 1094– 1101. doi: 10.1111/ liv.12495.
24. Madhwal S, Atreja A, Albeldawdi M et al. Is liver transplantation a risk factor for cardiovascular disease? A meta-analysis of observational studies. Liver Transpl 2012; 18(10): 1140– 1146. doi: 10.1002/ lt.23508.
25. Hejlova I, Honsova E, Sticova E et al. Prevalence and risk factors of steatosis after liver transplantation and patient outcomes. Liver Transpl 2016; 22(5): 644– 655. doi: 10.1002/ lt. 24393.
26. Richardson SH, Wong G, Garner E et al. Utility of glucagon-like peptide 1 receptor agonists as anti-obesity medications in liver transplant recipients. Liver Transpl 2024; 30(2): 226– 228. doi: 10.1097/ LVT.0000000000000233.
27. Watt KD, Charlton MR. Metabolic syndrome and liver transplantation: a review and guide to management. J Hepatol 2010; 53(1): 199– 206. doi: 10.1016/ j. jhep.2010.01.040.
28. Fatourou EM, Tsochatzis EA. Management of metabolic syndrome and cardiovascular risk after liver transplantation. Lancet Gastroenterol Hepatol 2019; 4(9): 731– 741. doi: 10.1016/ S2468-1253(19)30181-5.
29. Liarakos AL, Tentolouris A, Kokkinos A et al. Impact of glucagon-like peptide 1 receptor agonists on peripheral arterial disease in people with diabetes mellitus: a narrative review. J Diabetes Complications 2023; 37(2): 108390. doi: 10.1016/ j. jdiacomp.2022.108390.
30. Delman AM, Ammann AM, Shah SA. The current status of virus-positive liver transplantation. Curr Opin Organ Transplant 2021; 26(2): 160– 167. doi: 10.1097/ MOT.00000000000 00850.
31. Park JS, Gayam V, Pan CQ. Review article: preventing hepatitis B graft infection in hepatitis B patients after liver transplantation: immunoglobulin vs anti-virals. Aliment Pharmacol Ther 2020; 52(6): 944– 954. doi: 10.1111/ apt.15999.
32. Visseren T, Erler NS, Polak WG et al. Recurrence of primary sclerosing cholangitis after liver transplantation – analysing the European Liver Transplant Registry and beyond. Transpl Int 2021; 34(8): 1455– 1467. doi: 10.1111/ tri.13925.
33. Kerkar N, Vergani D. De novo autoimmune hepatitis – is this different in adults compared to children? J Autoimmun 2018; 95: 26– 33. doi: 10.1016/ j. jaut.2018.10.023.
34. Visseren T, Darwish Murad S. Recurrence of primary sclerosing cholangitis, primary biliary cholangitis and auto-immune hepatitis after liver transplantation. Best Pract Res Clin Gastroenterol 2017; 31(2): 187– 198. doi: 10.1016/ j. bpg.2017.04.004.
35. Haldar D, Kern B, Hodson J et al. Outcomes of liver transplantation for non-alcoholic steatohepatitis: a European Liver Transplant Registry study. J Hepatol 2019; 71(2): 313– 322. doi: 10.1016/ j. jhep.2019.04.011.
36. Faure S, Herrero A, Jung B et al. Excessive alcohol consumption after liver transplantation impacts on long-term survival, whatever the primary indication. J Hepatol 2012; 57(2): 306– 312. doi: 10.1016/ j. jhep.2012.03.014.
37. Bajer L, Slavcev A, Macinga P et al. Risk of recurrence of primary sclerosing cholangitis after liver transplantation is associated with de novo inflammatory bowel disease. World J Gastroenterol 2018; 24(43): 4939– 4949. doi: 10.3748/ wjg.v24.i43.4939.
38. Abdelrahim M, Esmail A, Abudayyeh A et al. Transplant oncology: an emerging discipline of cancer treatment. Cancers (Basel) 2023; 15(22): 5337. doi: 10.3390/ cancers15225337.
39. Burra P, Shalaby S, Zanetto A. Long-term care of transplant recipients: de novo neoplasms after liver transplantation. Curr Opin Organ Transplant 2018; 23(2): 187– 195. doi: 10.1097/ MOT.0000000000000499.
40. Lam K, Coomes EA, Nantel-Battista M et al. Skin cancer screening after solid organ transplantation: survey of practices in Canada. Am J Transpl 2019; 19(6): 1792– 1797. doi: 10.1111/ ajt.15224.
41. Zaffiri L, Chambers ET. Screening and management of PTLD. Transplantation 2023; 107(11): 2316– 2328. doi: 10.1097/ TP.0000000000004577.
42. Kim A, Waldron O, Daoud D et al. Comparative Review of Standardized Incidence Ratio of Nonlymphoid, De Novo Malignancies After Liver Transplant Versus After Kidney Transplant. Exp Clin Transplant 2024; 22(8): 600– 606. doi: 10.6002/ ect.2024.0136.