Perorální léčba vitaminem B12 u pacientů po ileokolické resekci pro Crohnovu nemoc
Kristýna Kaštylová1, Karin Černá 1, Jaroslava Hejnarová2, Martin Valkus2, Milan Lukáš3
+ Pracoviště
Souhrn
Cíl studie: Ověřit účinnost a bezpečnost perorálně podávaného vitaminu B12 u pacientů po ileokolické resekci pro Crohnovu nemoc (CN). Metodika: Srovnali jsme celkové sérové hladiny vitaminu B12 a jeho aktivní formy u 23 pacientů s CN po resekci ilea s nízkou počáteční koncentrací kobalaminu po měsíční substituci s 19 pacienty rovněž s CN po resekci ilea s nízkou počáteční koncentrací kobalaminu, kteří užívali perorální substituci vitaminu B12 po dobu dvou měsíců. Výsledky: V obou sledovaných kohortách došlo po 14 dnech terapie k signifikantnímu vzestupu sérových hladin celkové a aktivní formy vitaminu B12. Po celou dobu trvání perorální suplementace cyanokobalaminem byly tyto hladiny dále stabilní. V kohortě A (terapie po dobu 30 dnů) došlo po dvou měsících od počátku studie ke znatelnému poklesu hladin obou analytů, zatímco v kohortě B (s terapií trvající 60 dnů) k signifikantní fluktuaci hladin ani jednoho z měřených analytů nedošlo. V kohortě nemocných s dvouměsíčním trváním suplementace perorálním cyanokobalaminem bylo ke dni D-61 dosaženo signifikantně vyšších hladin celkového vitaminu B12 (p = 0,0044), nikoli však jeho aktivní formy. Spearmanův korelační koeficient hladin celkového a aktivního vitaminu B12 byl relativně velmi vysoký (r = 0,8081 [p = 0,0001]) a svědčil pro dobrou korelaci dynamiky vzestupu obou sledovaných forem vitaminu B12. Závěr: Kontinuální perorální podávání vitaminu B12 v dávce 1 000 µg denně je efektivní léčebnou strategií, protože vedla rychle k normalizaci a udržení normální koncentrace vitaminu B12 u pacientů po ileocekální resekci pro CN.
Klíčová slova
vitamin B 12, Crohnova nemoc, ileocekální resekce
Úvod
Vitamin B12 (jiným názvem kobalamin) patří mezi esenciální látky, které lidský organizmus potřebuje a nedokáže si je sám vytvořit. I přes jeho minimální produkci střevními bakteriemi jsme stále odkázáni na jeho přísun v živočišných produktech. Je nezbytný pro řadu biologických funkcí od spoluúčasti na krvetvorbě, vývoj nervové soustavy až po syntézu nukleových kyselin. Jeho nedostatek se projevuje nespecificky. Hlavními příznaky deficitu jsou neurologické projevy (pocity brnění a pálení končetin, poruchy koordinace pohybů) [1], psychiatrické obtíže (depresivní stavy, demence) nebo rozvoj makrocytární anemie (únava, nevýkonnost, dušnost) [2]. Deficience vitaminu B12 je pro svůj nejednoznačný obraz poměrně častou problematikou u pacientů s Crohnovou nemocí (CN).
Vitamin B12 představuje ve vodě rozpustný komplex několika sloučenin složených z porfyrinového skeletu, v jejichž centru najdeme kobalt. Vstřebávání vitaminu B12 z trávicího ústrojí je zajištěno dvěma mechanizmy – aktivním transportem nebo pasivní difuzí. Aktivní transport představuje hlavní formu resorpce a odehrává se v terminálním ileu. Je zajištěn receptory zprostředkovanou endocytózou a je pro něj nezbytný kobalamin ve vazbě na tzv. vnitřní faktor (vazebný protein produkovaný parietálními buňkami žaludeční sliznice), dále receptory v distálním ileu – tzv. cubiliny, membránové bílkoviny – megaliny, vápenaté ionty Ca a neutrální pH. Kobalamin navázaný na vnitřní faktor (tzv. intrinsic factor – IF) se naváže na vazebné místo receptoru cubilinu na povrchu enterocytu [3–5]. Následně vzniklý komplex kobalamin – vnitřní faktor-receptor chrání kobalamin před utilizací střevními bakteriemi a vnitřní faktor před účinkem proteolytických enzymů. Endocytózou vznikají endozomy, které postupně splývají s lyzozomy. Působením lyzozomálních enzymů je IF degradován a kobalamin je uvolněn z vazby. V cytosolu enterocytu je volný kobalamin znovu navázán, tentokrát na další transportní protein – transkobalamin II (TC II), čímž vzniká aktivní forma vitaminu B12 holotranskobalamin. Takto navázaný vitamin B12 opouští přes bazolaterální membránu střevní buňku a vstupuje do portální krve. Aktivní transport vitaminu B12 trvá kolem 3–4 hod [6,7]. Kobalamin podléhá v lidském těle následně reabsorpci, a to prostřednictvím enterohepatálního cyklu. V játrech se kobalamin váže na transportní protein transkobalamin I – haptocorrin – a přestupuje do žluče. Se žlučí se následně komplex – kobalamin – haptocorrin dostává do střeva a je absorbován jako kobalamin přijatý z potravy. V duodenu dochází k rozštěpení haptocorrinu – kobalaminu, kobalamin se může vázat na vnitřní faktor a následně se celý cyklus opakuje – vazba na cubilin a transport do enterocytu. Výše uvedeným způsobem se žlučí dostává do střeva 5–10 µg kobalaminu/den, což je obdobné jako z potravy [6].
Druhý způsob resorpce představuje proces pasivní difuze. Pasivní difuzí však přechází pouze kolem 1–3 % přijatého kobalaminu. Z tohoto důvodu se uplatňuje pouze při vyšších dávkách kobalaminu, nad několik desítek až stovek mikrogramů. Takto absorbovaný kobalamin se v krvi objeví prakticky do několika minut [3,7].
Při resekčních výkonech, u kterých dojde k odstranění terminálního nebo distálního ilea, se zvyšuje riziko deficitu vitaminu B12, neboť dochází ke zmenšení resorpční plochy, na které dochází k aktivnímu vstřebávání vitaminu B12. Doposud se mělo za to, že tito pacienti vyžadují suplementaci vitaminu B12 pouze parenterálně subkutánní (s.c.) či intramuskulární (i. m.) formou podání. Cílem naší studie bylo ověřit toleranci a efektivitu perorální suplementace vitaminem B12 u pacientů po ileocekální resekci pro CN.
Soubor pacientů a metodika
Soubor pacientů
Celkem bylo do projektu zahrnuto 45 pacientů s mírnou až středně těžkou aktivitou CN ve věku 23–68 let, z toho 24 žen a 21 mužů. V průběhu trvání projektu odstoupili z osobních důvodů dva pacienti (jeden muž a jedna žena), jedna pacientka ukončila studii po týdnu od zahájení substituce pro v.s. vedlejší účinky. Všichni účastníci podstoupili v minulosti resekční výkony, při nichž jim byla odstraněna část ilea, a neužívali v době zahájení studie a ani v posledních 2 letech jakoukoli formu suplementace vitaminem B12. Dalším zařazovacím kritériem byla vstupní koncentrace celkového vitaminu B12 < 250 pmol/l a také pacientův souhlas s účastí ve studii. Pacienty jsme náhodně rozdělili do dvou kohort, a to podle délky užívání substituce vitaminem B12. Kohortu A s 23 účastníky tvořili pacienti užívající suplementaci po dobu 1 měsíce, kohorta B představovala pacienty, jež byli substituováni po dobu 2 měsíců, a zahrnovala 19 účastníků.
Vyřazovací kritéria pro vstup do studie byla vysoká aktivita CN, anamnéza chirurgického výkonu v posledních 6 měsících, současná substituce preparáty vitaminu B12. Rovněž limitací pro zařazení do studie byla noncompliance pacienta, v případě žen probíhající gravidita a laktace, současná terapie preparáty obsahující metformin či inhibitory protonové pumpy (PPI) a anamnéza totální či parciální gastrektomie. Snahou bylo minimalizovat všechny další okolnosti, které mohou ovlivňovat absorpci vitaminu B12. Proto nás zajímaly stravovací návyky našich pacientů, všichni účastníci studie byli konzumenti živočišných výrobků.
Metodika
Dispenzarizace probíhala následujícím způsobem: v den zahájení studie (tj. den 0, D0) byl všem účastníkům po sepsání informovaného souhlasu a vyplnění vstupního dotazníku proveden odběr krve na koncentraci celkového a aktivního vitaminu B12, pacientovi byl vydán preparát vitamin B12 gamma v tabletové formě. Pacienti užívali po dobu prvního týdne dvě tablety cyanokobalaminu, tj. celkem 2 000 µg/den, a poté snížili dávkování na jednu tabletu, tj. 1 000 µg/den. Tímto způsobem probíhala suplementace celkově po dobu 4 (kohorta A) nebo 8 týdnů (kohorta B). Při stanovení denní doporučené dávky jsme se striktně drželi radou výrobce. Další kontrolní laboratorní odběry probíhaly následně 15., 31. a 61. den od zahájení studie (D15, D31 a D61).
Biologický materiál a vyšetření
Odběr krve ke stanovení koncentrace celkového a aktivního vitaminu B12 byl proveden dle výše uvedeného dispenzárního schématu. Vzorky žilní krve ze žíly v loketní jamce byly obvyklým způsobem odebrány do zkumavky bez aditiva a následně odeslány ke zpracování do laboratoře. Oba parametry byly stanovovány na imunochemickém analyzátoru Alinity i (Abbott, USA), souprava Alinity i Active-B12 (Holotranscobalamin) Reagent Kit Alinity i B12 Reagent Kit. Principem stanovení obou analytů je chemiluminiscenční imunoanalýza na mikročásticích (CMIA – chemiluminescent microparticle immunoassay).
CMIA patří mezi imunoanalytické metody, při nichž je antigen označen akridinem esterem a protilátka je vázána na paramagnetické částice v pevné fázi. Měří se kvantitativní množství světla emitovaného během oxidace peroxidu vodíku v alkalickém prostředí [8]. Postup při stanovení obou parametrů je obdobný, rozdíl je pouze v použité protilátce. V případě stanovení celkového vitaminu B12 se používají mikročástice potažené intrinsic faktorem (prasečí), u aktivního vitaminu B12 se jedná o mikročástice s antiholotranskobalaminem (myší, monoklonální). Imunoanalýza je dvoukroková, výsledná chemiluminiscenční reakce se měří v relativních světelných jednotkách (RLU – relative light units). U celkového vitaminu B12 existuje mezi množstvím kobalaminu ve vzorku a signálem nepřímá úměrnost, v případě aktivního vitaminu B12 se jedná o přímou úměrnost.
Statistická analýza
Statistická analýza naměřených dat byla provedena s pomocí softwaru Statistica 13 Academic (Tibco, USA). Snažili jsme se odpovědět na tři otázky. Pomocí neparametrického Kruskal-Wallisova testu jsme hodnotili dynamiku sérové koncentrace celkového a aktivního vitaminu B12 dle délky trvání substituce, dále nás zajímal vliv délky suplementace kyanokobalaminem na sérové hladiny obou sledovaných forem vitaminu B12 po 2 měsících trvání studie a v neposlední řadě nás, i vzhledem k nákladnosti vyšetření aktivního vitaminu B12, zajímala regresivní závislost koncentrace celkového kobalaminu k aktivnímu. K vyhodnocení jsme využili Spearmanův korelační koeficient. Za statisticky signifikantní byla označena hladina významnosti p ≤ 0,05.
Etické aspekty
Studie byla schválena Etickou komisí Klinického centra ISCARE a. s., číslo protokolu 20211125.
Výsledky
Dynamika vývoje sérových koncentrací celkového a aktivního vitaminu B12
V obou sledovaných kohortách došlo již po 14 dnech terapie k signifikantnímu vzestupu sérových hladin celkové i aktivní formy vitaminu B12. Po celou dobu trvání perorální suplementace cyanokobalaminem byly tyto hladiny dále stabilní. V kohortě A (terapie po dobu 30 dnů) došlo ke dni D61 opět ke znatelnému poklesu hladin obou analytů, zatímco v kohortě B (s terapií trvající 60 dnů) k signifikantní fluktuaci hladin ani jednoho z měřených analytů nedošlo (tab. 1, graf 1).
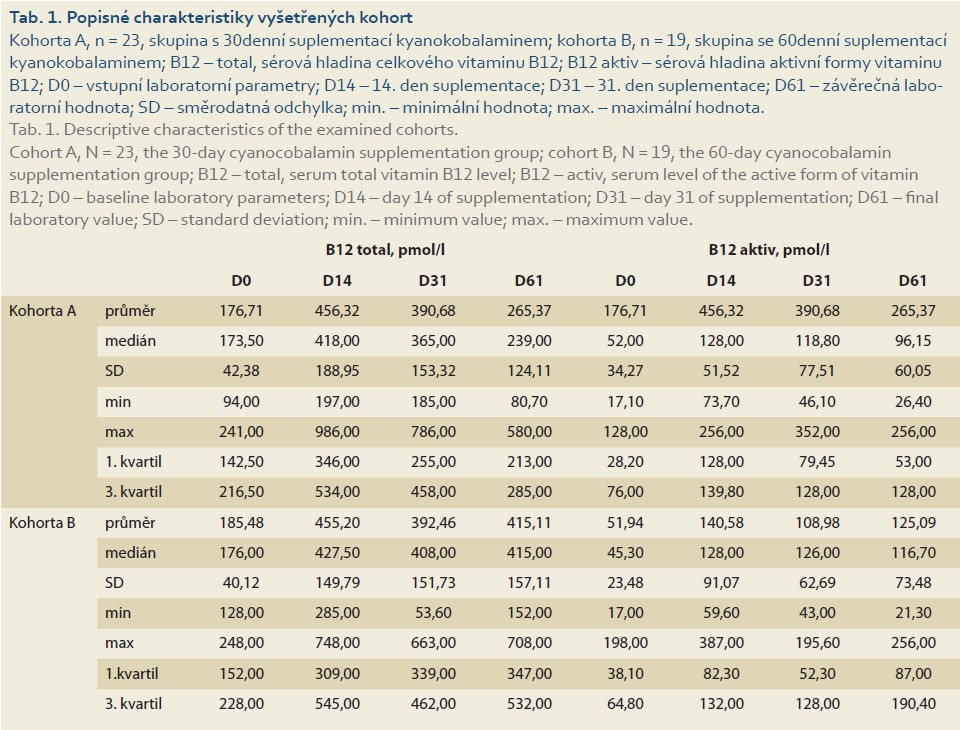
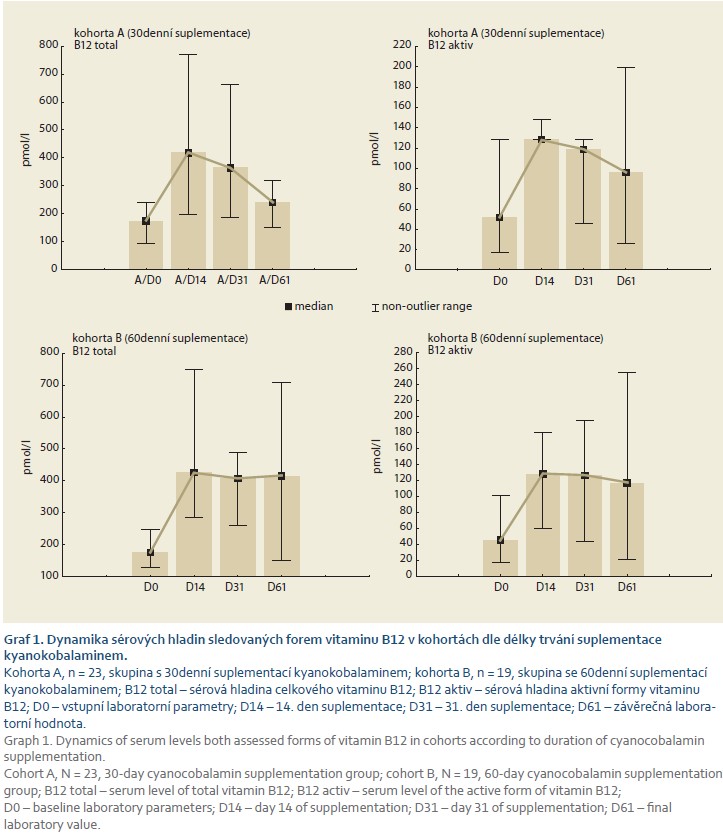
Vliv délky suplementace cyanokobalaminem na sérové hladiny obou sledovaných forem vitaminu B12 po 2 měsících trvání studie
V kohortě nemocných s dvouměsíčním trváním suplementace perorálním cyanokobalaminem bylo ke dni D61 dosaženo signifikantně vyšších hladin celkového vitaminu B12, nikoli však jeho aktivní formy (graf 2). Domníváme se, že je tomu tak z důvodu menšího rozptylu hodnot v případě aktivního vitaminu B12.
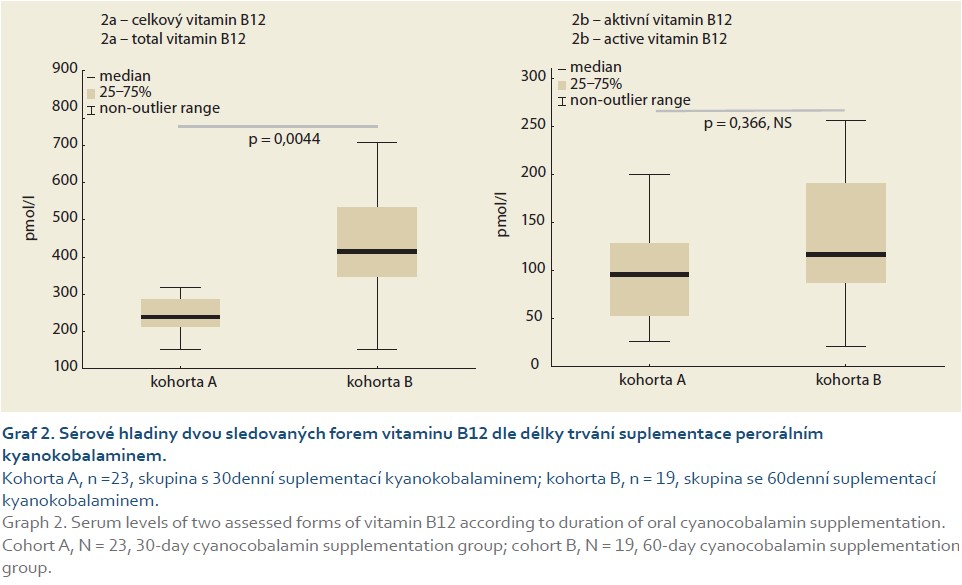
Korelace sérových koncentrací aktivní a celkové formy vitaminu B12
Pro klinickou praxi je relevantní otázka, zda je ke sledování metabolizmu vitaminu B12 u nemocných s CN vhodné detekovat aktivní formu (holotranskobalamin) tvořený komplexem transkobalaminu II + vitaminem B12, nebo pouze celkovou hladinu vitaminu B12 (kobalaminu vázaného na transkobalamin II a haptokorin), či zda je třeba provádět oba testy současně. Graf 3 dokumentuje velmi dobrou korelaci naměřených hodnot, což svědčí pro možnost volby jednoho z vyšetření.
Diskuze
Předkládaná studie je podle našich znalostí první v ČR, která hodnotila účinnost a toleranci perorální formy vitaminu B12 u pacientů po ileocekální resekci pro CN.
Výsledkem tohoto pilotního projektu jsou data dokladující dobrý efekt a výbornou toleranci perorální formy vitaminu B12. Podařilo se nám ověřit, že podávání vitaminu B12 ve vyšších dávkách vede, procesem pasivní difuze, ke korekci nízkých hladin vitaminu B12 a udržení jejich normalizace při setrvání v kontinuálním užívání.
Nemocní s idiopatickými střevními záněty jsou ohroženi deficiencí mikronutrientů především z důvodu malabsorpce a malnutrice. K dalším příčinným faktorům patří enteroenterální píštěle, striktury tenkého střeva vedoucí k syndromu bakteriálnímu přerůstání, enteropatie se ztrátou proteinů nebo nedostatečný přívod při dietních restrikcích. Předkládaná studie je zaměřena na nemocné s CN po resekci ilea z toho důvodu, že terminální ileum je nejdůležitější místo absorpce vitaminu B12 do cirkulace a také nejčastěji postiženým úsekem střeva při CN.
V předcházejících letech byla diskutována otázka, zda jsou všichni pacienti, kteří mají odstraněný úsek distálního ilea, ohroženi vznikem deficitu cyanokobalaminu. Na tuto otázku se snažili najít odpověď Duerksen et al [9], kterým se podařilo ve studii čítající 56 účastníků doložit, že resekce < 20 cm terminálního ilea nevedla u všech 14 pacientů k depleci kobalaminu (monitorováno Schillingovým testem). U zbývajících 24 pacientů, jimž bylo odstraněno 20–60 cm terminálního ilea, byl zjištěn abnormální výsledek Schillingova testu, ale již nebyla zjištěna jasná korelace mezi délkou resekovaného úseku terminálního ilea a výsledkem Schillingova testu. Lze tedy konstatovat, že délka resekovaného úseku terminálního ilea nebude jediným určujícím faktorem vzniku deficitu kobalaminu.
Většina doposud publikovaných českých i zahraničních studií zabývajících se problematikou nedostatku vitaminu B12 a možnosti jeho korekce se týkala deficitu u pacientů s makrocytární anemií. Jednou z takových studií je Bolmanova studie z roku 2003 [10]. Ta zahrnovala 60 pacientů starších 16 let s makrocytární anemií podmíněnou deficitem vitaminu B12, kteří byli rozděleni do dvou skupin – jedna užívající suplementaci vitamin B12 v perorální formě, druhá skupina dostávala intramuskulární formu vitaminu B12. Oběma skupinám byla podávána stejná dávka cyanokobalaminu dle definovaného schématu. Devadesátý den od zahájení studie byl zaznamenán signifikantní nárůst v koncentraci vitaminu B12 u obou skupin.
Rovněž Kuzminskiho studie [11] z roku 1993 porovnávala efekt perorální substituce vitaminem B12 s intramuskulární aplikací. Po 2 měsících od zahájení studie bylo zjištěno, že perorální substituce vedla k dosažení mnohem vyšší koncentrace vitaminu B12 v krvi než u intramuskulární formy. Rozdíl byl ještě daleko zřetelnější po 4 měsících trvání projektu.
Problematikou intermitentního podávání vitaminu B12 se zabývala japonská studie od Yumi Takasaki et al [12], která navzdory malému souboru pacientů (celkově 17) dospěla k závěru, že intermitentní terapie perorálním vitaminem B12 je stejně efektivní jako intermitentní aplikace parenterální formy.
O účinností perorální formy vitaminu B12 u 129 dětských pacientů pojednávala studie [13], která nejen porovnala efekt obou forem substituce (parenterální a perorální), ale také monitorovala rozdíl perorálně podávaného cyanokobalaminu s perorálně podávaným metylkobalaminem. Výsledkem studie bylo, že všechny tři skupiny (i. m. forma cyanokobalaminu, p. o. forma cyanokobalaminu a p. o. forma metylkobalaminu) dosáhly významného nárůstu v koncentraci celkového vitaminu B12.
Efekt perorálně podávaného kobalaminu byl rovněž zaznamenán u pacientů s pernicinózní anemií. V roce 2005 publikovali Andrés et al [14] projekt čítající deset účastníků s perniciózní anemií. Tito pacienti byli léčeni dávkou 1 000 µg kobalaminu/den po dobu 3 měsíců. U všech těchto pacientů byl zaznamenán vzestup koncentrace kobalaminu v krvi. Rovněž u dalších sledovaných parametrů – krevní obraz, neurologická symptomatologie – byl potvrzen příznivý efekt.
Catherine Qiu Hua Chan et al [15] publikovali v roce 2016 práci, která za pomoci databáze PubMed zmapovala všechny tehdejší studie, jejž se zajímaly o problematiku perorální suplementace vitaminem B12 u pacientů s pernicinózní anemií. Na základě stanovených kritérií se podařilo získat a sjednotit data ze dvou randomizovaných kontrolovaných studií, tří prospektivních prací, jednoho systematického přehledu a tří klinických recenzí. Výsledkem bylo zjištění, že denní dávka 1 000 µg kobalaminu/den je postačující ke korekci nedostatku kobalaminu u pacientů s perniciózní anemií.
V naší studii nemáme data o délce resekovaného úseku ilea, nebrali jsme v potaz ani délku odstupu studie od chirurgického zákroku. Nezabývali jsme se ani korelací s hodnotami červeného krevního obrazu. Odpověděli jsme však na dvě základní otázky, že perorální suplementace vitaminem B12 je v definované skupině nemocných účinná a že ke sledování efektu suplementace lze využít hladin celkového i aktivního vitaminu B12.
Všechny dostupné studie, včetně výsledů našeho projektu, dokumentující efekt perorální suplementace vitaminem B12 se jeví jako slibné pro korekci jeho deficitu. Otázkou zůstává, zde nebude postačující intermitentní perorální substituce, případně jak často bude nutno perorální formu vitaminu B12 podávat.
Závěr
Kontinuální perorální substituce vitaminem B12 u pacientů s CN po resekci terminálního ilea je účinná, dobře tolerovaná, nežádoucí účinky nebyly prakticky zaznamenány a zdá se být možnou adekvátní náhradou pro ty pacienty, kteří nemohou (např. porucha srážlivosti krve, užívání antikoagulancií) nebo nechtějí užívat parenterální formu kobalaminu. Jedinou nevýhodu vidíme v dosavadní absenci úhrady tabletové formy vitaminu B12 zdravotními pojišťovnami.
ORCID autorů
K. Kaštylová ORCID 0000-0002-8024-1626,
K. Černá ORCID 0000-0002-0562-6497,
M. Lukáš ORCID 0000-0002-1463-3840.
Doručeno/Submitted: 27. 3. 2022
Přijato/Accepted: 29. 3. 2022
MUDr. Kristýna Kaštylová
Klinické a výzkumné centrum pro střevní záněty
Klinické centrum ISCARE a. s. a 1. LF UK v Praze
Českomoravská 2510/19
190 00 Praha
kastylova.k@seznam.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Stabler SP. Clinical practice. Vitamin B12 deficiency. N Engl J Med 2013; 368(2): 149–160. doi: 10.1056/NEJMcp1113996.
2. Green R. Vitamin B12 deficiency from the perspective of a practicing of a practicing hematologist. Blood 2017; 129(19): 2603–2611. doi: 10.1182/blood-2016-10-569186.
3. Combs GF Jr. The vitamins: fundamental aspects in nutrition and health. 1st ed. Burlington: Elsevier Academic Press 2008.
4. Christensen EI, Birn H. Megalin and cubilin: synergistic endocytic receptors in renal proximal tubule. Am J Physiol Renal Physiol 2001; 280(4): F562–F573. doi: 10.1152/ajprenal.2001.280.4.F5462.
5. Verroust PJ, Christensen EI. Megalin and cubilin – the story of two multipurpose receptors unfolds. Nephrol Dial Transplant 2002; 17(11): 1867–1871. doi: 10.1093/ndt/17.11.1867.
6. Gropper SA, Smith JL, Groff JL. Advanced nutrition and human metabolism. 5th ed. Australia: Wadsworth/Cengage Learning 2009.
7. Stipanuk MH. Biochemical, physiological and molecular aspects of human nutrition. 2nd ed. Philadelphia: Saunders 2006.
8. Brozmanová H. Laboratorní metody v terapeutickém monitorování léků. Klin Farmakol Farm 2020; 34(2): 56–62. doi: 10.36290/far.2020.012.
9. Duerksen DR, Fallows G, Bernstein CN. Vitamin B12 malabsorption in patients with limited ileal resection. Nutrition 2006; 22(11–12): 1210–1213. doi: 10.1016/j.nut. 2006.08.017.
10. Bolaman Z, Kadikoylu G, Yukselen V et al. Oral versus intramuscular cobalamin treatment in megaloblastic anemia: a single-center, prospective, randomized, open-label study. Clin Ther 2003; 25(12): 3124–3134. doi: 10.1016/S0149-2918(03)90096-8.
11. Kuzminski AM, Del Giacco EJ, Allen RH et al. Effective treatment of cobalamin deficiency with oral cobalamin. Blood 1998; 92(4): 1191–1198. doi: 10.1182/blood.V92.4.1191.
12. Takasaki Y, Moriuchi Y, Tsushima H et al. Effectiveness of oral vitamin B12 therapy for pernicious anemia and vitamin B12 deficiency anemia. Rinsho Ketsueki 2002; 42(3): 165–169.
13. Tugba-Kartal A, Cagla-Mutlu Z. Comparison of sublingual and intramuscular administration of vitamin B12 for the treatment of vitamin B12 deficiency in children. Rev Invest Clin 2021; 72(6): 380–385. doi: 10.24875/RIC.20000208.
14. Andrés E, Loukili NH, Noel E et al. Effects of oral crystalline cyanocobalamin 1,000 μg/d in the treatment of pernicious anemia: an open-label, prospective study in Ten Patients. Curr Ther Res Clin Exp 2005; 66(1): 13–22. doi: 10.1016/j. Curtheres.2005.02.001.
15. Chan CQ, Low LL, Lee KH. Oral vitamin B12 replacement for the treatment of pernicious anemia. Front Med 2016; 3: 38. doi: 10.3389/fmed.2016.00038.