Steatóza pankreatu – klinicky závažné onemocnění?
David Solil1, Petr Dítě1, Marie Přecechtělová1, Martina Bojková Orcid.org 2, Jiří Dolina Orcid.org 1, Bohuslav Kianička Orcid.org 3
+ Pracoviště
Souhrn
Steatóza pankreatu je klinický termín označující akumulaci tuku ve slinivce břišní a představuje častý nález u starších a/ nebo obézních pacientů, neboť je úzce asociována s metabolickým syndromem. Pankreas hraje klíčovou roli v regulaci glykemické homeostázy prostřednictvím sekrece inzulinu a dalších hormonů. Tuková infiltrace pankreatu může vést k poruše jeho funkce. Prevalence stoupá s věkem a mírou obezity. Její klinické dopady nejsou tolik diskutovány jako u steatózy jater, která je považována za její nejvýznamnější prediktivní faktor. Širokou odbornou komunitou nebyla steatóza pankreatu ještě plně, jako samostatně definovaná choroba, akceptována. Kvůli své těsné vazbě na diabetes mellitus 2. typu může však přispívat ke vzniku či zhoršení průběhu inzulinové rezistence, kardiovaskulárních onemocnění, akutní pankreatitidy a zkoumá se také její souvislost s rizikem rozvoje nádoru pankreatu. Vzhledem k rostoucí pandemii obezity, prodlužování věku dožití a stále lepším a dostupnějším diagnostickým metodám lze paralelně v budoucnu očekávat její zvyšující se výskyt. To s sebou nese nové výzvy v nutnosti nastavení dispenzarizace a péče o tyto pacienty. Další sledování a výzkum v této oblasti je nadále nezbytný, neboť existuje stále jen omezené množství studií zabývajících se přesnými patofyziologickými mechanizmy mezi steatózou pankreatu a jejím klinickým dopadem na pacienta.
Klíčová slova
steatóza pankreatu, pankreas, steatóza jater, metabolický syndrom, obezita, chronická pankreatitida, pankreatický karcinom
Úvod
Obezita se stala v posledních letech neobyčejně významným celospolečenským problémem. Dle statistických údajů z roku 2016 trpělo více než 1,9 bilionu osob nadváhou, jejich body mass index (BMI) byl vyšší než 25 kg/ m2, resp. více než 650 milionů osob trpělo obezitou s BMI > 30 kg/ m2. Kvůli tomu zemřelo za toto období 2,8 milionu jedinců [1]. S obezitou je spojena řada závažných klinických postižení, jako je metabolický syndrom a jeho komponenty, arteriální hypertenze, kardiovaskulární a cerebrovaskulární příhody, dyslipidemie nebo malignity [2].
Pozornost je v současné době věnována stavům spojeným s ukládáním tuku ve tkáních parenchymatózních orgánů. Tento stav je označen jako steatóza orgánu [3]. V případě ukládání tuku v játrech, není-li příčinou alkohol, hovoříme o jaterní steatóze asociované s metabolickou dysfunkcí (MASLD), jejíž prevalence je 30 % [4]. Od staršího názvu nealkoholické steatózy jater (NAFLD – non-alcoholic fatty liver disease) bylo upuštěno pro možnou stigmatizaci pacientů při užívaném slovu alkohol v názvu onemocnění. MASLD je závažným stavem, protože se může přes stadium steatohepatitidy rozvinout až do stadia jaterní cirhózy, resp. terminálně až do karcinomu jater. Akumulace tuku postihuje kromě jater také pankreas, což je označeno jako steatóza pankreatu.
Terminologie
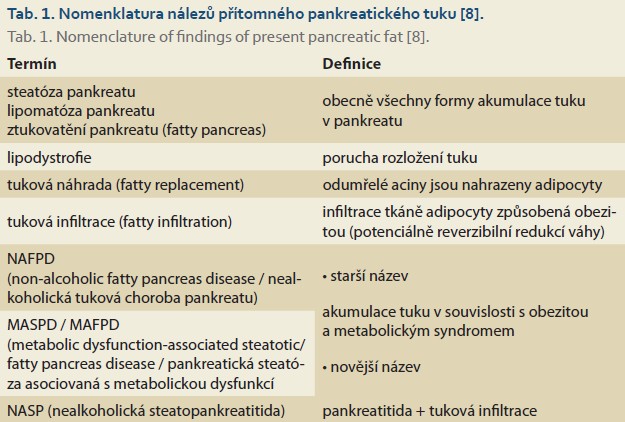
Koncept steatózy pankreatu poprvé popsal v roce 1933 Ogilvie [5], který u obézních jedinců popsal dvojnásobek množství pankreatického tuku oproti normostenikům. O 45 let později Olsen v autoptickém materiálu nalezl významný vzestup obsahu pankreatického tuku v souvislosti s věkem [6]. O 10 let později Stamm učinil stejný závěr, ale s novým pozorováním o úzkém vztahu mezi steatózou pankreatu, přítomností diabetes mellitus 2. typu a aterosklerózou [7]. Smits a van Geenen poprvé v literatuře podali ucelený přehled o nomenklatuře steatózy pankreatu [8] a následně Tariq et al. popsali klinickou jednotku pod označením non-alcoholic fatty pancreas disease (NAFPD) [9]. Vzhledem k nově používané terminologii metabolické steatózy jater (MASLD) se taktéž u pankreatu nyní používá označení MASPD (metabolic dysfunction-associated steatotic pancreas disease).
Širokou odbornou veřejností ale zatím nebyla steatóza pankreatu plně jako samostatně definovaná choroba akceptována. Možná i proto není její terminologie (tab. 1) v současné literatuře jednotná, což komplikuje její přehlednost. Kromě steatózy pankreatu se používá řada pojmů, jako např. lipomatóza (hromadění tuku), lipodystrofie (porucha rozložení tuku), fatty pancreas (nadměrná akumulace tuku) nebo pancreatic fatty replacement (nahrazení pankreatické žlázy adipocyty) se snahou odlišit pouze samotnou tukovou akumulaci (ukládání tuku mezi acinární buňky) od možného spolupodílu metabolické a zánětlivé složky, při níž dochází i k náhradě funkční parenchymové tkáně. Tato nejednotnost v názvosloví ztěžuje srovnávání jednotlivých studií a komplikuje standardizaci diagnostických i terapeutických přístupů.
Epidemiologie
Prevalence MASPD je uváděna v asijské studii v rozmezí 16– 35 % [10]. Incidence se zvyšuje s věkem. Metaanalýza sledující celkem 1 276 osob v jedenácti studiích nalezla prevalenci MASPD v 33 % (24– 41 %) [11]. Není pochyb, že MASPD je celkem frekventním onemocněním spojeným s řadou rizikových metabolických faktorů, dyslipidemií, hyperglykemií, metabolickým syndromem a s ním sekundárně spojeným rizikem vzniku nádorových onemocnění [12]. Vzhledem k rostoucí pandemii obezity, prodlužování věku dožití a zdokonalování diagnostických přístrojů lze očekávat další vzrůstající incidenci.
Patogeneze
MASPD je výsledkem několika patofyziologických procesů, které působí simultánně. Těmito procesy jsou buněčné poškození jako důsledek přímé interakce pankreatických buněk s volnými mastnými kyselinami, chronický oxidativní stres, lokální sekrece zánětlivých markerů, alterace glukozového metabolizmu a betaoxidace. V současnosti je za hlavní rizikový faktor považována obezita [10]. V souvislosti s obezitou existují dva mechanizmy hromadění pankreatického tuku. Prvním z nich je tzv. fatty replacement, kdy jsou odumřelé pankreatické acinární buňky nahrazeny adipocyty. Druhým mechanizmem je tzv. fat accumulation, tedy prosté hromadění adipocytů mezi acinárními buňkami [13].
Dalším významným rizikovým faktorem je věk. Epidemiologické studie prokázaly, že existuje pozitivní vztah mezi věkem a MASPD [14] s vyšším rizikem vzniku u mužů [15]. Významný rizikový a prediktivní faktor vzniku MASPD je MASLD [16]. Z patogenetického hlediska existují indicie, že MASLD může být spojena se zánětlivými faktory indukovanými adipocyty, především v asociaci s přítomností volných mastných kyselin (FFA). V experimentu exprese TNFα, interleukinu-6 (IL-6), monocyte chemoattractant protein-1 při FFA navozené hyperlipidemii statisticky významně zvyšují množství tělesného tuku [17]. Akumulace pankreatického tuku a zvýšená zánětlivá reakce byly laboratorně popsány u obézních myší po splenektomii a po aplikaci cytokinu IL-10 [18].
Oxidativní stres provází metabolický syndrom, diabetes mellitus a je spojen s procesy aterosklerózy. Předpokládá se, že chronický oxidativní stres hraje významnou roli při vzniku MASPD [19]. Vzestup tělesné hmotnosti vede k chronickému uvolňování kortizolu [20] a aktivaci hypotalamo-pituitární adrenální osy [21], což významně zvyšuje riziko vzniku metabolického syndromu a rizika vzniku aterosklerózy [22].
Adipocytokiny z tukové tkáně liberalizují cytokiny, adipokiny a chemokiny jako bioaktivní substance podílející se na metabolické homeostáze [23]. Pokles hladiny adiponektinu u obézních osob výrazně snižuje inzulinovou senzitivitu a vede ke snížení procesu -oxidace tělesných tkání [24].
Hlavním patogenetickým mechanizmem při ukládání tuku u osob MASPD je již výše zmíněný proces označený jako fatty replacement [25]. Je charakterizován akumulací tuku intralobulárně, a to jak v endokrinních, tak exokrinních pankreatických buňkách [26,27], což je příčinou odúmrtí pankreatických acinárních buněk a jejich náhrady adipocyty. Důsledkem je, že pankreatické betabuňky se stávají dysfunkčními [28,29]. Fatty replacement tak iniciuje nezvratné změny pankreatické morfologie i funkce. Ukládání tuku v pankreatu v kombinaci s volnou cirkulací mastných kyselin vedou k dysfunkci pankreatických betabuněk [30,31].
Pankreatická steatóza je spojena s poruchou regulačních mechanizmů. Patří sem změny fosfolipidové saturace mitochondriálních membrán vedoucí ke zhoršení mitochondriálních funkcí [32], včetně zvýšené produkce kyslíkových radikálů, ovlivnění cytochromu P450 CYP-2E1, a to především u osob s MASLD [33]. V pankreatické tkáni hyperglykemie nebo hypertriglyceridemie indukují vzestup volných mastných kyselin. Důsledkem je následná destrukce buněk acinárních i pankreatických ostrůvků [34].
Diagnostika
V současnosti neexistuje univerzálně přijatý standard pro diagnostiku a stanovení množství tuku v pankreatu. Histologické vyšetření sice stanovuje přítomnost tukových buněk a lipidových kapének v acinárních buňkách, avšak odběr vzorku pankreatu pomocí EUS navigované biopsie je technicky náročný, ne všude dostupný s navíc ne malým rizikem komplikací. Navíc tuk se v pankreatu rozkládá nerovnoměrně, takže vzorek nemusí být výtěžný a nemusí dobře reprezentovat celkovou míru tukové infiltrace. Získané vzorky z pankreatických resekátů se týkají minoritního výběru především onkologických pacientů, ale mohou posloužit k dalšímu bádání asociace steatózy s pankreatickým karcinomem.
Zobrazovací metody zůstávají hlavními diagnostickými nástroji. Nejrozšířenější a nejdostupnější je ultrazvuk břicha, při kterém bývá patrný typický obraz zvýšené echogenity žlázy. Tato metoda však naráží na určité limity – zejména u obézních pacientů bývá vizualizace pankreatu obtížná. Kromě toho je hodnocení echogenity subjektivní a expert dependentní, což ztěžuje srovnání. Pro orientaci se doporučuje porovnat echogenitu pankreatu s játry, případně s ledvinou nebo slezinou, pokud jsou játra rovněž hyperechogenní. Přesnější zobrazení pankreatu poskytuje endoskopická ultrasonografie (EUS) a výpočetní tomografie (CT), kde se tuková infiltrace projeví jako snížená denzita pankreatu. Množství tuku lze kvantifikovat pomocí Hounsfieldových jednotek v porovnání s denzitou sleziny. Nejpřesnější metodou pro stanovení množství tuku v celém pankreatu je v současnosti magnetická rezonance (MR), která umožňuje přesné kvantitativní hodnocení. Její širší využití v běžné praxi je však omezeno vyšší cenou a horší dostupností.
Možné klinické asociace steatózy pankreatu
Jaterní steatóza asociovaná s metabolickou dysfunkcí (MASLD) je stavem, kdy jsou hepatocyty infiltrovány tukem, aniž by etiologickým faktorem byl alkohol [35]. Embryonálně mají játra a pankreas stejný embryonický endoderm, čímž lze vysvětlit podobnosti v akumulaci tuku v játrech a pankreatu [36]. Údaje získané za použití zobrazovacích metod a histopatologické nálezy prokazují signifikantně významnou korelaci mezi současným výskytem MASPD a MASLD [37]. To potvrzují i nevelké počty studií, kdy autoři usuzují, že jaterní steatóza je významným prediktivním faktorem pro MASPD [11,16,38– 40]. Přítomnost steatózy pankreatu roste s věkem a je nejspíše ovlivněna či urychlena zánětlivou složkou, což potvrdil soubor 121 obézních dětí a adolescentů s prokázanou jaterní steatózou. U mladých jedinců se steatohepatitidou byl pozorován 80% vzestup přítomnosti MASPD [40]. U nemocných s MASPD je vyšší riziko vzniku MASLD ve spojitosti se vztahem mezi intrapankreatickým tukem a sekrecí inzulinu, resp. glukózovým metabolizmem [41].
Metabolický syndrom je definován přítomností alespoň tří z následujících rizikových faktorů [42]:
- arteriální hypertenze;
- hyperglykemie;
- hypertriglyceridemie;
- nízká hladina HDL cholesterolu;
- centrální obezita.
Obezita je multifaktoriální klinická jednotka, v níž dochází k patologické akumulaci tukové tkáně v netukových tkáních, jako je pankreas, srdce, játra, svalstvo. To vše je asociováno s diabetes mellitus, hyperlipidemií nebo kardiovaskulárními změnami [43,44]. Řada studií popsala očekávaný vztah mezi centrální obezitou a depozicí tuku v pankreatu [4,15]. V prospektivní studii Sepeho et al. byla při vyšetření EUS (prováděna z různých indikací) popisována steatóza pankreatu ve 27,8 % [45]. Osoby, které splňovaly kritéria metabolického syndromu, měly prevalenci steatózy pankreatu ve 40 %. V případě použití diety s vysokým obsahem tuků dochází k ukládání triglyceridů především v pankreatických buňkách oproti hepatocytům, čímž lze hovořit o pankreatické steatóze jako o časné konsekvenci metabolického syndromu [45]. Turecká klinická studie potvrdila asociaci akumulace tuku v pankreatu s metabolickým syndromem, ale i rizikový faktor, kterým byl BMI a přítomnost MASLD [46]. Sezgin et al. sledovali také korelaci mezi stupněm steatózy pankreatu na EUS a metabolickým syndromem [47]. Popsali, že míra pankreatické steatózy stoupá s věkem, hodnotou BMI, hladinou HbA1c a triglyceridů a alkalické fosfatázy.
Rozsah akumulace tuku v játrech se jeví jako jeden ze zásadních faktorů podílejících se na změnách jak exokrinních, tak endokrinních pankreatických funkcí. Jedinci s nízkou akumulací pankreatického tuku bývají většinou asymptomatičtí, jedinci s větším stupněm akumulace pankreatického tuku se mohou manifestovat např. projevy diabetu nebo malabsorbcí [48].
U steatózy pankreatu je častější 2. typ diabetes mellitus. Je charakterizován inzulinovou rezistencí s poruchou sekrece glukózy, což vede k omezení počtu a funkce pankreatických betabuněk a terminálně má za následek jejich destrukci. Zvláště akumulace viscerální tukové tkáně je významným rizikovým faktorem vzniku inzulinové rezistence [49,50]. Steatóza pankreatu je asociována se vzestupem incidence diabetes mellitus [51].
Steatóza pankreatu ovlivňuje metabolizmus glukózy chronickou low-grade inflamací a chronickým stresem, také nepřímo významně zvyšuje riziko vzniku kardiovaskulárních onemocnění. Sahin et al. vyšetřili skupinu 99 osob s koronární příhodou v korelaci s MASPD. Hodnoceno bylo tzv. SYNTAX skóre (bodovací systém používaný v kardiologii pro hodnocení komplexnosti onemocnění koronárních tepen vyjadřující rozsah a závažnost zúžení koronárních tepen způsobených aterosklerózou), které bylo u osob s přítomností MASPD výrazně vyšší než u jedinců bez MASPD (12,3 vs. 8,2; p < 0,001). U osob se steatózou pankreatu je tedy třeba pomýšlet i na možné koronární komplikace [52– 55].
Diskutována je asociace pankreatického karcinomu s obezitou a pankreatickou steatózou. Studie hodnotící 102 osob s pankreatickým duktálním adenokarcinomem prokázala nález steatózy pankreatu u signifikantně většího počtu nemocných než u zdravých jedinců [56,57]. Dle Lesmany et al. [11] je MASPD rizikovým faktorem vzniku karcinomu pankreatu, zatímco věk, pohlaví, diabetes a terén chronické pankreatitidy jsou faktory spíše kauzálními. U steatózy pankreatu se předpokládá dysfunkce autofagie vedoucí k aktivaci antioxidativních proteinů NQ01 [58]. Proto platí, že osoby se steatózou pankreatu by měly být systematicky, dlouhodobě sledovány.
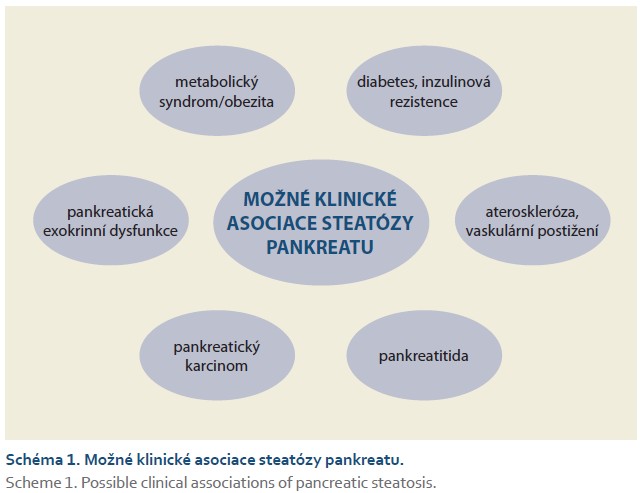
Rozvoj akutní či chronické pankreatitidy může být nejspíše také výsledkem dlouhého vývoje MASPD. Dle Sbeita a Khouryho je nutno považovat steatózu pankreatu za významné riziko indukce vzniku akutní pankreatitidy [59]. Náhrada odumřelých pankreatických acinů tukem u predisponovaných osob patří mezi hlavní etiologické faktory vzniku akutní pankreatitidy [60]. Všechny možné klinické asociace steatózy pankreatu zobrazuje schéma 1.
Léčba
Možnosti a nutnost léčby steatózy pankreatu jsou zatím podstatně méně prozkoumány než u jaterní steatózy. Vzhledem k obdobným patofyziologickým mechanizmům je základním cílem ovlivnit rizikové faktory nefarmakologickými opatřeními, tedy úpravou jídelníčku, snížením tělesné hmotnosti, zvýšením fyzické aktivity a omezením příjmu alkoholu. Specifická farmakologická léčba v současnosti není k dispozici. Farmakoterapie cílí na těsnou kompenzaci metabolického syndromu a dalších rizikových faktorů. U starších pacientů, kde může docházet k atrofii žlázy a náhradě pankreatické tkáně tukem jako možná součást fyziologického stárnutí, je otázkou, zda lze vůbec změnou životního stylu dosáhnout zvratu tohoto stavu. Při interpretaci zobrazovacích nálezů je proto důležité zohlednit tento kontext. Zdravější životospráva však jistě pacientovi nikterak neublíží.
Závěr
Steatóza pankreatu v souvislosti s rostoucím výskytem metabolického syndromu v populaci a přesnějším diagnostickým zobrazovacím metodám se bude stále častěji stávat tématem v našich ordinacích. Stále je diskutován klinický dopad na pacienta od prosté fyziologické atrofie pankretické žlázy až po zvýšené riziko vzniku metabolického či dokonce nádorového onemocnění. Diagnostika se opírá zejména o zobrazovací metody, přičemž nejvyšší přesnost nabízí MR. Vzhledem k absenci specifické farmakoterapie je základem léčby úprava životního stylu. Klinická interpretace nálezů musí být vždy individuální s ohledem na věk, celkový stav a rizikové faktory konkrétního pacienta. Včasná identifikace a intervence mohou zabránit rozvoji závažných komplikací, a zlepšit tak dlouhodobou prognózu pacienta.
Poděkování
Autoři děkují Mgr. Jitce Loscherové, vedoucí Knihovny FN u sv. Anny v Brně, za výjimečnou pomoc při odborném zpracování textu a paní Lence Živčákové z Knihovny FN Ostrava za nepostradatelnou pomoc při získávání rešerší.
ORCID autorů
D. Solil 0009-0004-3343-3424,
P. Dítě 0000-0002-1882-3051,
M. Přecechtělová 0009-0003-9212-8676,
M. Bojková 0000-0001-7799-2827,
J. Dolina 0000-0002-4204-4082,
B. Kianička 0000-0003-0988-5928.
Doručeno/ Submitted: 16. 7. 2025
Přijato/ Accepted: 1. 8. 2025
Korespondenční autor
MU Dr. David Solil
Interní gastroenterologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
david.solil@seznam.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Zhang CL, Wang JJ, Li JN et al. Nonalcoholic fatty pancreas disease: an emerging clinical challenge. World J Clin Case 2021; 9(23): 6624– 6638. doi: 10.12998/ wjcc.v9.i23.6624.
2. Pagkali A, Makris A, Brofidi K et al. Pathophysiological mechanisms and clinical associations of non-alcoholic fatty pancreas disease. Diabetes Metab Syndr Obes 2024; 17: 283– 294. doi: 10.2147/ DMSO.S397643.
3. Bobulescu IA, Lotan Y, Zhang J et al. Triglycerides in human kidney cortex: relationship with body size. PLoS One 2014; 9(8): e101285. doi: 10.1371/ journal.pone.0101285.
4. Le MH, Devaki PP, Jun DW et al. Prevalence of non-alcoholic fatty liver disease and risk factors for advanced fibrosis and mortality in United States. PLoS One 2017; 12(3): e0173499. doi: 10.1371/ journal.pone.0173499.
5. Ogilvie RF. The islands of Langerhans in 19 cases of obesity. J Pathol Bacteriol 1933; 37(3): 473– 481. doi: 10.1002/ path.1700370314.
6. Olsen TS. Lipomatosis of the pancreas in autopsy material and its relation to age and overweight. Acta Pathol Microbiol Scand A 1978; 86A(5): 367– 373. doi: 10.1111/ j. 1699-0463.1978.tb02058.x.
7. Stamm BH. Incidence and diagnostic significance of minor pathologic changes in the adult pancreas autopsy: a systematic study of 12 autopsies in patients witout known pancreatic disease. Hum Pathol 1984; 15(7): 677– 683. doi: 10.1016/ s0046-8177(84)80294-4.
8. Smits MM, van Geenen EJ. The clinical significance of pancreatic steatosis. Nat Rev Gastroenterol Hepatol 2011; 8(3): 169– 177. doi: 10.1038/ nrgastro.2011.4.
9. Tariq H, Nayudu S, Akella S et al. Non alcoholic fatty pancreatic disease: a review of literature. Gastroenterol Res 2016; 9(6): 87– 91. doi: 10.14740/ gr731w.
10. Yu TY, Wang CY. Impact of non-alcoholic fatty pancreas disease on glucose metabolism. J Diabetol Invest 2017; 8(6): 735– 747. doi: 10.1111/ jdi.12665.
11. Lesmana CR, Pakasi LS, Inggriani S et al. Prevalence of non-alcoholic fatty pancreas disease (NAFPD) and its risk factors among adult medical check-up patients in a private hospital: a large cross sectional study. BMC Gastroenterol 2015; 15: 174. doi: 10.1186/ s12876-015-0404-1.
12. Wu WC, Wang CY. Association between non-alcoholic fatty pancreas disease (NAFPD) and the metabolic syndrome: a case control retrospective study. Cardiovsc Diabetol 2013; 12: 77. doi: 10.1186/ 1475-2840-12-77.
13. Singh RG, Yoon HD, Wu LM et al. Ectopic fat accumulation in the pancreas and its clinical relevance: a systematic revue, meta-analysis and meta-regression. Metabolism 2017; 69: 1– 13. doi: 10.1016/ j. metabol.2016.12.012.
14. Ou HY, Wang CY, Yang YC et al. The association between nonalcoholic fatty pancreas disease and diabetes. PLoS One 2013; 8(5): e62561. doi: 10.1371/ journal.pone.0062561.
15. Lee JS, Kim SH, Jun DW et al. Clinical implications of fatty pancreas: correlations between fatty pancreas and metabolic syndrome. World J Gastroenterol 2009; 15(15): 1869– 1875. doi: 10.3748/ wjg.15.1869.
16. Al-Haddad M, Khashab M, Zyromski N et al. Risk factors for hyperechogenic pancreas on endoscopic ultrasound: a case-control study. Pancreas 2009; 38(6): 672– 675. doi: 10.1097/ MPA.0b013e3181a9d5af.
17. Wang C, Zhang M, Wu J et al. The effect and mechanism of TLR9/ KLF4 and FFA-induced adipocyte inflammation. Mediators Inflamm 2018; 2018: 6313484. doi: 10.1155/ 2018/ 6313484.
18. Gotoh K, Inoue M, Shiraishi K et al. Spleen-derived interleukin-10 downregulates the severity of high-fat diet-induced non-alcoholic fatty pancreas disease. PLoS One 2012; 7(12): e53154. doi: 10.1371/ journal.pone.0053154.
19. Lin M, Weng SY, Chai KF et al. Lipidomics as a tool of predicting progression from non-alcoholic fatty pancreas disease to type 2 diabetes mellitus. RSC Adv 2019; 9(71): 41419– 41430. doi: 10.1039/ c9ra07071k.
20. Tannenbaum BM, Brindley DN, Tannenbaum GS et al. High fat feeding alters both basal and cross-induced hypothalamic-pituitary-adrenal activity in the rat. Amer J Physiol 1997; 273(6): E1168– E1177. doi: 10.1152/ ajpendo.1997.273.6.E1168.
22. Bonora E. The metabolic syndrome and cardiovascular disease. Ann Med 2006; 38(1): 64– 80. doi: 10.1080/ 07853890500401234.
23. Juge-Aubry CE, Henrichot E, Meier CA. Adipose tissue: regulator of inflammation. Best Pract Res Clin Endocrinol Metab 2005; 19(4): 547– 566. doi: 10.1016/ j. beem.2005.07.009.
24. Petrov MS, Taylor R. Intra-pancreatic fat depoition: bringing hidden fat to the fore. Nat Rev Gastroenterol Hepatol 2022; 19(3): 996716. doi: 10.1038/ s41575-021-00551-0.
25. Catanzaro R, Cuffari B, Italia A et al. Exploring the metabolic syndrome: nonalcoholic fatty pancreas disease. World J Gastroenterol 2016; 22(34): 760– 765. doi: 10.3748/ wjg.v22.i34.7660.
26. Altinel D, Basturk O, Sarmiento M et al. Lipomatous pseudohypertrophy of the pancreas: a clinicopathologically distinct entity. Pancreas 2010; 39(3): 392– 397. doi: 10.1097/ MPA.0b013e3181bd2923.
27. Lee Y, Lingway I, Szczepaniak LS et al. Pancreatic steatosis: harbinger of type 2 diabetes in obese patients. Int J Obes 2010; 34(2): 396– 400. doi: 10.1038/ ijo.2009.245.
28. Chang ML. Fatty pancreas-centered metabolic basis of pancreatic adenocarcinoma: from obesity, diabetes, and pancreatitis to oncogenesis. Biomedicines 2022; 10(3): 692. doi: 10.3390/ biomedicines10010602.
29. Silva L, Fernandes MSS, Lima MA et al. Fatty pancreas: disease or finding? Clinics 2021; 76: e2439. doi: 10.6061/ clinics/ 2021/ e2439.
30. Nascimento FA, Barbosa-da-Silva S, Fernandes-Santos S et al. Adipose tissue, liver and structural alterations in C57BL/ 6 mice and high-fat-high sucrose diet supplemented with fish oil (n-3 fatty acid rich oil). Exp Toxicol Pathol 2010; 62(1): 17– 25. doi: 10.1016/ j. etp.2008. 12.008.
31. Lee Y, Hirose H, Ohneda M et al. Beta-cell lipotoxicity in the management of non-insulin- dependent diabetes of obese rats: impairment in adipocyte-beta-cell relationships. Proc Natl Acad Sci U S A 1994; 91(23): 10878– 10882. doi: 10.1073/ pnas.91.23.10878.
32. de Wilde J, Mohren R, van den Berg S et al. Short-term high fat-feeding results in morphological and metabolic adaptations in the skeletal muscles of C57BBL/ 61 mice. Physiol Genomics 2008; 32(3): 360– 369. doi: 10.1152/ physiolgenomics.00219.2007.
33. Chtioui H, Semela D, Ledermann M et al. Expression and activity of cytochrome P450 2E1 in patients with non-alcoholic steatosis and steatohepatitis. Liver Int 2007; 27(6): 764– 771. doi: 10.1111/ j. 1478-3231.2007.01524.x.
34. Yu TY, Wang CY. Impact of non-alcoholic fatty pancreas disease on glucose metabolism. J Diabetes Invest 2017; 8(6): 735– 747. doi: 10.1111/ jdi.12665.
35. van Geenen EJ, Smits MM, Scheuder TC et al. Nonalcoholic fatty liver disease is related to nonalcohilic fatty pancreas disease. Pancreas 2010; 39(8): 1185– 1190. doi: 10.1097/ MPA. 0b013e3181f6fce2.
36. Filippatos TD, Alexis K, Mavrikaki V et al. Non-alcoholic fatty pancreas disease: role of metabolic syndrome, “prediabetes”, diabetes and atherosclerosis. Dig Dis Sci 2022; 67(1): 26– 41. doi: 10.1007/ s10620-021-06824-7.
37. Yamazaki H, Tauchi S, Kimachi M et al. Association between pancreatic fat and incidence of matabolic syndrome: a 5-year Japanese cohort study. J Gastroenterol Hepatol 2018; 33(12): 2048– 2054. doi: 10.1111/ jgh.14266.
38. Wang CY, Ou HY, Chen MF et al. Enigmatic ectopic fat: prevalence of non-alcoholic fatty pancreas disease and its associated factors in Chinese population. J Am Heart Assoc 2014; 3(1): e000297. doi: 10.1161/ JAHA.113.000297.
39. Sijens PE, Edens MA, Bakker SJ et al. MRI-determined fat content of human liver, pancreas and kidney. World J Gastroenterol 2010; 16(16): 1993– 1998. doi: 10.3748/ wjg.v16.i16.1993.
40. Dela Corte C, Mosca A, Majo E et al. Nonalcoholic fatty pancreas disease and nonalcoholic fatty liver disease: more than ectopic fat. Clin Endocrinol 2015; 83(5): 656– 662. doi: 10.1111/ cen.12862.
41. Ragivarodom M, Geeratragool T, Pausawasdi N et al. Fatty pancreas: linking pancreas pathophysiology to nonalcoholic fatty liver disease. J Clin Transl Hepatol 2022; 10(6): 1229– 1239. doi: 10.14218/ JCTH.2022.00085.
42. Grundy SM, Cleemen JI, Daniels SR et al. Diagnosis and management of the metabolic syndrome: an American Heart Association/ National Heart, Lung and Blood Institute Scientific Statement. Circulation 2005; 112(17): 2735– 2752. doi: 10.1161/ CIRCULATIONAHA.105.169404.
43. Haslam DW, James WPT. Obesity. Lancet 2005; 366(9492): 1197– 1209. doi: 10.1016/ S0140- 6736(05)67483-1.
44. Pinnick KE, Collins SC, Londos C et al. Pancreatic ectopic fat is characterized by adipocyte infiltration and altered lipid composition. Obesity 2008; 16(3): 522– 530. doi: 10.1038/ oby.2007.110.
45. Sepe PS, Ohri A, Sanaka S et al. A prospective evaluation of fatty pancreas by using EUS. Gastroint Endosc 2011; 73(5): 987– 993. doi: 10.1016/ j. gie.2011.01.015.
46. Ozturk K, Dogan T, Celikkamat S et al. The association of fatty pancreas with subclinical atherosclerosis in non alcoholic fatty liver disease. Eur Gastroenterol Hepatol 2018; 30(4): 411– 417. doi: 10.1097/ MEG.0000000000001059.
47. Sezgin O, Yaras S, Özdogan O. Pancreatic steatosis is associated wit both metabolic syndrome and pancreatic steffness detected by ultrasound elastography. Dig Dis Sci 2022; 67(1): 293– 304. doi: 10.1007/ s10620-021-06844-3.
48. Sodhi KS, Vyas S, Khandelwa N et al. Complete pancreatic lipomatosis. Indian J Gastroenterol 2010; 29(2): 65. doi: 10.1007/ s12664-010-0023-2.
49. Seppälä-Lindroos A, Vehkavaara S, Häkkinen M et al. Fat accumulation in the liver is associated with defects in insulin supression of glucose production and serum free fatty acids independent of obesity in normal men. J Clin Endocrinol Metab 2002; 87(7): 3023– 3028. doi: 10.1210/ jcem.87.7.8638.
50. Kotronen A, Seppälä-Lindroos A, Bergholm R et al. Tissue specificity of insulin resistence in humans: fat in the liver rather than than muscle is associated with features of the metabolic syndrome. Diabetologia 2008; 51(1): 130– 138. doi: 10.1007/ s00125-007-0867-x.
51. Yamazaki H, Tsuboya T, Katanuma et al. Independent association between fatty pancreas and incidence and incidence of type 2 diabetes: 5-year Japanese cohort study. Diabetes Care 2016; 39(10): 1677– 1683. doi: 10.2337/ dc16-0074.
52. Sahin S, Yerlikaya MG, Ozdenya M.et al. Non-Alcoholic Fatty Pancreas Disease is Associated with SYNTAX Score in Acute Coronary Syndrome. Acta Cardiol Sin 2022; 38(6): 683– 690. doi: 10.6515/ ACS.202211_38(6).20220424A.
53. Lim S, Meigs B. Links between ectopic fatand vascular disease in humans. Arteroscler Thromb Vasc Biol 2014; 34(9): 1820– 1826. doi: 10.1161/ ATVBAHA.114.303035.
54. Rasool A, Dar W, Latief M et al. Nonalcoholic fatty liver disease as an independent risk factor for carotid artherosclerosis. Brain Circ 2017; 3(1): 35– 40. doi: 10.4103/ bc.bc_28_16.
55. Fracanzani A, Tiraboschi S, Pisano G et al. Progression of carotid vascular damage and cardiovascular events in non-alcoolic fatty liver disease patients compared to the general population during 10-years of follow up. Atherosclerosis 2016; 246: 208– 213. doi: 10.1016/ j. atherosclerosis.2016.01.016.
56. Arslan AA, Helzlsouer KJ, Kooperberg C et al. Anthropomeric measures, body mass index, and pancreatic cancer: pooled analysis from the Pancreatic Cancer Cohort Consortium (PanScan). Arch Intern Med 2010; 70(9): 791– 802. doi: 10.1001/ archinternmed.2010.63.
57. Hori M, Takahashi M, Hiraoka N et al. Association of pancreatic fatty infiltration with pancreatic ductal adenocarcinoma. Clin Transl Gastroenterol 2014; 5(3): e53. doi: 10.1038/ ctg. 2014.5.
58. Otsuka N, Shimizu K, Taniai H et al. Risk factors for fatty pancreas and effects of fatty infiltation on pancreatic cancer. Front Physiol 2023; 14: 1243983. doi: 10.3389/ fphys.2023.1243983.
59. Sbeit W, Khoury T. Fatty pancreas represents a risk factor for acute pancreatitis: a pilot study. Pancreas 2021; 50(7): 990– 993. doi: 10.1097/ MPA.0000000000001867.
60. Shah N, Rocha JP, Bhutiani N et al. Nonalcoholic fatty pancreas disease. Nutr Clin Pract 2019; 34(Suppl 1): S49– S56. doi: 10.1002/ ncp.10397.