Neurobiológia chorôb pečene
Mária Szántová Orcid.org 1, Boris Mravec2,3
+ Pracoviště
Souhrn
Nervový systém predstavuje významný faktor, ktorý sa podieľa na adaptačných a kompenzačných reakciách organizmu, a to nielen v rámci fyziologických, ale aj patologických procesov. Alterácia v činnosti nervového systému sa môže podieľať na vzniku somatických chorôb a môže tiež ovplyvňovať ich progresiu. Experimentálne a klinické štúdie preukázali, že nervový systém zohráva úlohu aj pri chorobách pečene. V závislosti na ochorení a na mechanizmoch a dráhach, môže nervový systém zohrávať pri chorobách pečene pozitívnu, ale aj negatívnu úlohu. Cieľom tohto prehľadového článku je priblížiť mechanizmy a dráhy, prostredníctvom ktorých nervový systém ovplyvňuje vznik a progresiu najčastejšie sa vyskytujúcich chorôb pečene, ako sú napríklad alkoholové poškodenie pečene, nealkoholová tuková choroba pečene, cholestatické choroby pečene, hepatitídy, cirhóza a hepatocelulárny karcinóm. V rámci článku tiež popisujeme možné terapeutické konzekvencie založené na modulácii prenosu signálov medzi nervovým systémom a pečeňou.
Klíčová slova
alkoholové poškodenie pečene, autonómny nervový systém, cirhóza, chronická hepatitida, hepatocelulárny karcinóm, cholestatické choroby pečene, neurobiológia, tuková choroba pečene
Úvod
Nervový systém zohráva významnú úlohu v regulácii činnosti vnútorných orgánov. Moduluje ich vývin, podieľa sa na udržiavaní homeostázy na úrovni buniek a tkanív v týchto orgánoch, reguluje adaptačné a kompenzačné reakcie na ich poškodenie a procesy spojené s ich regeneráciou a reparáciou [1]. Uvedené funkcie sú významné aj z hľadiska fyziologických funkcií pečene a tiež aj z hľadiska vzniku a progresie chorôb pečene. Mechanizmy a dráhy, ktoré ich sprostredkúvajú sú súčasťou kombinovaného hepatologického a neurobiologického výskumu, ktorý spadá do oblasti neurobiológie chorôb pečene [2]. Neurobiologický výskum, ktorý sa v minulosti zameriaval prevažne na skúmanie úlohy nervového systému pri neurologických chorobách a psychických poruchách, sa tak v súčasnosti začína čoraz viac venovať aj úlohe nervového systému pri vzniku a progresii celého spektra somatických chorôb [3], zahŕňajúcich aj choroby pečene.
Ochorenia pečene
Ochorenia pečene majú vo svete i na Slovensku stúpajúci trend morbidity i mortality, zvlášť v produktívnom veku. V rokoch 2018–2020 boli choroby pečene na Slovensku najčastejšou príčinou mortality u osôb v produktívnom veku do 45 rokov [4–6]. U osôb vo veku 45–64 rokov boli treťou najčastejšou príčinou úmrtí. Z hľadiska etiológie je na Slovensku najčastejšou príčinou hepatálnej mortality s alkoholom asociovaná choroba pečene (ALD), nasleduje nealkoholová tuková choroba pečene (NAFLD), vírusové hepatitídy a cholestatické choroby pečene. Alkohol má na svedomí 3 milióny (5,3 %) úmrtí ročne vo svete, pritom vo veku 20–39 rokov je to až 13,5 % všetkých úmrtí. V Európe, kontinente s najvyššou spotrebou alkoholu, je príčinou vyše milióna (10,1 %) úmrtí ročne. Na Slovensku je tento podiel ešte vyšší. ALD a NAFLD sú tiež najčastejšími príčinami vzniku hepatocelulárneho karcinómu (HCC), ktorého incidencia v posledných rokoch významne vzrastá. Rovnako vzrastá podiel pokročilých štádií – cirhózy pečene, kde sme krajinou s najvyšším výskytom vo svete [7].
Os mozog-pečeň
Obojsmerné interakcie medzi mozgom a pečeňou umožňujú na jednej strane mozgu komplexne regulovať činnosť pečene, na druhej strane pečeni ovplyvňovať mozgové funkcie. Tieto interakcie sprostredkúvajú ako nervové, tak aj humorálne dráhy. Uvedené interakcie okrem pečene často zahŕňajú aj ďalšie orgány tráviaceho traktu, čím sa zvyšuje efektívnosť regulácie metabolických procesov v organizme. Os mozog-pečeň taktiež zabezpečuje cirkadiánne zmeny v činnosti pečene. Táto os ale nezohráva významnú úlohu iba za fyziologických situácií, ale aj pri patologických procesoch. Nervový systém napríklad moduluje reparáciu a regeneráciu pečene, ovplyvňuje procesy súvisiace s fibrózou pečene ako aj vznikom a progresiou ďalších patologických procesov prebiehajúcich v pečeni (steatóza heparu, cirhóza, hepatocelulárny karcinóm). Nervový systém ovplyvňuje aj choroby, ktoré súvisia s činnosťou pečene na systémovej úrovni, akým je napríklad diabetes mellitus a obezita [2].
Nervové dráhy
Pečeň je inervovaná eferentnými (autonómnymi) a aferentnými (senzitívnymi) nervami. Eferentné nervy zahŕňajú ako sympatikové, tak aj parasympatikové nervy. Tieto nervy inervujú pečeňové artérie, venu portae a žlčové cesty. U ľudí sympatikové nervy zasahujú aj do tkaniva pečene, kde inervujú bunky jej parenchýmu. Senzitívne zakončenia aferentných nervov inervujúcich pečeň slúžia ako senzory, detegujúce prítomnosť a koncentrácie látok vstrebaných v tráviacom trakte. Tieto senzitívne zakončenia môžu obsahovať osmoreceptory, receptory detegujúce koncentrácie iónov, metabolitov (glukózy a mastných kyselín) a hormónov. Senzitívne nervy inervujú aj kapsulu pečene [2].
Humorálne dráhy
Mozog môže regulovať funkcie pečene prostredníctvom neuroendokrinného systému. Tak napríklad kortizol, ktorého sekrécia je regulovaná hypotalamo-hypofýzo-adrenokortikálnou osou, ovplyvňuje v pečeni metabolizmus glukózy [2]. Poznanie mechanizmov a dráh, ktoré sprostredkúvajú komunikáciu medzi mozgom a pečeňou vytvára podklad nielen pre lepšie porozumenie fungovania pečene za fyziologických podmienok, ale aj pre pochopenie úlohy nervového systému pri vzniku a progresii chorôb pečene. Tieto poznatky taktiež vytvárajú podklad pre zavedenie nových terapeutických a preventívnych postupov v hepatológii.
Nervový systém a choroby pečene
Nervový systém ovplyvňuje vznik a priebeh celého spektra chorôb pečene, od nealkoholovej tukovej choroby pečene až po hepatocelulárny karcinóm (obr. 1). Na druhej strane, choroby pečene môžu viesť k morfologickým a funkčným alteráciám nervového systému [8]. Môže tak vznikať circulus vitiosus, kedy sa alterácie v nervovom systéme spolupodieľajú na vzniku a progresii chorôb pečene a patologické zmeny v pečeni následne potencujú dysfunkčné pôsobenie nervového systému na pečeň.
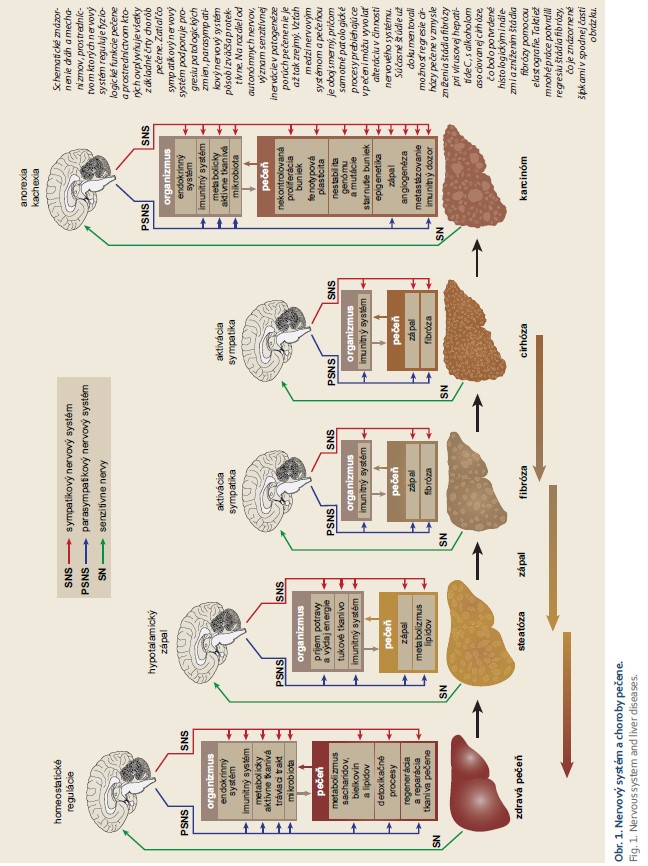
Alkoholová choroba pečene
Alkoholová choroba pečene zahŕňa celé spektrum klinických prejavov od jednoduchej alkoholovej steatózy, cez alkoholovú steatofibrózu až po cirhózu pečene a akútnu alkoholovú hepatitídu. Pozitívny anamnestický údaj konzumácie alkoholu (napr. AUDIT C 4 body a viac) spolu s laboratórnymi známkami poškodenia pečene (deRittisov index, elevácia GGT, MCV) alebo aj ultrasonografickými znakmi steatózy sú prejavmi alkoholovej choroby pečene.
Prostredníctvom autonómnych nervov reguluje nervový systém metabolické procesy prebiehajúce v metabolicky aktívnych tkanivách a orgánoch, zahŕňajúcich aj pečeň [9]. Je veľmi pravdepodobné, že autonómne nervy v pečeni v určitej miere regulujú aj detoxikáciu alkoholu. Na druhej strane, príjem alkoholu ovplyvňuje činnosť mozgu ako aj autonómneho nervového systému. Tak napríklad po príjme alkoholu dochádza k zvýšeniu plazmatických hladín noradrenalínu a adrenalínu v dôsledku zvýšenia aktivity sympatikových nervov, ako aj uvoľnenia katecholamínov z drene nadobličiek. Zvýšené hladiny katecholamínov môžu následne v pečeni aktivovať Kupfferové a hviezdicové bunky, a tak sa podieľať na vzniku zápalu a fibrózy [10]. Na úrovni mozgu pri alkoholovej chorobe pečene zohrávajú úlohu neuróny hypotalamu, ktoré syntetizujú -endorfín (BEP). Dokazuje to aj zistenie, že transplantácia BEP neurónov redukovala u samcov potkanov, ktorým sa 8 týždňov podávala potrava obsahujúca alkohol, vzostup triacylglyceridov, faktora aktivujúceho hepatálne hviezdicovité bunky, hladiny katecholamínov v pečeni a plazmatické hladiny endotoxínu [11]. Z hľadiska detoxikácie alkoholu v pečeni sa vplyv nervového systému na tento proces môže uplatňovať aj prostredníctvom cirkadiánnych regulácií funkcií pečene [12].
Nealkoholová tuková choroba pečene
Nealkoholová tuková choroba pečene (NAFLD) je definovaná stukovatením pečene s obsahom viac ako 5 % tuku v pečeni preukázaného buď pri MR spektroskopickom vyšetrení pečene alebo pri histologickom vyšetrení pečene pri dennej konzumácii alkoholu 20 g a menej pre ženu, resp. 30 g a menej pre muža [13]. Je druhou najčastejšou príčinou ochorení pečene, transplantácií pečene i HCC.
Nervový systém zohráva pri NAFLD komplexnú úlohu [14]. Mozog reguluje príjem potravy a výdaj energie, pričom na systémovej úrovni toto regulačné pôsobenie ovplyvňuje aj príjem tukov, a tým aj množstvo tukového tkaniva v organizme [15]. Na úrovni pečene autonómne nervy ovplyvňujú metabolizmus tukov [9]. Na druhej strane, zvýšené množstvo tukového tkaniva ovplyvňuje činnosť nervového systému a môže viesť k narušeniu rovnováhy v činnosti autonómneho nervového systému v prospech zvýšenej aktivity sympatika [16]. Vyvstáva preto otázka, či pri NAFLD je alterovaná sympatiková aktivita jedným z etiologických faktorov, alebo je dôsledkom hromadenia tukového tkaniva v organizme.
U pacientov s NAFLD je vo zvýšenej miere prítomná dysfunkcia autonómneho nervového systému [17,18]. Je ale otázne, či je táto autonómna dysfunkcia prítomná už v skorých štádiách choroby, a či sa teda podieľa na vzniku a progresii NAFLD [8]. Na úlohu autonómnej dysfunkcie, konkrétne zvýšenej aktivity sympatikového nervového systému pri vzniku NAFLD poukazujú niektoré experimentálne nálezy. Tak napríklad u myší kŕmených vysokotukovou potravou bola pozorovaná takmer dvojnásobne zvýšená sympatiková aktivita, pričom farmakologická ablácia sympatikových nervov redukovala steatózu a hepatomegáliu vyvolanú vysokotukovou diétou, a to nezávisle od zmien telesnej hmotnosti, príjmu energie alebo množstva tukového tkaniva [19]. Bolo tiež preukázané, že vysokotuková diéta viedla u myší k rozvoju reverzibilnej hepatálnej sympatikovej neuropatie, a to v dôsledku zvýšenej signalizácie sprostredkovanej TNF uvoľneným z makrofágov, ktorý pôsobil na molekulu Sarm1 (sterile alpha and TIR motif containing 1) nachádzajúcu sa na sympatikových neurónoch [20]. Zdá sa teda, že metabolický stres vyvolaný vysokotukovou diétou ovplyvňuje ako prežívanie, tak aj funkcie sympatikových neurónov inervujúcich pečeň [8].
Experimentálne údaje naznačujú, že na vzniku NAFLD v dospelosti sa môžu spolupodieľať alterácie v činnosti sympatikového nervového systému, ktoré sú dôsledkom metabolických inzultov pôsobiacich na organizmus už v prenatálnom alebo perinatálnom období [8]. Poukazuje na to fakt, že perinatálna expozícia vysokotukovej diéte znižuje sympatikovú inerváciu a zvyšuje apoptózu hepatocytov u samcov japonských makakov [21].
Zatiaľ čo zvýšená aktivita sympatikového systému sa môže podieľať na vzniku NAFLD, parasympatiková inervácia môže pôsobiť preventívne a to prostredníctvom potláčania zápalu vyvolaného vysokotukovou diétou [8]. Tak napríklad u myší kŕmených vysokotukovou diétou podávanie galantamínu, ktorý zvyšuje cholinergickú signalizáciu, signifikantne obmedzilo vznik steatózy pečene [22]. Naopak, vyradenie parasympatikového vplyvu na pečeň prostredníctvom hepatálnej vagotómie, potencovalo zápal v pečeni a aktivitu makrofágov u zvierat so steatohepatitídou indukovanou potravou bez obsahu metionínu a cholínu [23].
Na základe vyššie uvedených nálezov možno konštatovať, že dysfunkcia autonómneho nervového systému sa môže priamo podieľať na vzniku NAFLD. Na druhej strane, vysokotuková diéta môže vyvolať nerovnováhu v aktivite autonómneho nervového systému v prospech zvýšenej aktivity sympatika [8].
Vírusové hepatitídy
Nakoľko vplyv nervového systému sa najvýraznejšie môže prejaviť hlavne u chronických infekcií, v texte sa venujeme iba hepatitídam typu B a C.
Vplyv nervového systému na hepatitídy dokladajú aj naše pozorovania. V klinickej praxi na súbore vyše 100 pacientov s hepatitídou C sme pozorovali významný vplyv psychosociálnych faktorov jednak pri akvirácii hepatitídy C, ale aj v priebehu infekcie a jej dôsledkov a prognózy pacientov. Najčastejším faktorom u 70 % pacientov bola anamnéza intravenózneho užívania drog, približne 5 % akvirovalo infekciu pri darovaní plazmy pred rokom 1992. Z aspektu psychosociálnych faktorov išlo častejšie o osoby zo zraniteľného a rizikového prostredia s anamnézou abúzu alkoholu alebo iných látok v najbližšom prostredí rodiny, tiež osoby žijúce s jedným rodičom, v zahraničí alebo v nižšom sociálno-hygienickom štandarde, vyrastajúce v marginalizovaných komunitách. Na priebehu a závažnosti dôsledkov chronickej hepatitídy sa významnou mierou podieľal samotný postoj pacienta k svojmu ochoreniu. Prevažný podiel pacientov, najmä s hepatitídou C, bol s poruchou adaptability a správania, s tzv. neurastenickým syndrómom. Pacienti s depresívnym nastavením, larvovanou depresiou, úzkosťou, s potrebou bojovať proti nespravodlivosti a získať odškodné za ublíženie na zdraví (po iatrogénnej akvirácii hepatitídy pri darcovstve plazmy) dospeli v konečnom dôsledku po 25–30 rokoch trvania infekcie k závažnejším stupňom poškodenia pečene v porovnaní s osobami s vyrovnaným psychickým ladením, harmonickým rodinným zázemím a oporou. Samotný faktor „sebatrýznenia“ pacienta viedol i k vážnejšiemu poškodeniu pečene, ktorý vyústil až do cirhózy s potrebnou transplantáciou niekedy v koincidencii s trombózou portálnej vény, ktorá bola jej kontraindikáciou. Naopak, pacienti s pozitívnym naladením mysle, oceňujúci dary bytia a života dokázali prežiť významnú dobu 20–40 rokov bez známok cirhózy pečene či závažnej fibrózy. Eutýmia a pozitívne nastavenie mysle pomáha významne zlepšiť prognózu aj napriek nepriaznivým okolnostiam (napr. karcinóm pečene a nemožnosť explantácie pečene pri pokuse o transplantáciu) s dosiahnutím 8-ročného prežívania (doposiaľ). Mnohé práce dokumentujú signifikantne lepšie prežívanie u pacientov po transplantácii pečene v prípade, že mali predliečenú depresiu. V tejto oblasti je široké portfólio možností, ktoré má lekár k dispozícii na skvalitnenie manažmentu pacienta a využitie v zmysle podpornej liečby [24]. Naladenie pacienta ovplyvňuje produkciu hormónov a ďalších biologicky aktívnych látok, ktoré ovplyvňujú nervový, imunitný a humorálny systém, a tým dokážu ovplyvniť prognózu vývoja ochorenia.
Štúdia skúmajúca inerváciu pečene u pacientov s chorobami pečene preukázala signifikantné zníženie plochy vyplnenej nervami v pomere k celkovej portálnej ploche (NFRA) u jedincov s chronickou vírusovou hepatitídou v porovnaní s osobami s pokročilým štádiom fibrózy pečene. Hodnoty NFRA sa u pacientov s vírusovou hepatitídou C po liečbe zlepšila spoločne so zlepšením miery fibrózy pečene [25].
Nervový systém ovplyvňuje zápalové procesy v organizme prostredníctvom nervových a humorálnych dráh. Nervovú moduláciu zápalu zabezpečujú autonómne nervy, ktoré regulujú zápal na systémovej, regionálnej a lokálnej úrovni. Na humorálnej regulácii zápalu sa podieľa hypotalamo-hypofýzo-adrenokortikálna (HPA) os, ktorá vykazuje systémové imunomodulačné, prípadne inhibičné pôsobenie na zápal [26].
Základným nervovým regulátorom zápalu v organizme je nervus vagus. Aferentné zakončenia tohto hlavového nervu monitorujú prítomnosť zápalu v tkanivách tých orgánov, ktoré sú najčastejšou bránou vstupu patogénov, ako sú respiračný a tráviaci systém, a teda aj pečeň. Eferentné dráhy nervus vagus zasa vykazujú protizápalové pôsobenie v inervovaných tkanivách. Tieto aferentné a eferentné dráhy nervus vagus tvoria tzv. cholinergickú protizápalovú dráhu, ktorá v organizme tonicky inhibuje prozápalovú aktivitu imunitných buniek. Sympatikové nervy vo všeobecnosti pôsobia na zápal buď stimulačne, ak je ich aktivácia iba akútna, alebo inhibične, ak sú tieto nervy aktivované chronicky [27].
Viaceré štúdie preukázali, že zápalové procesy v pečeni sú modulované autonómnymi nervami. Na druhej strane samotná hepatitída môže ovplyvňovať autonómne nervy. Zistilo sa, že zatiaľ čo adrenergické sympatikové neuróny zmierňujú priebeh zápalu v pečeni, peptidergické primárne aferentné neuróny senzitívne na kapsaicín zápalové procesy v pečeni potencujú. Predpokladá sa, že tieto účinky vyplývajú aj z faktu, že nervové vlákna sa v pečeni nachádzajú v tesnej blízkosti rôznych typov imunitných buniek [28]. Zaujímavým sa javí aj zistenie, že u pacientov s chronickou hepatitídou B a C je prítomná autonómna neuropatia [29]. V nedávno publikovanej štúdii autori taktiež zistili, že u pacientov s chronickou hepatitídou C je prítomná zvýšená aktivita sympatikového nervového systému [30]. Okrem autonómnej inervácie sa na modulácii zápalu v pečeni podieľa aj HPA os. Klinické štúdie a animálne experimenty naznačujú, že práve HPA os sprostredkúva negatívny vplyv mozgu na priebeh experimentálnej hepatitídy B a C. Stresom zvýšené hladiny glukokortikoidov totiž pôsobia poškodzujúco na hepatocyty, o čom svedčí aj nález zvýšených transamináz v uvedených štúdiách [31]. Naopak, inhibične na zápal v pečeni pôsobí parasympatikový nervový systém, a to prostredníctvom cholinergickej protizápalovej dráhy [32].
Nervový systém okrem vyššie uvedených účinkov môže ovplyvniť aj efektivitu vakcinácie proti hepatitídam. V klinickej štúdii sa totiž zistilo, že stres môže predstavovať faktor, ktorý negatívne ovplyvňuje tvorbu protilátok po podaní vakcíny proti hepatitíde B [33]. Zdá sa, že tento efekt stresu je sprostredkovaný ako sympatikom, tak aj HPA osou [34].
Cholestatické choroby pečene
Modulačný vplyv nervového systému na cholestatické choroby pečene sa môže uplatňovať prostredníctvom autonómnych nervov. Biliárny systém je inervovaný z dvoch zdrojov, a to prostredníctvom parasympatikových vlákien nervus vagus a sympatikových vlákien plexus coeliacus (tzv. plexus solaris) sprevádzajúcich truncus coeliacus. Vetvy nervus phrenicus tiež môžu dosahovať biliárny systém. Neuróny žlčníka sú relatívne neexcitabilné, sú riadené vágovými stimulmi a modulované hormónmi a peptidmi so senzitívnych vlákien a zápalovými mediátormi. Funkciu žlčníka a biliárneho systému ovplyvňuje množstvo aktívnych látok (napr. substantia P, galanín, oxid dusnatý, vazoaktívny intestinálny polypeptid) [35]. Okrem regulácie fyziologických funkcií biliárneho systému zohráva nervový systém úlohu aj pri vzniku biliárnej fibrózy. Autonómne a senzitívne nervy totiž zabezpečujú tkanivovú homeostázu v pečeni (napr. kvalitatívne a kvantitatívne charakteristiky extracelulárnej matrix), pričom narušenie ich modulačného pôsobenia sa môže podieľať aj na procesoch spojených s fibrotickými zmenami biliárneho aparátu [36].
Nálezy z klinickej štúdie u pacientov s primárnou biliárnou cholangitídou naznačujú, že v liečbe tejto choroby je možné využiť stimuláciu cholinergickej protizápalovej dráhy nervus vagus. Autori štúdie totiž preukázali, že neinvazívna transkutánna neuromodulácia spoločne s podávaním ursodeoxycholovej kyseliny signifikantne zlepšila funkcie pečene u týchto pacientov [37].
Cholestatické choroby pečene sú na jednej strane ovplyvňované nervovým systémom, na druhej strane sami môžu narúšať činnosť nervového systému. Dokladá to aj nález u pacientov s primárnou sklerotizujúcou cholangitídou, u ktorých bola pozorovaná súvislosť medzi únavou, ktorá je pri tomto ochorení často prítomná a autonómnou dysfunkciou, ktorá sa prejavovala napríklad hypotenziou sprostredkovanou autonómnym nervovým systémom [38].
Cirhóza pečene
Nervový systém moduluje viaceré procesy zapojené do patogenézy cirhózy pečene. Tak napríklad, noradrenalín uvoľňovaný zo sympatikových nervových zakončení potencuje proliferáciu hviezdicovitých buniek pečene, ako aj fibrózu tkaniva pečene. O úlohe parasympatikového systému v týchto procesoch nie sú dostatočné dôkazy, ale predpokladá sa, že protizápalovým pôsobením v pečeni nervus vagus inhibuje proces fibrózy [39].
Na druhej strane, cirhóza pečene môže zvyšovať aktivitu sympatikového nervového systému, čo preukázali viaceré štúdie. Je možné, že ide o kompenzačnú reakciu organizmu na patologické procesy prebiehajúce v pečeni. Skúmanie aktivity sympatikového nervového systému u pacientov s cirhózou, ktoré prebieha už niekoľko desaťročí, preukázalo nepriamo na základe vzostupu plazmatických hladín katecholamínov, zvýšenú sympatikovú aktivitu pri tomto ochorení [40]. Zdá sa, že zvýšená aktivita sympatika súvisí s retenciou sodíka a vody a so znížením perfúzie obličiek, pričom môže ísť o adaptačnú, resp. kompenzačnú reakciu organizmu na narušenie homeostázy v dôsledku cirhózy [41]. Zvýšená sympatiková aktivita v splanchnickej oblasti bola preukázaná aj v animálnom modeli cirhózy [42]. Údaje z klinickej štúdie u pacientov s cirhózou poukazujú aj na narušenia činnosti nervus vagus. Autori tejto štúdie predpokladajú, že je to dôsledok poruchy aferentnej vagovej signalizácie [43]. Zdá sa, že abnormality v činnosti autonómneho nervového systému sú prítomné už v skorých štádiách cirhózy, pričom je ich možné detegovať ako scintigraficky, tak aj analýzou variability srdcovej frekvencie [42].
Keďže sympatikový nervový systém môže potencovať procesy súvisiace so vznikom a progresiou cirhózy pečene a nakoľko samotná prítomnosť cirhózy zvyšuje aktivitu sympatikového nervového systému, je možné, že sa tak vytvára circulus vitiosus, ktorý negatívne ovplyvňuje prognózu pacientov s cirhózou pečene. Zásah do tohto bludného kruhu môže predstavovať nový terapeutický postup, ktorý môže zamedziť alebo aspoň spomaliť progresiu tohto ochorenia do zlyhania pečene.
Hepatocelulárny karcinóm
Hepatocelulárny karcinóm (HCC) predstavuje najčastejší typ rakoviny pečene (v 75–85 %).
Klinická prax nás učí, že fixovaná neodkloniteľná predstava pacientov s karcinofóbiou skutočne viedla k manifestácii ochorenia po šiestich až 10 rokoch dispenzarizácie pacientov.
Autonómny nervový systém sa významnou mierou podieľa na vzniku a progresii nádorových chorôb, zahŕňajúcich aj nádory pečene [44]. Poukazuje na to viacero faktov. Tak napríklad zvýšená denzita sympatikových vlákien v tkanive hepatocelulárneho karcinómu je spojená s horšou prognózou [45]. Expresia monoaminooxidázy A (MAOA), enzýmu, ktorý sa podieľa aj na degradácii adrenalínu a noradrenalínu uvoľňovaných zo sympatikových nervových zakončení a drene nadobličiek, je znížená u pacientov s hepatocelulárnym karcinómom, pričom zvýšené hladiny MAOA sa spájajú s lepším prežívaním a predĺženým prežívaním bez nádorovej choroby [46]. Chemická denervácia sympatika pomocou 6-hydroxydopamínu (6-OHDA) redukovala fibrózu a tvorbu hepatocelulárneho karcinómu u potkanov exponovaných dietylnitrosamínu (DEN) [45].
Na úrovni mozgu pôsobia inhibične na chemicky indukovanú karcinogenézu v pečeni neuróny syntetizujúce ß-endorfín (BEP). Zistilo sa totiž, že transplantácia týchto neurónov do hypotalamu potkanov redukovala histologické zmeny vyvolané podávaním karcinogénu dietylnitrosamínu, konkrétne fibrózu, zápalovú infiltráciu, hladiny faktora aktivujúceho hepatálne hviezdicovité bunky, ukladanie kolagénu, množstvo preneoplastických lézií a hladiny katecholamínov. Došlo tiež k zvýšeniu hladín cytotoxických faktorov uvoľňovaných z NK buniek v pečeni. Výsledkom uvedeného pôsobenia bolo obmedzenie vzniku hepatocelulárneho karcinómu u zvierat, ktorým sa do hypotalamu implantovali BEP neuróny [11].
Transplantácia pečene
Transplantácia pečene predstavuje radikálny spôsob liečby ochorení pečene v nezvratnom štádiu poškodenia v štádiu cirhózy pečene za splnenia inklúznych a exklúznych kritérií. Od roku 2010 sa vykonáva pravidelný transplantačný program pečene v centre HEGITO FN F. D. Roosevelta v Banskej Bystrici, kde bolo doposiaľ vykonaných 353 transplantácií pečene (k 30. 9. 2022) [47]. Perióda pandémie covidu-19 prerušila prirodzený beh transplantačných programov vo väčšine častí sveta s najvýraznejšou redukciou až zastavením v krajinách s najvyššou mierou lockdownu a reštrikcií, potreba transplantácií zostáva však stacionárne vysoká.
Transplantácia pečene predstavuje výkon, pri ktorom sa jej inervácia nerekonštruuje. Trvá asi jeden rok, kým dôjde k spontánnej reinervácii tkaniva transplantovanej pečene. Počas tohto obdobia je teda pečeň denervovaná [48]. Vzhľadom na význam nervovej regulácie pečeňových funkcií sú funkcie transplantovanej pečene, u ktorej ešte neprebehla reinervácia, narušené. Neprítomnosť inervácie tkaniva transplantovanej pečene môže ovplyvniť metabolizmus v tomto orgáne. Dokladá to klinická štúdia u pacientov s transplantovanou pečeňou, u ktorých bol v 30. deň po transplantácii preukázaný zvýšený pokojový energetický výdaj, zatiaľ čo na konci štúdie (370 dní po transplantácii) došlo k jeho zníženiu [49]. Zistilo sa tiež, že nervový systém ovplyvňuje aj rozsah portálnej hypertenzie u pacientov s transplantovanou pečeňou. Perioperačný záznam EKG a spektrálna dopplerovská ultrasonografia preukázali, že u príjemcov čiastočného transplantátu pečene je posun sympatikovágovej rovnováhy v prospech parasympatika spojený so znížením portálnej hypertenzie [50].
Ischemicko-reperfúzne poškodenie pečene
Ischemicko-reperfúzne poškodenie pečene (PIRP) je charakterizované ako sterilná zápalová odpoveď vyvolaná prirodzenou imunitou v dôsledku včasnej orgánovej dysfunkcie a zlyhania po transplantácii pečene. Celulárne poškodenie v dôsledku PIRP je významným faktorom dysfunkcie štepu, ale aj akútnej a chronickej rejekcie [51].
Rozsah ischemicko-reperfúzneho poškodenia (IRP) orgánov je významne determinovaný pôsobením cholinergickej protizápalovej dráhy nervus vagus. Animálne experimenty totiž preukázali, že zatiaľ čo zvýšenie signalizácie prenášanej touto dráhou (elektrická stimulácia nervus vagus, podávanie agonistov 7-nikotínových receptorov) signifikantne obmedzuje rozsah IRP orgánov, obmedzenie tejto signalizácie (napr. vagotómiou) naopak zvyšuje rozsah IRP [52–55]. Experimentálne štúdie naznačujú, že aj pri PIRP zohrávajú úlohu autonómne nervy. Viaceré animálne štúdie totiž poukazujú na význam parasympatikovej inervácie v prevencii PIRP [56–58]. Obmedzenie PIRP, ktoré sprostredkúvajú axóny nervus vagus je pravdepodobne dôsledkom inhibičného pôsobenia cholinergickej protizápalovej dráhy na zápalové procesy prebiehajúce v tkanive ischemizovanej pečene [57]. Na rozdiel od parasympatikových nervov, úloha sympatikových nervov pri PIRP nie je zrejmá [59].
Naše klinické skúsenosti
Na význam osi mozog-pečeň v hepatológii poukazujú aj klinické skúsenosti. Z klinickej observácie pacientov s chronickými vírusovými hepatitídami B a C máme skúsenosti, že pacienti s eutýmiou, t.j. pozitívnym nastavením mysle majú aj pri dlhodobom 30-ročnom trvaní ochorenia významne nižší stupeň zápalu i fibrózy v porovnaní s pacientmi s dystýmiou, resp. psychosociálnou dysharmóniou alebo pocitom chronického stresu. Osoby s pocitmi krivdy a seba- utvrdzovaním v chorobe majú závažnejší stupeň poškodenia pečene v porovnaní s ostatnými. Fixované negatívne myšlienkové vzorce, ktoré si človek osvojí a nedokáže sa ich zbaviť, ho často po rokoch dovedú k výsledkom, ktoré si vyprojektoval v mysli. Štúdie u pacientov po transplantácii pečene zistili zvýšenie mortality asociované s mierou depresie, a to až 17% nárast mortality pri vzostupe depresie o 1 bod na Beckovej škále depresie [60]. Naopak, diagnostika a liečba depresie v predtransplantačnej perióde bola asociovaná so signifikantne nižšou mierou akútnej celulárnej rejekcie v porovnaní s neliečenými pacientmi [61].
Terapeutické implikácie
Vznik, priebeh a prognóza chorôb pečene sú ovplyvňované prenosom signálov autonómnymi a pravdepodobne aj senzitívnymi nervami inervujúcimi tkanivo pečene. Vo všeobecnosti je možné konštatovať, že zatiaľ čo zvýšená aktivita sympatikových nervov sa spolupodieľa na vzniku a progresii patologických procesov prebiehajúcich v pečeni, naopak, zvýšená aktivita hepatálnych vetiev nervus vagus pôsobí prospešne, t.j. obmedzuje rozsah poškodenia pečene. Určovanie autonómnej rovnováhy a postupy, zamerané na obmedzenie aktivity sympatika, a aktiváciu parasympatika preto môžu predstavovať nové postupy v terapii chorôb pečene. Pri implikácii týchto postupov bude potrebné najskôr určiť pomer aktivít sympatika a parasympatika. To umožní identifikovať tých pacientov, u ktorých prevažuje aktivita sympatika a u ktorých je teda žiadúce obmedziť sympatikovú signalizáciu a potencovať aktivitu nervus vagus.
Pomer aktivít sympatikového a parasympatikového nervového systému je možné určiť neinvazívne na základe vyhodnotenia variability srdcovej frekvencie (HRV) z EKG záznamu, ako aj určovaním kožnej vodivosti [62]. Nakoľko aktivita sympatika sa zvyšuje v dôsledku pôsobenia stresorov, je možné využiť aj dotazníky, ktoré určujú mieru stresu u daného jedinca. Zvýšenie aktivity sympatika môže byť ale aj dôsledkom samotného ochorenia pečene. Tak napríklad sa zistilo, že u pacientov s cirhózou pečene je HRV znížená [63]. Zníženie HRV je dôsledkom porušenia sympatikovágovej rovnováhy posunutej v prospech zvýšenej sympatikovej aktivity [62]. Uvedené nálezy naznačujú, že samotné ochorenie pečene je faktor (stresor), ktorý zvyšuje aktivitu sympatika. Je ale možné, že takto zvýšená aktivita sympatika je odrazom adaptačnej, prípadne kompenzačnej reakcie organizmu na patologický proces prebiehajúci v pečeni.
U pacientov s prevahou sympatikovej aktivity je potom možné využiť prístupy zamerané na úpravu autonómnej rovnováhy. Na základe súčasných poznatkov sa javí ako najefektívnejšie využitie psychologických intervencií zameraných na zníženie aktivity neuroendokrinnej stresovej reakcie (sympatikového nervového systému a HPA osi), ktorá je zvýšená u pacientov vystavených pôsobeniu negatívnych psychosociálnych faktorov (stresorov) a u pacientov s depresiou. Na druhej strane zvýšenie aktivity parasympatikového systému môže mať tiež priaznivý vplyv na priebeh chorôb pečene. Na dosiahnutie toho je možné využiť skupinové a individuálne psychoterapeutické intervencie. Prospešný môže byť aj pravidelný autogénny tréning prípadne využitie bio-feedbacku. Okrem toho sa ako perspektívne javí využitie elektroceutík, t.j. prístrojov, ktoré generujú elektrické impulzy a prostredníctvom nich modulujú prenos autonómnymi a senzitívnymi nervami [64]. Uvedené intervencie nielen rozširujú terapeutické možnosti v hepatológii, ale môžu tiež zvýšiť efektivitu konvenčnej liečby pacientov s chorobami pečene. Výhodou uvedených intervencií je to, že okrem zlepšenia priebehu ochorenia často zvyšujú aj celkovú kvalitu života pacientov.
Okrem ovplyvňovania aktivity sympatikového a parasympatikového nervového systému je možné využiť v terapii v hepatológii aj ďalší aspekt osi mozog-pečeň. Tak napríklad senzitivitu pečene na farmaká môže zvýšiť prispôsobenie doby ich podávania k cirkadiánnym rytmom, ako aj k aktivite autonómnych nervov [12].
Záver
Experimentálne a klinické štúdie jednoznačne dokladujú význam nervového systému v regulácii funkcií pečene ako za fyziologických, tak aj patologických situácií. Na základe súčasných poznatkov je možné konštatovať, že posun aktivity autonómneho nervového systému v prospech sympatika pôsobí na činnosť pečene negatívne, zatiaľ čo zvýšenie aktivity nervus vagus obmedzuje rozsah patologických procesov prebiehajúcich v pečeni. Významným je aj fakt, že samotné ochorenie pečene môže vyvolať autonómnu nerovnováhu, kedy prevažuje aktivita sympatika nad aktivitou parasympatika. Môže sa tak vytvoriť circulus vitiosus, ktorý potencuje progresiu chorôb pečene, a zhoršuje tak ich prognózu. Intervencie, zamerané na obnovenie autonómnej rovnováhy (napr. psychoterapia, autogénny tréning, bio-feedback, farmaká a prípadne aj elektroceutiká obmedzujúce sympatikovú signalizáciu a potencujúce parasympatikovú signalizáciu) môžu rozšíriť spektrum terapeutických postupov využiteľných v hepatológii.
ORCID autorov
B. Mravec ORCID 0000-0002-3177-6819,
M. Szántová ORCID 0000-0003-4287-5481.
Doručené/Submitted: 10. 10. 2022
Prijaté/Accepted: 5. 1. 2023
prof. MUDr. Boris Mravec, PhD.
Fyziologický ústav
LF UK Bratislava
Sasinkova 2
813 72 Bratislava
boris.mravec@fmed.uniba.sk
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Boilly B, Faulkner S, Jobling P et al. Nerve Dependence: From Regeneration to Cancer. Cancer Cell 2017; 31(3): 342–354. doi: 10.1016/j.ccell.2017.02.005.
2. Jensen KJ, Alpini G, Glaser S. Hepatic nervous system and neurobiology of the liver. Compr Physiol 2013; 3(2): 655–665. doi: 10.1002/cphy.c120018.
3. Lipták P, Ďuríček M, Prokopič M et al. Autonómna dysregulácia pri syndróme dráždivého čreva, funkčnej dyspepsii a globus pharyngeus – prehľad literatúry a pilotné výsledky. Gastroent Hepatol 2020; 74(4): 327–333. doi: 10.14735/amgh2020327.
4. NCZI: 2018 Zdravotnícka ročenka SR, NCZI, Bratislava, 2019, 227 s. ISBN: 978-80-89292-71-4.
5. NCZI: 2019 Zdravotnícka ročenka SR, NCZI, Bratislava, 2021, 248 s. ISBN: 978-80-89292-77-6.
6. NCZI: 2020 Zdravotnícka ročenka SR, NCZI, Bratislava, 2021, 260 s. ISBN: 978-80-89282-80-6.
7. Collaborators GBDC. The global, regional, and national burden of cirrhosis by cause in 195 countries and territories, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet Gastroenterol Hepatol 2020; 5(3): 245–266. doi: 10.1016/S2468-1253(19)30349-8.
8. Miller BM, Oderberg IM, Goessling W. Hepatic Nervous System in Development, Regeneration, and Disease. Hepatology 2021; 74(6): 3513–3522. doi: 10.1002/hep.32055.
9. Yi CX, la Fleur SE, Fliers E et al. The role of the autonomic nervous liver innervation in the control of energy metabolism. Biochim Biophys Acta 2010; 1802(4): 416–431. doi: 10.1016/j.bbadis.2010.01.006.
10. Lelou E, Corlu A, Nesseler N et al. The Role of Catecholamines in Pathophysiological Liver Processes. Cells 2022; 11(6): doi: 10.3390/cells11061021.
11. Murugan S, Boyadjieva N, Sarkar DK. Protective effects of hypothalamic beta-endorphin neurons against alcohol-induced liver injuries and liver cancers in rat animal models. Alcohol Clin Exp Res 2014; 38(12): 2988–2997. doi: 10.1111/acer.12580.
12. Ishay Y, Kolben Y, Kessler A et al. Role of circadian rhythm and autonomic nervous system in liver function: a hypothetical basis for improving the management of hepatic encephalopathy. Am J Physiol Gastrointest Liver Physiol 2021; 321(4): G400–G412. doi: 10.1152/ajpgi.00186.2021.
13. European Association for the Study of the L, European Association for the Study of D, European Association for the Study of O. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol 2016; 64(6): 1388–1402. doi: 10.1016/j.jhep.2015.11.004.
14. Rebelos E, Iozzo P, Guzzardi MA et al. Brain-gut-liver interactions across the spectrum of insulin resistance in metabolic fatty liver disease. World J Gastroenterol 2021; 27(30): 4999–5018. doi: 10.3748/wjg.v27.i30.4999.
15. Münzberg H, Qualls-Creekmore E, Berthoud HR et al. Neural Control of Energy Expenditure. Handb Exp Pharmacol 2016; 233: 173–194. doi: 10.1007/164_2015_33.
16. Guarino D, Nannipieri M, Iervasi G et al. The Role of the Autonomic Nervous System in the Pathophysiology of Obesity. Front Physiol 2017; 8: 665. doi: 10.3389/fphys.2017.00665.
17. Newton JL, Pairman J, Wilton K et al. Fatigue and autonomic dysfunction in non-alcoholic fatty liver disease. Clin Auton Res 2009; 19(6): 319–326. doi: 10.1007/s10286-009-0031-4.
18. Sun W, Zhang D, Sun J et al. Association between non-alcoholic fatty liver disease and autonomic dysfunction in a Chinese population. QJM 2015; 108(8): 617–624. doi: 10.1093/qjmed/hcv006.
19. Hurr C, Simonyan H, Morgan DA et al. Liver sympathetic denervation reverses obesity-induced hepatic steatosis. J Physiol 2019; 597(17): 4565–4580. doi: 10.1113/JP277994.
20. Liu K, Yang L, Wang G et al. Metabolic stress drives sympathetic neuropathy within the liver. Cell Metab 2021; 33(3): 666–675. doi: 10.1016/ j.cmet.2021.01.012.
21. Grant WF, Nicol LE, Thorn SR et al. Perinatal exposure to a high-fat diet is associated with reduced hepatic sympathetic innervation in one-year old male Japanese macaques. PLoS One 2012; 7(10): e48119. doi: 10.1371/journal.pone.0048119.
22. Satapathy SK, Ochani M, Dancho M et al. Galantamine alleviates inflammation and other obesity-associated complications in high-fat diet-fed mice. Mol Med 2011; 17(7–8): 599–606. doi: 10.2119/molmed.2011.00083.
23. Nishio T, Taura K, Iwaisako K et al. Hepatic vagus nerve regulates Kupffer cell activation via alpha7 nicotinic acetylcholine receptor in nonalcoholic steatohepatitis. J Gastroenterol 2017; 52(8): 965–976. doi: 10.1007/s00535-016-1304-z.
24. Szántová M. Podporné faktory v liečbe chronických hepatitíd. Trendy v hepatológii 2010; 3: 25–29.
25. Mizuno K, Haga H, Okumoto K et al. Intrahepatic distribution of nerve fibers and alterations due to fibrosis in diseased liver. PLoS One 2021; 16(4): e0249556. doi: 10.1371/journal.pone.0249556.
26. Sternberg EM. Neural regulation of innate immunity: a coordinated nonspecific host response to pathogens. Nat Rev Immunol 2006; 6(4): 318–328. doi: 10.1038/nri1810.
27. Reardon C, Murray K, Lomax AE. Neuroimmune Communication in Health and Disease. Physiol Rev 2018; 98(4): 2287–2316. doi: 10.1152/physrev.00035.2017.
28. Neuhuber WL, Tiegs G. Innervation of immune cells: evidence for neuroimmunomodulation in the liver. Anat Rec A Discov Mol Cell Evol Biol 2004; 280(1): 884–892. doi: 10.1002/ar.a.20093.
29. Huang CC, Wu KL, Liu JS et al. Autonomic impairment in treatment-naive patients with chronic hepatitis B and C infections. Auton Neurosci 2021; 238: 102928. doi: 10.1016/j.autneu.2021.102928.
30. Poliwczak AR, Bialkowska J, Wozny J et al. Cardiovascular risk assessment by electrocardiographic Holter monitoring in patients with chronic hepatitis C. Arch Med Sci 2020; 16(5): 1031–1039. doi: 10.5114/aoms.2020.96600.
31. Vere CC, Streba CT, Streba LM et al. Psychosocial stress and liver disease status. World J Gastroenterol 2009; 15(24): 2980–2986. doi: 10.3748/wjg.15.2980.
32. Chida Y, Sudo N, Kubo C. Does stress exacerbate liver diseases? J Gastroenterol Hepatol 2006; 21(1 Pt 2): 202–208. doi: 10.1111/j.14 40-1746.2006.04110.x.
33. Marsland AL, Bachen EA, Cohen S et al. Stress, immune reactivity and susceptibility to infectious disease. Physiol Behav 2002; 77(4–5): 711–716. doi: 10.1016/s0031-9384(02)00923-x.
34. Burns VE, Ring C, Drayson M et al. Cortisol and cardiovascular reactions to mental stress and antibody status following hepatitis B vaccination: a preliminary study. Psychophysiology 2002; 39(3): 361–368. doi: 10.1017/s0048577201393022.
35. Balemba OB, Salter MJ, Mawe GM. Innervation of the extrahepatic biliary tract. Anat Rec A Discov Mol Cell Evol Biol 2004; 280(1): 836–847. doi: 10.1002/ar.a.20089.
36. Ehrlich L, Scrushy M, Meng F et al. Biliary epithelium: A neuroendocrine compartment in cholestatic liver disease. Clin Res Hepatol Gastroenterol 2018; 42(4): 296–305. doi: 10.1016/ j.clinre.2018.03.009.
37. Yang H, Yang H, Wang L et al. Transcutaneous Neuromodulation improved inflammation and sympathovagal ratio in patients with primary biliary ssscholangitis and inadequate response to Ursodeoxycholic acid: a pilot study. BMC Complement Med Ther 2020; 20(1): 242. doi: 10.1186/s12906-020-03036-w.
38. Dyson JK, Elsharkawy AM, Lamb CA et al. Fatigue in primary sclerosing cholangitis is associated with sympathetic over-activity and increased cardiac output. Liver Int 2015; 35(5): 1633–1641. doi: 10.1111/liv.12709.
39. Amir M, Yu M, He P et al. Hepatic Autonomic Nervous System and Neurotrophic Factors Regulate the Pathogenesis and Progression of Non-alcoholic Fatty Liver Disease. Front Med (Lausanne) 2020; 7: 62. doi: 10.3389/fmed.2020.00062.
40. Henriksen JH, Ring-Larsen H, Christensen NJ. Aspects of sympathetic nervous system regulation in patients with cirrhosis: a 10-year experience. Clin Physiol 1991; 11(4): 293–306. doi: 10.1111/j.1475-097x.1991.tb00658.x.
41. Henriksen JH, Ring-Larsen H, Christensen NJ. Sympathetic nervous activity in cirrhosis. A survey of plasma catecholamine studies. J Hepatol 1985; 1(1): 55–65. doi: 10.1016/s0168-8278(85)80068-4.
42. Estrela HF, Damasio ES, Fonseca EK et al. Differential Sympathetic Vasomotor Activation Induced by Liver Cirrhosis in Rats. PLoS One 2016; 11(4): e0152512. doi: 10.1371/journal.pone.0152512.
43. Hendrickse MT, Triger DR. Vagal dysfunction and impaired urinary sodium and water excretion in cirrhosis. Am J Gastroenterol 1994; 89(5): 750–757.
44. Mravec B. Neurobiology of cancer: Definition, historical overview, and clinical implications. Cancer Med 2022; 11(4): 903–921. doi: 10.1002/cam4.4488.
45. Huan HB, Wen XD, Chen XJ et al. Sympathetic nervous system promotes hepatocarcinogenesis by modulating inflammation through activation of alpha1-adrenergic receptors of Kupffer cells. Brain Behav Immun 2017; 59: 118–134. doi: 10.1016/j.bbi.2016.08.016.
46. Li J, Yang XM, Wang YH et al. Monoamine oxidase A suppresses hepatocellular carcinoma metastasis by inhibiting the adrenergic system and its transactivation of EGFR signaling. J Hepatol 2014; 60(6): 1225–1234. doi: 10.1016/j.jhep.2014.02.025.
47. Adamcová Selčanová S, Takáč R, Vnenčáková J et al. Cirhóza pečene u rómskych pacientov z pohľadu hepatologického transplantačného centra. Gastroent Hepatol 2022; 76(4): 334–340. doi: 10.48095/ccgh2022334.
48. Kjaer M, Jurlander J, Keiding S et al. No reinnervation of hepatic sympathetic nerves after liver transplantation in human subjects. J Hepatol 1994; 20(1): 97–100. doi: 10.1016/s0168-8278(05)80473-8.
49. Ferreira LG, Santos LF, Anastacio LR et al. Resting energy expenditure, body composition, and dietary intake: a longitudinal study before and after liver transplantation. Transplantation 2013; 96(6): 579–585. doi: 10.1097/TP.0b013e31829d924e.
50. Kim E, Choi DL, Jung JY et al. Shift in Sympathovagal Balance Toward Parasympathetic Predominance Is Associated With Attenuation of Portal Hyperperfusion in Cirrhotic Recipients Undergoing Living Donor Liver Transplant. Transplant Proc 2019; 51(5): 1511–1515. doi: 10.1016/j.transproceed.2019.01.117.
51. Hirao H, Nakamura K, Kupiec-Weglinski JW. Liver ischaemia-reperfusion injury: a new understanding of the role of innate immunity. Nat Rev Gastroenterol Hepatol 2022; 19(4): 239–256. doi: 10.1038/s41575-021-00549-8.
52. Inoue T, Abe C, Kohro T et al. Non-canonical cholinergic anti-inflammatory pathway-mediated activation of peritoneal macrophages induces Hes1 and blocks ischemia/reperfusion injury in the kidney. Kidney Int 2019; 95(3): 563–576. doi: 10.1016/j.kint.2018.09.020.
53. Buchholz B, Kelly J, Munoz M et al. Vagal stimulation mimics preconditioning and postconditioning of ischemic myocardium in mice by activating different protection mechanisms. Am J Physiol Heart Circ Physiol 2018; 314(6): H1289–H1297. doi: 10.1152/ajpheart.00286.2017.
54. Tarras SL, Diebel LN, Liberati DM et al. Pharmacologic stimulation of the nicotinic anti-inflammatory pathway modulates gut and lung injury after hypoxia-reoxygenation injury. Surgery 2013; 154(4): 841–847. doi: 10.1016/j.surg.2013.07.018.
55. Geng Y, Chen D, Zhou J et al. Role of Cholinergic Anti-Inflammatory Pathway in Treatment of Intestinal Ischemia-Reperfusion Injury by Electroacupuncture at Zusanli. Evid Based Complement Alternat Med 2017; 2017: 6471984. doi: 10.1155/2017/6471984.
56. Chies AB, Nakazato PCG, Spadella MA et al. Rivastigmine prevents injury induced by ischemia and reperfusion in rat liver. Acta Cir Bras 2018; 33(9): 775–784. doi: 10.1590/s0102-865020180090000005.
57. Park J, Kang JW, Lee SM. Activation of the cholinergic anti-inflammatory pathway by nicotine attenuates hepatic ischemia/reperfusion injury via heme oxygenase-1 induction. Eur J Pharmacol 2013; 707(1–3): 61–70. doi: 10.1016/j.ejphar.2013.03.026.
58. Bundzikova J, Pirnik Z, Lackovicova L et al. Brain-liver interactions during liver ischemia reperfusion injury: a minireview. Endocr Regul 2011; 45(3): 163–172. doi: 10.4149/endo_2011_03_163.
59. Friman S, Wallin M, Gustafsson BI et al. Sympathetic nerves do not affect experimental ischemia-reperfusion injury of rat liver. Transplant Proc 2009; 41(2): 743–745. doi: 10.1016/j.transproceed.2009.01.035.
60. Corruble E, Barry C, Varescon I et al. Depressive symptoms predict long-term mortality after liver transplantation. J Psychosom Res 2011; 71(1): 32–37. doi: 10.1016/j.jpsychores.2010.12.008.
61. Rogal S, Shenai N, Kruckenberg K et al. Post-transplant Outcomes of Persons Receiving a Liver Graft for Alcoholic Liver Disease. Alcohol Alcohol 2018; 53(2): 157–165. doi: 10.1093/alcalc/agx100.
62. Lombardi F, Malliani A, Pagani M et al. Heart rate variability and its sympatho-vagal modulation. Cardiovasc Res 1996; 32(2): 208–216. doi: 10.1016/0008-6363(96)00116-2.
63. Abid NU, Mani AR. The mechanistic and prognostic implications of heart rate variability analysis in patients with cirrhosis. Physiol Rep 2022; 10(8): e15261. doi: 10.14814/phy2.15261.
64. Ramadi KB, Srinivasan SS, Traverso G. Electroceuticals in the Gastrointestinal Tract. Trends Pharmacol Sci 2020; 41(12): 960–976. doi: 10.1016/j.tips.2020.09.014.