Multimodální přístup v léčbě generalizovaných malignit gastrointestinálního traktu
Zuzana Bielčiková1, Jan Ulrych2, Vladimír Frýba2, Petr Hrabák Orcid.org 3, Michal Zubaľ1, Ľudmila Křížová1, Luboš Petruželka Orcid.org 1
+ Pracoviště
Souhrn
Východiska: Zhoubnými nádory střeva, slinivky břišní, jícnu a žaludku ročně v ČR onemocní přes 10 tisíc pacientů. Nemalá část pacientů relabuje nebo je diagnostikována v lokálně pokročilém neresekabilním stadiu, event. ve stadiu metastatické nemoci. Prognózu těchto nemocných lze ovlivnit onkologickou léčbou a v řadě případů také chirurgickou, endoskopickou nebo radiologickou intervencí. Metody: Článek shrnuje možnosti léčby pacientů s pokročilými nebo metastatickými zhoubnými nádory gastrointestinálního traktu z pohledu onkologa a chirurga s cílem přiblížit onkologická data o prognóze nemocných a chirurgické metody léčby dalším členům multidisciplinárního týmu. Endoskopické metody jsou konzultovány s gastroenterologem. Výsledky: Význam chirurgické léčby není u všech zmiňovaných jednotek stejný a je ovlivněn mnoha proměnnými. Chirurgie má největší význam v léčbě jaterních metastáz u nádorů tlustého střeva, naopak limitovaný paliativní přínos má resekce jaterních metastáz u karcinomu pankreatu. Závěr: Multimodální přístup k léčbě nádorů gastrointestinálního traktu nabízí zařazení chirurgické léčby v současnosti i tam, kde v minulosti nebyla standardně doporučována. Podmínkou správné indikace operačního výkonu je multioborové posouzení každého konkrétního pacienta.
Klíčová slova
kolorektální karcinom, karcinom slinivky, karcinom jícnu, karcinom žaludku, zhoubné novotvary GIT, relapsy, operace
Úvod
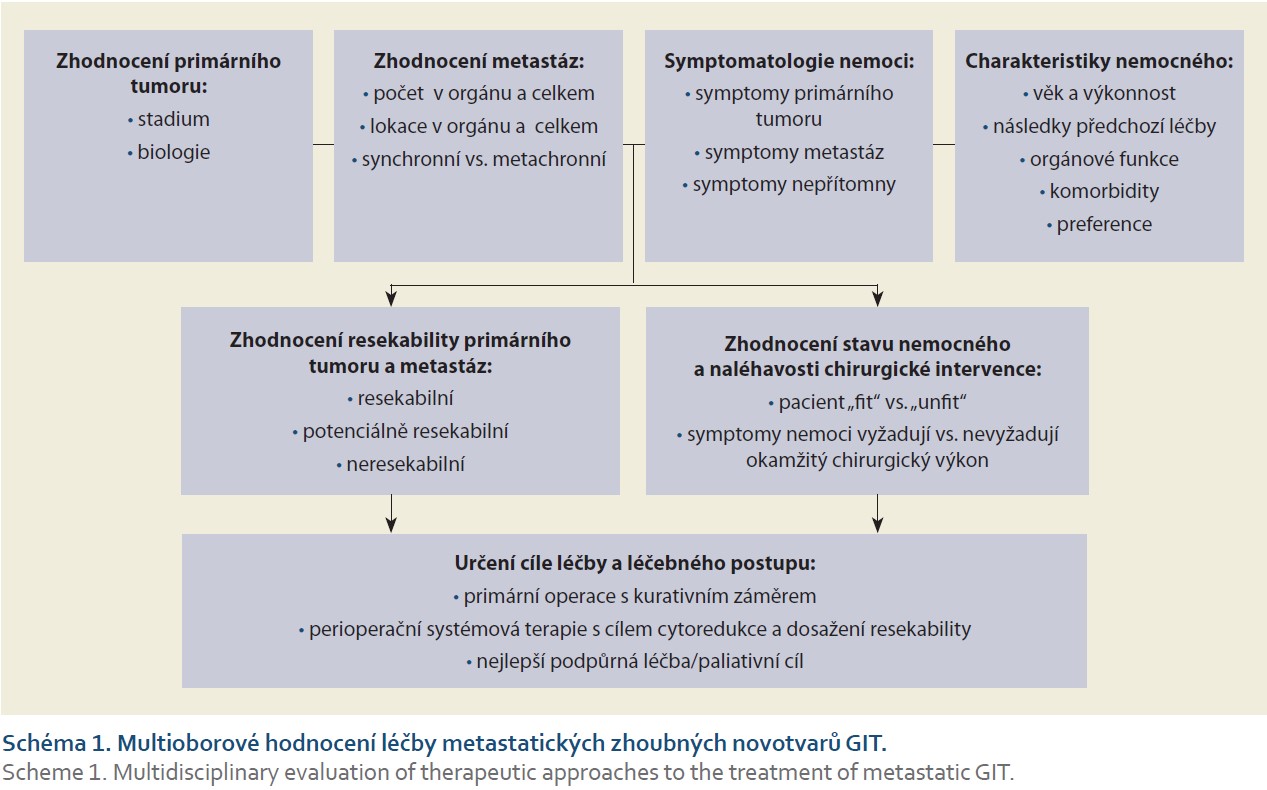
Zhoubné nádory (ZN) gastrointestinálního traktu (GIT) představují nejobjemnější skupinu nádorů. Vedoucími malignitami stran incidence jsou nádory tlustého střeva a konečníku (CRC) s incidencí kolem 65 případů na 100 tisíc obyvatel a nádory slinivky břišní (PC) s incidencí asi 22–24/100 tisíc. Ostatní jednotky, tedy nádory jícnu (OC), žaludku (GC), primární nádory jater a žlučových cest postihují souhrnem asi 25/100 tisíc obyvatel. Mortalita ZN GIT se přibližuje incidenčním číslům, s výjimkou CRC, kde dosahuje asi polovinu incidenčních případů. CRC jsou zároveň diagnózami s nejnižším podílem metastatických stadií (asi 20 %), což lze jistě přičítat screeningu. Protipólem je PC, kde pozdní diagnóza s výskytem vzdálených metastáz postihuje až polovinu pacientů a dalších 10–30 % tvoří lokálně pokročilá neresekabilní stadia. Lokální relapsy, stejně jako metastatické stadium, jsou nositeli špatné prognózy. Možností, jak zlepšit prognózu, zejména u CRC, je chirurgická intervence. Z onkologického pohledu má chirurgická léčba význam radikální (kurativní) nebo paliativní, v závislosti na rozsahu a pokročilosti maligního onemocnění. Avšak tento bipolární charakter chirurgické léčby se v kontextu komplexní onkologické terapie generalizované malignity může poněkud ztrácet. Takže i chirurgická resekce orgánových metastáz může mít kurativní potenciál nebo paliativní chirurgická léčba může kromě kvality života ovlivnit i délku přežití. V neposlední řadě mají onkologický význam a dopad na prognózu pacienta i komplikace chirurgické léčby. Variabilita metastatického postižení i jejich odlišný dopad na přežívání nemocných, interindividuální rozdíly mezi pacienty, rozdíly v biologii nádorů, široká paleta chirurgických, endoskopických, radiointervenčních výkonů a systémové onkologické terapie i cíle jejich indikace (schéma 1) – to vše vyžaduje multidisciplinární týmové řešení (MDT). Článek shrnuje základní onkologické a chirurgické aspekty, které jsou podkladem pro indikaci operace u generalizovaných ZN GIT, a diskutuje kontroverze, které ve světle MDT mnohdy ztrácejí sporný náboj.
Kolorektální karcinom
Základní onkologická data
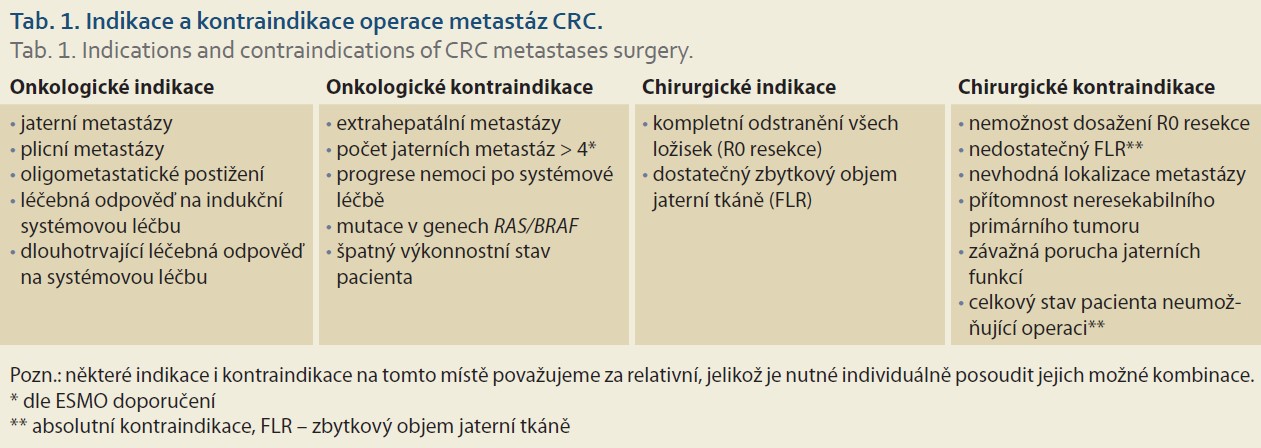
Asi u 20–30 % nově diagnostikovaných pacientů s kolorektálním karcinomem (CRC) jsou kromě primárního tumoru přítomny také synchronní (SM) jaterní metastázy. U 15–25 % nemocných se s odstupem od diagnózy primárního tumoru objeví metachronní (MM) jaterní metastázy. Některé práce poukazují na prognostický význam tohoto parametru, kdy pacienti se SM mají horší prognózu než nemocní s MM [1]. Izolované postižení jater (30–40 % nemocných) a/nebo plic (10 % nemocných) má lepší prognózu než postižení jiných lokalit, nejčastěji peritonea (30–40 % pacientů). Stejně důležitý je počet metastáz, kdy pacienti s oligometastatickým postižením mají lepší celkové přežití (OS), přičemž pod pojmem oligometastatická nemoc rozumíme nejčastěji přítomnost 1–5 metastatických lézí v jednom orgánu. S rostoucím počtem metastáz nezávisle na jejich lokalizaci se prognóza zhoršuje. Přežívání nemocných s pravostrannými nádory střeva je horší ve srovnání s levostrannými, což souvisí s biologií nemoci v pravé a levé části tračníku [2–4]. Agresivitu primárního tumoru lze hodnotit i na základě histologických parametrů, např. na základě přítomnosti mutace v genech RAS [5]. Medián OS pacientů s metastatickým CRC je asi 30 měsíců. Na prognózu nemoci má vliv také složení systémové terapie (chemoterapie ± cílená léčba), léčebná odpověď na tuto léčbu a také možnost chirurgické intervence [6]. Nemalá část pacientů (20–50 %) s oligometastatickým postižením (nejčastěji jater) může být po kompletní jaterní resekci vyléčena. Kompletní resekce jaterních metastáz by měla být provedena vždy, když je to možné, přestože ne všichni pacienti z ní profitují stejně [7]. Chirurgická intervence extrahepatálních metastáz nemusí zajistit nemocným delší OS, ale resekce limitovaného postižení, zejména plicního, by měla být vždy zvažována [8]. Cílem MDT je volba diagnostického postupu, cíle léčby a léčebné strategie, založená na kritickém zhodnocení mimo jiné také indikace chirurgické léčby (schéma 1). Indikační a kontraindikační kritéria pozbývají v MDT onkologický, resp. chirurgický přívlastek a v celistvém pohledu na nemoc a jeho nositele jsou v jednotlivých bodech pouze relativní (tab. 1). Zjednodušené schéma léčebného cíle a léčebné strategie zahrnuje:
- kurativní strategie – primární chirurgický výkon u resekabilního postižení;
- potenciálně kurativní strategie – indukční systémová terapie u potenciálně resekabilního postižení s cílem zmenšení nádoru a dosažení resekability;
- paliativní strategie s kontrolou malignity – intenzivní systémová terapie u neresekabilních symptomatických nebo rychle progredujících nádorů u pacientů v dobrém stavu (PS) s cílem zmenšení nádoru či jeho stabilizace;
- paliativní strategie – zahrnuje systémovou terapii s dobrou tolerancí s cílem zpomalit progresi u neresekabilních nádorů „unfit“ nemocných a nebo asymp- tomatických pacientů v případě pomalu progredující nemoci.
Chirurgické léčebné / endoskopické léčebné přístupy
Radikální chirurgický výkon nejčastěji zvažujeme u nemocných s izolovaným postižením jater a/nebo plic nebo s izolovaným postižením peritonea s příp. synchronním postižením jater.
Resekce jaterních metastáz je jediná potenciálně kurativní metoda léčby s 5letým OS blížícím se 60 %. Dokonce i opakované jaterní resekce mají signifikantní vliv na celkové OS [9]. U resekabilních SM jater mají všechny možnosti chirurgického přístupu (simultánní resekce, klasická etapová resekce a reverzní etapová resekce) srovnatelné výsledky stran rekurence choroby a OS. V posledních letech převažuje reverzní „liver first“ přístup nebo simultánní resekce a tradiční „colorectal first“ přístup je rezervován pro symptomatické primární tumory s významným krvácením nebo stenózou. Při simultánní resekci není vhodné kombinovat velké jaterní resekce (> 3 jaterní segmenty) s náročnou resekcí primárního tumoru (typicky karcinom rekta), tyto výkony zvyšují morbiditu i mortalitu. U pacientů s hraničně (potenciálně) resekabilními jaterními metastázami může být cíl léčby rovněž kurativní za předpokladu dosažení resekability zmenšením metastáz indukční systémovou léčbou nebo zvětšením objemu zbytkové jaterní tkáně (FLR). Časné zhodnocení systémové léčby (po 2 měsících léčby) je předpokladem akceptovatelné perioperační morbidity. Zvýšení resekability lze dosáhnout také pomocí několika pokročilých metod – embolizace portální větve (PVE) s kompenzatorní hypertofií druhostranného laloku, dvoudobý resekční výkon u bilobárního postižení, ALPPS (associating liver partition with portal vein ligation for staged hepatectomy), kombinace chirurgického výkonu s další lokální ablativní metodou (radiofrekvenční ablace, mikrovlnná ablace) či případně se stereotaktickou radioterapií (SBRT – stereotactic body radiation therapy). U malé skupiny vysoce selektovaných pacientů může být zvažována i možnost transplantace jater.
Pulmonální metastazektomie je v dnešní době považována za etablovaný způsob léčby za předpokladu, že jsou plíce jediným místem generalizace (kromě případných resekabilních jaterních metastáz), všechna plicní ložiska jsou resekabilní a primární CRC je pod kontrolou. Alternativou k chirurgické léčbě jsou termické ablativní metody (radiofrekvenční ablace a mikrovlnná ablace) a SBRT. Pětileté OS po plicních metastazektomiích CRC je přibližně 40 %, většinu publikovaných dat reprezentují malé retrospektivní soubory [10].
Pro prognózu nemocných s peritoneálním rozsevem je rozhodující rozsah postižení hodnocený pomocí PCI (peritoneal cancer index) a provedení kompletní chirurgické cytoredukce (CRS). Rozsah výkonu je variabilní, s možností vícečetných orgánových resekcí a částečnou až subtotální parietální peritonektomií. Cílem je odstranění všech peritoneálních tumorových depozit. Navazujícím krokem je HIPEC, tedy laváž peritoneální dutiny ohřátým cytostatikem, přičemž hypertermie (42–43 °C) potencuje cytotoxický účinek cytostatika. Morbidita CRS+HIPEC dosahuje 24–42 %, což je srovnatelné s rozsáhlými onkochirurgickými výkony (např. velkou jaterní resekcí). Morbiditu může zvyšovat také předoperační systémová léčba. V centrech s dostatečnou zkušeností a při dobré selekci pacientů vede CRS+HIPEC k prodloužení přežití pacientů za akceptovatelné morbidity.
Paliativní chirurgická léčba zahrnuje nejčastěji řešení maligní nádorové obstrukce. Operace může být efektivní v případě lokálně pokročilého tumoru s intraluminální obstrukcí, naopak operace maligní nádorové obstrukce při karcinomatóze je zatížena větší morbiditou a často i neúspěchem v podobě úlevy od symptomů nemoci. Technicky se může jednat o založení derivační stomie, spojkové operace, resekce části střeva, případně o kombinace výkonů. Maligní nádorová obstrukce při karcinomatóze má velmi špatnou prognózu s mediánem OS 3–8 měsíců v případě chirurgické léčby a 4–5 týdnů v případě neoperabilních pacientů [11]. Dalšími situacemi u pacientů v paliativním režimu, které mohou vyžadovat chirurgické řešení, je maligní fistula, která vzniká růstem tumoru (často v pánvi), může arodovat okolní struktury, a vést tak k inkontinenci, močovým infekcím až urosepsi, k chronickým průjmům s malabsorpcí, chronickým bolestem. K řešení se využívá řada výkonů, jako jsou perkutánní drenáže, derivace moči (zavádění ureterálních stentů, punkční epicystostomie, nefrostomie), derivace stolice formou střevní bypassové operace nebo založením stomie. Perforace tumoru do volné dutiny břišní vede k peritonitidě. Je indikována urgentní operace s resekcí perforované části střeva a založením derivační stomie, konstrukce anastomózy v těchto případech není doporučována. Růst tumoru s arozí cév vede k závažnému, často exsanqiunačnímu krvácení, k zástavě krvácení je využíván angiointervenční výkon s embolizací krvácející cévy, v případě neúspěchu pak chirurgický výkon jako ultimum refugium.
Karcinomy jícnu a žaludku
Základní onkologická data
Přes 60 % nemocných s karcinomem jícnu (OC) a 50 % nemocných s karcinomem žaludku (GC) je v době diagnózy již v lokálně pokročilém anebo metastatickém stadiu [12]. Nejčastějšími lokalitami metastáz u OC jsou játra, SM lze očekávat u 35–40 % nemocných, MM u 6–25 % [13]. U GC jsou nejčastější lokality metastáz játra (48 %), peritoneum (32 %), plíce (15 %) anebo kosti (12 %) [14,15]. Jaterní SM u GC lze očekávat v 3–14 %, MM až v 37 % případů po kurativní gastrektomii. Relapsy postihují až polovinu pacientů s OC a až 60 % s GC [16]. Nejčastější lokace relapsů je v oblasti lymfatických uzlin. Podíl oligometastatických případů dosahuje asi 9 % u OC a 5 % u GC. Asi pětina pacientů s OC a asi třetina pacientů s GC se dožívá 5 let. Nejdéle žijí nemocní, kteří podstoupili radikální léčbu primárního tumoru, naopak 5leté přežívání v generalizovaném stadiu zřídka přesahuje 5 %. Výjimkou mohou být případy oligometastatické nemoci jater při GC podrobené chirurgické intervenci [17]. Prodloužení OS bylo pozorováno u solitární metastázy nebo ≤ 3 metastáz menších rozměrů s unilobárním jaterním postižením, u MM nebo při nižších hodnotách krevních tumorózních markerů CEA a CA 19.9 [18,19]. Z biologického pohledu jsou příznivější HER2 dependentní GC, PDL1 pozitivní GC/OC a mikrosatelitově instabilní (MSI-H) GC. V portfoliu léčebných možností generalizovaných pacientů s OC a GC převažují modality systémové terapie. Kromě chemoterapie je již standardem cílená anti-HER2 léčba (u HER2 pozitivního GC) nebo imunoterapie (u PDL1 pozitivních nebo MSI-H nádorů). Chirurgická intervence připadá klinicky v úvahu u jednotlivých pacientů odpovídajících na paliativní systémovou léčbu, naopak u „unfit“ nemocných je indikována nejlepší pod- půrná léčba.
Chirurgické léčebné / endoskopické léčebné přístupy
Dle současných doporučení je standardem léčby u pacientů s orgánovými metastázami OC a GC systémová paliativní terapie a chirurgická resekce není rutinně indikována. Vzhledem k velmi nízkému počtu pacientů s oligometastatickým OC jsou i výsledky chirurgické léčby jaterních a plicních metastáz OC prezentovány pouze na kazuistických sděleních či na malých souborech 4–49 pacientů [20]. Na základě takto limitovaných dat tedy nelze obecně doporučit chirurgickou léčbu ani u oligometastatického OC.
Význam chirurgické léčby orgánových metastáz je však aktuálně diskutován v léčbě jaterních metastáz GC. Nejen asijská guidelines (Japanese Gastric Cancer Association), ale i recentní evropská guidelines (ESMO 2022) totiž navrhují zvážit jaterní resekci u selektované skupiny pacientů s GC a limitovaným jaterním postižením [17]. Robustní systematické metaanalýzy dokumentují signifikantní onkologický benefit u této skupiny nemocných s mediánem OS až 31 měsíců [19].
Navzdory obecně velmi nepříznivé prognóze pacientů s peritoneálním rozsevem GC je v současné době akceptován konsenzus ohledně onkologického benefitu cytoredukční chirurgie a HIPEC u selektované skupiny pacientů dle ESMO 2022 i NCCN guidelines. Základní předpoklady jsou podobné jako u CRC. Novou metodou v léčbě peritoneální karcinomatózy je PIPAC (pressurized intraperitoneal aerosol chemotherapy). Tato laparoskopicky asistovaná intraperitoneální chemoterapie byla již aplikována a hodnocena i u peritoneálního rozsevu GC, a to s dokumentovaným příznivým efektem na OS i kvalitu života [21].
Paliativní léčba lokálně pokročilého OC je indikována při rozvoji dysfagie nebo při krvácení. Zahrnuje paliativní resekci jícnu nebo bypassovou operaci. Vzhledem k vysoké morbiditě a mortalitě paliativních operací a krátkému mediánu OS (5,5 měsíce) [22] je v současnosti preferována spíše paliativní léčba nechirurgická. Zde má nezastupitelnou roli endoskopický přístup. U indikovaných pacientů, u kterých není zvažováno operační řešení, je možné zprůchodnění jícnu zajistit zavedením samoexpandibilního metalického stentu (SEMS). Tuto metodu lze u pacientů s delší očekávanou dobou přežívání s výhodou kombinovat s brachyterapií. Naopak radioterapie a chemoterapie předcházející zavedení SEMS jsou některými autory považovány za rizikové faktory pro vznik komplikací [23]. Výhodou endoskopické terapie je výrazně nižší zatížení pacienta i zdravotnického systému v porovnání s chirurgickou léčbou a promptní efekt, který se dostavuje v řádu dní. Plně potahované SEMS pak lze s výhodou použít k terapii maligních ezofageálních píštělí. Spolupráce s endoskopistou a nutricionistou je klíčová i pro zajištění enterální výživy, ať již nazojejunální sondou (NJS), tak i např. perkutánní endoskopickou gastrostomií (PEG) [24]. V situacích, kdy PEG nelze zavést pro kompletní obstrukci jícnu tumorem, je z nutriční indikace prováděna chirurgická gastrostomie nebo jejunostomie.
Paliativní redukční operace primárního tumoru u asymptomatického pacienta s generalizovaným GC není v současnosti obecně doporučována [17]. Nejčastější indikací k paliativnímu chirurgickému výkonu jsou komplikace lokálně pokročilého tumoru žaludku – krvácení, obstrukce nebo perforace. V případě krvácení je metodou první volby endoskopické ošetření krvácení nebo arteriální embolizace. Pokračující nebo recidivující krvácení je indikací k paliativní resekci žaludku. K tumorózní obstrukci nádorem dochází nejčastěji ve výtokové oblasti žaludku. U pacientů s poruchou evakuace žaludku (GOO – gastric outlet obstruction) a s očekávanou dobou přežití v řádu několika měsíců lze pak zvažovat řadu paliativních endoskopických výkonů, které vedou ke zlepšení symptomatologie. V prvé řadě lze obstrukci řešit zavedením nepotahovaného SEMS. Tento výkon má v porovnání s paliativní chirurgickou gastroenteroanastomózou (GEA) nižší morbiditu a mortalitu [25]. Komplikací tohoto výkonu však bývá obstrukce stentu, ať již přijímanou potravou, či prorůstáním nádoru, což vede k nutnosti re-endoskopie či k chirurgickému řešení. Proto je toto řešení vhodné zejména u pacientů s očekávanou dobou přežití nepřesahující 2 měsíce [26]. Nověji lze využít k paliativní terapii maligního GOO endoskopickou ultrasonografii (EUS). Principem EUS navigované GEA pomocí lumen apozičního metalického stentu (LAMS) je vytvoření spojky mezi žaludkem a distálním duodenem nebo první kličkou jejuna – v závislosti na anatomických poměrech a charakteru postižení. Tato metoda vykazuje ve srovnání s chirurgickou GEA nižší míru komplikací, kratší dobu hospitalizace a rychlejší obnovení p. o. příjmu potravy [27,28]. Rovněž v porovnání se zavedením duodenálního SEMS je EUS-GEA metodou s menší mírou komplikací, srovnatelnou úspěšností provedení a nižší mírou reintervencí [29]. Limitací výkonu může být vzdálenost cílové kličky tenkého střeva od žaludku, ascites, portální hypertenze s perigastrickými kolaterálami či postižení těla žaludku nádorem [30,31]. Chirurgická léčba GOO je většinou zvažována až po selhání výše uvedených paliativních endoskopických výkonů nebo pokud tyto endoskopické techniky nejsou dostupné. Zahrnuje paliativní resekci žaludku nebo chirurgickou GEA. Paliativní resekce žaludku je provázena vyšší morbiditou i letalitou, a proto je metodou volby spíše GEA, která má dlouhodobě dobrou toleranci pro solidní stravu.
Perforaci primárního nádoru žaludku je nutné vždy řešit operačně. V terénu nádorové infiltrace je resekce žaludku metodou volby.
Karcinom pankreatu
Základní onkologická data
Chirurgická intervence základní nemoci, tedy karcinomu pankreatu (PC), je možná jen u asi 15–20 % pacientů. Zbytek nemocných se potýká s lokálně pokročilým, neresekabilním (30–40 %) nebo metastatickým PC (40–50 %) [32]. Zvýšení počtu resekcí u primárně hraničně resekabilních tumorů lze dosáhnout neoadjuvantní chemoterapií [33] nebo chemoradioterapií, a to na úroveň cca 40 % [34]. Prognóza nemocných je obecně špatná, 5 let se dožívá jen asi 5–10 % pacientů, s resekcí 15–20 % nemocných [35]. Lepší prognózu mohou mít pacienti s hereditárně podmíněným PC [36]. Počet lokálně relabujících pacientů do 2 let od operace přesahuje 30 % [37]. Operace jaterních metastáz při PC obecně nezlepšuje prognózu nemoci [38] a je vyhrazena pouze individuálním případům se solitárním, event. oligometastatickým postižením [39], ovšem pouze s paliativním, nikoli kurativním záměrem. Standardem léčby metastazujícího PC zůstává systémová chemoterapie, hereditárně podmíněné nádory nebo nádory s MSI-H mohou profitovat z nových léčebných možností v podobě PARP (poly (ADP-ribóza) polymeráza) inhibitorů a imunoterapie.
Chirurgické léčebné / endoskopické léčebné přístupy
Chirurgickou léčbu orgánových metastáz u generalizovaného PC nelze považovat za radikální. Odstranění orgánových metastáz však může být spojeno s prodloužením OS, jak dokumentují výsledky jaterních resekcí (OS 7,8–19 měsíců) a plicních resekcí (OS 22,8–47 měsíců) u vysoce selektované skupiny pacientů s oligometastatickým PC [40]. Tento onkologický benefit operace nebyl ale zatím jednoznačně validován a dokumentované prodloužení OS může být způsobeno spíše příznivými biologickými charakteristikami oligometastatického postižení. Přitom jaterní i plicní resekce jsou provázeny signifikantní morbiditou a mortalitou. V kontextu rizik operačního výkonu, sporného efektu na OS a často špatného klinického stavu pacienta je v současnosti indikován chirurgický resekční výkon orgánových metastáz PC pouze v ojedinělých případech.
Paliativní chirurgická léčba má své kruciální postavení v léčbě komplikací lokálně pokročilého PC. Právě management lokálních komplikací zásadním způsobem určuje nejen kvalitu života onkologického pacienta, ale významně ovlivňuje také možnosti systémové onkologické léčby (tolerance paliativní chemoterapie atd.), a tím i prognózu. Mezi typické lokální komplikace primárního tumoru patří obstrukční ikterus a obstrukce duodena s GOO. Dnes je zlatým standardem v léčbě maligního obstrukčního ikteru endoskopické zavedení stentu do žlučových cest pomocí ERCP. Endoskopická biliární drenáž je technicky proveditelná u 90 % pacientů, má nízkou morbiditu, mortalitu i kratší dobu hospitalizace [41], což umožňuje rychlé zahájení či pokračování systémové chemoterapie. Nevýhodou je vyšší počet endoskopických redrenáží z důvodu ucpání stentu a recidivující biliární obstrukce [42]. Chirurgická léčba je tak v současnosti indikována z důvodu technického selhání endoskopické drenáže žlučových cest nebo v rámci primární operace s peroperačním nálezem neresekabilního tumoru a zahrnuje provedení biliodigestivní anastomózy, nejčastěji ve dvou typech technického provedení – choledochoduodenoanastomóza nebo hepatikojejunoanastomoza dle Rouxe-Y [43].
U přibližně 10–25 % pacientů s PC se v průběhu onemocnění vyvine obstrukce duodena, kterou je možné vyřešit chirurgicky provedením GEA nebo endoskopicky. Chirurgická GEA má lepší dlouhodobé funkční výsledky, ale je provázena signifikantní morbiditou (25–35 %) a nízkou letalitou (2 %) [41]. Je tedy většinou indikována u pacientů v dobrém klinickém stavu a s delší life expectancy (> 2 měsíce). Již zmíněné metody endoskopického řešení GOO (SEMS, EU-GEA) jsou využívány i v případě duodenální obstrukce PC. Specifikem pro PC je však častý souběh biliární a duodenální obstrukce. V případě, že uzávěr duodena znemožňuje zavedení biliárního stentu standardní cestou při nepřístupnosti Vaterské papily, lze k zajištění drenáže žlučových cest provést perkutánní transhepatální biliární drenáž (PTD) pod RTG kontrolou. Tato metoda je však zatížena značnou mírou komplikací a pacienta limituje nutností ponechání zevní části drenáže, nadto v případě metastáz pravého jaterního laloku či velkého ascitu je PTD obtížná nebo kontraindikovaná. Alternativou jsou EUS navigované metody biliární drenáže za použití metalických či kovových stentů – zejména EUS navigovaná choledochoduodenoanastomóza či hepatikogastroanastomóza, příp. (je-li Vaterská papila dosažitelná, ale ERCP nelze provést z jiných důvodů) přicházejí v úvahu rendez-vous techniky s využitím EUS v kombinaci s ERCP [44]. Při optimálních podmínkách lze duodenální i biliární obstrukci řešit EUS navigovanými výkony v jedné době [45]. Využití EUS navigovaných metod biliární drenáže je tedy platnou alternativou jak PTD, tak paliativních chirurgických výkonů.
Diskuze
Řešení jednotlivých případů nemocných se ZN GIT cestou MDT je již zlatým standardem, který zlepšuje prognózu a/nebo zlepšuje kvalitu života pacientů, případně přináší úlevu symptomatickým nemocným. Výsledkem kvalitní mezioborové spolupráce a dobře fungujícího působení MDT je smysluplná indikace chirurgické léčby u co největšího počtu případů generalizovaných ZN GIT.
Role onkologa spočívá ve zhodnocení onkologického přínosu chirurgického výkonu. V současnosti je zhodnocení biologické povahy ZN nadřazeno původním indikačním kritériím, jako je počet a lokalizace metastáz, a to zejména u OC a GC. Z biologických charakteristik ZN se nejčastěji zohledňuje stupeň diferenciace tumoru, postižení lymfatických uzlin, invaze do krevních či lymfatických cév a perineurální propagace. Elevace nádorových markerů signalizuje možnou přítomnost mikrometastatické nemoci. Z nádorů žaludku jsou prognosticky příznivější nádory HER2 pozitivní, a to nejen biologickou povahou, ale také vyšší odpovědí na cílenou léčbu. Novou modalitou u OC/GC s pozitivitou PDL1 nebo MSI-H je imunoterapie. U CRC je jednou z často hodnocených biologických charakteristik přítomnost mutace v genech RAS. Zvažování operace u nádorů odpovídajících výrazně a/nebo dlouho na systémovou léčbu je strategií založenou na nepřímém testování biologické povahy nemoci s možnou selekcí jednotlivých pacientů. Z tohoto pohledu zůstává zatím nedořešeno postavení chirurgické léčby na pozadí imunoterapie. Vzhledem k poněkud odlišenému mechanizmu fungování imunoterapie, odlišným kritériím hodnocení její účinnosti i možnosti dlouhodobých léčebných odpovědí u respondérů může být paradoxně chirurgická léčba orgánových metastáz kontraindikována. Správné posouzení vhodnosti chirurgické léčby vyžaduje ideálně hodnocení na úrovni klinických studií nebo sdílení širších klinických zkušeností.
Role chirurga spočívá v pečlivém zhodnocení resekability orgánových metastáz a vyhodnocení perioperačních rizik konkrétního chirurgického výkonu u konkrétního pacienta. V případě jaterních metastáz je v současnosti resekabilita definována schopností odstranit veškeré jaterní metastázy s lemem zdravé tkáně (R0 resekce) a zachovat dostatečný objem zbytkového jaterního parenchymu, vč. zachování cévního přítoku, odtoku a adekvátní biliární drenáže. Z pohledu chirurga je tak otázka počtu a velikosti metastáz kontroverzní až irelevantní téma. Stran perioperačních rizik nesmí samotná operace pacienta zatěžovat neúměrně vysokým rizikem komplikací, natož jej bezprostředně ohrožovat na životě.
V indikacích resekčních výkonů tak existuje celá řada na první pohled kontroverzních situací. Ne každý relaps či orgánové metastázy je vhodné operovat, i když je/jsou resekabilní. Z onkologického pohledu jsou to zejména případy s nepříznivou biologií popsané výše. Opakem mohou být pacienti „superrespondéři“, zejména v odpovědi na zmiňovanou imunoterapii, která může chirurgickou léčbu diskreditovat. Na první pohled nepochopitelná se může zdát situace, kdy jediná, špatně lokalizovaná metastáza může být kontraindikací operace, naproti tomu i pět metastáz na povrchu jater lze někdy odstranit relativně málo náročnou jaterní resekcí. Přínos chirurgického výkonu je však vždy pochybný u neperspektivního případu (z pohledu klinického stavu pacienta anebo biologie nádoru), a to přesto, že „standardní“ chirurgická i onkologická definice resekability (odstranění veškeré nádorové masy v organizmu) je naplněna. Přítomnost peritoneální karcinomatózy pak vyžaduje z důvodu vysoké morbidity CRS a HIPEC „superselekci“ nemocných.
U resekabilních jaterních metastáz pacientů s CRC se může zdát kontroverzní sekvence resekce jater a primárního tumoru. V případě resekability primárního tumoru i metastatického postižení v současnosti neexistuje (a vzhledem k heterogenitě pacientů existovat pravděpodobně ani nebude) randomizovaná studie hodnotící výsledky jednotlivých chirurgických přístupů. Z pohledu onkologa je stěžejní provedení, či neprovedení resekce, jinak řečeno je prognóza určena provedením radikální operace, nikoli pořadím výkonů. Pořadí výkonů má pak spíše dopad na výskyt perioperačních komplikací. Sekvence systémové a lokoregionální léčby podléhá stanovení resekability, potenciální resekability či non-resekability maligní nemoci.
Volba typu systémové léčby (chemoterapie samotná vs. v kombinaci s cílenou léčbou) je podřazena léčebnému záměru (kombinace není indikována u resekabilních nemocných) a biologickým charakteristikám nemoci (přítomností mutace v genech RAS). Z chirurgického pohledu je systémová onkologická léčba často důležitým předoperačním faktorem s dopadem na funkci jaterní tkáně (hepatotoxicita některých chemoterapeutik) nebo s rizikem pooperačních komplikací (anti-VEGF cílená léčba a riziko krvácivých a vaskulárních komplikací). Terminologie definující léčebný cíl (neoadjuvantní, indukční, konverzní záměr) jsou z praktického pohledu nedůležité.
V otázce indikace chirurgické léčby u symptomatických primárních tumorů je patrně největší kontroverzí přítomnost peritoneální karcinomatózy, a to jak z prognostického, tak funkčního pohledu. Nicméně symptomatický pacient s metastatickým CRC je vždy důvodem k časnému chirurgickému řešení, kdy v úvahu připadá paliativní resekce primárního tumoru nebo stomie. Těžko představitelné je vynechání léčby u pacientů s OC, GC či PC trpícími lokálními komplikacemi progredující nemoci. Zde je prognostický pohled podřazen kvalitě života nemocného. Úkolem MDT je v tomto případě volba výkonu (invazivního, či neinvazivního v případě možnosti) s nejnižší morbiditou.
Naopak indikace operace u asymptomatických nemocných s rozsahem nemoci, kde chirurgická léčba nemá vyhlídky na prodloužení života, postrádá obvykle výše pojmenované léčebné záměry (schéma 1). Důvodem mohou být často nereálné požadavky nemocného, kde úkolem MDT je objasnění situace a předložení nechirurgických alternativ. Indikace takového výkonu je pouze relativní, míra kontroverze může být někdy jen úhlem pohledu.
Absolutních kontraindikací chirurgické léčby pacientů s metastatickým ZN GIT je málo. Z chirurgického pohledu jsou to pouze špatný celkový stav pacienta a technická (ne) proveditelnost výkonu. Úkol onkologa je zde zřejmý, nabídnout k operaci pouze pacienty, jejichž prognóza obhajuje smysluplnost chirurgické léčby. Jakýkoli tabelární seznam (tab. 1) indikací či kontraindikací je nedostatečný a neodráží skutečný stav, kdy rozhodování v MDT je celistvé. V otázce přínosu MDT je tedy zřejmé, že správná indikace správného pacienta je vždy přínosná. Dosažení tohoto cíle vyžaduje nejen erudici zainteresovaných, ale zejména pochopení funkce onkologa a chirurga v MDT, potažmo dalších odborností, jejichž role je rovněž nezastupitelná, přesahuje ale diskutované téma a záměr publikace. Výběr pacienta onkologem a chirurgické zhodnocení, zda a jak může být operován, přesahují v MDT rámec standardní mezioborové spolupráce. Bez vzájemné kooperace a znalosti významu toho druhého pro fungování MDT by pacient z komplexní léčby nikdy neprofitoval.
ORCID autorů
Z. Bielčiková ORCID 0000-0001-8434-9848,
J. Ulrych ORCID 0000-0002-5225-9562,
V. Frýba ORCID 0000-0003-2768-7204,
P. Hrabák ORCID 0000-0003-0536-9782,
M. Zubaľ ORCID 0000-0001-6556-6185,
L. Petruželka ORCID 0000-0002-4397-0635.
Doručeno/Submitted: 31. 8. 2022
Přijato/Accepted: 29. 9. 2022
MUDr. Zuzana Bielčiková, Ph.D.
Onkologická klinika
1. LF UK a VFN v Praze
U Nemocnice 488/2
12808 Praha 2
zuzana.bielcikova@vfn.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Tsai MS, Su YH, Ho MC et al. Clinicopathological features and prognosis in resectable synchronous and metachronous colorectal liver metastasis. Ann Surg Oncol 2007; 14(2): 786–794. doi: 10.1245/s10434-006-9215-5.
2. Liu C, Wang T, Yang J et al. Distant Metastasis Pattern and Prognostic Prediction Model of Colorectal Cancer Patients Based on Big Data Mining. Front Oncol 2022; 12: 878805. doi: 10.3389/fonc.2022.878805.
3. Elias D, Liberale G, Vernerey D et al. Hepatic and extrahepatic colorectal metastases: When resectable, their localization does not matter, but their total number has a prognostic effect. Ann Surg Oncol 2005; 12(11): 900–909. doi: 10.1245/ASO.2005.01.010.
4. Zucchelli G, Moretto R, Rossini D et al. Oligometastatic colorectal cancer: Prognostic implications of tumor load, role of locoregional treatments, and of first-line therapy intensification – A pooled analysis of TRIBE and TRIBE2 studies by GONO. J Clin Oncol 2020; 38(4_suppl): 12. doi: 10.1200/jco.2020.38.4_ suppl.12.
5. Jácome AA, Vreeland TJ, Johnson B et al. The prognostic impact of RAS on overall survival following liver resection in early versus late-onset colorectal cancer patients. Br J Cancer 2021; 124(4): 797–804. doi: 10.1038/s41416-020- 01169-w.
6. Bulut G, Oytun MG, Almuradova E et al. Contribution of “complete response to treatment” to survival in patients with unresectable metastatic colorectal cancer: A retrospective analysis. PLoS One 2021; 16: e0259622. doi: 10.1371/journal.pone.0259622.
7. Kanas GP, Taylor A, Primrose JN et al. Survival after liver resection in metastatic colorectal cancer: Review and meta-analysis of prognostic factors. Clin Epidemiol 2012; 4(1): 1203–1213. doi: 10.2147/CLEP.S34285.
8. Creasy JM, Sadot E, Koerkamp BG et al. Actual 10-year survival after hepatic resection of colorectal liver metastases: what factors preclude cure? Surgery 2018; 163(6): 1238–1244. doi: 10.1016/j.surg.2018.01.004.
9. Mise Y, Aloia TA, Brudvik KW et al. Parenchymal-sparing hepatectomy in colorectal liver metastasis improves salvageability and survival. Ann Surg 2016; 263(1): 146–152. doi: 10.1097/SLA.0000000000001194.
10. Beckers P, Berzenji L, Yogeswaran SK et al. Pulmonary metastasectomy in colorectal carcinoma. J Thorac Dis 2021; 13(4): 2628–2635. doi: 10.21037/jtd-2019-pm-14.
11. Tuca A, Guell E, Martinez-Losada E et al. Malignant bowel obstruction in advanced cancer patients: Epidemiology, management, and factors influencing spontaneous resolution. Cancer Manag Res 2012; 4(1): 159–169. doi: 10.2147/CMAR.S29297.
12. Corona E, Yang L, Esrailian E et. al. Trends in Esophageal Cancer Mortality and Stage at Diagnosis by Race and Ethnicity in the United States. Cancer Causes Control 2021; 32(8): 883–894. doi: 10.1007/s10552-021-01443-z.
13. Procopio F, Marano S, Gentile D et al. Management of liver oligometastatic esophageal cancer: Overview and critical analysis of the different loco-regional treatments. Cancers (Basel) 2020; 12(1): 20. doi: 10.3390/cancers12010020.
14. Riihimäki M, Hemminki A, Sundquist K et al. Metastatic spread in patients with gastric cancer. Oncotarget 2016; 7(32): 52307–52316. doi: 10.18632/oncotarget.10740.
15. Li SC, Lee CH, Hung CL et al. Surgical resection of metachronous hepatic metastases from gastric cancer improves long-term survival: A population-based study. PLoS One 2017; 12(7): e0182255. doi: 10.1371/journal.pone. 0182255.
16. Parry K, Visser E, van Rossum PSN et al. Prognosis and Treatment After Diagnosis of Recurrent Esophageal Carcinoma Following Esophagectomy with Curative Intent. Ann Surg Oncol 2015; 22(Suppl_3): S1292–S1300. doi: 10.1245/s10434-015-4840-5.
17. Lordick F, Carneiro F, Cascinu S et al. Gastric cancer: ESMO Clinical Practice Guideline for diag nosis, treatment and follow-up. Ann Oncol 2022; S0923–7534(22)01851-8. doi: 10.1016/ J.ANNONC.2022.07.004.
18. Marte G, Tufo A, Steccanella F et al. Efficacy of surgery for the treatment of gastric cancer liver metastases: A systematic review of the literature and meta-analysis of prognostic factors. J Clin Med 2021; 10(5): 1141. doi: 10.3390/jcm10051141.
19. Granieri S, Altomare M, Bruno F et al. Surgical treatment of gastric cancer liver metastases: Systematic review and meta-analysis of long-term outcomes and prognostic factors. Crit Rev Oncol Hematol 2021; 163: 103313. doi: 10.1016/j.critrevonc.2021.103313.
20. Schizas D, Lazaridis II, Moris D et al. The role of surgical treatment in isolated organ recurrence of esophageal cancer-a systematic review of the literature. World J Surg Oncol 2018; 16(1): 55. doi: 10.1186/s12957-018-13 57-y.
21. Alyami M, Hübner M, Grass F et al. Pressurised intraperitoneal aerosol chemotherapy: rationale, evidence, and potential indications. Lancet Oncol 2019; 20(7): e368–e377. doi: 10.1016/S1470-2045(19)30318-3.
22. Coffey MR, Bachman KC, Worrell SG et al. Palliative Surgery Outcomes for Patients with Esophageal Cancer: An NCDB Analysis. J Surg Res 2021; 267: 229–234. doi: 10.1016/ j.jss.2021.05.013.
23. Iwasaki H, Mizushima T, Suzuki Y et al. Factors That Affect Stent-Related Complications in Patients with Malignant Obstruction of the Esophagus or Gastric Cardia. Gut Liver 2017; 11(1): 47–54. doi: 10.5009/gnl16172.
24. Spaander MCW, van der Bogt RD, Baron TH et al. Esophageal stenting for benign and malignant disease: European Society of Gastrointestinal Endoscopy (ESGE) Guideline – Update 2021. Endoscopy 2021; 53(7): 751–762. doi: 10.1055/a-1475-0063.
25. Ghoshal UC, Kumar V. Antroduodenal stenting for malignant gastric outlet obstruction: technique and outcome. J Dig Endosc 2019; 10(1). doi: 10.4103/jde.JDE_64_18.
26. Itoi T, Baron TH, Khashab MA et al. Technical review of endoscopic ultrasonography-guided gastroenterostomy in 2017. Dig Endosc 2017; 29(4): 495–502. doi: 10.1111/den.12794.
27. Kouanda A, Binmoeller K, Hamerski C et al. Endoscopic ultrasound-guided gastroenterostomy versus open surgical gastrojejunostomy: clinical outcomes and cost effectiveness analysis. Surg Endosc 2021; 35(12): 7058–7067. doi: 10.1007/s00464-020-08221-z.
28. Perez-Miranda M, Tyberg A, Poletto D et al. EUS-guided Gastrojejunostomy Versus Laparoscopic Gastrojejunostomy: An International Collaborative Study. J Clin Gastroenterol 2017; 51(10): 896–899. doi: 10.1097/MCG.000 0000000000887.
29. Ge PS, Young JY, Dong W et al. EUS-guided gastroenterostomy versus enteral stent placement for palliation of malignant gastric outlet obstruction. Surg Endosc 2019; 33(10): 3404–3411. doi: 10.1007/s00464-018-066 36-3.
30. Cominardi A, Tamanini G, Brighi N et al. Conservative management of malignant gastric outlet obstruction syndrome-evidence based evaluation of endoscopic ultrasound-guided gastroentero-anastomosis. World J Gastrointest Oncol 2021; 13(9): 1086–1098. doi: 10.4251/wjgo.v13.i9.1086.
31. Kerdsirichairat T, Irani S, Yang J et al. Durability and long-term outcomes of direct EUS-guided gastroenterostomy using lumen-apposing metal stents for gastric outlet obstruction. Endosc Int Open 2019; 7(2): E144–E150. doi: 10.1055/a-0799-9939.
32. van Veldhuisen E, van den Oord C, Brada LJ et al. Locally advanced pancreatic cancer: Work-up, staging, and local intervention strategies. Cancers (Basel) 2019; 11(7): 976. doi: 10.3390/cancers11070976.
33. Gillen S, Schuster T, Büschenfelde CM Zum et al. Preoperative/neoadjuvant therapy in pancreatic cancer: A systematic review and meta-analysis of response and resection percentages. PLoS Med 2010; 7(4): e1000267. doi: 10.1371/journal.pmed.1000267.
34. Petrelli F, Coinu A, Borgonovo K et al. FOLFIRINOX-based neoadjuvant therapy in borderline resectable or unresectable pancreatic cancer: A meta-analytical review of published studies. Pancreas 2015; 44(4): 515–521. doi: 10.1097/MPA.0000000000000 314.
35. Latenstein AEJ, van Roessel S, van der Geest LGM et al. Conditional Survival After Resection for Pancreatic Cancer: A Population-Based Study and Prediction Model. Ann Surg Oncol 2020; 27(7): 2516–2524. doi: 10.1245/s10434-020-08235-w.
36. Golan T, Kanji ZS, Epelbaum R et al. Overall survival and clinical characteristics of pancreatic cancer in BRCA mutation carriers. Br J Cancer 2014; 111(6): 1132–1138. doi: 10.1038/bjc. 2014.418.
37. Cloyd JM, Crane CH, Koay EJ et al. Impact of hypofractionated and standard fractionated chemoradiation before pancreatoduodenectomy for pancreatic ductal adenocarcinoma. Cancer 2016; 122(17): 2671–2679. doi: 10.1002/cncr.30117.
38. Gleisner AL, Assumpcao L, Cameron JL et al. Is resection of periampullary or pancreatic adenocarcinoma with synchronous hepatic metastasis justified? Cancer 2007; 110(11): 973–977. doi: 10.1002/cncr.23074.
39. Zanini N, Lombardi R, Masetti M et al. Surgery for isolated liver metastases from pancreatic cancer. Updates Surg 2015; 67(1): 19–25. doi: 10.1007/s13304-015-0283-6.
40. Timmer FEF, Geboers B, Nieuwenhuizen S et al. Locoregional treatment of metastatic pancreatic cancer utilizing resection, ablation and embolization: A systematic review. Cancers (Basel) 2021; 13(7): 1608. doi: 10.3390/ cancers13071608.
41. Perinel J, Adham M. Palliative therapy in pancreatic cancer – palliative surgery. Transl Gastroenterol Hepatol 2019; 4: 28. doi: 10.21037/ tgh.2019.04.03.
42. Moss A, Morris E, Mac Mathuna P. Palliative biliary stents for obstructing pancreatic carcinoma. In: Mac Mathuna P. Cochrane Database of Syst Rev 2006; CD004200. doi: 10.1002/14651858.CD004200.pub2.
43. Ryska M. Preoperative staging in patients with pancreatic cancer. Gastroenterol a Hepatol 2015; 69(6): 525–529. doi: 10.14735/AMGH2015525.
44. Kraus M, Kovala P, Kremer M. Využití EUS navigované choledochoduodenostomie v léčbě biliární obstrukce. Gastroent Hepatol 2014; 68(2): 146–148.
45. Nosek V, Pintová J. EUS navigované gastrointestinální anastomózy – nové možnosti terapeutické endoskopie. Gastroent Hepatol 2020; 74(4): 302–310. doi: 10.14735/amgh2020302.