Krvácení z varixů – pohled na terapii po Bavenu VI
Tomáš Fejfar Orcid.org 1, Václav Jirkovský Orcid.org 1, Štěpán Šembera Orcid.org 1, Tomáš Vaňásek Orcid.org 2, Petr Hůlek1,3
+ Pracoviště
Souhrn
Varikózní krvácení je nejzávažnější a potenciálně smrtící komplikací portální hypertenze. Léčba akutní ataky dnes probíhá podle jasných doporučení a obsahuje zajištění nemocného volumexpanzí a hemosubstitucí, antibiotickou profylaxi a zejména podávání vazoaktivní léčby spolu s endoskopickým ošetřením. V případě selhání indikujeme transjugulární intrahepatální portosystémovou spojku (TIPS) pomocí potahovaného stentu. Jako most k TIPS či v případě jeho kontraindikace zavádíme dedikovaný jícnový stent nebo balonkovou sondu. V sekundární a primární profylaxi se uplatňuje léčba neselektivním β-blokátorem a endoskopická léčba.
Klíčová slova
krvácení, léčba, portální hypertenzeÚvod
Nejčastější příčinou klinicky významné portální hypertenze je ve většině zemí jaterní cirhóza, jejíž incidence stále narůstá. Většina nemocných s jaterní cirhózou je přitom asymptomatických a o své jaterní chorobě neví. V případě dekompenzace jaterního onemocnění je nemocný ohrožen rozvojem ascitu s možným hepatorenálním selháváním, jaterní encefalopatií a zejména krvácením do zažívacího traktu, které je u těchto nemocných nejčastější smrtící komplikací. Současně je i třetí nejčastější příčinou krvácení do horní části zažívací trubice [1,2].
V populaci nemocných s dosud kompenzovanou jaterní cirhózou je roční riziko varikózního krvácení kolem 4 %. U nemocných s již diagnostikovanými významnými varixy (F2–F3) ale přesahuje 10–15 % a v závislosti na dalších faktorech může přesahovat 80 % [3]. Významným ukazatelem rizika krvácení je velikost a vzhled varixů, proto je u všech nemocných v době diagnózy chronického pokročilého jaterního onemocnění indikována diagnostická horní endoskopie [1,2]. S velikostí a vzhledem varixů jsou významnými prediktory rizika krvácení zejména míra pokročilosti jaterního onemocnění klasifikovaná podle Child-Pughovy klasifikace a invazivně měřená hodnota portosystémového gradientu, která je nejčastěji získána měřením tlaku ve volné a zaklíněné jaterní žíle. Riziko krvácení i jeho recidivy výrazně stoupá u nemocných ve skupině B a C dle Child-Pughovy klasifikace a s gradientem mezi volným a zaklíněným tlakem v jaterní žíle (HVPG – hepatic vein pressure gradient) > 16–20 mm Hg [2].
V posledních desetiletích, díky rozvoji terapeutických možností, úmrtnost na varikózní krvácení klesá [4]. Stále má ale první ataka krvácení vysokou letalitu (15–20 %) a je spojena s vysokým rizikem recidivy [5]. V terapii však stále dochází k novým posunům.
Od roku 1990 se na severu Itálie (Baveno) konají v pětiletých intervalech setkání předních evropských a světových expertů na poli portální hypertenze. Závěry těchto setkání se v minulosti vždy výrazně otiskly do všech jak evropských, tak amerických doporučených postupů pro terapii a diagnostiku komplikací portální hypertenze. V dubnu minulého roku proběhlo toto setkání již pošesté a opět přineslo úpravy a nová doporučení v této oblasti [5]. Lze očekávat, že se znovu promítnou v doporučených postupech a běžné klinické praxi.
Léčba akutní ataky varikózního krvácení
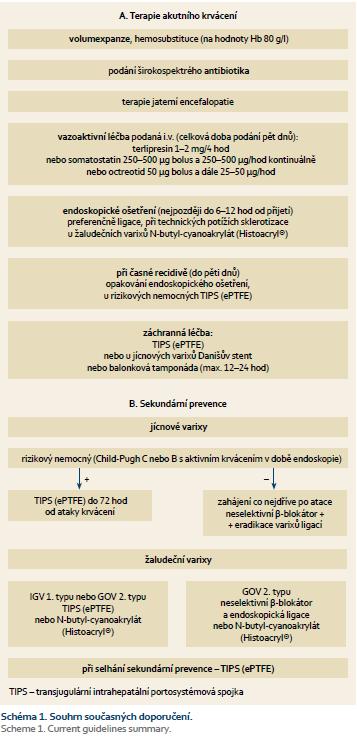
Léčba akutní ataky varikózního krvácení vždy vyžaduje intenzivní multidisciplinární přístup za účasti endoskopického týmu, intenzivisty a radiologa. Základní léčba sestává z kombinace obecného zajištění nemocného, podání vazoaktivních léků, které je nutno podat u každého nemocného s podezřením na varikózní krvácení již v přednemocniční péči, a endoskopického ošetření. V případě selhání léčby lze indikovat transjugulární intrahepatální portosystémovou spojku (TIPS) či k překlenutí kritického období použít balonkovou tamponádu nebo zavést jícnový stent.
Zajištění nemocného
Základním a prvním opatřením po zajištění adekvátního žilního vstupu je volumová resuscitace pomocí krystaloidů s následnou hemosubstitucí. Přístup k hemosubstituci je v současné době spíše konzervativní s cílem udržení hodnot hemoglobinu v rozmezí 70–80 g/l (hematokryt 0,21–0,24), vyjma nemocných s pokračujícím krvácením [1,2]. U nemocných s přidruženými kardiovaskulárními chorobami a vysokým rizikem ischemických komplikací je vhodnější cílová hodnota hemoglobinu kolem 100 g/l. Substituce na vyšší hodnoty je dle dostupných dat naopak spojena s vyšším rizikem recidivy krvácení [6]. Korekce protrombinového času/INR pomocí čerstvě mražené plazmy nebo rekombinantního faktoru VII (rVIIa) není v současné době doporučována [2,5], i když existují data ze dvou randomizovaných studií ukazující benefit podání rVIIa u nemocných ve vyšším riziku recidivy krvácení (Child-Pugh > 8 a aktivní krvácení v době endoskopie) [7,8]. Pro doporučení substituce trombocytů u nemocných s krvácením nejsou v současné době dostupná data podporující tento postup.
Velmi častou komplikací u nemocných s portální hypertenzí jsou systémové infekce. Je prokázané, že systémová infekce (spontánní bakteriální peritonitida, pneumonie, infekce močových cest) je jedním ze spouštěcích faktorů varikózního krvácení a podílí se na selhání léčby i vyšší úmrtnosti [9]. U všech nemocných s varikózním krvácením je proto indikováno podání širokospektrého antibiotika, které zvyšuje úspěšnost zástavy krvácení, snižuje riziko jeho recidivy i celkovou úmrtnost [10–12]. Léčba má být zahájena již v úvodu, pokud možno ještě před endoskopickým ošetřením. Nejvyšší průkaz je pro podání chinolonů a cefalosporinů III. generace (ceftriaxon) [1,2,5]. Na druhou stranu se nyní objevují data, která ukazují, že z tohoto přístupu profitují spíše jen nemocní s pokročilejším jaterním onemocněním (Child-Pugh B a C) [5,13].
Krvácení je velmi často spojeno s rozvojem nebo zhoršením jaterní encefalopatie. Léčba v případě manifestní encefalopatie u akutního krvácení je stejná jako v ostatních situacích a sestává zejména z podávání laktulózy (15–30 ml/8–12 hod k dosažení 2–3 stolic denně) a rifaximinu [14,15]. V souladu s názorem některých odborníků je tato léčba u rizikových nemocných podávána i preventivně [5].
Vazoaktivní léčba
Jak již bylo řečeno úvodem, základním kamenem léčby jsou léky ovlivňující splanchnickou perfuzi. V sou?asn? dob? jsčasné době jsou dostupné a v klinické praxi používané: terlipresin, somatostatin a octreotid (tab. 1). Vazoaktivní lék má být podán před endoskopickým ošetřením, při podezření na varikózní krvácení, pokud možno již při prvním kontaktu s nemocným v přednemocniční péči [1,2,5]. Dále má být podáván po dobu pěti dnů [2,5,16].
Nejdéle používaným a v klinických studiích prověřeným lékem je terlipresin. Terlipresin je syntetický analog vazopresinu, selektivní V1 agonista (N-triglycyl-8-lysin-vazopresin). Jako syntetický analog vazopresinu byl poprvé vyroben v roce 1964 v Československu. Způsobují splanchnickou vazokonstrikci s výrazným snížením portálního tlaku a průtoku v portosystémových kolaterálách [17,18]. Jeho biologický poločas (3,5 hod) umožňuje bolusové intermitentní podávání každé 4 hod. Dávka 1–2 mg signifikantně snižuje portální průtok a průtok ve vena azygos a ve vysokém procentu vede k zástavě krvácení (75–83 %) a dle prospektivních studií prokazatelně snižuje mortalitu i riziko recidivy krvácení [19,20]. Pozitivní je i snížení rizika rozvoje hepatorenálního selhání [1]. Velmi důležitá je možnost jeho podání již během transportu krvácejících pacientů do nemocničního zařízení. Nežádoucí účinky nejsou příliš časté, ale vždy je nutno mít na paměti kontraindikace (ischemická choroba srdeční, těžší hypertenze). Opatrnosti je třeba i u nemocných ve vyšším věku. Nejzávažnější komplikací může být periferní i myokardiální ischemie (3 % pacientů). Méně závažnou, ale poměrně častou komplikací bývá diluční hyponatremie, která je častěji pozorována u méně pokročilých pacientů [21].
Druhým lékem, který můžeme použít v první volbě nebo v případě kontraindikace podání terlipresinu, je somatostatin. Jeho účinek je patrně alespoň částečně dán i inhibicí sekrece glukagonu (který u nemocných s cirhózou způsobuje vazodilataci). Kontinuální podávání somatostatinu u akutního krvácení snižuje HVPG. Nevýhodou je velmi krátký poločas (asi 2 min), což vyžaduje podávání v kontinuální infuzi. Léčbu krvácení zahajujeme podáním bolusu 250–500 µg s následným kontinuálním podáváním 250–500 µg/hod [1,2,5]. Podávání vyšší dávky (500 µg) přináší benefit u nemocných s aktivním krvácením v době endoskopie [22].
Podobné farmakologické účinky jako somatostatin má jeho analog oktreotid. V porovnání se somatostatinem je pro klinické použití výhodný jeho delší poločas (90–120 min) a především podstatně delší farmakologické působení (8–12 hod). Stejně jako somatostatin signifikantně snižuje portální tlak [1,2,5]. V léčbě je podáván v úvodu bolusově (50 µg) s následným infuzním podáním (25–50 µg/hod) [1,2].
I když je účinnost terlipresinu v placebem kontrolovaných studiích dokumentována nejlépe a některé srovnávací práce ukazují větší účinnost terlipresinu na snížení HVPG [23], podle posledních doporučení [5] a meta- analýz [20,24] je použití všech tří léků jak po stránce zástavy krvácení a prevence recidivy, tak i ovlivnění úmrtnosti srovnatelné. V našich podmínkách je i cena terlipresinu a somatostatinu obdobná.
Endoskopická léčba
Horní endoskopie slouží jak k určení zdroje krvácení (až 30 % nemocných s jaterní cirhózou má nevarikózní zdroj krvácení), tak spolu s farmakoterapií vazoaktivní látkou patří k základním terapeutickým možnostem. Vzhledem k vysoké účinnosti podané vazoaktivní léčby [25,26] máme k endoskopii přistoupit až po zajištění a stabilizaci nemocného. Podle současných doporučení [1,2,5] nejpozději do 12 hod, potažmo 6 hod od přijetí. Před výkonem nesmíme zapomínat i na zajištění dýchacích cest a u rizikového nemocného raději předem volíme orotracheální intubaci. Evropskou endoskopickou společností i hepatologickou obcí [5] je doporučováno 30–60 min před endoskopií i.v. podání erytromycinu (250 mg). Jeho podání vede k lepšímu přehledu během endoskopie, zkrácení doby endoskopie i snížení potřeby opakování vyšetření [27,28]. Intravenózní forma erytromycinu ale není nyní v ČR dostupná a lze jej získat jen individuálním dovozem.
Za endoskopickou léčebnou metodu volby akutního varikózního krvácení v oblasti jícnu je dnes považována ligace jícnových varixů [2,5], která má v porovnání se sklerotizační léčbou vyšší účinnost a signifikantně nižší výskyt komplikací [29,30]. Skleroterapii lze ale jistě použít v případě, že ligace není možná.
Kombinace farmakoterapie a endoskopické léčby přináší v současnosti nejlepší kontrolu akutního varikózního krvácení a zejména snižuje riziko časné recidivy [31]. Dnes je považována za zlatý standard.
V rámci přístupu k nemocným je nutno mít vždy na paměti i prediktivní ukazatele možného selhání naší terapie, ke kterým patří zejména vstupně známky šoku, pokročilost jaterního onemocnění (Child-Pugh B a C, MELD > 18), renální insuficience, aktivní krvácení v době endoskopie, asociovaná trombóza portální žíly, hepatocelulární karcinom (HCC) a zejména vysoký portosystémový gradient (HVPG) > 16–20 mm Hg [32–34].
Selhání léčby
V případě selhání výše uvedené terapie nebo k zajištění nemocného k transportu k definitivnímu ošetření lze použít ke kompresi krvácejícího jícnového varixu balonkovou tamponádu (trojcestná dvoubalonková Sengstaken-Blakemorova sonda). Správným zavedením a adekvátní insuflací vzduchem lze dosáhnout hemostázy v 60–90 % případů. Po desuflaci je však riziko recidivy krvácení poměrně veliké (až 50 %). Použití sondy je spojeno i s vysokým rizikem komplikací (10–15 %), zejména aspirací, proto je opět velmi často k zajištění dýchacích cest nutná sou?asn? orotrachčasná orotracheální intubace. Při nedostatečně erudovaném použití hrozí i lacerace jícnu. Maximální doba insuflace takto zavedené sondy je 12–24 hod [1,2,5]. Při delším intervalu je vysoké riziko nekrózy jícnu [35].
Na základě dosud publikovaných dat se za lepší metodu, v porovnání s balonkovou sondou, jeví použití dedikovaného jícnového stentu [5]. Tento dedikovaný jícnový stent (SX-Ella stent Danis®) k zástavě nekontrolovatelného krvácení využívá svou expanzní sílu, kterou komprimuje krvácející varix a působí proti portálnímu tlaku. Tím dochází k zástavě varikózního krvácení. Jeho zavedení během současné terapeutické endoskopie je díky speciálnímu zavaděči poměrně snadné. Zástavu krvácení dosahuje v 90–100 % [36,37]. Možné komplikace jsou poměrně málo závažné. Nejčastěji se jedná o migraci stentu a otlakové ulcerace při horním a dolní okraji hrdla stentu [36–38]. V porovnání s balonkovou sondou přináší delší období zajištění nemocného a překlenutí období s vysokým rizikem recidivy krvácení s možností zahájení následné adekvátní sekundární profylaxe. U nemocných s vyšší pokročilostí jaterního onemocnění ve vysokém riziku recidivy umožňuje i delší dobu restituce jaterních funkcí po proběhlém krvácení a v některých případech již umožňuje následnou léčbu pomocí TIPS.
Za záchranou léčbu v případě selhání metod první linie je ale stále považována urgentní TIPS [2,5]. Kombinace snížení portálního tlaku vytvořeným zkratem a endovaskulární uzavření cévy tkáňovým lepidlem v místě krvácení bez nutnosti operační zátěže vede k okamžité zástavě krvácení u 91–100 % nemocných [39,40]. Třicetidenní recidivy se vyskytují v 7–30 % případů a jsou v převážné většině případů způsobeny akutní okluzí zkratu. Měsíční mortalita je kolem 28–55 %, která je dána zejména závažným stavem, ve kterém již nemocní k vytvoření urgentní spojky přicházejí. Velký význam má urgentní TIPS i u nemocných s krvácením ze žaludečních varixů [40], které hůře reaguje na endoskopickou léčbu, a u nemocných s krvácením z portální gastropatie. I TIPS má však své kontraindikace a limitace a je třeba mít na paměti, že u nemocných s výraznou jaterní insuficiencí (Child-Pugh > 13) je úmrtnost po výkonu extrémní, a ti tedy kandidáty na léčbu pomocí TIPS nejsou [1,2,5,41]. I zde je pak možnost použít jícnový stent [5]. Stále ale zůstává část pacientů s vysoce pokročilým onemocněním, kteří na ataku varikózního krvácení zemřou.
Primární a sekundární prevence
Základní snahou lékařů pečujících o nemocné s portální hypertenzí ale je, aby k atace krvácení nebo její recidivě vůbec nedošlo. Zásadní je tedy řádná dispenzarizace nemocných a preventivní léčba. Samozřejmou součástí je terapie základního onemocnění, která riziko dekompenzace a krvácení signifikantně ovlivňuje [5]. Intervaly dispenzárních endoskopií by se nyní měly řídit nejen předchozím endoskopickým nálezem, ale i stavem a kompenzací základního jaterního onemocnění [5].
Primární prevence
Léčebnou intervencí se u nemocného s portální hypertenzí snažíme, aby k varikóznímu krvácení (primární prevence) nebo v ideálním případě ani k rozvoji varixů (preprimární prevence) nedošlo nebo aby riziko příhody bylo alespoň sníženo. Své nezastupitelné místo v tomto bodě mají neselektivní β-blokátory a endoskopická léčba. Volba jednoho nebo druhého léčebného postupu je do značné míry na domluvě mezi lékařem a pacientem, samozřejmě s ohledem na možné kontraindikace a přidružené choroby. V dosud publikovaných 19 prospektivních randomizovaných studiích přinášejí oba přístupy srovnatelné výsledky z pohledu přežívání nemocných [42]. Z pohledu prevence krvácení je možný mírný benefit na straně endoskopické léčby [42], který je ale zřejmě z pohledu přežívání vyvážen dalšími pozitivními účinky β-blokátoru [43].
Neselektivní β-blokátory snižují HVPG snížením minutového srdečního výdeje a pravděpodobně i přímým působením na splanchnickou cirkulaci [44,45]. V hemodynamických studiích byl s pozitivním výsledkem na snížení HVPG testován efekt propanololu, nadololu, timololu, mepindololu a carvedilolu [43]. Největší množství dat pochází ze studií s propranololem. Jako nejúčinnější na snížení portálního tlaku se dnes ale jeví carvedilol působící i jako α1-antagonista [43,46], který je účinnější u vyššího procenta nemocných než propranolol (31 vs. 43 %) [43]. Jako další prospěšný efekt je popisován jeho antioxidační, antifibrotický a protizánětlivý účinek [47–49]. Naopak, známky endoteliální dysfunkce by mohly sloužit i jako možné ukazatele odpovědi na léčbu [50]. Použití carvedilolu v klinické praxi je ale spojeno s možným vyšším rizikem nežádoucích účinků [51]. Proto dávku zvyšujeme pozvolna dle tolerance. Většinou začínáme dávkou 3,125 mg 2× denně s cílovou dávkou 6,25 mg 2× denně. V ČR podporuje použití carvedilolu i jeho dostupnost na rozdíl od ostatních výše jmenovaných neselektivních β-blokátorů.
V klinické praxi se v indikaci β-blokátoru řídíme pokročilostí jaterního onemocnění, přidruženými chorobami, snášenlivostí, ale zejména aktuálním endoskopickým nálezem.
Velmi rozporuplné jsou názory na profylaktickou léčbu neselektivním β-blokátorem u nemocných bez varixů (preprimární prevence). Jsou sice data ukazující, že tento postup může bránit rozvoji varixů u nemocných s HVPG nad 10 mm Hg, kteří odpoví na léčbu β-blokátorem snížením HVPG alespoň o 10 % [52]. Plošné podávání β-blokátoru u této skupiny nemocných ale v současné době doporučeno není [2,5].
U nemocných s malými varixy (F1) ještě bez přítomnosti dalších rizikových faktorů (červené známky na varixech, Child-Pugh C) je benefit z profylaktické léčby neselektivním β-blokátorem z části dokumentován a v současné době je akceptován jako spíše prospěšný [2,5]. K terapii neselektivním β-blokátorem jsou jistě již indikováni nemocní s malými varixy a přítomností varovných známek na varixech nebo s větší pokročilostí jaterního onemocnění (skupina C dle Child-Pugh skóre). U nemocných se známou hodnotou HVPG převyšující 10 mm Hg bychom měli pravděpodobně postupovat obdobně [52] nebo alespoň zkrátit interval endoskopických kontrol.
U nemocných se signifikantními varixy (F2–F3) je v současné době podávání neselektivního β-blokátoru standardem. Jeho podávání vede ke snížení rizika krvácení (RR 0,54; 95% CI 0,39 ± 0,74, potřebný počet léčených pacientů (NNT – number needed to treat) 11) i snížení úmrtnosti (RR 0,75; 95% CI 0,57 ± 1,06) [53]. V případě použití propranololu je možným ukazatelem efektivnosti naší léčby z části dosažení bazální srdeční frekvence 55 pulzů/min či snížení klidové frekvence o 20 % proti vstupním hodnotám. V případě terapie carvedilolem tyto ukazatele odpovědi přínosné nejsou. Optimálním přístupem by byla řízená terapie na podkladě měření HVPG s ověřením efektu léčby, které ale v plošném měřítku dosud brání dostupnost invazivního měření. Ověření poklesu HVPG pod 12 mm Hg nebo snížení alespoň o 20 % proti výchozím hodnotám je nejlepším ukazatelem odpovědi na léčbu a adekvátní prevence. Poměrně velká část nemocných na podání β-blokátoru poklesem HVPG neodpoví (dle zvoleného preparátu 46–75 %) [1,2,50,52,53]. Přidání izosorbid 5-mononitrátu do terapie vedlo dle některých studií k dalšímu snížení rizika krvácení [54]. Bylo však spojeno s vyšším výskytem nežádoucích účinků a vliv na úmrtnost prokázán nebyl. V současné době v primární prevenci jeho přidání do kombinace doporučováno není [2,5].
Alternativou k farmakoterapii u nemocných s kontraindikací či intolerancí terapie β-blokátorem je endoskopická ligace jícnových varixů. Data ukazují, že použití ligace snižuje riziko krvácení v průměru o 64 % (RR 0,36; 95% CI 0,26–0,5; NNT 4), úmrtnost na krvácení o 80 % (RR 0,20; 95% CI 0,11–0,39; NNT 7) i úmrtnost celkovou (RR 0,55; 95% CI 0,43–0,71; NNT 5) [55]. V meta- analýzách v porovnání s farmakoterapií je pak stejně efektivní ve snížení úmrtnosti a spíše efektivnější ve snížení rizika krvácení [42] za cenu vyššího rizika závažnějších komplikací [5]. Některé studie dokonce prokazovaly snížení úmrtnosti v porovnání s terapií β-blokátorem, ale mutlivariantní analýza tento závěr nepotvrdila [42]. Ekonomická náročnost obou metod je ve světovém měřítku též spíše srovnatelná, i proto je preferován individuální přístup.
Sekundární prevence
Po první epizodě krvácení jsou nemocní v horizontu dvou let vystaveni riziku recidivy krvácení v 60–63 % [56]. Z tohoto důvodu je u všech nemocných indikována neodkladná sekundární prevence v kombinaci farmakoterapie β-blokátorem a endoskopickou eradikací varixů pomocí ligace.
V roce 2004 byla ale publikována první práce dokumentující pozitivní efekt časného snížení portosystémového gradientu u rizikových nemocných pomocí TIPS. Ve skupině nemocných s HVPG > 20 mm Hg měřeným do 72 hod po atace krvácení byl dokumentován jasný pozitivní efekt zavedení časného TIPS již po první atace krvácení (do 72 hod). V této studii se prokázalo nejen snížené riziko recidivy krvácení, ale i snížení jak časné, tak roční úmrtnosti [57]. V následujících 11 letech pak byly uspořádány a publikovány další dvě multicentrické studie již definující rizikové pacienty na podkladě klinických dat. I v těchto studiích na skupinách 63 a 75 nemocných [58,59] byl prokázán pozitivní efekt časného TIPS (ePTFE – expandovaný polytetrafluoroetylen) se zlepšeným přežíváním nemocných v horizontu šesti týdnů (97 vs. 67 %, NNT 3,3) i jednoho roku (86 vs. 61 %, NNT 4,0) [58] v porovnání se standardní sekundární prevencí. Je nutno zdůraznit, že těchto dobrých výsledků bylo dosaženo v selektované skupině s vyloučením nemocných s trombózou porty, HCC přesahující milánská kritéria, závažnějším srdečním selháváním a významnou renální insuficiencí (kreatin > 265 µmol). Indikace časného TIPS je od roku 2010, kdy byla prvně uvedena v doporučeních z Bavena, ve většině evropských center již akceptována [5].
V případě, že indikace k časnému zavedení TIPS není, pokračujeme ve standardní sekundární profylaxi.
Farmakoterapie neselektivním β-blokátorem, stejně jako v primární prevenci, snižuje riziko recidivy krvácení v průměru z 60–63 na 42 % spolu se signifikantním snížením letality (z 27 na 20 %) [56]. Nejlepších výsledků však bylo dosaženo kombinovanou terapií s endoskopickou ligací jícnových varixů [60,61]. Skleroterapie pro vysoký výskyt komplikací (až 14 %) spolu s vyšším počtem sezení nutných k dosažení eradikace není v současné době již preferovaným přístupem. Výsledky z multivariantní analýzy ukazují, že výhodu neskýtá ani kombinace skleroterapie a ligace [1,2].
V případě, že nemocný nemůže být současně léčen β-blokátorem, není dnes endoskopická léčba jako monoterapie doporučována a nemocný by měl být indikován k zavedení TIPS [5].
Problematická je skupina s pokročilejším jaterním onemocněním ve skupině B a C dle Child-Pughovy klasifikace, zejména pak nemocní s refrakterním ascitem. Objevuje se stále více prací prokazujících i negativní efekt β-blokátoru u těchto nemocných s rizikem zhoršení oběhových parametrů a zkráceným přežíváním [62–65]. Tento pohled reflektují i poslední doporučení z Bavena doporučující u nemocných s refrakterním ascitem velmi bedlivou monitoraci hodnot krevního tlaku, sérového sodíku a kreatitnu s včasnou redukcí dávky β-blokátoru nebo jeho vysazením v případě horšení těchto parametrů [5].
Žaludeční varixy
Žaludeční varixy se vytvářejí u 5–33 % nemocných s portální hypertenzí a zdrojem krvácení jsou v 5–10 % (25% riziko krvácení v horizontu dvou let) [66]. U žaludečních varixů má prognostický význam kromě rozlišení velikosti varixu, pokročilosti jaterního onemocnění (Child-Pughova klasifikace) a přítomnosti varovných známek také lokalizace varixu [67]. K jejich popisu je v současné době nejčastěji užívána klasifikace dle Sarina [68]. Z prognostického hlediska jsou nejzávažnějším nálezem izolované gastrické varixy (IGV) v oblasti žaludečního fundu (IGV 1. typu), které jsou zdrojem krvácení až v 78 % [67,68].
Léčba krvácení
V případě akutního krvácení z varixu žaludku je základní léčba vč. farmakoterapie identická jako u krvácení z varixů jícnových. Odlišná je však léčba endoskopická, při které je za metodu volby u gastroezofagealních varixů 2. typu (GOV II) a IGV považováno použití okluze krvácejícího varixu syntetickým či přirozeným tkáňovým lepidlem [1,2,5]. Nejlépe zdokumentovaný efekt je při užití syntetického N-butyl-2-cyanoakrylátu (Histoacryl®) [69,70]. U gastroezofageálních varixů 1. typu (GOV I) lze někdy provést i ligaci. Z podstaty problému nelze jako záchrannou léčbu použít dedikovaný jícnový stent nebo klasickou Blakemor-Sengstakenovu balonkovou sondu, ale sondu jednobalonkovou (Linton-Nichlasova). Svou roli zde opět sehrává TIPS [2,5,71].
Data pro primární i sekundární prevenci jsou bohužel chudší než u varixů jícnových.
U GOV I varixů v primární prevenci můžeme volit mezi léčbou β-blokátorem a léčbou endoskopickou. Po endoskopické léčbě jícnových varixů dochází v některých případech k vymizení často asociovaných GOV I (30–60 %) a GOV II (20 %). Proto je při souběhu těchto nálezů doporučováno začít eradikací varixů jícnových a v léčbě varixů žaludečních pokračovat až tehdy, pokud po šesti týdnech od ošetření nedojde k jejich vymizení. V sekundární prevenci volíme mezi farmakoterapií a endoskopií nebo TIPS [2,5].
V případě GOV II a IGV v primární prevenci můžeme volit mezi léčbou endoskopickou s aplikací tkáňového lepidla a léčbou neselektivním β-blokátorem [5], v sekundární prevenci je pak doporučováno zavedení TIPS nebo pokračování v endoskopické eradikaci aplikací tkáňového lepidla[2,5].
Zkratky
HVPG –gradient mezi volným a zaklíněným tlakem v jaterní žíle
NSBB – neselektivní β-blokátor
EVL – endoskopická ligace varixů
ePTFE – expandovaný polytetrafluoroetylen (stent potažený ePTFE)
NNT – potřebný počet léčených pacientů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Doručeno/Submitted: 24. 2. 2016
Přijato/Accepted: 2. 4. 2016
MUDr. Tomáš Fejfar, Ph.D.
II. interní gastroenterologická klinika
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
fejfatom@seznam.cz

Literatura
1. De Franchis R et al. Portal hyperten- sion IV. Proceedings of the Fourth Baveno International Consensus Workshop. London: Blackwell Publishing Ltd. 2006.
2. De Franchis R et al. Portal Hyperten- sion V. Proceedings of the Fifth Baveno International Consensus Workshop. London: Blackwell Publishing Ltd. 2011.
3. North Italian Endoscopic Club for Study and Treatment of Esophageal Varices. Prediction of the first variceal haemorrhage in patiens with cirrhosis of the liver and esophageal varices. A prospective multicenter study. N Engl J Med 1988; 319 (15): 983–989.
4. Carbonell N, Pauwels A, Sarfaty L et al. Improved survival after variceal bleeding in patients with cirrhosis over the past two decades. Hepatology 2004; 40 (3): 652–659.
5. De Franchis R. Baveno VI Faculty. Expanding consensus in portal hypertension: report of the Baveno VI Consensus Workshop: stratifying risk and individualizing care for portal hypertension. J Hepatol 2015; 63 (3): 743–752. doi: 10.1016/j.jhep.2015.05.022.
6. Villanueva C, Colomo A, Bosch A et al. Transfusion strategies for acute upper gastrointestinal bleeding. N Engl J Med 2013; 368 (1): 11–21. doi: 10.1056/NEJMoa 1211801.
7. Bosch J, Thabut D, Albillos A et al. Recombinant factor VIIa for variceal bleeding in patients with advanced cirrhosis: a randomised, controlled trial. Hepatology 2008; 47 (5): 1604–1614. doi: 10.1002/hep.22216.
8. Bendtsen F, D’Amico G, Rusch E et al. Effect of recombinant Factor VIIa on outcome of acute variceal bleeding: an individual patient based meta-analysis of two controlled trials. J Hepatol 2014; 61 (2): 252–259. doi: 10.1016/j.jhep.2014.03.035.
9. Goulis J, Armonis A, Patch D et al. Bacterial infection is independently associated with failure to control bleeding in cirrhotic patients with gastrointestinal hemorrhage. Hepatology 1998; 27 (5): 1207–1212.
10. Bernard B, Grangé JD, Khac EN et al. Antibiotic prophylaxis for the prevention of bacterial infections in cirrhotic patients with gastrointestinal bleeding: a meta-analysis. Hepatology 1999; 29 (6): 1655–1661.
11. Soares-Weiser K, Brezis M, Tur-Kaspa R et al. Antibiotic prophylaxis for cirrhotic patients with gastrointestinal bleeding. Cochrane Database Syst Rev 2002; 9 (2): CD002907.
12. Chavez-Tapia NC, Barrientos-Gutierrez T, Tellez-Avila FI et al. Antibiotic prophylaxis for cirrhotic patients with upper gastrointestinal bleeding. Cochrane Database Syst Rev 2010; 8 (9): CD002907. doi: 10.1002/14651858.CD002907.pub2.
13. Tandon P, Abraldes JG, Keough A et al. Risk of bacterial infection in patients with cirrhosis and acute variceal hemorrhage, based on Child-Pugh class, and effects of antibiotics. Clin Gastroenterol Hepatol 2015; 13 (6): 1189–1196. doi: 10.1016/j.cgh.2014.11.019.
14. American Association for the Study of Liver Diseases; European Association for the Study of the Liver. Hepatic encephalopathy in chronic liver disease: 2014. Practice guideline by the European Association for the Study of the Liver and the American Association for the Study of Liver Diseases. J Hepatol 2014; 61 (3): 642–659. doi: 10.1016/j.jhep.2014.05.042.
15. Vilstrup H, Amodio P, Bajaj J et al. Hepatic encephalopathy in chronic liver disease: 2014 Practice Guideline by the American Association for theStudy of Liver Diseases and the European Association for the Study of the Liver. Hepatology 2014; 60 (2): 715–735. doi: 10.1002/hep.27210.
16. Hůlek P, Krajina A (eds). Current Practice of TIPS. Hradec Králové: Olga Štambergová 2001.
17. Merkel C, Gatta A, Bolognesi M et al. Hemodynamic changes of systemic, hepatic and splenic circulation following triglycyl-lysin-vasopressin administration in alcoholic cirrhosis. Dig Dis Sci 1988; 33 (9): 1103–1109.
18. Møller S, Hansen EF, Becker U et al. Central and systemic haemodynamic effect of terlipressin in portal hypertensive patients. Liver 2000; 20 (1): 51–59.
19. Ioannou G, Doust J, Rockey DC. Terlipressin for acute esophageal variceal hemorrhage. Cochrane Database Syst Rev 2003; 1: CD002147.
20. Wells M, Chande N, Adams P. Meta-analysis: vasoactive medications for the management of acute variceal bleeds. Aliment Pharmacol Ther 2012; 35 (11): 1267–1278. doi: 10.1111/j.1365-2036.2012.05088.x.
21. Yim SY, Seo YS, Jung CH et al. Risk factors for developing hyponatremia during terlipressin treatment: a retrospective analyses in variceal bleeding. J Clin Gastroenterol 2015; 49 (7): 607–712. doi: 10.1097/MCG.0000000000000217.
22. Moitinho E, Planas R, Banares R et al. Multicenter randomised controlled trial comparing different schedules of somatostatin in the treatment of acute variceal bleeding. J Hepatol 2001; 35 (6): 712–718.
23. Vilanueva C, Planella M, Arycil C et al. Hemodynamic effects of terlipressin and high somatostatin dose during acute variceal bleeding in nonresponders to the usual somatostatin dose. Am J Gastroenterol 2005; 100 (3): 624–630.
24. Seo YS, Park SY, Kim MY et al. Lack of difference among terlipressin, somatostatin, and octreotide in the control of acute gastroesophageal variceal hemorrhage. Hepatology 2014; 60 (3): 954–963. doi: 10.1002/hep.27006.
25. D’Amico G, Pietrosi G, Tarantino I et al. Emergency sclerotherapy versus vasoactive drugs for variceal bleeding in cirrhosis: a Cochrane meta-analysis. Gastroenterology 2003; 124 (5): 1277–1291.
26. D’Amico G, Pagliaro L, Pietrosi G et al. Emergency sclerotherapy versus vasoactive drugs for variceal bleeding in cirrhotic patients. Cochrane Database Syst Rev 2010; 3: CD002233. doi: 10.1002/14651858. CD002233.pub2.
27. Bai Y, Guo JF, Li ZS. Meta-analysis: erythromycin before endoscopy for acute upper gastrointestinal bleeding. Aliment Pharmacol Ther 2011; 34 (2): 166–171. doi: 10.1111/j.1365-2036.2011.04708.x.
28. Theivanayagam S, Lim RG, Cobell WJ et al. Administration of erythromycin before endoscopy in upper gastrointestinal bleeding: a meta-analysis of randomized controlled trials. Saudi J Gastroenterol 2013; 19 (5): 205–210. doi: 10.4103/ 1319-3767.118120.
29. Lo GH, Lai KH, Cheng JS et al. Emergency banding ligation versus sclerotherapy for the control of active bleeding from esophageal varices. Hepatology 1997; 25 (5): 1101–1104.
30. Villanueva C, Piqueras M, Aracil C at al. A randomized controlled trial comparing ligation and sclerotherapy as emergency endoscopic treatment added to somatostatin in acute variceal bleeding. J Hepatol 2006; 45 (4): 560–567.
31. Bañares R, Albilos A, Rincon D et al. Endoscopoc treatment versus endoscopic plus pharmacologic treatment for acute variceal bleeding: a meta-analysis. Hepatology 2002; 35 (3): 609–615.
32. Abraldes JG, Villanueva C, Bañares R et al. Hepatic venous pressure gradient and prognosis in patients with acute variceal bleeding treated with pharmacologic and endoscopic therapy. J Hepatol 2008; 48 (2): 229–236.
33. D’Amico G, De Franchis R. Upper digestive bleeding in cirrhosis. Posttherapeutic outcome and prognostic indicators. Hepatology 2003; 38 (3): 599–612.
34. Cárdenas A, Ginès P, Uritz J et al. Renal failure after upper gastrointestinal bleeding in cirrhosis: incidence, clinical course, predictive factors and short-term prognosis. Hepatology 2001; 34 (4 Pt 1): 671–676.
35. Avgerinos A, Armonis A. Balloon tamponade technique and efficacy in variceal haemorrhage. Scand J Gastroenterol Suppl 1994; 207: 11–16.
36. Zehetner J, Shamiyeh A, Wayand W et al. Results of a new method to stop acute bleeding from esophageal varices: implantation of a self-expanding stent. Surg Endosc 2008; 22 (10): 2149–2152. doi: 10.1007/s00464-008-0009-7.
37. Wright G, Lewis H, Hogan B et al. A self-expanding metal stent for complicated variceal hemorrhage: experience at a single center. Gastrointest Endosc 2010; 71 (1): 71–78. doi: 10.1016/j.gie.2009.07.028.
38. Fejfar T, Šafka V, Jirkovský V et al. Danišův jícnový stent v terapii varikózního krvácení. Gastroent Hepatol 2013; 67 (2): 98–103.
39. Sanyal AJ, Freedman AM, Luketic VA et al. Transjuglar intrahepatic portosystemic shunts for patients with active variceal hemorrhage unresponsive to sclerotherapy. Gastroenterology 1996; 111 (1): 138–146.
40. Chau TN, Patch D, Chan YW et al. “Salvage“ transjugular intrahepatic portosystemic shunts: gastric fundal compared with esophageal variceal bleeding. Gastroenterology 1998; 114 (5): 981–987.
41. Krajina A, Hulek P, Fejfar T et al. Quality improvement guidelines for Transjugular Intrahepatic Portosystemic shunt (TIPS). Cardiovasc Intervent Radiol 2012; 35 (6): 1295–1300. doi: 10.1007/s00270- 012-0493-y.
42. Gluud LL, Krag A. Banding ligation versus beta-blockers for primary prevention of oesophageal verices in adults. Cochrane Database Syst Rev 2012; 8: CD004544. doi: 10.1002/14651858.CD004544.pub2.
43. Tripathi D, Hayes PC. Beta-blockers in portal hypertension: new developments and controversies. Liv Intern 2014; 34 (5): 655–667. doi: 10.1111/liv.12360.
44. Ohnishi K, Nakayama T, Saito M et al. Effects of propranolol on portal hemodynamics in patients with chronic liver disease. Am J Gastroenterol 1985; 80 (2): 132–135.
45. Mastai R, Bosch J, Navasa M et al. Effects of alpha-adrenergic stimulation and beta-adrenergic blockade on azygos blood flow and splanchnic haemodynamics in patients with cirrhosis. J Hepatol 1987; 4 (1): 71–79.
46. Sinagra E, Perricone G, D’Amico M et al. Systematic review with meta-analysis: the haemodynamic effects of carvedilol compared with propranolol for portal hypertension in cirrhosis. Aliment Pharmacol Ther 2014; 39 (6): 557–568. doi: 10.1111/apt.12634.
47. Akbas H, Ozden M, Kanko M et al. Protective antioxidant effects of carvedilol in a rat model of ischaemia-reperfusion injury. J Int Med Res 2005; 33 (5): 528–536.
48. Hamdy N, El-Demerdash E. New therapeutic aspect for carvedilol: antifibrotic effects of carvedilol in chronic carbon tetrachloride-induced liver damage. Toxicol Appl Pharmacol 2012; 261 (3): 292–299. doi: 10.1016/j.taap.2012.04.012.
49. Bakris GL, Fonseca V, Katholi RE et al. Metabolic effects of carvedilol vs metoprolol in patients with type 2 diabetes mellitus and hypertension: a randomized controlled trial. JAMA 2004; 292 (18): 2227–2236.
50. Bruha R, Vitek L, Petrtyl J et al. Effect of carvedilol on portal hypertension depends on the degree of endothelial activation and inflammatory changes. Scand J Gastroenterol 2006; 41 (12): 1454–1463.
51. Lo GH, Chen WC, Wang HM et al. Randomized, controlled trial of carvedilol versus nadolol plus isosorbide mononitrate for the prevention of variceal rebleeding. J Gastroentol Hepatol 2012; 27 (11): 1681–1687. doi: 10.1111/j.1440-1746.2012.07244.x.
52. Groszmann RJ, Garcia-Tsao G, Bosch J et al. Beta-blockers to prevent gastroesophageal varices in patients with cirrhosis. N Engl J Med 2005; 353 (21): 2254–2261.
53. Vlachogiannakos J, Goulis J, Patch D et al. Review article: primary prophylaxis for portal hypertensive bleeding in cirrhosis. Aliment Pharmacol Ther 2000; 14 (7): 851–860.
54. Tripathi D, Hayes PC. Review article: a drug therapy for the prevention of variceal haemorrhage. Aliment Pharmacol Ther 2001; 15 (3): 291–310.
55. Imperiale T, Chalasani N. A meta-analysis of endoscopic variceal ligation for primary prophylaxis of esophageal variceal bleeding. Hepatology 2001; 33 (4): 802–807.
56. Grace N, Lo GH, Nevens F et al. Preventing rebleeding in 2010. In: De Franchis R et al. Portal Hypertension V. Proceedings of the Fifth Baveno International Consensus Workshop. London: Blackwell Publishing Ltd. 2011.
57. Monescillo A, Martínez-Lagares F, Ruiz-del-Arbol L et al. Influence of portal hypertension and its early decompression by TIPS placement on the outcome of variceal bleeding. Hepatology 2004; 40 (4): 793–801.
58. García-Pagán JC, Caca K, Bureau C et al. Early use of TIPS in patients with cirrhosis and variceal bleeding. N Engl J Med 2010; 362 (25): 2370–2379. doi: 10.1056/ NEJMoa0910102.
59. Garcia-Pagán JC, Di Pascoli M, Caca K et al. Use of early-TIPS for high-risk variceal bleeding: results of a post-RCT surveillance study. J Hepatol 2013; 58 (1): 45–50. doi: 10.1016/j.jhep.2012.08.020.
60. Lo GH, Lai KW, Cheng JS et al. Endoscopic variceal ligation plus nadolol and sucralfate compared with ligation alone for the prevention of variceal rebleeding: a prospective, randomised trial. Hepatology 2000; 32 (3): 462–465.
61. de la Peña J, Brullet E, Sanchez-Hernández E et al. Variceal ligation plus nadolol compared with ligation for prophyla for prophylaxis of variceal rebleeding: a multicenter trial. Hepatology 2005; 41 (3): 572–578.
62. Sersté T, Francoz C, Durand F et al. Beta-blockers cause paracentesis-induced circulatory dysfunction in patients with cirrhosis and refraktory ascites: a cross-over study. J Hepatol 2011; 55 (4): 794–799. doi: 10.1016/j.jhep.2011.01.034.
63. Sersté T, Melot C, Francoz C et al. Deleterious effect of beta-blockers on survival in patients with cirrhosis and refractory ascites. Hepatology 2010; 52 (3): 1017–1022. doi: 10.1002/hep.23775.
64. Krag A, Wiest R, Albillos A et al. The window hypothesis: haemodynamic and non-haemodynamic effect of beta-blockers improve survival of patients with cirrhosis during a window in the disease. Gut 2012; 61 (7): 967–969. doi: 10.1136/gutjnl-2011-301348.
65. Ge PS, Runyon BA. The changing role of beta-blocker therapy in patients with cirrhosis. J Hepatol 2014; 60 (3): 643–653. doi: 10.1016/j.jhep.2013.09.016.
66. Garcia-Tsao, Sanyal AJ, Grace ND et al. Prevention and managament of gastroesophageal varices and variceal hemorrhage in cirrhosis. Hepatology 2007; 46 (3): 922–938.
67. Ryan BM, Stockbrugger RW, Ryan JM. A pathophysiologic, gastroenterologic and radiologic approach to the managament of gastric varices. Gastroenterology 2004; 126 (4): 1175–1189.
68. Sarin SK, Kumar A. Gastric varices: profile, classification and management. Am J Gastroenterol 1989; 84 (10): 1244–1249.
69. Lo GH, Lai KH, Cheng JS et al. A prospective randomized trial of butyl cyanoacrylate injection versus band ligation in the management of bleeding gastric varices. Hepatology 2001; 33 (5): 1060–1064.
70. Tan PC, Hou MC, Lin HC et al. A randomized trial of endoscopic treatment of acute gastric variceal haemorrhage: N-butyl-2-cyanoacrylate injection versus band ligation. Hepatology 2006; 43 (4): 690–697.
71. Tripathi D, Therapondos G, Jackson E et al. The role of the transjugular intrahepatic portosystemic stent shunt (TIPSS) in the management of bleeding gastric varices: clinical and haemodynamic correlations. Gut 2002; 51 (2): 270–274.