Karcinom pankreatu z pohledu pacienta
Miroslav Ryska1
+ Pracoviště
Souhrn
Duktální adenokarcinom pankreatu je v současnosti velkým zdravotním problémem tzv. rozvinutých zemí. Naše populace dosahuje v posledních statistikách první místo v incidenci v Evropě, která bude do roku 2030 dvojnásobná. Radikální resekce je v kombinaci s adjuvantní chemoterapií jedinou léčbou s kurativním záměrem. Z významné pokročilosti onemocnění při prvních symptomech onemocnění však rezultuje nízká úspěšnost léčby. Je proto velmi důležité dodržovat racionální diagnosticko-terapeutický postup a co nejdříve zařadit multidisciplinárním týmem pacienta do vhodné skupiny: primárně resekovatelný, borderline resekovatelný, neresekovatelný (lokálně pokročilý nebo metastazující) – a zahájit adekvátní terapii. Předkládané sdělení si klade za cíl seznámit čtenáře s pravděpodobným postojem pacienta nacházejícího se v různých fázích onemocnění a léčebných skupinách.
Klíčová slova
diagnostika, karcinom pankreatu, pohled pacienta, terapieÚvod
Duktální adenokarcinom pankreatu (PC – pancreatic cancer), s nejhorší prognózou, tvoří 85 % malignit tohoto orgánu. Zbytek připadá na vzácné primární tumory, malignizované cystické tumory, neuroendokrinní tumory a sekundární metastatická postižení. V širším klinickém pohledu lze mezi malignity hlavy pankreatu počítat i karcinom distálního žlučovodu a maligní ampulom – vyžadují shodnou chirurgickou terapii a přístup. Ampulom má oproti PC a karcinomu žlučových cest výrazně lepší prognózu.
PC je považován za velký zdravotní problém tzv. rozvinutých zemí. V současné době incidence, v závislosti na geografickém regionu, přesahuje 15–20 nových případů/100 000 obyvatel. V ČR se tak ročně jedná o 2 100 nových onemocnění. Naše populace dosahuje v posledních statistikách první místo v incidenci v Evropě [1]. Očekává se, že incidence do roku 2030 by mohla být oproti dnešku více než dvojnásobná. Nehledě ke skutečnosti, že prevalence oproti incidenci v posledním období dle dat Národního onkologického registru (NOR) narůstá, PC by tak mohl být jednou z nejčastější příčiny úmrtí na solidní zhoubný nádor v průběhu následujících 10–15 let.
V posledním období je patrná zjevná snaha o vytvoření optimálního diagnosticko-léčebného postupu. Vzniká celá řada doporučení [2–6]. Pohled pacienta však může být mnohdy výrazně odlišný od lékaře, se kterým se v průběhu léčby setkává – praktického lékaře, gastroenterologa, chirurga, onkologa či radioterapeuta. Vzhledem k absenci tohoto pohledu v naší odborné literatuře si dovolím na základě vlastní klinické praxe tento pohled představit, a to i s vědomím, že se nemusí jednat o všeobecně platnou zkušenost.
Rozdělení nemocných na základě terapie
Nejefektivnější léčebnou modalitou s kurativním záměrem u nemocného s PC je radikální odstranění postižené části slinivky se standardní lymfadenektomií [7], a to v podobě pankreatoduodenektomie nebo levostranné pankreatektomie se splenektomií, v závislosti na lokalizaci nádoru. Totální pankreatektomie je u PC indikována poměrně výjimečně, asi v 11 % [8].
Členění pacientů podle lokální pokročilosti či přítomnosti diseminace odpovídá současným možnostem resekci provést
Neresekabilní nález (U – unresectable) – přibližně u 65 % pacientů s PC se jedná o lokálně neresekabilní nádor či o přítomnost diseminace (M1). U této skupiny nemocných je indikována, v závislosti na celkovém zdravotním stavu nemocného (PS – performance status) nebo po dohodě s pacientem, paliativní chemoterapie či symptomatická léčba (zejména analgetická se zajištěním žlučové drenáže při stenóze terminálního choledochu). U paliativní chemoterapie je podmínkou morfologické vyšetření nádoru. Nejvhodnější je endoultrasonografie (endoUS) s tenkojehlovou biopsií (FNAB – fine needle aspiration biopsy). Pacient, po uvědomění si svého zdravotního stavu, většinou reaguje slovy „tak to jsem už bez šance“ a jeho otázky se týkají především odhadu délky života, možnosti odstranění bolesti, příjmu potravy a tekutin. Mnohdy u něj přetrvává pochybnost, zda opravdu nejde účinně pomoci. Část nemocných se s diagnózou vnitřně nesmíří. Podstatné je zajistit vedle účinné žlučové drenáže u lokalizace PC v hlavě pankreatu především analgetickou terapii a zmírnit pocit, že zdravotnický systém na takového pacienta nemá čas. V praxi se s nezájmem pacienti této skupiny setkávají bohužel často.
Borderline resekabilní nález (BR) – na základě výsledku zobrazovacích metod lze u cca 15 % nemocných lokální pokročilost hodnotit jako hraničně resekabilní na základě tzv. borderline konceptu [9], a to z důvodů žilní či arteriální angioinvaze. Podmínkou dalšího postupu je též morfologické potvrzení přítomnosti PC. Výsledek následné neoadjuvantní chemoradioterapie (v současné době upřednostňovaný FOLFIRINOX) se zhodnotí pomocí tzv. restagingového CT v podobě multidetektorové výpočetní tomografie (MDCT). Regrese nádoru (v USA) či absence jeho progrese (v Evropě) znamená u přibližně 30 % pacientů této skupiny indikaci k resekčnímu výkonu [10]. Délka přežívání nemusí být výrazně horší než u primární resekce. U 70 % nemocných s negativní odpovědí na neoadjuvantní terapii lze pokračovat v paliativní chemoterapii nebo převést pacienta na symptomatickou léčbu. Po sdělení lokální pokročilosti s návrhem neoadjuvantní terapie převažuje naděje a sám pacient většinou žádá provést maximum s výhledem na resekční výkon. Proto se sám snaží, aby terapie byla zahájena co nejdříve.
Primární resekci (R – resectable) lze provést u přibližně 20 % nemocných, u kterých angioinvaze není předoperačně prokázána. Na některých pracovištích do této skupiny zařazují i pacienty s ohraničenou nádorovou infiltrací portomezenterického žilního segmentu [11]. I u této skupiny nemocných představuje podání neoadjuvantní chemoradioterapie určité výhody, u nás se však v souladu se současnou evropskou klinickou praxí mimo klinické studie nepodává. Cílem chirurga je radikální resekce s minimálním rizikem časné pooperační mortality a morbidity. Nicméně časnou pooperační komplikaci zaznamenáme u více než poloviny nemocných. Úsilí je nasměrováno na co nejrychlejší její řešení a na co nejmenší prodloužení průměrné doby hospitalizace, aniž bychom ohrozili pacienta.
Pacienti této skupiny se především dotazují na detaily operace, možné komplikace, délku hospitalizace a pooperační životosprávu s výhledem na délku přežití, event. nutnost podávání adjuvantní chemoterapie a její účinnost.
Většinu nemocných s PC lze zařadit do jedné z výše uvedených skupin.
Pokládané otázky
Při vysloveném podezření na karcinom pankreatu lze dotazy nemocných rozdělit na následující oblasti:
- „Proč zrovna já?“, „Proč teď, když jsem se těšil, jak si užiji důchod?“
- „Mohl jsem něco udělat, abych neonemocněl?“
- „Proč onemocnění pokračuje tak rychle?“
- „Co je potřeba rychle udělat?“, „Co je pro mě teď nejdůležitější?“
- „Jakou mám šanci přežít?“
- „Neonemocní moje děti stejnou chorobou?“
Pojďme si najít stručné vysvětlení a odpovědi na prvních pět otázek, šestá otázka přesahuje rámec tohoto sdělení a znalosti autora.
Odpověď na otázku č. 1 – „Proč zrovna já?“, „Proč teď, když jsem se těšil, jak si užiji důchod?“
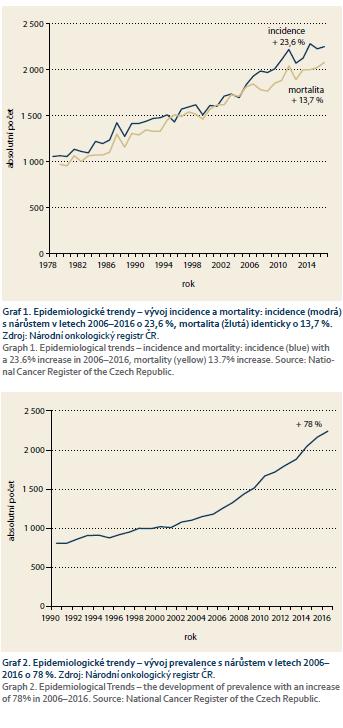
Epidemiologické trendy u PC jsou zřejmé z grafů 1 a 2. Je patrné, že nárůst prevalence je za posledních 10 let téměř dvojnásobný! Věkové rozložení znevýhodňuje seniory ve věku kolem 67–73 let, a je tudíž smutným vysvětlením dotazujících se pacientů „Proč teď?“. Věkové rozložení a stadium onemocnění nicméně potvrzují, že pokročilý nález znemožňující provést radikální resekční výkon je v této věkové kategorii podobný ostatním skupinám. Navíc podle predikce stárnutí české populace se výrazně zvyšuje podíl občanů starších 60/65 let s tím, že v roce 2030 dosáhne 30/25 %.
Odpověď na otázku č. 2 – „Mohl jsem něco udělat, abych neonemocněl?“
Hlavními negenetickými rizikovými faktory je kouření, diabetes, obezita a Helicobacter pylori [12]. V případě diabetu se jedná o T3cDM se zvyšující se inzulinovou rezistencí, hyperinzulinemií s normální glykemií, s funkční poruchou beta buněk, s insuficiencí hormonální glukózové regulace [13]. PC je spojeno v 68 % s diabetem – oproti ostatním malignitám, u kterých se diabetes vyskytuje v 15–20 %. Epidemiologická studie Maisonneuve et al [12] prokázala, že pokud by bylo vyloučeno kouření a eradikován Helicobacter pylori, 2/3 negenetických rizikových faktorů vzniku PC by bylo eliminováno. Chronická pankreatitida znamená výrazně vyšší riziko PC. Stále platí, že u části nemocných operovaných pro chronickou pankreatitidu patolog najde v resekované tkáni překvapivě PC [14].
Odpověď na výše uvedenou otázku je nasnadě – nekouřit, mít dostatečné množství pohybu, nebýt obézní, nebýt alkoholikem a vyvarovat se riziku vzniku pankreatitidy.
Odpověď na otázku č. 3 – „Proč onemocnění pokračuje tak rychle?“
Velmi zjednodušeně lze konstatovat, že na vzniku PC se podílí mutační aktivace onkogenů, především KRAS, inaktivace supresorových genů TP53, p16/CDKN2A, SMAD4 a inaktivace „genome maintenance“ hMLH1, MSH2 kontrolující opravu DNA chyb. Epiteliální buňky pankreatických vývodů umožní vznik klonální expanze, z acinárních buněk přes prekurzory vzniká infiltrativní karcinom. Celý proces vzniku subklonu s metastatickou kapacitou trvá řadu let [15,16]. Problémem je, že bezpříznakově. Pokud bychom našli cestu, jak předejít pokročilým formám PC s 5letým přežitím pouhých 8 % a nemocné operovat ve fázi Tis, přežití by mohlo dosáhnout až 75 % [17]. Odhad doby progrese ze stadia T1 do T4 činí okolo 14 měsíců [18]. Budoucí zavedení efektivního screeningu s odhalováním nekurzorových lézí však může znamenat obtížně řešitelný problém pro chirurgy. Budeme resekovat pankreas u bezpříznakového pacienta s rizikem současné operační mortality a vysoké pooperační morbidity?
Odpovědět na třetí otázku tak znamená vystavit pacienta frustraci vyvolané současnou úrovní našeho poznání, a tím i našich limitovaných terapeutických možností.
Odpověd na otázku č. 4 – „Co je potřeba rychle udělat?“, „Co je pro mě teď nejdůležitější?“
Při vyslovení podezření na PC na základě klinických příznaků (ztráty na váze, nespecifických dyspeptických obtíží, de novo diabetes mellitus, algického syndromu, obstrukčního ikteru) a diagnostického CT je nutné odeslat pacienta do centra (centrem je chápáno komplexní onkologické centrum spolupracující se zdravotnickými pracovišti, které se diagnostice a terapii nemocných s PC frekventně věnuje).
Po stanovení stagingu onemocnění (MDCT – pankreatický protokol) je pacient prezentován na multidisciplinárním týmu (MDT). Ten rozhodne v případě PC o dalším postupu pacienta: R, BR nebo U. Resekční výkon by měl být proveden co nejdříve.
V případě BR je nutné zavést v případě obstrukce žlučových cest endoskopicky stent a následně provést endoUS s FNAB a cytologicky verifikovat malignitu. Toto vysvětlení většinou pacienti akceptují. Poté po provedené neoadjuvantní chemoradioterapii na základě re-stagingového MDCT je třeba rozhodnout, zda indikovat resekční výkon s kurativním záměrem nebo pokračovat v chemoterapii s paliativním cílem, event. symptomaticky. V případě neresekabilního nálezu či diseminace lze na základě PS pacienta a po dohodě s ním pokračovat v paliativní chemoterapii či v symptomatické léčbě [19,20].
ERCP není v případě PC diagnostické. Je indikováno v případě ikteru s bilirubinem > 250 mmol/l (z naší zkušenosti spíše dříve, tj. > 150 mmol/l), při cholangoitidě, při verifikaci nádoru žlučových cest, při odložení resekčního výkonu (BR), při paliativní či symptomatické terapii a je spojeno s papilotomií a se zavedením biliárního stentu k účinné derivaci žluče [21].
ERCP, MRCP a pozitronová emisní tomografie (PET) jsou tak mnohdy zbytnými vyšetřeními [22]. V případě potřeby by měly být indikovány na základě rozhodnutí MDT. Stejně tak je mnohdy zbytná hospitalizace s léčbou ikteru infuzemi a dietou. Časté provádění těchto zbytných vyšetření je spojeno s prodloužením doby odeslání pacienta k adekvátní terapii, v některých případech i ke zbytečným komplikacím, které mohou léčbu pacienta s PC znemožnit [23].
Odpověď na otázku č. 5 – „Jakou mám šanci přežít?“
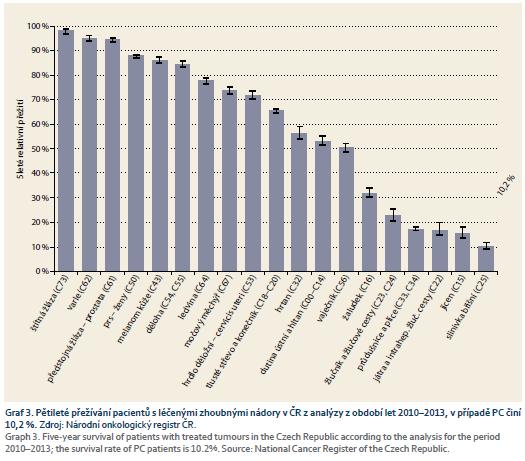
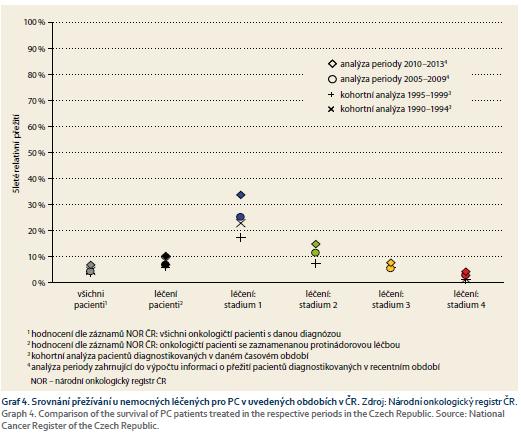
Přežití pacientů s léčenými zhoubnými nádory v ČR z analýzy z období let 2010–2013 je patrné z grafů 3 a 4. Je nutné zmínit, že za poslední desetiletí dochází v ČR k mírnému zlepšení 5tiletého přežívání. Pacient efektivně léčený v I. stadiu PC má podle údajů NOR v posledních letech v ČR pravděpodobnost 5tiletého přežití 33,7 % (95% CI 26,6–40,8), ve IV. stadiu pouze 4,2 % (95% CI 3,2–5,5). Zásadní podmínkou zlepšení šance nemocného s PC je zahájit léčbu v časnějším stadiu onemocnění, kdy lze provést resekční výkon.
Současnými příčinami časté beznaděje jak u pacientů s PC, tak i u části lékařů, jsou omezené možnosti prevence a časné diagnostiky, radikální resekce slinivky se vznikem časté recidivy v průběhu 12–24 měsíců po operaci, malá efektivita systémové protinádorové léčby a krátkodobé přežívání léčených nemocných s mediánem 18–23 měsíců a 5letým přežíváním menším než 10 % (data NOR). Alternativní metody léčby – protonová terapie, lokální chemoterapie, radiofrekvenční ablace a další – nedoznaly širšího klinického uplatnění.
Dodržení racionálního diagnostického postupu s včasným rozhodnutím MDT o adekvátní terapii a její provedení znamená nejen u části nemocných zlepšení šance na přežití, ale i zlepšení kvality života těch pacientů, u kterých nelze pro pokročilost onemocnění radikální resekční výkon provést [24]. Tímto postupem lze zmenšit podíl nemocných, kteří tráví zbývající část života ve zdravotnickém zařízení, mnohdy s klamnou nadějí na uzdravení.
Předneseno na 9. podzimním setkání gastroenterologů v Hluboké nad Vltavou dne 15. 9. 2018.
Za poskytnutá data NOR a ÚZIS patří poděkování prof. RNDr. L. Duškovi, Ph.D., řediteli ÚZIS. Práce byla podpořena MO 1012.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Doručeno/Submitted: 29. 9. 2018
Přijato/Accepted: 10. 10. 2018
prof. MUDr. Miroslav Ryska, CSc.
Chirurgická klinika 2. LF UK a ÚVN
U vojenské nemocnici 1200
160 00 Praha 6
miroslav.ryska@uvn.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Loveček M, Skalický P, Ryska M et al. Aktuální stav chirurgické léčby karcinomu pankreatu v České republice. Rozhl Chir 2016; 95 (4): 151–162.
2. Yamaguchi K, Okusaka T, Shimizu K et al. Clinical practice guidelines for pancreatic cancer 2016 from the Japan Pancreas Society: a synopsis. Pancreas 2017; 46: 595–604. doi: 10.1097/MPA.0000000000000816.
3. Pancreatic Adenocarcinoma, Version 2.2017, NCCN clinical practice guidelines in onkology. J Natl Compr Canc Netw 2017; 15 (8): 1028–1061. doi: 10.6004/jnccn.2017.0131.
4. van Rijssen LB, van der Geest LG, Bollen TL et al. National compliance to an evidence-based multidisciplinary guideline on pancreatic and periampullary carcinoma. Pancreatology 2016; 16: 133–137. doi: 10.1016/j.pan.2015.10.002.
5. Seufferlein T, Porzner M, Heinemann V et al. Ductal pancreatic adenocarcinoma. Dtsch Arztebl Int 2014; 111 (22): 396–402. doi: 10.3238/arztebl. 2014.0396.
6. Klinický standard pro diagnostiku a léčbu pa-cientů se zhoubným onemocněním pankreatu. Národní sada klinických standardů. Národní referenční centrum 2011. [online]. Dostupné z: https: //docplayer.cz/4052671-Odborna-cast-leden-2011-klinicky-standard-pro-diagnostiku-a-lecbu-pacientu-se-zhoubnym-onemoc-nenim-pankreatu-narodni-sada-klinickych-stan-dardu.html.
7. Glanemann M, Shi B, Liang F et al. Surgical strategies for treatment of malignit pancreatic tumors: extended, standard or local surgery? World J Surg Oncol 2008; 6: 123. doi: 10.1186/1477-7819-6-123.
8. Ryska M, Rudiš J. Total pancreatectomy for pancreatic malignancy – from history to the present day. Rozhl Chir 2016; 95 (10): 345–349.
9. Bockhorn M, Uzunoglu FG, Adham M et al. Borderline resectable pancreatic cancer: a consensus statement by the International Study Group of Pancreatic Surgery (ISGPS). Surgery 2014; 155 (6): 977–988. doi: 10.1016/j.surg.2014.02.001.
10. Hackert T, Strobel O, Michalski CW et al. The TRIANGLE operation – radical surgery after neoadjuvant treatment for advanced pancreatic cancer: a single arm observational study. HPB (Oxford) 2017; 19 (11): 1001–1007. doi: 10.1016/j.hpb.2017.07.007.
11. de Geus SW, Evans DB, Bliss LA et al. Neoadjuvant therapy versus upfront surgical strategies in resectable pancreatic cancer: a Markov decision analysis. Eur J Surg Oncol 2016; 42 (10): 1552–1560. doi: 10.1016/j.ejso.2016.07. 016.
12. Maisonneuve P, Lowenfels AB. Risk factors for pancreatic cancer: a summary review of meta-analytical studies. Int J Epidemiol 2015; 44 (1): 186–198. doi: 10.1093/ije/dyu240.
13. Frič P, Škrha J, Šedo A et al. Early pancreatic carcinogenesis – risk factors, early symptoms, and the impact of antidiabetic drugs. Eur J Gastroenterol Hepatol 2016; 7: e19–e25. doi: 10.1097/MEG.0000000000000646.
14. Merdrignac A, Sulpice L, Rayar M et al. Pancreatic head cancer in patients with chronic pancreatitis. Hepatobiliary Pancreat Dis Int 2014; 13 (2): 192–197.
15. Yachida S, Jones S, Bozic I et al. Distant metastasis occurs late during the genetic evolution of pancreatic cancer. Nature 2010; 467 (7319): 1114–1117. doi: 10.1038/nature09515.
16. Yeo TP. Demographics, epidemiology, and inheritance of pancreatic ductal adenocarcinoma. Semin Oncol 2015; 42 (1): 8–18. doi: 10.1053/j.seminoncol.2014.12.002.
17. Kenner BJ, Chari ST, Maintra A et al. Early detection of pancreatic cancer – a defined future using lessons from other cancers: a white paper. Pancreas 2016; 45 (8): 1073–1079. doi: 10.1097/MPA.0000000000000701.
18. Yu J, Blackford AL, Dal Molin M et al. Time to progression of pancreatic ductal adenocarcinoma from low-to-high tumour stages. Gut 2015; 64 (11): 1783–1789. doi: 10.1136/ gutjnl-2014-308653.
19. De la Cruz MS, Young AP, Ruffin MT et al. Diagnosis and management of pancreatic cancer Am Fam Physician 2014; 89 (8): 626–632.
20. Ducreux M, Cuhna AS, Caramelia C et al. Cancer of the pancreas: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2015; 26 (Suppl 5): v56–v68. doi: 10.1093/annonc/mdv295.
21. Pietryga JA, Morgan DE. Imaging preoperatively for pancreatic adenocarcinoma. J Gastrointest Oncol 2015; 6 (4): 343–357. doi: 10.3978/ j.issn.2078-6891.2015.024.
22. Pisters PW, Hudec WA, Hess KR et al. Effect of praeoperative biliary decompression on pancreaticoduodenectomy – associated morbidity in 300 consecutive patients. Ann Surg 2001; 234: 47–55.
23. Cooper M, Newman NA, Ibrahim AM et al. Unnecessary tests and procedures in patients presenting with solid tumors of the pankreas. J Gastrointest Surg 2013; 17 (7): 1218–1223. doi: 10.1007/s11605-013-2213-6.
24. Ryska M, Dušek L, Pohnán R et al. Kvalita života je důležitým faktorem indikační rozvahy u nemocných s karcinomem pankreatu. Multicentrická prospektivní studie. Gastroent Hepatol 2012; 66 (4): 303–310.