Infekcie pri cirhóze pečene – naše skúsenosti
Lucia Mihaličová1, Zuzana Bališová1, Martin Janičko Orcid.org 2, Sylvia Dražilová1
+ Pracoviště
Souhrn
Infekcia je častou komplikáciou u pacientov s cirhózou pečene majúci vplyv na klinický priebeh a prognózu. V našej retrospektívnej analýze sme hodnotili 72 pacientov s cirhózou pečene hospitalizovaných na oddelení vnútorného lekárstva s JIS metabolickou Nemocnice Poprad. Počas hospitalizácie sme aktívne pátrali po infekčných komplikáciach. Infekčné komplikácie sme našli u 37 pacientov (51,38 %). Pacienti s alkoholovou chorobou pečene mali štatisticky signifikantne vyššiu incidenciu infekcií ako pacienti s inou príčinou cirhózy pečene (p = 0,031). Celkom 14 pacientov malo infekciu močových ciest, 11 infekciu dýchacích ciest, osem spontánnu baktériovú peritonitídu, jeden infekciu kože a mäkkých tkanív, jeden infekciu Clostridium difficile. Dvaja pacienti mali súčasne bronchopneumoniu a infekciu močových ciest. Medzi pacientami s infekciou a bez infekcie neboli štatisticky signifikantné rozdiely vo veku, pohlaví, trvaní hospitalizácie a mortalite. Infekčné komplikácie sú časté u pacientov s cirhózou pečene, hlavne vtedy, ak cirhóza je spôsobená alkoholovou chorobou pečene.
Klíčová slova
alkoholová choroba pečene, bronchopneumonia, cirhóza pečene, infekcia močového traktu, infekcie, spontánna baktériová peritonitídaÚvod
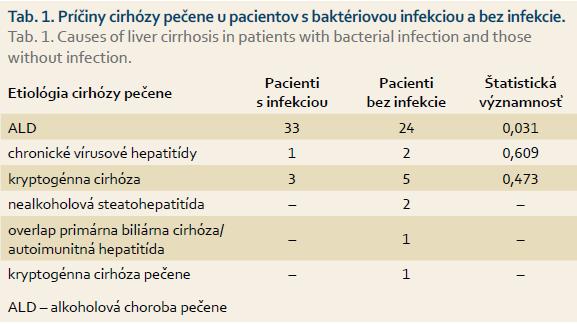
Cirhóza pečene je najčastejšou príčinou získanej imunodeficiencie, ktorá predstihne aj AIDS. Zároveň vzniká trvalá aktivácia imunitného systému s tvorbou zápalových mediátorov, označovaná ako CDAI (s cirhózou asociovaná imunitná dysfunkcia). Baktériové infekcie sú diagnostikované u 25–47 % hospitalizovaných pacientov s cirhózou pečene a sú najvýznamnejšou príčinou akútnej dekompenzácie pečeňovej choroby [1]. Spôsobujú asi 25 % úmrtí u pacientov s cirhózou pečene. Vznik infekcie u cirhotikov ovplyvňujú viaceré faktory: malnutrícia, stupeň pokročilosti pečeňovej choroby, krvácanie do gastrointestinálneho traktu, pridružené ochorenia ako diabetes mellitus, invazívne procedúry, nízka hladina albumínu v ascitickej tekutine a predchádzajúci atak spontánnej baktériovej peritonitídy (SBP) [1–3]. Najčastejšie sú močové infekcie, infekcie dýchacích ciest, SBP, spontánna bakteriémia a infekcie mäkkých tkanív. Cieľom našej práce je zhodnotiť výskyt infekcií u pacientov s cirhózou pečene hospitalizovaných na oddelení vnútorného lekárstva s JIS metabolickou Nemocnice Poprad v období od 1. 1. do 31. 12. 2014, ich vplyv na dĺžku hospitalizácie a mortalitu pacientov s cirhózou pečene.
Vlastné pozorovanie
V období od 1. 1. do 31. 12. 2014 bolo hospitalizovaných na oddelení vnútorného lekárstva s JIS metabolickou Nemocnice Poprad 72 pacientov s cirhózou pečene.
Všetkým pacientom sme po odobratí anamnézy a fyzikálneho vyšetrenia urobili RTG hrudníka. Pri podozrení na infekt dýchacích ciest (IDC) sme odobrali materiál na kultivačné vyšetrenie spúta. Pacientom sme odobrali do sterilnej skúmavky moč na kultivačné vyšetrenie po dezinfekcii ústia močovej rúry roztokom hypermangánu alebo z permanentného katétra. Pacientom s ascitom sme pri vykonaní punkcie ascitu odobrali ascites na vyšetrenie leukocytov a kultivačné vyšetrenie. Pacientom sme pri febrilitách odobrali hemokultúru do Bactecu.
Diagnózu SBP sme stanovili podľa štandardných kritérií:
1. více než 250 neutrofilov/mm3 v ascitickej tekutiny (v prípade nemožnosti stanoviť absolútny počet neutrofilov v ascitickej tekutine: více než 500 leukocytov/mm3 ascitickej tekutiny).
2. a/alebo pozitívna baktériová kultivácia ascitu.
Diagnózu infekcie dýchacích ciest sme stanovili po fyzikálnom vyšetrení a kultivačnom vyšetrení spúta. Diagnózu bronchopneumonie (BP) sme určili po komplexnom zhodnotení fyzikálneho vyšetrenia, RTG snímky hrudníka (vrátane tomografie) a event. kultivačného vyšetrenia spúta. Za infekciu močového traktu (UTI – urinary tract infection) sme považovali signifikantnú bakteriúriu 105 mikroorganizmov/ml moča. Diagnózu kože a mäkkých tkanív sme stanovili na základe klinického vyšetrenia. Diagnózu infekcie Clostridium difficile (CDI) sme určili vyšetrením klostrídiového toxínu v stolici.
Ihneď po stanovení diagnózy sme začali antibiotickú liečbu. V prípade dostupnosti kultivačného vyšetrenia v čase zistenia infekčnej komplikácie sme zvolili antibiotikum (ATB) s dobrou citlivosťou na príslušný mikroorganizmus.
Pokročilosť pečeňového ochorenia bola hodnotená podľa Child-Pugh a MELD (Model For End-Stage Liver Disease) skóre.
Výsledky sú uvádzané v prípade intervalových dát ako priemer +/– SD a ako relatívne početnosti v prípade kategorických dát. Rozdiely v intervalových premenných boli testované Mann-Whitneyho U-testom a v kategorických premenných χ-kvadrát testom. Pracovali sme na hladine významnosti α = 5 %, čiže hodnoty pri porovnávaní výsledkov boli považované za štatisticky signifikantné pri p < 0,05.
Baktériovú infekciu sme zistili u 37 pacientov, čo predstavuje 51,38 % súboru, baktériová infekcia nebola potvrdená u 35 pacientov, čo predstavuje 48,61 % súboru.
Charakteristika súboru pacientov je uvedená v tab. 1. Najčastejšou príčinou cirhózy pečene u hospitalizovaných pacientov bola alkoholová choroba pečene (ALD – alcoholic liver disease). Pacienti s alkoholovou cirhózou pečene mali signifikantne častejšie baktériovú infekciu ako ostatní pacienti.
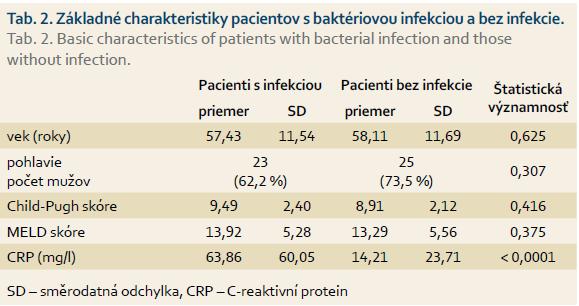
Pacienti s infekčnou komplikáciou mali vyššie hodnoty Child-Pugh a MELD skóre pri prijatí do nemocnice. Rozdiely neboli štatisticky významné v porovnaní s pacientmi bez infekcie. Pacienti s dokázanou infekciou mali signifikantne vyššie hodnoty CRP pri prijatí na hospitalizáciu ako pacienti bez dokázanej infekcie. Základné charakteristiky pacientov s cirhózou pečene uvádzame v tab. 2.
Z 37 pacientov s diagnostikovanou baktériovou infekciou malo 14 UTI, 11 infekciu dýchacích ciest, osem SBP, jeden pacient mal infekciu kože a mäkkých tkanív (SSTI – skin and soft tissue infection) a jeden pacient mal infekciu spôsobenú CDI. Dvaja pacienti mali súčasne BP a UTI.
U pacientov s UTI tvorili skupinu patogénov zachytených vo vyšetrovanom moči: Escherichia coli, Enterococcus faecalis, Pseudomonas aeruginosa, Proteus mirabilis, Streptococcus beta-haemolyticus skupiny B. V liečbe sme použili u deviatich pacientov fluorochinolóny (ciprofloxacin, norfloxacin) v monoterapii, u dvoch pacientov cefalosporíny 3. generácie (cefotaxim) v monoterapii, u jednoho pacienta chránené penicilíny (amoxicilín-klavulanát) v monoterapii a u dvoch pacientov fluorochinolóny (ciprofloxacin) a cefalosporíny 3. generácie (cefoperazon-sulbactam) v dvojkombinácii.
Ďalšou skupinou boli pacienti s infekciou dýchacích ciest vrátane bronchopneumónie. U štyroch pacientov išlo o IDC, u siedmich pacientov BP, ďalší dvaja pacienti s BP mali súčasne UTI. Kultivačnými vyšetreniami boli v dýchacích cestách zachytené: Staphylococcus aureus, Klebsiella pneumoniae, Haemophilus influenzae, Streptococcus pneumoniae. U pacientov, ktorí nemali potvrdenú BP, sme v troch prípadoch použili fluorochinolóny (ciprofloxacin) v monoterapii a v jednom prípade cefalosporíny 3. generácie (cefotaxim) v monoterapii. Dvaja pacienti s BP boli liečení glykopeptidmi (vancomycin) v monoterapii, päť pacientov fluorochinolónmi (ciprofloxacin) a cefalosporínmi 3. generácie (cefotaxim, cefoperazon-sulbactam) v dvojkombinácii. Z pacientov s dvoma infekciami bol jeden pacient liečený dvojkombináciou fluorochinolónov a amoxicilínu-klavulanátu a jeden pacient karbapenémami (meropenem).
Osem pacientov malo SBP, všetci užívali dlhodobo inhibitory protonovej pumby (IPP). Diagnóza bola u všetkých pacientov určená na základe stanovenia počtu polymorfonukleárnych leukocytov v ascitickej tekutine, pozitívnu kultiváciu sme zistili len u jedného pacienta, kedy išlo o záchyt Escherichia coli. Jeden pacient bol liečený fluorochinolónmi (ciprofloxacin) v monoterapii, jeden pacient glykopeptidovými ATB (vancomycin) v monoterapii a jeden pacient karbapenémom (meropenem) v monoterapii. Traja pacienti boli liečení cefalosporínmi 3. generácie (cefotaxim, cefoperazon-sulbactam) a fluorochinolónmi (ciprofloxacin) v dvojkombinácii, dvaja pacienti glykopeptidovými ATB (vancomycin) a karbapenémom (meropenem) v dvojkombinácii.
Jeden pacient mal potvrdenú kolitídu asociovanú s CDI. Išlo o 62-ročného muža s cirhózou pečene v teréne ALD. Pacient bol na naše pracovisko prijatý prekladom z oddelenia anesteziológie a intenzívnej medicíny, kde bol pre ventilátorovú pneumóniu liečený amoxicilín-klavulanátom. Pacient užíval antisekrečnú liečbu, bez jasnej indikácie. Diagnóza CDI bola stanovená na základe klinickej prítomnosti hnačiek, anamnézy užívania ATB a pozitívneho dôkazu toxínov CDI v stolici. Bol liečený metronidazolom s dobrým efektom.
Ďalší pacient, 77-ročný muž s kryptogénnou cirhózou pečene, mal SSTI. V liečbe boli použité fluorochinolóny (ciprofloxacin) v kombinácii s amoxi- cilín-klavulanátom.
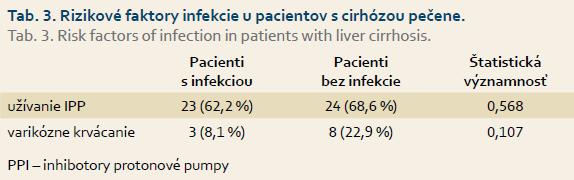
Ďalej sme vyhodnocovali rizikové faktory vzniku infekcie u pacientov s cirhózou pečene, ako užívanie IPP a anamnéza varikózneho krvácania (tab. 3).
V skupine pacientov s baktériovou infekciou užívalo až 23 pacientov IPP, pritom indikáciu na liečbu IPP sme zistili len u 12 pacientov. V prípade užívania IPP najčastejšie dokumentovanou indikáciou k tejto liečbe bola vredová choroba gastroduodena. U troch cirhotikov predchádzal vzniku infekcie atak varikózneho krvácania. Užívanie IPP a atak varikózneho krvácania sa neukázali ako rizikové faktory vzniku infekcie u pacientov s cirhózou pečene v našom súbore.
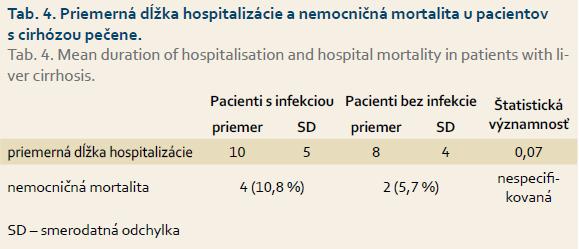
V súbore našich pacientov sme porovnávali priemernú dĺžku hospitalizácie a mortalitu u pacientov s infekčnou komplikáciou a bez nej (tab. 4). Priemerná dĺžka hospitalizácie u pacientov s cirhózou pečene s baktériovou infekciou bola 10 dní. V skupine pacientov s infekčnou komplikáciou došlo u štyroch z nich k úmrtiu, a to u troch s BP a jedného so SBP. Pacienti s infekčnou komplikáciou boli hospitalizovaní dlhšie ako pacienti bez infekcie. Rozdiel bol na hranici štatistickej významnosti, neboli prítomné štatisticky významné rozdiely v nemocničnej mortalite.
Diskusia
Cirhóza pečene je ochorenie spojené s vysokou predispozíciou k vzniku baktériových infekcií [4,5]. Klinické prejavy pritom nemusia byť zreteľné, často môže mať infekcia asymptomatický priebeh a jej hlavným prejavom je dekompenzácia pečeňovej choroby. Preto u všetkých pacientov hospitalizovaných pre dekompenzáciu pečeňovej choroby je nutné aktívne po infekcii pátrať. Súčasťou tohto pátrania je okrem základného biochemického a hematologického vyšetrenia založenie kultivačných vyšetrení vrátane hemokultúry, realizácia zobrazovacích diagnostických metód (RTG hrudníka, ultrasonografie brucha), u pacientov s ascitom diagnostická paracentéza, u pacientov s fluidotoraxom diagnostická pleurálna punkcia.
Medzi najčastejšie baktériové infekčné komplikácie u pacientov s cirhózou pečene patria SBP, UTI, infekcie dýchacích ciest, spontánna bakteriémie a SSTI [4,6,7]. Takéto spektrum infekcií sme zistili aj v skupine našich pacientov. V diagnostike sme sa opierali o klinické prejavy, laboratórne výsledky, výsledky kultivačných vyšetrení a zobrazovacie vyšetrovacie metódy.
V 60 % tieto infekcie môžu vzniknúť v komunitnom prostredí a v 40 % v súvislosti so zdravotnou starostlivosťou či nozokomiálne [2]. Rizikovými faktormi zvyšujúcimi možnosť vzniku infekčných komplikácií je pokročilosť pečeňového ochorenia, gastrointestinálne krvácanie, invazivita diagnostických a terapeutických výkonov, prekonané ataky SBP, polymorbidita pacientov, nízka hladina bielkoviny v ascitickej tekutine. Užívanie IPP a atak varikózneho krvácania sa neukázali ako rizikové faktory vzniku infekcie u pacientov s cirhózou pečene v našom súbore. Komunitné infekcie sú v 60 % spôsobené gramnegatívnymi baktériami, hlavne Escherichia coli, Klebsiella spp., Enterobacter spp., Pseudomonas aeruginosa [2,3]. Prevažná väčšina týchto patogénov sa uplatnila na vyvolaní baktériových komplikácií aj v našej skupine pacientov s cirhózou pečene. Naopak pri nozokomiálnych infekciách a infekciách asociovaných s nemocničnou starostlivosťou (HCA infekciách) začala prevažovať grampozitívna flóra, čo zrejme súvisí aj s nárastom invazívnych procedúr a profylaktickou antibiotickou liečbou. V našej skupine pacientov to boli Staphylococcus aureus a Streptococcus beta-haemolyticus skupiny B. Nebezpečenstvom v poslednej dobe je vznik multirezistencie, ktorá je definovaná odolnosťou voči trom a viacerým ATB, vrátane β-laktámových ATB [5,8,9]. Jej vývoj súvisí s častým užívaním ATB, dlhodobou profylaxiou norfloxacinom, opakovanými hospitalizáciami, polymorbiditou (napr. diabetes mellitus) [5].
Je potrebné si uvedomiť, že pacienti s cirhózou pečene sú sekundárne imunodeficitní a vzhľadom na prítomnosť portálnej hypertenzie sú predisponovaní k črevnému prerastaniu a baktériovej translokácii. A práve tieto procesy sú základom patogenézy vzniku baktériových infekčných komplikácií. V súčasnosti pribúdajú dôkazy o možnom negatívnom vplyve užívania antisekrečnej liečby (IPP) u pacientov s cirhózou pečene [10,11]. Negatívny vplyv spočíva v potenciácii baktériového prerastania, čoho dôsledkom je vyššie riziko vzniku SBP a CDI. Štúdiami bolo dokumentované, že preskripcia antisekrečnej liečby bola často bez jasne dokumentovanej indikácie [11]. Tento fakt bol zjavný aj v našej skupine pacientov, kde z 23 pacientov užívajúcich IPP bolo 11 bez jasne dokumentovanej indikácie.
Kľúčovým opatrením u cirhotikov s infekciou je včasná a od počiatku intenzívna antibiotická liečba. Iniciálna voľba empirických ATB vychádza z typu, závažnosti a pôvodu infekcie (komunitná, HCA, nozokomiálna) a z regionálnych údajov o rezistencii ATB na infekcie. Pri komunitných infekciách ostávajú základom liečby treťogeneračné cefalosporíny, v prípadoch infekcií asociovaných so zdravotnou starostlivosťou a nozokomiálne vzniknutých sú preferované ATB zo skupiny karbapenémov, glykopetidové ATB, inhibítory betalaktamáz [12,13]. Dĺžka liečby je individuálna s výnimkou SBP, kde je odporúčaná minimálne päťdňová antibiotická liečba [14]. Tieto terapeutické metódy sme aplikovali aj v našich podmienkach, kde sme preferenčne použili cefalosporíny 3. generácie, a fluorochinolóny.
Preventívne ATB krytie je odporúčané u pacientov s cirhózou pečene pri ataku gastrointestinálneho krvácania, po prekonaní epizódy SBP a u pacientov s nízkym obsahom bielkovín v ascitickej tekutine (pod 15g/l) [14–16]. Negatívnym následkom nadmernej ATB profylaxie je však vznik rezistentných kmeňov baktérií.
Záver
Pacienti s cirhózou pečene predstavujú vulnerabilnú populáciu s vysokým rizikom vzniku baktériových komplikácií. Tieto sú v súčasnosti akceptované ako samostatná komplikácia cirhózy pečene, pretože sa podpisujú pod mortalitu týchto pacientov.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Doručeno/Submitted: 23. 2. 2016
Přijato/Accepted: 22. 3. 2016
MUDr. Sylvia Dražilová, PhD.
Oddelenie vnútorného lekárstva s JIS metabolickou
Nemocnica Poprad, a. s.
Banícka 803/28
058 45 Poprad
Slovenská republika
drazilova.s@nemocnicapp.sk
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Bruns T, Zimmermann HW, Stallmach A. Risk factors and outcome of bacterial infections in cirrhosis. World J Gastroenterol 2014; 20 (10): 2542–2554. doi: 10.3748/wjg.v20.i10.2542.
2. Pleguezuelo M, Benitez JM, Jurado J et al. Diagnosis and management of bacterial infections in decompensated cirrhosis. World J Hepatol 2013; 5 (1): 16–25. doi: 10.4254/wjh.v5.i1.16.
3. Fernández J, Acevedi Hm Castro M et al. Prevalence and risk factors of infections by multiresistant bacteria in cirrhosis: a prospective study. Hepatology 2012; 55 (5): 1551–1561. doi: 10.1002/hep.25532.
4. Bunchorntavakul C, Chavalitdhamrong D. Bacterial infections other than spontaneous bacterial peritonitis in cirrhosis. World J Hepatol 2012, 4 (5): 158–168. doi: 10.4254/wjh.v4.i5.158.
5. Acevedo J. Multiresistant bacterial infections in liver cirrhosis: clinical impact and new empirical antibiotic treatment policies. World J Hepatol 2015; 7 (7): 916–921. doi: 10.4254/wjh.v7.i7.916.
6. Preda CM, Ghita R, Ghita C et al. A retrospective study of bacterial infections in cirrhosis. Maedica (Buchar) 2011; 6 (3): 185–192.
7. Dražilová S, Janičko M. Infekcie pri cirhóze. Gastroenterol Prax 2015; 14 (1): 31–34.
8. Arvaniti V, D’Amico G, Fede G et al. Infections in patients with cirrhosis increase mortality four-fold and should be used in determining prognosis. Gastroenterology 2010; 139 (4): 1246–1256. doi: 10.1053/j.gastro.2010.06.019.
9. Fernández Guerrero ML, González Ló- pez J, Górgolas M. Infectious endocarditis in patients with cirrhosis of the liver: a model of infection in the frail patient. Eur J Clin Microbiol Infect Dis 2010; 29 (10): 1271–1275. doi: 10.1007/s10096-010-0998-8.
10. Bajaj JS, Zadvornova Y, Heuman DM et al. Association of proton pump inhibitor therapy with spontaneous bacterial peritonitis in cirrhotic patients with ascites. Am J Gastroenterol 2009; 104 (5): 1130–1134. doi: 10.1038/ajg.2009.80.
11. Deshpande A, Pasupuleti V, Thota P et al. Acid-suppressive therapy is associated with spontaneous bacterial peritonitis in cirrhotic patients: a meta-analysis. J Gastroenterol Hepatol 2013; 28 (2): 235–242. doi: 10.1111/jgh.12065.
12. Jalan R, Fernandez J, Wiest R. Bacterial infections in cirrhosis: a position statement based on the EASL Special Conference 2013. J Hepatol 2014; 60 (6): 1310–1324. doi: 10.1016/j.jhep.2014.01.024.
13. Prado V, Acevedo J, Fernández J. Bacterial infections in cirrhosis: prevention and treatment. Curr Hepatology Rep 2014; 13: 43–49.
14. European Association for the Study of the Liver. EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol 2010; 53 (3): 397–417. doi: 10.1016/j.jhep.2010.05.004.
15. Hou MC, Lin HC, Liu TT et al. Antibiotic prophylaxis after endoscopic therapy prevents rebleeding in acute variceal hemorrhage: a randomized trial. Hepatology 2004; 39 (3): 746–753.
16. De Franchis R, Baveno V. Revising consensus in portal hypertension: report of the Baveno V consensus workshop on metho- dology of diagnosis and therapy in portal hypertension. J Hepatol 2010; 53 (4): 762–768. doi: 10.1016/j.jhep.2010.06. 004.