Imunopatologické komplikace biologické léčby blokátory TNF-α
Karin Malíčková Orcid.org 1,2
+ Pracoviště
Souhrn
Biologická léčba terapeutickými monoklonálními protilátkami namířenými proti cytokinu TNF-α je velmi účinná a bezpečná, nežádoucí účinky jsou obvykle mírné a dobře léčitelné. Terapie však může být provázena i závažnými akutními a chronickými vedlejšími účinky. Z povahy samotných biologických léčivých přípravků vyplývá, že tyto nežádoucí reakce jsou důsledkem sekundářních imunopatologických změn vyvolaných blokádou ústředního prozánětlivého cytokinu TNF-α. Jde nejčastěji o reakce časné a oddálené přecitlivělosti na terapeutický imunoglobulin, o reakce související s indukovanou nerovnováhou imunitního systému, jakož i o vzácnější důsledky cytokinové dysbalance nebo zkřížené antigenní raktivity. Článek přináší přehled a klisifikaci imunopatologických komplikací biologické léčby blokážory anti-TNF-α.
Klíčová slova
TNF-alfa, adalimumab, idiopatické střevní záněty, infliximabÚvod
Jako biologické léčivé přípravky jsou označována proteinová či peptidová léčiva připravená expresí genů vnesených do hostitelského organizmu. Biologická léčba (BL) dnes patří mezi nejrychleji rostoucí odvětví farmakoterapie. Nejvíce se rozvíjející oblast moderních biologických léčiv představují terapeutické monoklonální protilátky, jejichž hlavní léčebné využití spočívá v terapii imunopatologických chorob. V léčbě idiopatických střevních zánětů (IBD) se v posledních desetiletích významným způsobem uplatňuje především BL terapeutickými monoklonálními protilátkami proti cytokinu TNF-α, a to zejména terapie infliximabem a adalimumabem [1].
Jako všechny léky mohou mít i terapeutické monoklonální protilátky proti TNF-α nežádoucí účinky. Nežádoucí účinek léku lze definovat jako nepříznivou a nezamýšlenou odezvu na léčivo. Jde o velmi heterogenní skupinu reakcí, které lze klasifikovat dle různých kritérií. Tento článek je věnován mechanizmům vzniku a managementu nežádoucích účinků anti-TNF-α biologických léčiv, proto na úvod stručně zrekapitulujeme podstatu jejich farmakologického účinku.
Mechanizmus účinku terapeutických monoklonálních protilátek proti TNF-α
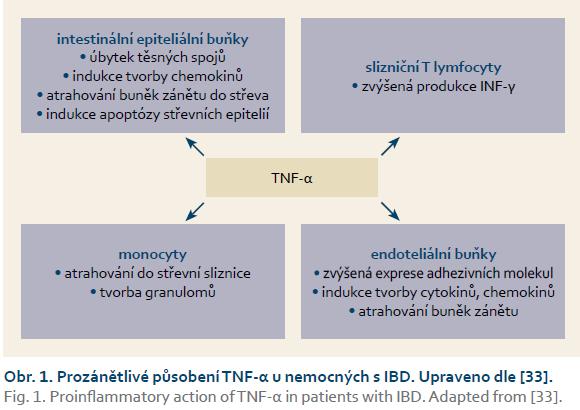
TNF-α je cílovou strukturou BL IBD ze zcela pochopitelných důvodů. Je to cytokin produkovaný buňkami imunitního systému (ale nejen jimi) jako odpověď na „poplachová hlášení“. TNF-α patří mezi hlavní složky zánětlivých kaskád, indukuje produkci a sekreci řady dalších prozánětlivých mediátorů. V malých množstvích lokálně moduluje funkce leukocytů a endotelií – indukuje expresi adhezivních molekul, zvyšuje cévní permeabilitu, stimuluje buňky k produkci chemokinů. Při vysoké produkci působí TNF-α systémově/endokrinně: při jeho nadprodukci vzniká horečka, dochází ke kostimulaci makrofágů a k produkci IL-1 a IL-6, k indukci tvorby proteinů akutní fáze, prostaglandinů a proteáz a k aktivaci koagulační kaskády [2]. Schéma prozánětlivého působení TNF-α u nemocných s IBD uvádí obr. 1.
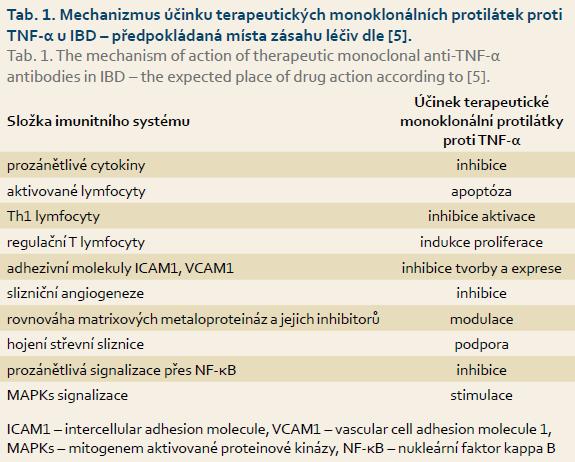
TNF-α se v organizmu vyskytuje ve formě solubilní a transmembránové, přičemž solulibní vzniká odštěpením z transmembránové působením TNF-konvertujícího enzymu. Funkční aktivitou disponují obě formy TNF. Váží se na receptory pro TNF, a to na TNF-RI a TNF-RII, které jsou exprimovány na povrchu cílových buněk. Vazbou cytokinu na receptor TNF-RI dochází k aktivaci transkripčního faktoru NF-κB, a tím k aktivaci genů pro faktory účastnící se zánětlivých kaskád a procesů apoptózy. Signalizace přes TNF-RII je obdobná, nevede však k aktivaci apoptotických procesů. Oba receptory existují v organizmu i v solubilní formě, a fungují tak i jako přirození antagonisté samotného cytokinu. Terapeutické monoklonální protilátky proti TNF-α se váží s vysokou afinitou na rozpustné a transmembránové formy TNF-α a na jejich solubilní receptory, čímž inhibují funkční aktivitu tohoto cytokinu [3,4]. Přesný mechanizmus účinku však znám není. Předpokládaná místa, na kterých anti-TNF-α biologika blokují zánětlivé kaskády, uvádí tab. 1.
Klasifikace imunopatologických nežádoucích účinků terapeutických monoklonálních protilátek proti TNF-α
Nežádoucí účinky biologických léčiv souvisí s mechanizmy jejich účinku a s charakterem cílových struktur, proti kterým jsou namířené. V roce 2006 byla Pichlerem navržena a záhy široce akceptována nová klasifikace nežádoucích účinků biologik [6], podle které je dělíme do pěti tříd (tab. 2).Imunopatologické nežádoucí reakce typu α
Imunopatologické nežádoucí reakce typu α jsou podmíněny vysokými hladinami cytokinů. Klinicky se projevují velmi heterogenně – od chřipkovitých příznaků až po těžkou cytokinovou bouři („cytokine storm“), která se manifestuje formou multiorgánové dysfunkce indukované nesprávnou/nevhodnou a generalizovanou zánětlivou odpovědí. Reakce typu α jsou podmíněny nadměrnou tvorbou zejména IL-1β, IL-6 a IL-8 v aktivovaných imunokompetentních buňkách (monocytech, makrofázích, lymfocytech a/nebo NK buňkách). Tento typ nežádoucích účinků anti-TNF-α biologik je velmi vzácný, u infliximabu nepřevyšuje 0,2 % všech hlášených nežádoucích účinků [7].
Imunopatologické nežádoucí reakce typu β
Imunopatologické nežádoucí reakce typu β jsou u anti-TNF-α biologik naopak poměrně časté a představují významný klinický problém.
Infliximab je chimérická (lidská/myší) monoklonální protilátka, a je proto pochopitelné, že je pro pacientův imunitní systém imunogenem. Avšak i zcela humánní adalimumab je induktorem tvorby protilátek, a to zejména antiidiotypových. Tvorba protilátek proti biologikům (ADA – anti-drug antibodies) je dána nejen jejich imunogenicitou, ale je závislá i na cestě podání (nitrožilní, podkožní) nebo na souběžném podávání imunosupresiv [8,9]. ADA jsou často příčinou reakcí časné a/nebo oddálené přecitlivělosti, vedou též ke snížení účinnosti BL.
Časné nežádoucí polékové reakce vznikají do 1–2 hod (ale i během několika vteřin) po podání infliximabu u cca 10 % léčených pacientů; např. v klinické studii ASPIRE (nemocní s revmatoidní artritidou léčení infliximabem) se časné reakce přecitlivělosti vyskytly u 15 % a závažné časné reakce u 0,4 % nemocných [10]. K reakci časné přecitlivělosti může dojít až po opakovaném setkání s příčinným antigenem, tj. léčivem. Při prvním setkání s antigenem dochází k senzibilizaci pacienta, ke stimulaci diferenciace specifických klonů pomocných Th2 lymfocytů a následně B lymfocytů, které začnou pod vlivem cytokinů secernovat ADA. Tyto se naváží na receptory žírných buněk a bazofilů a po opakovaném setkání s příčinným antigenem dochází k jejich masivní degranulaci, k uvolnění řady metabolitů a ke spuštění prozánětlivých signálů a kaskád. Klinicky se časné poinfuzní reakce projevují nejčastěji svěděním, otoky obličeje, rukou nebo rtů, dysfagií, kopřivkou, bolestmi hlavy a svalů, vzácněji dochází k těžkým celkovým reakcím s možností rozvoje až anafylaktického šoku. Jestliže se objeví akutní reakce při podání léčiva, musí být jeho podávání okamžitě přerušeno, k dispozici musí být vybavení pro akutní pomoc, jako je adrenalin, antihistaminika, kortikosteroidy a vybavení pro umělé dýchání. K prevenci mírných a přechodných reakcí mohou být pacienti premedikováni např. antihistaminikem, hydrokortisonem a/nebo paracetamolem.
Při léčbě terapeutickými monoklonálními protilátkami se mohou vyskytnout rovněž pozdní polékové reakce přecitlivělosti (7.–10. den po podání). Tento druh hypersenzitivity je podmíněn tvorbou cirkulujících antigen-protilátkových komplexů, které se deponují v postkapilárních venulách s lokální aktivací komplementového systému. Důsledkem je migrace polymorfonukleárů a zánět v místě akumulace těchto imunokomplexů. Klinicky se tyto reakce přecitlivělosti projevují zejména bolestmi kloubů a svalů, horečkou, kožním exantémem, kopřivkou, bolestmi hlavy a někdy dokonce dechovou tísní. Velmi rizikové je v tomto ohledu opakované podávání infliximabu s delším časovým odstupem. V klinické studii ACCENT I (nemocní s Crohnovou nemocí) byla incidence „serum-sickness-like“ projevů 2,4 % [11].
Sérové protilátky proti terapeutickým monoklonálním protilátkám lze poměrně snadno detekovat a kvantifikovat. V posledních pěti letech je komerčně dostupných několik detekčních systémů k monitorování výskytu sérových protilátek proti infliximabu a adalimumabu, vesměs založených na principu enzymové imunoanalýzy.
Publikované výsledky klinických studií i klinické zkušenosti ukazují, že 15–20 % nemocných s IBD primárně neodpovídá na terapii terapeutickými monoklonálními protilátkami proti TNF-α a že v průběhu jednoho roku dochází ke ztrátě odpovědi u další pětiny pacientů [12]. Neodpovídavost na terapii je do značné míry též připisována imunogenicitě biologik a tvorbě ADA, které neutralizují léčivo, a negativně tak ovlivňují jeho efekt.
Imunopatologické nežádoucí reakce typu γ
Imunopatologické nežádoucí reakce typu γ jsou dány nerovnováhou imunitního systému neboli imunodeviací. Tuto při BL provádíme cíleně za účelem utlumení patologického zánětlivého procesu, avšak nežádoucím důsledkem může být: 1. sekundární imunodeficience s následnou indukcí infekce; 2. indukce jiné imunopatologie, zejména rozvoj nových autoimunitních fenoménů; 3. indukce vzniku malignit.
Imunopatologické nežádoucí reakce typu γ – infekce
Intracelulární patogeny nejsou většinou krátce žijícími polymorfonukleárními leukocyty zcela usmrceny, často přežívají např. v makrofázích a jsou značně odolné proti nitrobuněčným baktericidním reakcím. Infekce vyvolaná těmito bakteriemi může být zvládnuta jen po dostatečné aktivaci makrofágů. V neaktivovaných makrofázích žijí bakterie, viry či plísně chráněny před ostatními obrannými mechanizmy a množí se. U intracelulárních parazitů, i když došlo ke klinickému uzdravení, proto nelze mít nikdy jistotu, že byly z organizmu zcela eliminovány. Často latentně přežívají v makrofázích a při oslabení organizmu může dojít k exacerbaci infekce. Nitrobuněčně se množící mikrobi aktivují zejména Th1 lymfocyty a stimulují tvorbu jejich cytokinů, které působí regulačně ve smyslu útlumu Th2 cytokinové sítě. Pokud tedy za účelem BL IBD utlumíme ústřední prozánětlivý cytokin Th1 skupiny TNF-α, negativně ovlivníme maturaci fagozomů, apoptotické procesy a aktivaci T lymfocytů, což může vést k sekundární imunodeficienci a ke klinickým projevům infekce.
U pacientů léčených monoklonálními protilátkami proti TNF-α byly pozorovány tuberkulóza a jiné mykobakteriózy, bakteriální infekce vč. sepse a pneumonie, invazivní mykotické, virové a ostatní oportunní infekce. Tyto infekce mohou být vzácně až fatální. Incidence závažných systémových infekcí u nemocných s IBD na BL nepřesahuje jednotky procent [13]. V klinické praxi jsou však významným problémem recidivující respirační infekce (sinusitidy, faryngitidy, bronchitidy), močové infekce, kožní stafylokoková furunkulóza až karbunkulóza, slizniční kandidózy (stomatitidy, vulvovaginitidy) a recidivující herpetické infekce (herpes simplex virus, varicella zoster virus).
Díky aktivnímu screeningu latentní tuberkulózy (klinické a rentgenové vyšetření, QuantiFERON TB-Gold test, T-Spot TB test, Mantoux) před zahájením BL a při provádění pravidelných kontrol v průběhu léčby je v současné době incidence tuberkulózy při BL v populaci IBD pacientů velmi nízká a nepředstavuje větší riziko. Před zahájením BL je vhodné provést všechny vakcinace podle současných směrnic o očkování, pokud je to možné, přičemž však očkování pacientů s autoimunitními chorobami a imunokompromitovaných pacientů má určitá specifika a efekt vakcinace může být vlivem nemoci i terapie změněný [14]. Někdy se v léčbě opakovaných infekcí pacientů na BL anti-TNF-α přípravky terapeuticky osvědčuje pasivní imunizace polyspecifickými imunoglobuliny. Kontraindikovány jsou standardní imunostimulátory typu inosin pranobexu.
Imunopatologické nežádoucí reakce typu γ – autoimunita
Podávání biologických léčiv může někdy vést k demaskování preexistující cytokinové dysbalance nebo ji může přímo způsobit. Následkem může být rozvoj autoimunitních chorob, autoinflamatorních syndromů a alergií.Je známou skutečností, že nemocní léčení anti-TNF-α léčivy tvoří významně často orgánově nespecifické protilátky typu antinukleárních protilátek (ANA) a protilátek proti dvouvláknové DNA [15,16]. Ve velké belgické studii vykazovala více než polovina pacientů s IBD léčených infliximabem pozitivitu ANA, přičemž u téměř 3/4 nemocných došlo k výskytu těchto autoprotilátek po méně než třech dávkách nitrožilního infliximabu [17]. Tyto autoprotilátky jsou však v naprosté většině případů pouze laboratorním fenoménem a nejsou sdruženy s klinickými příznaky systémového lupusu (SLE). Jejich vznik lze považovat za vcelku fyziologický proces, který přispívá k normálnímu odstraňování nukleárních antigenů vzniklých v procesech apoptózy při hojení střeva.
U malé části nemocných však nakonec k projevům polékového SLE, leukocytoklastické vaskulitidy, artritidy či jiných imunopatologických chorob dojde. Dosud není zcela známo, podle jakého klíče k rozvoji sekundárních iatrogenních autoimunit dochází. Je možné, že ve zvýšeném riziku jsou jedinci s predispozicí ve formě nízké aktivity deoxyribonukleázy I [18]. Jiné teorie se zabývají významem nadprodukce B lymfocytárního aktivačního faktoru, který je jako člen molekulární rodiny TNF ligandů ovlivňován anti-TNF-α biologiky a jeho nadměrná exprese může vést ke klinické manifestaci autoprotilátkami mediovaných systémových nebo orgánově specifických autoimunit [19]. Klinický obraz polékového SLE zahrnuje bolesti a/nebo otoky kloubů a svalů, kožní exantém, serozitidy a výjimečně viscerální postižení. Tyto klinické projevy obvykle vyžadují ukončení BL, po kterém dochází zpravidla k ústupu obtíží [20].
Závažným klinickým problémem při léčbě IBD infliximabem nebo adalimumabem je paradoxní vznik těžkých psoriaziformních kožních lézí. Vyskytuje se v různé míře až u 10 % léčených pacientů [21] a vysvětluje se závažnou nerovnováhou mezi potlačenou produkcí TNF-α a významnou nadprodukcí interferonu-α (IFN-α). Vznik psoriaziformních lézí je indukován plazmocytoidními dendritickými buňkami, které infiltrují kůži, a prostřednictvím hojně produkovaného IFN-α spouští zánětlivé změny vedoucí ke vzniku kožních defektů [22]. Plazmocytoidní dendritické buňky jsou za normálních okolností inhibovány cytokinem TNF-α. Pakliže tento BL cíleně zablokujeme, může dojít u predisponovaných jedinců k rozvoji psoriázy. Při rozsáhlém kožním postižení bývá někdy nezbytné ukončení BL, avšak v literatuře je referována kompletní regrese kožních změn po ukončení anti-TNF-α léčby jen u cca 50 % postižených [23].
Imunopatologické nežádoucí reakce typu γ – onkogeneze
Již Paul Ehrlich a následně Burnet s Thomasem postulovali hypotézu, že aktivace zánětlivých procesů jakožto součást imunitní odpovědi vede k eliminaci zmutovaných buněčných struktur [24]. Tento proces „imunosurveillance“ spočívá v rozeznání aberantních proteinů nebo jejich komplexů s MHC antigeny a v jejich eliminaci, při které se uplatňují především CD8+ cytotoxické T lymfocyty, NK buňky a prostřednictvím produkce TNF-α a IFN-γ též CD4+ pomocné T lymfocyty, významnou protektivní roli mají též antiangiogenně působící chemokiny. Na druhou stranu, chronický zánět zvyšuje riziko nádorového bujení, přičemž předpokládanými mechanizmy jsou poškození DNA a/nebo potenciace přežívání, proliferace, migrace a invazivity nádorových buněk pod vlivem TNF, IL-1, IL-6 chemokinů a růstových faktorů. Na molekulární úrovni je klíčovým spojovacím článkem mezi zánětem a malignitou transkripční faktor NF-κB, jehož aktivace mimo jiného stimuluje proliferaci maligně transformovaných buněk [25].
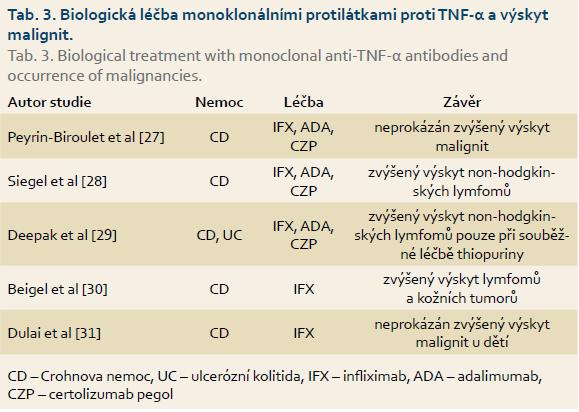
Studie upozorňující na zvýšený výskyt některých malignit u nemocných léčených anti-TNF-α biologiky se začaly objevovat již koncem 90. let minulého století [26], avšak dosud s kontroverzními závěry. Tab. 3 uvádí přehled některých významných metaanalýz výskytu malignit u nemocných léčených infliximabem, adalimumabem a dalšími přípravky namířenými proti TNF-α.
Předpokládá se, že pacienti s autoimunitními chorobami vč. IBD jsou obecně více vnímaví k poškození DNA a anti-TNF-α terapie může tuto skutečnost ještě potencovat, a podpořit tak maligní transformaci a vznik nádorového onemocnění.
Imunopatologické nežádoucí reakce typu δ
Imunopatologické nežádoucí reakce typu δ jsou podmíněny zkříženou reaktivitou cílového antigenu biologického léčiva s jinou tkání/molekulární strukturou v těle pacienta. Příkladem pro TNF a anti-TNF-α léčbu je zkřížená tolerance bakteriálního lipopolysacharidu s jinými TLR4-specifickými ligandy vč. TNF, což může mít negativní vliv na imunitní mechanizmy v průběhu sepse nebo neinfekčního syndromu systémové zánětlivé odpovědi, a tedy na vysoké riziko imunoparalýzy a neodpovídavosti na bakteriální endotoxin u nemocných léčených anti-TNF-α BL [32].
Závěr
Každé léčivo má kromě hlavního léčebného efektu, pro který se využívá, účinky další – vedlejší. Některé z nich mohou vážně poškodit zdraví a/nebo vývoj jedince nebo dokonce způsobit smrt. I když je bezpečnost léků před jejich uvedením na trh přísně testována, nepodaří se vždy rozpoznat všechna rizika vedoucí ke vzniku nežádoucích účinků. Biologická léčiva mají méně nežádoucích účinků než xenobiotika a obvykle nevykazují známky lékových interakcí, i když pro definitivní hodnocení je klinická zkušenost zatím omezená. Je bohužel skutečností, že až na výjimky dosud nemáme k dispozici žádný spolehlivý biomarker, který by v klinické praxi pomáhal vytipovat nemocné se zvýšeným rizikem imunopatologické komplikace BL. Opatření k prevenci vzniku těchto nežádoucích účinků léčby jsou proto ve většině případů nesnadná až nereálná.
Práce byla podpořena Nadačním fondem IBD-Comfort a grantem IGA MZ NT 14300.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Doručeno/Submitted: 3. 12. 2015
Přijato/Accepted: 29. 12. 2015
MUDr. Karin Malíčková
Klinická imunologie a alergologie – laboratoř
Ústav lékařské biochemie a laboratorní diagnostiky
1. LF UK a VFN v Praze
Karlovo nám. 32
121 11 Praha 2
kmali@lf1.cuni.cz

Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Bortlík M, Ďuricová D, Kohout P et al. Doporučení pro podávání biologické terapie u idiopatických střevních zánětů: 2. vydání. Gastroent Hepatol 2012; 66 (1): 12– 22.
2. Sandborn WJ. Strategies for targeting tumour necrosis factor in IBD. Best Pract Res Clin Gastroenterol 2003; 17(1):
105– 117.
3. Tilg H, Moschen A, Kaser A. Mode of function of biological anti-TNF agents in the treatment of inflammatory bowel
diseases. Expert Opin Biol Ther 2007; 7(7): 1051– 1059.
4. Zbořil V. Infliximab v klinické léčebné praxi. Klin Farmakol Farm 2005; 19: 67– 71.
5. Danese S. Mechanisms of action of infliximab in inflammatory bowel disease: an anti-inflammatory multitasker. Dig Liver Dis 2008; 40 (Suppl 2): S225– S228. doi: 10.1016/ S1590-8658(08)60530-7.
6. Pichler WJ. Adverse side-effects to biological agents. Allergy 2006; 61(8): 912– 920.
7. Descotes J. Immunotoxicity of monoclonal antibodies. MAbs 2009; 1(2): 104– 111.
8. Nanda KS, Cheifetz AS, Moss AC. Impact of antibodies to infliximab on clinical outcomes and serum infliximab levels
in patients with inflammatory bowel disease (IBD): a meta-analysis. Am J Gastroenterol 2013; 108(1): 40– 47. doi:
10.1038/ ajg.2012.363.
9. Fiorino G, Danese S, Pariente B et al. Paradoxical immune-mediated inflammation in inflammatory bowel disease patients receiving anti-TNF-α agents. Autoimmun Rev 2014; 13(1): 15– 19. doi: 10.1016/ j.autrev.2013.06.005.
10. Visvanathan S, Marini JC, Smolen JS et al. Changes in biomarkers of inflammation and bone turnover and associations
With clinical efficacy following infliximab plus methotrexate therapy in patients with early rheumatoid arthritis. J Rheumatol 2007; 34(7): 1465– 1474.
11. Hanauer SB, Wagner CL, Bala M et al. Incidence and importance of antibody responses to infliximab after maintenance or episodic treatment in Crohn’s disease. Clin Gastroenterol Hepatol 2004; 2(7): 542– 553.
12. D’Haens GR, Panaccione R, Higgins PD et al. The London position statement of the World congress of Gastroenterology on biological therapy for IBD with the European Crohn’s and Colitis Organization: when to start, when to stop, which drug to sed by interferon-γ-expressing Th1 cells and IL-17A/ IL-22-expressing Th17 cells and respond to anti-IL-12/ IL-23 antibody treatment. Gut 2014; 63(4): 567– 577. doi: 10.1136/ gutjnl-2012-302853.
23. Cleynen I, Vermeire S. Paradoxical inflammation induced by anti-TNF agents in patients with IBD. Nat Rev Gastroenterol Hepatol 2012; 9(9): 496– 503. doi: 10.1038/ nrgastro.2012.125.
24. Klein G, Klein E. Surveillance against tumors – is it mainly immunological? Immunol Lett 2005; 100(1): 29– 33.
25. Lawrence T. Macrophages and NF-κB in cancer. Curr Top Microbiol Immunol 2011;349: 171– 184. doi: 10.1007/ 82_2010_100.
26. Bickston SJ, Lichtenstein GR, Arseneau KO et al. The relationship between infliximab treatment and lymphoma in Crohn’s disease. Gastroenterology 1999; 117(6): 1433– 1437.
27. Peyrin-Biroulet L, Deltenre P, de Suray N et al. Efficacy and safety of tumor necrosis factor antagonists in Crohn’s disease: meta-analysis of placebo-controlled trials. Clin Gastroenterol Hepatol 2008; 6(6):
644– 653. doi: 10.1016/ j.cgh.2008.03.014.
28. Siegel CA, Marden SM, Persing SM et al. Risk of lymphoma associated with combination anti-tumor necrosis factor
and immunomodulator therapy for the treatment of Crohn’s disease: a meta-analysis. Clin Gastroenterol Hepatol 2009; 7(8): 874– 881. doi: 10.1016/ j.cgh.2009.01.004.
29. Deepak P, Sifuentes H, Sherid M et al. T-cell non-Hodgkin’s lymphomas reported to the FDA AERS with tumor necrosis factor-alpha (TNF-α) inhibitors: results of the REFURBISH study. Am J Gastroenterol 2013;
108(1): 99– 105. doi: 10.1038/ ajg.2012.334.
30. Beigel F, Steinborn A, Schnitzler F et al. Risk of malignancies in patients with inflammatory
bowel disease treated with thiopurines or anti-TNF alpha antibodies. Pharmacoepidemiol Drug Saf 2014; 23(7):
735– 744. doi: 10.1002/ pds.3621.
31. Dulai PS, Thompson KD, Blunt HB et al.Risks of serious infection or lymphoma with anti-tumor necrosis factor therapy for pediatric inflammatory bowel disease: a systematic review. Clin Gastroenterol Hepatol
2014; 12(9): 1443– 1451. doi: 10.1016/ j.cgh.2014.01.021.
32. Potter C, Cordell HJ, Barton A et al. Association between anti-tumour necrosis factor treatment response and
genetic variants within the TLR and NF{kappa}B signalling pathways. Ann Rheum Dis 2010; 69(7): 1315– 1320. doi:
10.1136/ ard.2009.117309.
33. Tak PP. Role of tumor necrosis factor (TNF) in immune-mediated inflammatory diseases. [online]. Available from: www.medscape.org/ viewarticle/ 545412.