Domáca parenterálna výživa – význam a využitie v klinickej praxi
Andrea Fojtová1, Barbora Norek1, Tomáš Zamborský Orcid.org 1, Marián Bátovský Orcid.org 1
+ Pracoviště
Souhrn
Domáca parenterálna výživa je náhradná cesta a forma výživy u pacientov s ireverzibilným zlyhaním intestinálnych funkcií, u ktorých enterálna výživa nie je možná, resp. dlhodobo nedostačujúca s prehlbujúcim sa energetickým deficitom. Zahájením parenterálnej výživy v domácom prostredí sa zlepšuje kvalita života pacientov a tým aj priebeh základného ochorenia s optimalizáciou klinických prejavov malnutrície. K najčastejším indikáciám zahájenia domácej parenterálnej výživy patria rozsiahle redukcie absorbčnej plochy pri intestinálnych resekciách (pri chirurgických komplikáciách M. Crohn, pri ischemickej nekróze tenkého čreva v dôsledku trombózy vo VMS, resp. embólii alebo AS uzávere pri AMS), ale tiež aj funkčné zlyhanie čreva rôznej etiológie a nádorové ochorenia s dostatočnou utilizáciou základných živín.
Klíčová slova
črevné zlyhanie, domáca parenterálna výživa, malnutrícia, syndrom krátkého střevaÚvod
Zahájenie klinickej výživy (parenterálnej aj enterálnej) by malo byť súčasťou komplexnej liečby u pacientov so zistenou malnutríciou pri črevnom zlyhaní rôznej etiológie. Domáca parenterálna výživa (DPV) sa najčastejšie nasadzuje pri ireverzibilnom zlyhaní čreva, s trvalou potrebou parenterálnej substitúcie základných živín, elektrolytov a aditív. Vzhľadom na možné komplikácie vyplývajúce zo zahájenia DPV zvažujeme benefit a riziko centrálneho podávania základných živín.
Indikačné kritériá zaradenia pacienta do programu DPV
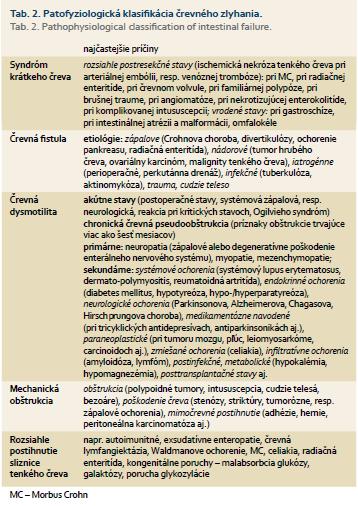
1. Medicínske kritériá: K najčastejším indikačným kritériám patrí zlyhanie funkcií čreva. Prvýkrát bol definovaný pojem „črevné zlyhanie“ v roku 1981 Flemingom a Remingtonom ako „redukcia funkcie čreva s poruchou digescie a absorbcie základných živín“ [1]. Môže byť následkom rôznych ochorení (vrodených anomálií tráviaceho traktu, systémových ochorení, prítomnosti benígnych a malígnych nádorov, zápalových ochorení tráviaceho traktu) postihujúcich rôzne vekové kategórie [2–4]. Pacienti s ireverzibilnou formou chronického črevného zlyhania vyžadujú DPV, alebo zváženie transplantácie tenkého čreva [5]. Pôvodná definícia Fleminga a Remingtona bola revidovaná ďaľšími odborníkmi [6]. Nové indikačné kritériá a klasifikácia črevného zlyhania bola schválená na konferencii ESPEN (European Society for Clinical Nutrition and Metabolism) v marci 2014 (tab. 1). Črevné zlyhanie sa definovalo ako redukcia funkčnej plochy čreva s minimálnou absorbciou makronutrientov, vody, resp. elektrolytov, s potrebou intravenóznej suplementácie základných živín potrebných pre ďalší vývoj a rast.
Zahájením DPV pri benígnych ochoreniach možno dosiahnuť reverzibilitu črevného zlyhania v 20–50 % v priebehu 1–2 rokov [5]. Pri pokročilých nádorových ochoreniach je zahájenie DPV kontroverzné [7]. Pracovná skupina ESPEN neodporúča zahájenie DPV u pacientov s predpokladanou dľžkou života menej ako tri mesiace [8]. Ďaľšie rozhodovanie nasadenia DPV u onkologických pacientov je v stupni utilizácie základných živín a v miere sebestačnosti pacienta (Karnofského skóre > 50 bodov). V rámci patofyziologickej klasifikácie črevného zlyhania je definovaná široká škála najčastejších príčin jednotlivých patofyziologických jednotiek, čím sa rozširujú možnosti indikácie DPV pri schvaľovaní žiadostí poisťovňou (tab. 2) a zjednodušuje sa komunikácia medzi jednotlivými odborníkmi.
Hlavnou príčinou chronického črevného zlyhania vyžadujúceho si zahájenie DPV v Európe je syndróm krátkeho čreva rôznej etiológie, u dospelých 75 % a 50 % u detí [9]. Reverzibilita črevného zlyhania u pacientov s chronickou črevnou pseudoobštrukciou je nižšia než u pacientov so syndrómom krátkeho čreva pri postresekčných stavoch (tj. iba 25–50 % u dospelých a iba 25–38 % u detí je reverzibilných) [10,11].
K ďalším indikačným kritériám patria:
2. Nutričné kritériá: hodnotí sa závažnosť malnutrície, prítomnosť deficitných syndrómov, reverzibilita metabolických porúch, individuálne nutričné požiadavky a overuje sa možnosť kombinovanej EV a PV;
3. Biosomatické kritériá: stav koagulácie, údaje o trombotických príhodách, o minulých kanyláciách, epidemiologické údaje o prekonanej sepse a bakteriálnej endokarditíde a priechodnosť centrálnych žíl;
4. Psychosociálne kritériá: časovo náročné pre celú rodinu, písomný súhlas, preverujú sa hygienické návyky.
Príprava pacienta na DPV
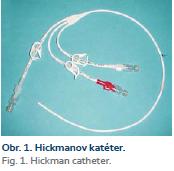
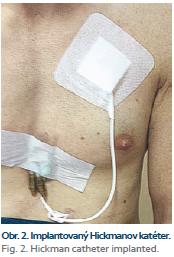
Po zhodnotení nutričného stavu pacienta určíme typ a stupeň malnutrície pomocou anamnézy, antropometrických a biochemických vyšetrení (absolvovaný počet lymfocytov, bielkovín, albumínov, CHE, transferínu, cholesterolu, CRP). Po vypočítaní energetickej bilancie u pacienta (Harris-Benedictova rovnica + stresové faktory ako korelačný faktor a index aktivity, dusíková bilancia) s prihliadnutím na pridružené ochorenia (napr. diabetes mellitus, chronické obličkové ochorenie, prítomná pretrvávajúca cholestáza aj.) zahájime po podpísaní informovaného súhlasu pacientom podávanie parenterálnej výživy. U pacienta je dôležitá adekvátna edukácia, aby sme predišli infekčným komplikáciám. Vzhľadom na potrebu dlhodobého podávania DPV sa k centrálnej kanylácii (v. subclavia, v. jugularis interna, resp. externa) používajú tunelizované Hickmanove (obr. 1, 2) alebo Broviakove katétre, alebo pod kožu umiestnené porty (obr. 3). Hickmanov katéter má vnútornú plochu pokrytú silikónovou alebo polyuretánovou výstelkou, ktorá má nízku trombogenicitu. Má dakrónovú manžetu, ktorá slúži na podkožnú fixáciu katétra a zabraňuje pomnoženiu a prieniku baktérií pozdĺž katétra z kože do podkožia. Pri správnom zavedení by mal byť koniec katétra umiestnený v pravej predsieni, alebo vo v. cava superior. Väčšinou používame firemne vyrábané parenterálne vaky, s možnosťou doplnenia aditív do vaku podľa potreby. Dôležitá je pravidelná ambulantná kontrola pacienta so zmenou parenterálneho režimu podľa klinického a laboratórneho stavu.
Komplikácie DPV
K najčastejším kauzálnym príčinám kaválovej sepsy (50 %) sú koaguláza negatívne stafylokoky (Staphylococcus epidermidis, Staphylococcus aureus) [12]. Účinnou prevenciou infekčných komplikácií je roztok taurolidínu, ktorý pôsobí proti širokej škále baktérií a húb vrátane meticilín a vankomycín rezistentných, zabraňuje tvorbe biofilmu a kolonizácii katétra. Z metabolických príčin okrem oxalátovej nefropatie pri syndróme krátkeho čreva je veľmi častý aj vznik steatózy pečene, ktorá sa vyskytuje pri vysokom prívode glukózy, nedostatku esenciálnych mastných kyselín a pri nadmernom prívode triacylglycerolov a nedostatku karnitínu. K ďaľším príčinám vzniku steatózy patria aj aplikácia hepatotoxických liekov, sepsa, biliárna obštrukcia a tiež aj bakteriálna translokácia [13]. Vzhľadom na vyššie uvedené je potrebný konštantný prívod energie (25–35 kcal/kg TH), proteínov (0,8–1,5 g/kg TH/deň), sacharidov (3–6 g/kg TH/deň), tukov (max. 1 g/kg/deň) so zvážením individuálnej potreby u pacientov v rámci prevencie overfeeding syndrómu [14]. Dôležitosť podávania aditív (vitamínov, stopových prvkov, resp. subtitúcia iontov) spočíva v prevencii vzniku deficitných syndrómov (napr. Wernickeho encefalopatia pri deficite thiamínu). Osteopénia pri dlhodobom podávaní parenterálnej výživy bola zaznamenaná cca u 41–46 % pacientov, preto je potrebná substitúcia vápnika a fosfátov v roztokoch [15].
Alternatívne riešenia pri dlhodobej DPV
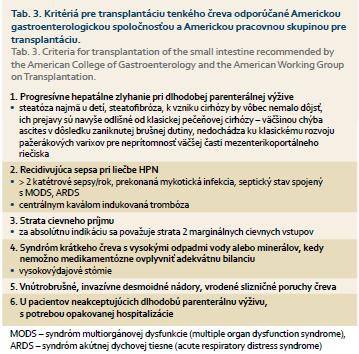
Z ďalších liečebných možností pri črevnom zlyhaní je aj použitie analógu glukagon-like peptidu, ktorý zvyšuje prietok krvi črevami a portálny prietok krvi, inhibuje sekréciu žalúdočnej kyseliny a znižuje motilitu čreva. K ďaľšiemu alternatívnemu riešeniu radíme transplantáciu tenkého čreva, ktorá sa vyvinula v posledných 10 rokoch. Dnes sa považuje za jediné dlhodobé riešenie pre pacientov so zlyhaním čreva, u ktorých došlo k závažným komplikáciám pri dlhodobej parenterálnej výžive (tab. 3). Prvýkrát zaznamenanú transplantáciu tenkého čreva v roku 1967 vykonali prof. Liliheim et al. Počet úspešných transplantácií tenkého čreva stúpa aj vďaka pokroku v imunosupresívnej liečbe, v operačnej technike a pooperačnej starostlivosti. Počet kandidátov na transplantáciu tenkého čreva sa neustále zvyšuje. Väčšina kandidátov je mladších ako šesť rokov. Najčastejšou indikačnou príčinou na transplantáciu tenkého čreva je syndróm krátkeho čreva.
Záver
Význam DPV spočíva v skvalitnení života pacientov, u ktorých je potrebná parenterálna substitúcia základných živín. V rámci prevencie možných komplikácií DPV je potrebný multidisciplinárny prístup k pacientovi s pravidelnou ambulantnou kontrolou a dôkladnou opatrovateľskou starostlivosťou. Dôležitá je aj samotná edukácia pacienta s vypracovaním ošetrovateľských protokolov. Nasadením DPV sa znižujú nemocničné náklady na hospitalizáciu pacienta.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Doručeno/Submitted: 2. 10. 2015
Přijato/Accepted: 8. 10. 2015
MUDr. Andrea Fojtová
Gastroenterologická klinika SZU a UN Bratislava
Antolská 11
851 07 Bratislava
Slovenská republika
andreafojtova@gmail.com


Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Fleming CR, Remington M. Intestinal failure. In: Hill GL (ed.). Nutrition and the surgical patient. Edinburgh: Churchill Livingstone 1981: 219–235.
2. O’Keefe SJ, Buchman AL, Fishbein TM et al. Short bowel syndrome and intestinal failure: consensus definitions and overview. Clin Gastroenterol Hepatol 2006; 4 (1): 6–10.
3. D’Antiga L, Goulet O. Intestinal failure in children: the European view. J Pediatr Gastroenterol Nutr 2013; 56 (2): 118–126. doi: 10.1097/MPG.0b013e318268a9e3.
4. Pironi L, Goulet O, Buchman A et al. Outcome on home parenteral nutrition for benign intestinal failure: a review of the literature and benchmarking with the European prospective survey of ESPEN. Clin Nutr 2012; 31 (6): 831–845. doi: 10.1016/j.clnu.2012.05.004.
5. NHS National Commissioning Group for highly specialised services. Strategic framework for intestinal failure and home parenteral nutrition services for adults in England [online]. Available from: www.specialisedservices.nhs.uk/library/28/Strategic_Framework_for_Intestinal_Failure_and_Home_Parenteral_Nutrition_Services_for_Adults_in_England_1.pdf.
6. Dreesen M, Foulon V, Hiele M et al. Quality of care for cancer patients on home parenteral nutrition: development of key interventions and outcome indicators using a two-round Delphi approach. Support Care Cancer 2013; 21 (5): 1373–1381. doi: 10.1007/s00520-012-1679-1.
7. Bozzetti F, Santarpia L, Pironi L et al. The prognosis of incurable cachectic cancer patients on home parenteral nutrition: a multicentre observational study with prospective follow-up of 414 patients. Ann Oncol 2014; 25 (2): 487–493. doi: 10.1093/annonc/mdt549.
8. Dreesen M, Foulon V, Vanhaecht K et al. Guidelines recommendations on care of adult patients receiving home parenteral nutrition: a systematic review of global practices. Clin Nutr 2012; 31 (5): 602–608. doi: 10.1016/j.clnu.2012.02.013.
9. Pironi L, Hébuterne X, Van Gossum A et al. Candidates for intestinal transplantation: a multicenter survey in Europe. Am J Gastroenterol 2006; 101 (7): 1633–1643.
10. Pironi L, Joly F, Forbes A et al. Home Artificial Nutrition & Chronic Intestinal Failure Working Group of the European Society for Clinical Nutrition and Metabolism (ESPEN). Long-term follow-up of patients on home parenteral nutrition in Europe: implications for intestinal transplantation. Gut 2011; 60 (1): 17–25. doi: 10.1136/gut.2010.223255.
11. Amiot A, Joly F, Alves A et al. Long-term outcome of chronic intestinal pseudo-obstruction adult patients requiring home parenteral nutrition. Am J Gastroenterol 2009; 104 (5): 1262–1270. doi: 10.1038/ajg.2009.58.
12. Dibb M, Carlson G, Abraham A et al. OC-034 Salvage of central venous catheters in HPN catheter-related blood stream infections is safe and effective: 18 years experience from a national centre. Gut 2012; 61 (Suppl 2): A14–A15. doi: 10.1136/gutjnl-2012-302514a.34.
13. Gabe SM, Culkin A. Abnormal liver function tests in the parenteral nutrition fed patient. Frontline Gastroenterol 2010; 1: 98–104. doi: 10.1136/fg.2009.000521.
14. National Institute of Clinical Excellence. Nutrition support in adults: oral nutrition support, enteral tube feeding and parenteral nutrition [online]. Available from: nice.org.uk/CG32/Guidance/pdf/ English.
15. Fitzgerald KA, MacKay MW. Calcium and phosphate solubility in neonatal parenteral nutrient solutions containing TrophAmine. Am J Hosp Pharm 1986; 43 (1): 88–93.