Hereditární pankreatitida jako příčina komplikací při léčbě závažného hematoonkologického onemocnění
Ondřej Pták1, Jan Schwarz1, Renata Vondráková2, Josef Sýkora1
+ Pracoviště
Souhrn
Úvod: Hereditární pankreatitidy jsou závažné, geneticky podmíněné poruchy uvolňování a aktivace trypsinogenu, které mohou buď kauzálně, nebo jako souběžný etiologický faktor způsobovat opakované epizody pankreatitidy, případně vést k rozvoji chronického zánětu slinivky břišní. Popis případu: Prezentujeme kazuistiku 2,5letého pacienta léčeného pro akutní lymfoblastickou leukemii, u něhož došlo během intenzivní fáze terapie k rozvoji akutní rekurentní pankreatitidy vedoucí k trvalým strukturálním změnám pankreatu bez poruchy jeho exokrinní nebo endokrinní funkce. Akutní pankreatitida může být vzácným nežádoucím účinkem některých chemoterapeutik. Vzhledem k netypickému opakování atak a jejich vzniku po podání chemoterapeutik, mezi jejichž nežádoucí účinky rozvoj pankreatitidy nepatří, bylo provedeno molekulárně genetické vyšetření cílené na hereditární pankreatitidy s pozitivním nálezem mutace v genu SPINK1. Závěr: Kazuistika ilustruje přínos cíleného pátrání po možných příčinách rekurentních pankreatitid včetně genetického vyšetření.
Klíčová slova
akutní pankreatitida, hereditární pankreatitida, akutní rekurentní pankreatitida, SPINK1, akutní lymfoblastická leukemie, chemoterapie
Úvod
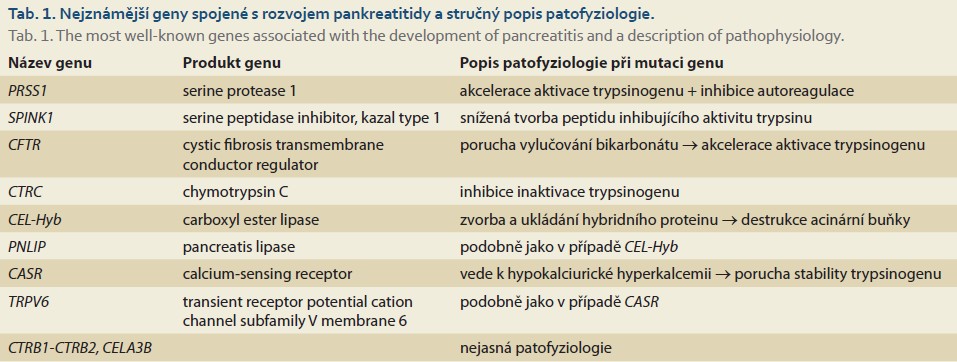
Akutní pankreatitida (AP) je závažné, potenciálně život ohrožující onemocnění. U dětí se nejčastěji setkáváme s mírnou edematózní formou. Mezi další formy zánětů slinivky dle délky jejich trvání patří akutní rekurentní pankreatitida (ARP), jež je charakterizována nejméně dvěma atakami pankreatitidy, mezi kterými dojde k úplnému ústupu bolestí břicha a/nebo ke kompletní normalizaci sérové amylázy/lipázy, a chronická pankreatitida (CP), u které bolesti břicha přetrvávají v souladu s nálezem dle zobrazovacích vyšetření, exokrinní nebo endokrinní dysfunkcí a/nebo histologickým potvrzením chronických zánětlivých změn [1,2]. U dětí a mladistvých má pankreatitida zpravidla rozdílnou etiologii než u dospělých pacientů. Až v 60 % případů se u dětí nepodaří etiologii objasnit. Mezi časté příčiny AP patří infekce, traumatické poškození, obstrukce pankreatických a/nebo žlučových vývodů a některá multisystémová onemocnění [3]. Jednou z možných příčin rozvoje pankreatitidy jsou mutace nejrůznějších genů, které vedou k intrapankreatickému uvolnění a aktivaci trypsinogenu. Poruchy na genetickém podkladě se souhrnně označují jako hereditární pankreatitidy (HP). Podmínkou pro toto označení je přítomnost některé ze známých mutací (PRSS1, SPINK1, CFTR, CTRC, CEL-hyb, PNLIP, CASR, TRPV6 a CELA 3B) [3,4], blíže tab. 1. Další podmínka pro označení HP je přítomnost proběhlé pankreatitidy u příbuzných v první nebo druhé linii. Ta však není absolutní (např. u mutací vzniklých de novo).
Kazuistika
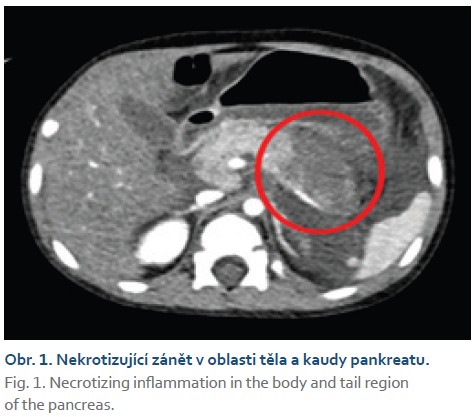
Chlapec (2,5 roku) byl hospitalizován na naší klinice pro akutní lymfoblastickou leukemii. V rámci protokolární léčby byla podána 10. den po jejím zahájení pegylovaná L-asparagináza (PEG-ASP). Pátý den po podání PEG-ASP se u chlapce objevily subfebrilní teploty. Vzhledem k souběžné výrazné leukopenii po předchozí chemoterapii byla zahájena antibiotická léčba. Následující den došlo laboratorně k výrazné elevaci sérové lipázy (27 μkat/l), kterou na našem pracovišti po podání asparaginázy pravidelně monitorujeme. Rozvoj pankreatitidy je totiž známým důsledkem toxicity asparaginázy [5–8]. Chlapec byl klinicky unavený, bledší. Na bolesti břicha si nestěžoval, nezvracel. Bylo doplněno ultrasonografické vyšetření břicha, v němž nebyl pankreas přehledný. Proto jsme doplnili CT vyšetření břicha, které odhalilo nekrotizující zánět pankreatu v oblasti kaudy a části těla s přítomným ascitem (obr. 1). Byla zahájena infuzní terapie a vyloučili jsme perorální příjem. Analgetika chlapec nevyžadoval. Postupně došlo na zavedených opatřeních k normalizaci hladin sérové lipázy, kontrolní USG pankreatu odhalilo suspekci na tvořící se pseudocystu. Zbývající část indukční fáze léčby ALL zvládl chlapec bez dalších významnějších komplikací, na jejím konci dosáhl cytologické remise. V průběhu další protokolární léčby již PEG-ASP podána nebyla.
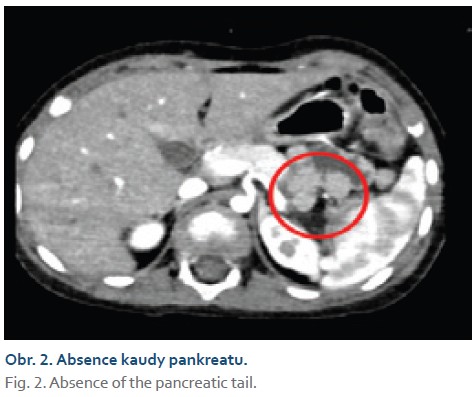
Také začátek konsolidační léčby (bloky cytarabinu, cyklofosfamid, merkaptopurin) prošel chlapec bez obtíží. Po odběru kostní dřeně v rámci zahájení protokolu M se u pacienta objevily vysoce elevované hladiny sérové lipázy fluktuující během dalších dní mezi normálními a vysoce pozitivními hodnotami. Chlapec byl po celou dobu bez klinických obtíží. Ultrasonografické vyšetření neodhalilo zánětlivé změny pankreatu, proto bylo doplněno CT, v němž byla nicméně zjištěna absence kaudy pankreatu (obr. 2). Opětovně byla zahájena standardní léčba pankreatitidy. Po normalizaci laboratorních parametrů bylo pokračováno v chemoterapii.
Den po podání první dávky vysokodávkovaného metotrexátu (HD-MTX) došlo u chlapce k vysoké elevaci sérové lipázy (27 μkat/l), klinicky byl chlapec zcela asymptomatický, zahájili jsme pouze hydrataci. Ultrasonografické vyšetření prokázalo edém hlavy a těla pankreatu s prosáknutím peripankreatické tkáně. Terapeuticky bylo rozhodnuto o redukci další dávky HD-MTX, jejíž podání a vyloučení proběhlo bez komplikací. Den po podání třetí dávky HD-MTX došlo k opětovné elevaci sérové lipázy (19,7 μkat/l), dle USG bylo patrné pouze mírné prosáknutí pankreatu. Po 3 dnech došlo k normalizaci ultrasonografického i laboratorního nálezu. Klinicky byl chlapec po celou dobu asymptomatický. Po této atace byl odebrán materiál k vyšetření genů hereditárních pankreatitid (konkrétně PRSS1 a SPINK1). Poslední čtvrtá dávka HD-MTX byla opětovně podána v redukované podobě. Podání i vyloučení MTX proběhlo bez komplikací.
V reintenzifikační fázi léčby ALL byla podána dle protokolu dvojice chemoterapeutik (vinkristin a doxorubicin). Následující den došlo k rozvoji bolestí břicha se zvracením, laboratorně výrazná elevace sérové lipázy (41 μkat/l). Ultrasonografické vyšetření bylo obtížně hodnotitelné. Zahájili jsme hydrataci s podáváním analgetik. Po týdnu od začátku obtíží bylo doplněno MR břicha s nálezem prokrvácené nekrózy pankreatu s nevelkým edémem. Terapeuticky bylo rozhodnuto o dalším podávání chemoterapie vždy v monoterapii. Po podání dalšího vinkristinu se nicméně opět objevila elevace sérové lipázy, tentokrát opět bez klinického korelátu a s časnou normalizací hladin. V rámci další ambulantní kontroly 2 týdny po poslední chemoterapii byla laboratorně zjištěna elevace sérové lipázy (9 μkat/l), bez klinických obtíží. Následující den progredovala hladina na 32 μkat/l. Ultrasonografické vyšetření prokázalo nález hemoragického zánětu pankreatu s prosáknutím okolní tukové tkáně. Po 2 dnech bylo doplněno MRCP, kde byla popsána progrese nekrózy s drobným ascitem a oboustranně patrným fluidotoraxem. Postupně došlo na zvyklé terapii k normalizaci laboratorního stavu, po celou dobu byl chlapec bez klinických obtíží. V rámci léčby ALL byla po této epizodě ukončena konvenční chemoterapie a chlapci byla podána jedna 28denní infuze blinatumomabu (anti-CD19) [9], kterou toleroval dobře. Po skončení infuze jsme zaznamenali jednorázovou elevaci sérové lipázy > 50 μkat/l, s normalizací následující den. Ukončením infuze blinatumomabu byla ukončena i intenzivní fáze léčby ALL.
Po zahájení udržovací terapie byl již chlapec zcela bez obtíží. Opakovaně byla nabrána hladina elastázy, která byla v normě. Glykemie byly u chlapce rovněž v normě. Dva týdny po zahájení udržovací terapie jsme obdrželi výsledky molekulárně genetického vyšetření metodou sekvenování nové generace. Byla zjištěna varianta C.101A>G p. (Asn34Ser) v genu SPINK1 v heterozygotní formě, která je rizikovým faktorem pro rozvoj chronické pankreatitidy. Přímá kauzalita mezi přítomností genu a rozvojem pankreatitidy u této varianty genu popsána nebyla. Na rozvoji epizod akutní pankreatitidy se tedy pravděpodobně podílela jak genetická predispozice, tak faktory vnějšího prostředí (chemoterapie, strava).
Aktuálně je chlapec bez klinických obtíží, v pokračující remisi svého primárního onemocnění (schéma 1).

Diskuze
V naší kazuistice popisujeme pacienta s ARP, který prodělal celkem pět atak pankreatitidy. Progrese do ARP se uvádí přibližně u 15–35 % dětí s AP [2,3]. Zároveň se předpokládá, že ARP je předstupněm chronické pankreatitidy [3]. Průběh u našeho pacienta byl komplikován rozvojem nekrózy, která se v literatuře uvádí u < 1 % dětí [10]. Ta následně vedla ke ztrátě části slinivky bez poruchy její funkce.
Při diferenciální diagnostice bylo primárně pomýšleno na infekci u imunosuprimovaného pacienta nebo toxický vliv chemoterapie. Infekční příčina nebyla nikdy prokázána. Pankreatitida jako nežádoucí toxický účinek léčby se uvádí u 3,2–19,9 % dětí [2]. Pankreatitida jako následek toxicity asparaginázy se vyskytuje u 2,3–11 % pacientů [11]. Ostatní chemoterapeutika, po kterých došlo u našeho pacienta k rozvoji pankreatitidy (metotrexát, vinkristin), se běžně se zvýšeným rizikem AP nepojí.
Prokázaná varianta genu SPINK1 u našeho pacienta zvyšuje riziko rozvoje chronické pankreatitidy. Produktem nemutovaného genu SPINK1 je peptid, který se váže k intrapankreatickému trypsinogenu a inhibuje asi 20 % jeho intrapankreatické aktivity. V případě mutované varianty k inhibici nedochází, což usnadňuje uvolnění a aktivaci trypsinogenu intrapankreaticky s následným rozvojem nekrózy [4].
Závěr
Rozvoj AP po podání chemoterapeutik, mezi jejichž nežádoucí účinky pankreatitida nepatří (metotrexát, vincristine), byl pro nás vodítkem k indikaci genetických vyšetření, která potvrdila patologickou variantu genu SPINK1. Tato varianta není zřejmě kauzální pro vznik pankreatitidy, ale představuje rizikový faktor pro její rozvoj a pravděpodobně se podílela na jejím vzniku spolu s toxickým působením pegylované asparaginázy, mezi jejíž známé nežádoucí účinky rozvoj pankreatitidy patří. U pacientů s ARP je vždy potřeba myslet i na geneticky podmíněné příčiny vzniku ataky pankreatitidy a cíleně po nich pátrat. Mezi běžně vyšetřované geny patří CFTR, PRSS1, SPINK1 ad.
ORCID autorů
O. Pták 0009-0008-1847-8738,
J. Schwarz 0000-0003-4214-8858,
J. Sýkora 0000-0002-1256-4570.
Doručeno/Submitted: 14. 11. 2025
Přijato/Accepted: 21. 11. 2025
Korespondenční autor
MUDr. Ondřej Pták
Dětská klinika LF UK a FN Plzeň
alej Svobody 80
304 60 Plzeň
ptako@fnplzen.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. BSPGHAN Pancreatitis Working Group. Guidelines for the diagnosis and management of acute pancreatitis in children. 2024 [online]. Dostupné z: https: //bspghan.org.uk/wp-content/uploads/2024/04/guidelines-for-the-diagnosis-and-management-of-pancreatitis-in-children.pdf.
2. Suzuki M, Sai JK, Shimizu T. Acute pancreatitis in children and adolescents. World J Gastrointest Pathophysiol 2014; 5(4): 416–426. doi: 10.4291/wjgp.v5.i4.416.
3. Suzuki M, Minowa K, Isayama H et al. Acute recurrent and chronic pancreatitis in children. Pediatr Int 2021; 63(2): 137–149. doi: 10.1111/ped.14415.
4. Yu B, Yu Y, Wang X et al. A narrative review on the role of genetics in children with acute recurrent pancreatitis and chronic pancreatitis. Pediatr Investig 2023; 7(4): 268–276. doi: 10.1002/ped4.12404.
5. Bai HX, Lowe ME, Husain SZ. What have we learned about acute pancreatitis in children? J Pediatr Gastroenterol Nutr 2011; 52(3): 262–270. doi: 10.1097/MPG.0b013e3182061d75.
6. Zhou H, Lu J, Wang T et al. Acute pancreatitis following asparaginase treatment in pediatric acute lymphoblastic leukemia with heterozygous SPINK1 c.194 + 2T>C intronic variant: a case report. Front Pediatr 2024; 12: 1493362. doi: 10.3389/fped.2024.1493362.
7. Hijiya N, van der Sluis IM. Asparaginase-associated toxicity in children with acute lymphoblastic leukemia. Leuk Lymphoma 2016; 57(4): 748–757. doi: 10.3109/10428194.2015.1101098.
8. Tang HJ, Chen CC, Hu WT et al. Effects of asparaginase-associated pancreatitis in children with haematological tumors. Front Oncol 2024; 14: 1472049. doi: 10.3389/fonc.2024.1472049.
9. Šrámková L. Nové léčebné postupy v léčbě dětské akutní lymfoblastické leukémie. Ces Slov Pediat 2022; 77(5): 265–271. doi: 10.55095/ CSPediatrie2022/042.
10. Raizner A, Phatak UP, Baker K et al. Acute necrotizing pancreatitis in children. J Pediatr 2013; 162(4): 788–792. doi: 10.1016/j.jpeds.2012.09.037.
11. Maziarczyk A, Lambach M, Kura P et al. Acute pancreatitis in children with acute lymphoblastic leukemia. Acta Haematologica Polonica 2023; 54(5): 295–301. doi: 10.5603/ahp.95319.