Hepatobiliárne komplikácie autozomálne recesívnej polycystickej choroby obličiek
Miroslava Brndiarová1, Nikola Haláčová1, Marek Kozár2, Michal Demeter3, Martin Schnierer Orcid.org 3, Zuzana Havlíčeková Orcid.org 1
+ Pracoviště
Souhrn
Úvod: Polycystická autozomálne recesívna choroba obličiek (ARPCHO) je raritná, značne fenotypovo variabilná primárna cíliopatia. Poškodenie obličiek a pečene sú typickými prejavmi a prognóza ochorenia závisí od ich progresie v čase. Hlavným extrarenálnym prejavom je fibrocystická prestavba pečene, ktorá sa prejavuje intrahepatálnou portálnou hypertenziou a cholangitídou. Metódy: Retrospektívne zhodnotenie výskytu a vývoja hepatobiliárnych prejavov ochorenia. Výsledky: Do súboru bolo zaradených 8 detí s polycystickou autozomálne recesívnou chorobou obličiek. Poškodenie obličiek a hypertenzia boli prítomné u všetkých detí v súbore. Hepatobiliárne prejavy boli popísané u 5 detí (62,5 %). Trombocytopénia predchádzala splenomegáliu v časovom období jeden rok. Súčasťou výsledkov sú aj tri kazuistiky. Záver: Pacienti s ARPCHO by mali byť cielene vyšetrení so zameraním na posúdenie hepatálnych prejavov ochorenia.
Klíčová slova
autozomálne recesívna polycystická choroba obličiek, fibrocystická prestavba pečene, ezofágové varixy, trombocytopénia

Úvod
Polycystická autozomálne recesívna choroba obličiek (ARPCHO) je raritná, geneticky podmienená primárna cíliopatia. Prevalencia ochorenia je 1: 20 000 živonarodených detí. Podkladom ochorenia je mutácia v PKHD1 a DZIP1L géne [1]. Ochorenie patrí do skupiny vrodených hepatorenálnych fibrocystických syndrómov. Typická je cystická dilatácia zberných kanálikov obličiek s dilatovanými zbernými kanálikmi žlčových ciest a periportálna fibróza rôzneho stupňa, ktorá je prítomná u všetkých pacientov s ARPCHO. Ochorenie je značne fenotypovo variabilné a poškodenie obličiek a pečene je progresívne [2,3].
Tradične sa ARPCHO delí na perinatálny, neonatálny, infantilný a juvenilný typ. Toto delenie ale často nezodpovedá klinickým pozorovaniam, pri ktorých sa zisťuje fenotypové prekrývanie medzi stupňom poškodenia obličiek a pečene. Praktickejšie je rozdelenie na novorodeneckú a neskorú (juvenilnú) formu ochorenia [4]. Novorodenecká forma sa manifestuje už perinatálne. Obličky sú zväčšené, prítomná je faciálna dysmorfia, dychová nedostatočnosť, znížená funkcia obličiek a hypertenzia. Obličkové zlyhávanie progreduje v čase a je potrebná dialyzačná a transplantačná liečba. Poškodenie pečene nie je v tomto období významné. Prítomný je určitý stupeň periportálnej fibrózy s normálnou funkciou pečene. Jej poškodenie sa väčšinou prejaví v neskoršom veku, ak dieťa prežíva na dialýze alebo je transplantované alebo ak sa dožije adolescencie a dospelosti [1]. Neskorá (juvenilná) forma sa klinicky manifestuje až v predškolskom alebo školskom veku. Typický je ťažký stupeň portálnej fibrózy s príznakmi poškodenia pečene s minimálnym postihnutím obličkových tubulov. Okrem periportálnej pečeňovej fibrózy sa popisujú drobné parenchýmové cysty alebo dilatované intrahepatálne žlčové cesty (Caroliho choroba) [5]. Hepatocelulárna funkcia zvyčajne zostáva stabilná. Pečeňové enzýmy v sére (AST, ALT a GMT) sa vo väčšine prípadov pohybujú vo fyziologickom rozmedzí a parametre cholestázy môžu byť zvýšené. Prejavom progresie intrahepatálnej portálnej hypertenzie je vývoj ezofágových a gastrických varixov s rizikom krvácania, hypersplenizmus a trombocytopénia [3]. Biliárne cystické poškodenie predisponuje k vzniku bakteriálnej cholangitídy spôsobenej stázou žlče, ktorá môže prebiehať aj fatálne. U dospelých pacientov je aj častejší výskyt nádorových ochorení pečene, predovšetkým cholangiokarcinómu [3]. Časom sa funkcia pečene zhoršuje a v určitých prípadoch je indikovaná aj transplantácia pečene častejšie v dospelosti [3,5].
Súbor a metódy
Cieľom predloženej retrospektívnej práce bolo zhodnotiť výskyt a vývoj hepatobiliárnych prejavov ARPCHO. Do súboru bolo zaradených 8 pacientov s diagnózou ARPCHO sledovaných v rokoch 2007–2023. Ochorenie bolo u 7 pacientov potvrdené genetickým vyšetrením.
Výsledky
Súbor tvorilo 8 detí (1 chlapec, 7 dievčat) s diagnózou ARPCHO. V súbore boli aj dvaja súrodenci (dievčatá). Genetické vyšetrenie bolo realizované u 7 detí (87,5 %) a potvrdilo určitý typ mutácie v PKHD1 géne. Všetky deti (100 %) mali v priebehu sledovania ultrasonografickým vyšetrením (USG) popísaný typický obraz pre ARPCHO (zväčšené obličky so zmazanou echoštruktúrou a s početnými bilaterálnymi cystickými ložiskami). Rozdiel bol iba v čase prvej pozitivity USG vyšetrenia. Hypertenzia ako jeden z hlavných prejavov ochorenia bola zaznamenaná u všetkých detí (100 %). Dialyzačnú liečbu vyžadovali 4 deti (50 %) a u všetkých bola použitá peritoneálna dialýza. Bilaterálna nefrektómia bola potrebná u 1 dieťaťa (12,5 %). V priebehu sledovaného obdobia 4 deti (50 %) exitovali na komplikácie súvisiace so základným ochorením.
Hepatobiliárne prejavy ochorenia boli popísané u 5 detí (62,5 %). Práve tieto prejavy boli u jedného dieťaťa prvým prejavom ARPCHO. Trombocytopénia predchádzala splenomegáliu v časovom období jeden rok. Súčasťou výsledkov sú aj tri kazuistiky. Najdôležitejšie charakteristiky sledovaného súboru sú uvedené v tab. 1.

Kazuistika 1
Dievča bolo vo veku 3 rokov odoslané do gastroenterologickej ambulancie našej kliniky za účelom diferenciálnej diagnostiky hepatosplenomegálie. Dieťa sa narodilo z tretej fyziologickej gravidity, pôrodná váha a dĺžka boli primerané. Ultrasonografické vyšetrenie obličiek bolo po narodení v norme.
Vo veku 3 rokov prekonalo salmonelovú enteritídu, ktorá bola komplikovaná febrilným stavom. V krvnom obraze bola zaznamenaná anémia (hemoglobín 87 g/l, norma 100–123 g/l) a trombocytopénia (100 × 109, norma 170–550 × 109), hemokoagulačné parametre boli v norme, sérové koncentrácie aminotransferáz boli na hornej hranici normy (ATS 0,77 μkat/l, norma 0,10–0,60 μkat/l; ALT 0,44 μkat/l, norma 0,10–0,60 μkat/l). Na ultrasonografickom vyšetrení brucha dominovala hepatosplenomegália. Pečeň bola zväčšená v pozdĺžnom smere v medioklavikulárnej čiare veľkosti 12,5 cm, parenchým bol výrazne nehomogénny, zvýšenej echogenity s niekoľkými cystoidnými útvarmi. Žlčník bol zväčšený. Portálna véna mala primeranú šírku, ale vyšší prietok 28 cm/s. Obličky boli bez patologických zmien. CT portografia potvrdila hepatomegáliu (LL 16 cm, CC 10 cm, AP 12 cm) a splenomegáliu (12 cm × 6,5 cm). Pravý a ľavý ductus hepaticus bol dilatovaný, ductus choledochus bol rozšírený a cholecysta bola zväčšená. Ďalším nálezom bol maloobjemový ascites. V bioptickej vzorke pečene bol parenchým pečene tvorený z objemových a nodulárnych formácií pečeňových buniek. V periportálnych hepatocytoch bol obraz intracelulárnej cholestázy, apoptózy a nekrózy. Periportálne polia boli výrazne fibroticky rozšírené s prítomnými hrubými pruhmi väziva. Malé a stredne veľké žlčovody boli zmnožené. Popísaný obraz zodpovedal vrodenej malformácii žlčovodov typu kongenitálnej pečeňovej fibrózy, ktorá býva často asociovaná s ARPCHO. Genetické vyšetrenie potvrdilo v géne PKHD1 prítomnosť troch patogénnych variantov v heterozygotnom stave. Funkčné vyšetrenie obličiek bolo v norme. Ambulantné 24-hodinové meranie tlaku (ABPM) nepotvrdilo hypertenziu (TK pod 90. percentil).
Vo veku 5 rokov boli rodičmi dieťaťa referované nechutenstvo, bolesti brucha a početné objemnejšie stolice. V bioptickej vzorke duodenálnej sliznice dominoval obraz deštruktívnej lézie typu 3a Marshovej klasifikácie a v sliznici antra žalúdka obraz chronickej aktívnej antrumgastritídy asociovanej s infekciou Helicobacter pylori. Gastroezofágové varixy prítomné neboli. Kontrolné USG vyšetrenie popísalo zväčšené obličky a mikrocystoidné útvary bilaterálne. Pri opakovanom ABPM bola potvrdená hypertenzia.
Vo veku 13 rokov bolo prijaté v spádovej nemocnici pre vracanie krvi a hypotenziu. V laboratórnych parametroch bola zaznamená anémia a trombocytopénia (95 × 109). Po preklade na naše pracovisko bola realizovaná ezofagogastroduodenofibroskopia (EGD) s nálezom ezofágových varixov a portálnej gastroduodenopatie. Bola vykonaná endoskopická ligácia. Na aktuálnom ultrasonografickom vyšetrení je pečeň zväčšená s nehomogénnym echogénnejším parenchýmom s nepravidelnými líniami a s viacerými cystoidnými útvarmi (4–5 mm). Obličky sú zväčšené s echogénnejším parenchýmom a s mikrocystami (obr. 1).
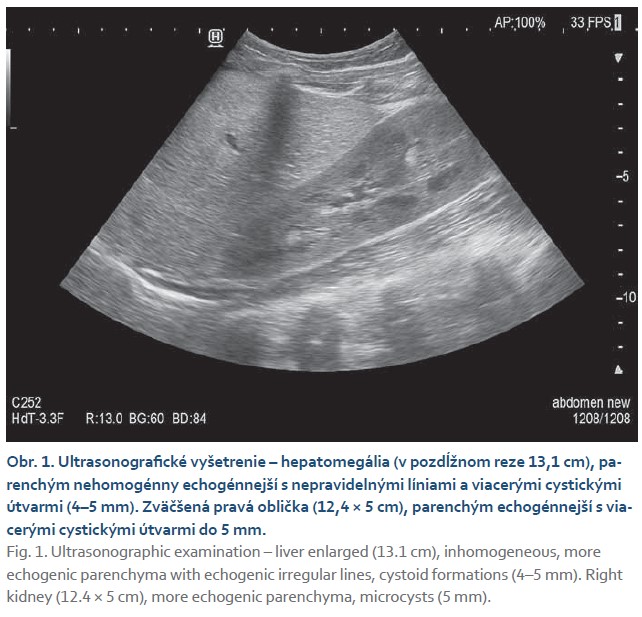
Kazuistika 2
Dievča sa narodilo z prvej sledovanej gravidity pre perinatálne popísané polycystické obličky. Pri prvom ultrasonografickom vyšetrení bol na obličkách popisovaný tzv. obraz rozsypanej soli a korenia (zväčšené obličky so zvlnenými kontúrami, veľmi zle ohraničené voči okoliu, s kalcifikátmi, kortikomedulárna dediferenciácia, s početnými mikrocystami obojstranne). Pečeň a slezina neboli pri narodení zväčšené.
Od troch rokov bola postupne v krvnom obraze pozorovaná trombocytopénia (do 110 × 109). Na USG vyšetrení brucha bola pozorovaná hepatosplenomegália. Pečeň mala v pozdĺžnom smere veľkosť 13,3 cm, parenchým bol echogénnejší, nehomogénnej echoštruktúry. Intra- a extrahepatálne žlčové cesty neboli dilatované. Slezina bola zväčšená v pozdĺžnom reze veľkosti 12,5 × 6 cm, parenchým bol primeranej echogenity. V bioptickej vzorke pečene bol obraz kongenitálnej pečeňovej fibrózy. Ezofagogastroduodenofibroskopické vyšetrenie bolo fyziologické a bez prítomnosti varixov. Doplnená bola aj liečba hypertenzie.
Vo veku 5 rokov bola pre progresiu renálneho zlyhávania zaradená do pravidelného dialyzačného programu peritoneálnou dialýzou. Dialyzačná liečba bola komplikovaná peritonitídou a neskôr technickými komplikáciami. Celkový stav a laboratórne parametre dieťaťa neboli uspokojivé. Postupne došlo k vymiznutiu diurézy. Dievča bolo malnutričné a trpelo nechutenstvom. Hepatosplenomegália progredovala. Navrhovanú výživu sondou a realizáciu EGD rodičia odmietali.
Vo veku 8 rokov bolo dievča prijaté na našu kliniku pre odmietanie stravy a tekutín. V klinickom obraze bola prítomná tachykardia, hypotenzia a dehydratácia, v laboratórnych parametroch bola zaznamenaná anémia a trombocytopénia. Nasledujúci deň po prijatí došlo u dieťaťa k poruche vedomia s rýchlou úpravou s následným vracaním čerstvej krvi s koagulami a s odchodom melenickej stolice neskôr aj s prímesou čerstvej krvi. Bola realizovaná EGD s popisom veľkých ezofágových varixov a početných krvácajúcich erózií žalúdka. Aj napriek endoskopickému ošetreniu varixov a konzervatívnej liečbe bolo pozorované opakované krvácanie, pridružila sa aj dysfunkcia ostatných orgánov (multiorgánové zlyhávanie). Rodičia vzhľadom na nepriaznivý vývoj a zlej prognóze ochorenia vyjadrili želanie, aby sa už liečba a starostlivosť nerozširovali a dieťa v priebehu ďalších dní exitovalo.
Kazuistika 3
Dievča sa narodilo z druhej sledovanej gravidity pre perinatálne popísané polycystické obličky a pozitívnu rodinnú anamnézu (sestra s geneticky potvrdenou diagnózou ARPCHO). Po narodení boli obličky zväčšené so známkami zlyhávania a bola prítomná hypertenzia. Ultrasonograficky bola popisovaná hepatomegália s drobnými cystickými ložiskami. V priebehu ďalšieho obdobia bola pozorovaná progresia obličkového zlyhávania s potrebou dialyzačnej liečby (od 12 rokov). Progredovala aj hepatomegália. Od 2 rokov bola v krvnom obraze pozorovaná trombocytopénia v postupnej progresii a splenomegália. Dialyzačná liečba a starostlivosť o dieťa bola značne komplikovaná pre ťažký autizmus a zlú spoluprácu.
Vo veku 14 rokov bola realizovaná EGD pre progresiu hepatosplenomegálie a trombocytopénie, ako aj pre referované intermitentné vracanie stravy a riedke stolice. Bola verifikovaná antrumgastritída, bez nálezu varixov. V priebehu 5 mesiacov od poslednej EGD bolo dieťa akútne prijaté pre septický stav (febrílie do 40 °C), hypotenziu, vracanie, bolesti brucha pod pravým rebrovým oblúkom a intoleranciu tekutín a stravy. V laboratórnych parametroch bola prítomná vysoká zápalová aktivita (C-reaktívny proteín 254 mg/l, norma 0–5 mg/l, prokalcitonín 82 µg/l, norma 0–0,5 µg/l). V krvnom obraze bola pozorovaná trombocytopénia (25 × 109) a anémia (Hb 72 g/l). Hepatálne enzýmy boli zvýšené (AST 21 µkat/l, ALT 15,3 µkat/l, GMT 1,47 µkat/l). Parametre cholestázy boli v norme. Ultrasonograficky bola pečeň zväčšená, v pravom laloku v S7–8 sa zobrazilo ložisko nehomogénneho parenchýmu na ploche 10 cm s echogénnymi okrskami s hypo- až anechogénnymi cystoidnými až tubulárnymi štruktúrami. Natívne CT vyšetrenie brucha (podanie kontrastnej látky nebolo možné vzhľadom na oligúriu, hemodialýzu nebolo možné realizovať) popísalo v S7–8 nehomogénne ložisko (LL 40 mm, CC 35 mm, AP 24 mm) s viacpočetnými kalcifikátmi. Dorzokaudálne od tohto ložiska boli prítomné slepo končiace vinuté tubulovité štruktúry charakteru abscesu. Slezina veľkosti 17,5 × 10 cm bola významne zväčšená, bez ložiskových zmien s vinutými mierne dilatovanými cievami v okolí (varikózne zmeny). Keďže nebolo možné podať kontrastnú látku počas CT vyšetrenia, doplnená bola kontrastná ultrasonografia pečene (CEUS – contrast-enhanced ultrasound). V priebehu vyšetrenia sa pozorovalo nehomogénne sýtenie popisovaného ložiska kontrastnou látkou. V arteriálnej fáze bol zaznamenaný mierne hyperintenzívny signál kontrastnej látky v periférnych častiach ložiska, ako aj v septách intralezionálne, s výpadkami signálu v hypoechogénnych oblastiach ložiska (obr. 2a). Táto hypointenzivita signálu pretrvávala v priebehu všetkých fáz CEUS vyšetrenia. V portálnej, ako aj neskorej fáze bolo pozorované postupné zoslabovanie signálu kontrastnej látky v oblastiach, ktoré boli v arteriálnej fáze hypersignálne (obr. 2b). Začatá bola kombinovaná antibiotická liečba (karbapeném, linezolid, ceftriaxon, metronidazol). Opakované kultivačné vyšetrenia (hemokultúra, dialyzát) boli bez dôkazu patogénu. Zvažovaná bola aj punkcia a drenáž abscesového ložiska, ale vzhľadom na stav pacientky a nemožnosť realizovať hemodialýzu nebola uskutočnená. Kombinovaná antibiotická liečba bola ukončená na 21. deň. Kontrolná kontrastná ultrasonografia popisovala začínajúcu kolikváciu v abscesovom ložisku. Po troch mesiacoch sa na USG vyšetrení pečene zobrazilo v S7–8 neostro ohraničené ložisko s echogénnymi okrajmi na ploche cca 75 mm.
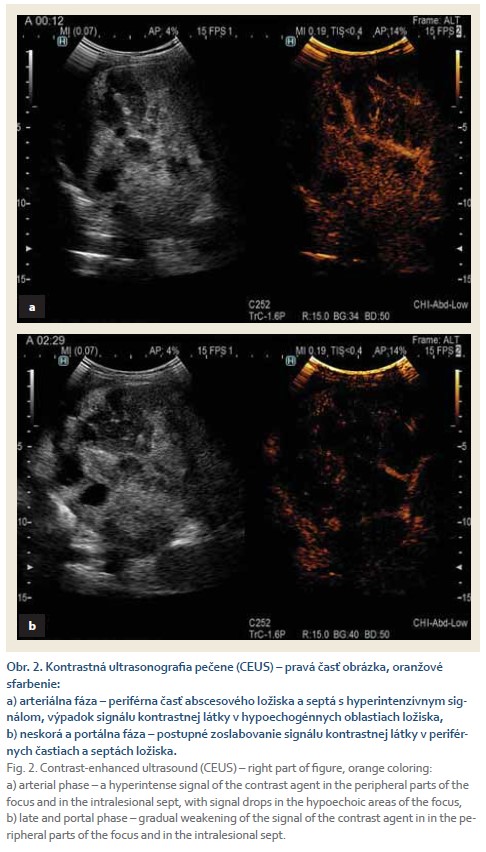
Diskusia
Funkcia obličiek a poškodenie pečene sú u pacientov s ARPKD značne variabilné a nezávislé. Stupeň poškodenia pečene nekoreluje so stupňom poškodenia obličiek. Existuje určitý vzťah medzi genotypom a fenotypom, ale jednoznačná variabilita závažnosti ochorenia nie je daná len typom mutácie v PKHD1 géne [2,6].
Ultrasonografický obraz poškodenia obličiek a pečene nie je u pacientov s ARPCHO špecifický. Najčastejšie sa popisujú zväčšené obličky, hyperechogénny parenchým s poruchou kortikomedulárnej diferenciácie a kortikálne mikrocysty [1]. Skoré štádium vrodenej fibrózy pečene je často ultrasonograficky asymptomatické. Biopsia pečene má v diagnostike ARPCHO väčšiu úlohu a to predovšetkým u pacientov s minimálnym alebo netypickým poškodením obličiek [7].
Dostupná literatúra popisuje individuálne kazuistiky a súbory pacientov, v ktorých sa popisuje poškodenie pečene [5,8]. Práca autorov Gunay-Aygun et al (2013), ktorá zozbierala 73 pacientov vo veku 1 až 56 rokov, je jednou z väčších štúdií. Z počtu 22 pacientov s ezofágovými varixami malo 5 pacientov prítomné krvácanie, ktoré sa objavilo v detskom, ale aj dospelom veku. Koncentrácie sérových transamináz a alkalickej fosfatázy boli u väčšiny pacientov fyziologické alebo len mierne zvýšené. Splenomegáliu malo 47 pacientov a jej stupeň koreloval s počtom trombocytov v krvnom obraze. Autori nepreukázali žiadnu koreláciu medzi funkciou obličiek a portálnou hypertenziou. Frekvencia výskytu portálnej hypertenzie u pacientov s miernym poškodením obličiek bola podobná ako u pacientov so závažným poškodením [6]. V našom súbore máme podobné zistenia.
Intrahepatálna portálna hypertenzia je najvýznamnejším prejavom poškodenia pečene s ARPCHO [3,9] a rozvinie sa až u dvoch tretín pacientov [6]. Akútne krvácanie z pažerákových varixov je závažná komplikácia portálnej hypertenzie, ktorá ohrozuje život pacienta a vyžaduje akútne endoskopické ošetrenie. Z pohľadu ich preventívnej diagnostiky je najspoľahlivejšia EGD. Nie sú ale vypracované jednoznačné odporúčania vo frekvencii realizácie tohto vyšetrenia u pacientov s ARPCHO [7]. U detí s rekurentným krvácaním z varixov možno zvážiť chirurgické riešenie vytvorením portosystémového šantu. Komplikáciou môže byť hepatálna encefalopatia, ktorá má nepriaznivý vývoj a môže byť potencovaná aj súčasnou urémiou [7]. Stupeň portálnej hypertenzie je ťažko kvantifikovať. Najlepším prediktorom jej závažnosti je počet krvných doštičiek v krvnom obraze. Trombocytopénia má skorý nástup, ale u pacientov s ARPKD je nedostatočne diagnostikovaná [6]. Ultrasonografické vyšetrenie pečene a sleziny má dobrý informatívny charakter. Podľa niektorých odporučení by mali pacienti minimálne jedenkrát ročne podstúpiť USG vyšetrenie pečene a sleziny a vyšetrenie krvného obrazu s počtom trombocytov [6].
Pre vysoké riziko vzniku bakteriálnej cholangitídy by sa malo toto ochorenie aktívne vyhľadávať u pacientov s ARPCHO, febrilným stavom a bolesťami brucha [2]. Zriedkavé akútne cholangitídy môžu byť liečené prerušovanou antibiotickou liečbou, ale ak sú prítomné recidívy, zvažovaná by mala byť dlhodobá antibiotická liečba. Recidívy chronickej infekcie môžu byť ťažko zvládnuteľné pre nedostatočný odtok infikovanej žlče. Vo všeobecnosti sa na zvýšenie vylučovania žlče používa kyselina ursodeoxycholová. V prípade pacientov s cholangitídou a ARPCHO sú len obmedzené informácie o jej podpornom a preventívnom účinku [10].
Diagnostika pečeňových abscesov je založená na CT vyšetrení s podaním kontrastnej látky. U pacientov s chronickým obličkovým zlyhávaním môže byť podanie kontrastnej látky problematické z dôvodu jej nefrotoxicity. Kontrastná ultrasonografia (CEUS) je v súčasnosti schválená a odporúčaná diagnostická metóda druhej voľby v diferenciálne diagnostickom algoritme fokálnych lézií pečene. Diagnostika prebieha v reálnom čase bez potreby špeciálnej prípravy pred výkonom, nezaťažuje pacienta radiačným žiarením, môže byť realizovaná aj u pacientov so zníženou funkciou obličiek [11]. CEUS obraz abscesového ložiska v pečeni závisí od etiologického agens a od štádia, v ktorom je vyšetrované. Všeobecne v priebehu arteriálnej fázy dochádza k typickému zosilneniu signálu kontrastných mikrobublín na periférii abscesového ložiska pečene a v jeho septách za súčasného zosilnenia signálu okolitého kongestívneho pečeňového parenchýmu. V kolikvujúcich intralezionálnych oblastiach sa nepozoruje zvýraznenie signálu v arteriálnej ani portálnej fáze. V neskorej fáze postupne zoslabuje signál kontrastných mikrobublín v ložisku s pretrvávajúcou hyposignalitou v kolikvujúcich častiach ložiska [12,13].
Liečba ARPCHO je iba symptomatická. U pacientov s neskorou (juvenilnou) formou je zameraná na liečbu komplikácií portálnej hypertenzie. Rekurentná cholangitída alebo nekontrolovateľná portálna hypertenzia sú indikáciou transplantácie pečene [14,15]. Pre kombinovanú transplantáciu pečene a obličky nie sú jednoznačné odporučenia. Indikovaná je pri poškodení pečene a súčasnom významnom poškodení obličkových funkcií [15,16]. V pohľadu úmrtnosti nie je kombinovaná transplantácia spojená s väčšou úmrtnosťou v porovnaní s transplantáciou jedného orgánu [15]. Anamnéza cholangitídy u pacientov indikovaných na transplantáciu obličiek je rizikovým faktorom z dôvodu jej možnej rekurencie pri imunosupresívnej liečbe. Preto by mala byť v týchto prípadoch zvažovaná kombinovaná transplantácia [17].
Záver
Závažnosť niektorých ochorení je daná nielen jej hlavnými prejavmi, ale aj ich komplikáciami. Nielen zlyhanie obličiek, ale aj fibrocystická prestavba pečene a stupeň portálnej hypertenzie určujú prognózu ARPCHO. Dlhodobý vývoj pacientov s ARPKD je heterogénny a nezávisí od veku v čase diagnózy.
ORCID autorov
M. Brndiarová ORCID 0000-0002-8446-5678,
M. Kozár ORCID 0009-0009-1497-6817,
M. Demeter ORCID 0000-0003-4585-9380,
M. Schnierer ORCID 0000-0001-9880-619X,
Z. Havličeková ORCID 0000-0001-5336-9942.
Doručené/Submitted: 3. 7. 2023
Prijaté/Accepted: 1. 8. 2023
doc. MUDr. Zuzana Havlíčeková, PhD.
Klinika detí a dorastu
JLF UK a UN Martin
Kollárova 2
036 01 Martin
zhavlicekova@gmail.com
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Gimpel C, Avni FE, Bergmann C et al. Perinatal diagnosis, management, and follow-up of cystic renal diseases: A clinical practice recommendation with systematic literature reviews. JAMA Pediatr 2018; 172(1): 74–86. doi: 10.1001/jamapediatrics.2017.3938.
2. Dorval G, Boyer O, Couderc A et al. Long-term kidney and liver outcome in 50 children with autosomal recessive polycystic kidney disease. Pediatr Nephrol 2021; 36(5): 1165–1173. doi: 10.1007/s00467-020-04808-9.
3. Srinath A, Shneider BL. Congenital hepatic fibrosis and autosomal recessive polycystic kidney disease. J Pediatr Gastroenterol Nutr 2012; 54(5): 580–587. doi: 10.1097/MPG.0b013e31824711b7.
4. Liebau MC. Early clinical management of autosomal recessive polycystic kidney disease. Pediatr Nephrol 2021; 36(11): 3561–3570. doi: 10.1007/s00467-021-04970-8.
5. Turkbey B, Ocak I, Daryanani K et al. Autosomal recessive polycystic kidney disease and congenital hepatic fibrosis (ARPKD/CHF). Pediatr Radiol 2009; 39(2): 100–111. doi: 10.1007/s00247-008-1064-x.
6. Gunay-Aygun M, Font-Montgomery E, Lukose L et al. Characteristics of congenital hepatic fibrosis in a large cohort of patients with autosomal recessive polycystic kidney disease. Gastroenterology 2013; 144(1): 112–121. doi: 10.1053/j.gastro.2012.09.056.
7. Wehrman A, Kriegermeier A, Wen J. Diagnosis and Management of Hepatobiliary Complications in Autosomal Recessive Polycystic Kidney Disease. Front Pediatr 2017; 5: 124. doi: 10.3389/fped.2017.00124.
8. Burgmaier K, Kilian S, Bammens B et al. Clinical courses and complications of young adults with Autosomal Recessive Polycystic Kidney Disease (ARPKD). Sci Rep 2019; 9(1): 7919. doi: 10.1038/s41598-019-43488-w.
9. Majeed AN, Font-Montgomery E, Lukose L et al. Prospective Evaluation of Kidney and Liver disease in Autosomal Recessive Polycystic Kidney Disease-Congenital Hepatic Fibrosis. Mol Genet Metab 2020; 131(1–2): 267–276. doi: 10.1016/ j.ymgme.2020.08.006.
10. Ros E, Navarro S, Bru C et al. Ursodeoxycholic acid treatment of primary hepatolithiasis in Caroli’s syndrome. Lancet 1993; 342(8868): 404–406. doi: 10.1016/0140-6736(93)92817-D.
11. D’Onofrio M, Crosara S, De Robertis R et al. Contrast-Enhanced Ultrasound of Focal Liver Lesions. AJR Am J Roentgenol 2015; 205(1): 56–66. doi: 10.2214/AJR.14.14203.
12. Kishina M, Koda M, Tokunaga S et al. Usefulness of contrast-enhanced ultrasound with Sonazoid for evaluating liver abscess in comparison with conventional B-mode ultrasound. Hepatol Res 2015; 45(3): 337–342. doi: 10.1111/hepr.12347.
13. Michnová Z, Pršo M, Zúbriková L et. al. Diagnostika ložiskových lézí jater u dětí s využitím kontrastní ultrasonografie. Gastroent Hepatol 2019; 73(6): 481–487. doi: 10.14735/amgh2019481.
14. Ko JS, Yi NJ, Suh KS et al. Pediatric liver transplantation for fibropolycystic liver disease. Pediatr Transplant 2012; 16(2): 195–200. doi: 10.1111/j.1399-3046.2012.01661.x.
15. Mekahli D, van Stralen KJ, Bonthuis M et al. ESPN/ERA-EDTA Registry Kidney versus combined kidney and liver transplantation in young people with autosomal recessive polycystic kidney disease: data from the European Society for Pediatric Nephrology/European Renal Association-European Dialysis and Transplant (ESPN/ERAEDTA) Registry. Am J Kidney Dis 2016; 68: 782–788. doi: 10.1053/j.ajkd.2016.06.019.
16. Millwala F, Segev DL, Thuluvath PJ. Caroli’s disease and outcomes after liver transplantation. Liver Transpl 2008; 4(1): 11–7. doi: 10.1002/lt.21366.
17. Wen J, Furth SL, Ruebner R. Kidney and liver transplantation in children with fibrocystic liver-kidney disease: data from the US scientific registry of transplant recipients: 1990–2010. Pediatr Transplant 2014; 18: 726–732. doi: 10.1111/petr.12330.