Eozinofilní ezofagitida u dětských pacientů – aktuální poznatky a zkušenosti z klinické praxe
Marek Vebr1, Jan Forejt1, Josef Sýkora1, Jan Schwarz1
+ Pracoviště
Souhrn
Eozinofilní ezofagitida (EoE) je chronické, progredující a imunitně zprostředkované onemocnění jícnu charakterizované výraznou infiltrací eozinofilů ve sliznici (≥ 15 eozinofilů na jedno zorné pole v alespoň jednom bioptickém vzorku) při absenci jiných příčin ezofageální eozinofilie. Specifické rizikové faktory vzniku onemocnění nejsou známy, avšak mužské pohlaví, atopie a pozitivní rodinná anamnéza významně zvyšují riziko jeho rozvoje. V osobní anamnéze bývá často přítomna konkomitance astmatu, alergické rýmy, atopické dermatitidy nebo potravinové alergie. Může být i poléková (např. orální imunoterapie). Klinické projevy jsou věkově závislé. U kojenců a mladších dětí bývají symptomy nespecifické – odmítání potravy, zvracení a neprospívání. U starších dětí a adolescentů se častěji objevuje dysfagie, odynofagie, regurgitace či uvíznutí sousta v jícnu. Diagnóza EoE vychází z kombinace klinické manifestace, endoskopického vyšetření a histologického zpracování bioptických vzorků. Rozhodující je průkaz eozinofilní infiltrace sliznice jícnu alespoň v jednom odebraném vzorku. Léčba zahrnuje podávání inhibitorů protonové pumpy, topických kortikosteroidů nebo zavedení eliminační diety. Cílem článku je prezentovat problematiku tohoto onemocnění v dětském věku a publikovat zkušenosti z našeho pracoviště.
Klíčová slova
eozinofilní ezofagitida, pediatrie, dysfagie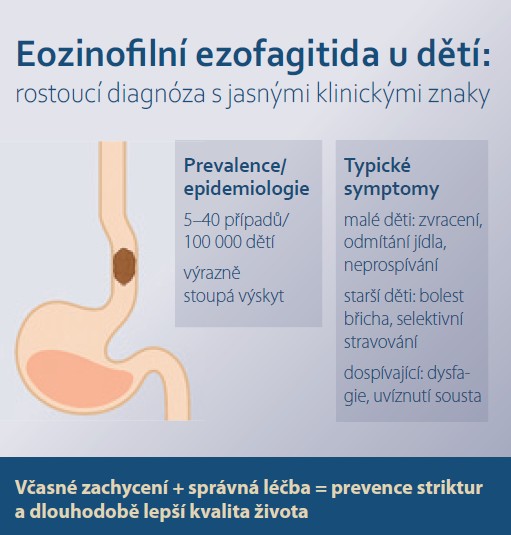
Úvod
Eozinofilní ezofagitida je chronické, imunitně zprostředkované zánětlivé onemocnění jícnu charakterizované infiltrací sliznice eozinofily a postupnou remodelací stěny jícnu. V současnosti je považována za jednu z hlavních příčin dysfagie a impakce sousta v dětském věku [1]. Onemocnění se rozvíjí u geneticky predisponovaných jedinců po expozici potravinovým nebo inhalačním alergenům [2,3].
Incidence EoE u dětské populace celosvětově narůstá a dosahuje až 5–40 případů na 100 000 obyvatel [4]. Podle dostupných pediatrických studií se incidence EoE před 5–10 lety pohybovala přibližně mezi 5 a 7 případy na 100 000 dětí ročně, s výraznou geografickou variabilitou [5–7]. Včasné rozpoznání je zásadní, protože neléčený zánět vede k fibrotizaci a strukturálním změnám jícnu, které mohou výrazně ovlivnit kvalitu života dítěte. Vzhledem k časté asociaci s atopickými chorobami je nezbytný multidisciplinární přístup zahrnující spolupráci pediatra, gastroenterologa, alergologa a nutričního terapeuta.
Patofyziologie
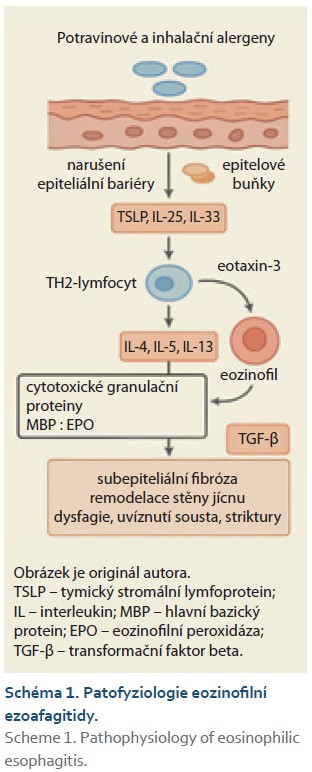
Eozinofilní ezofagitida vzniká u geneticky predisponovaných jedinců v důsledku narušení epiteliální bariéry a následné imunologické odpovědi typu Th2. Poškození epitelu vede ke zvýšené propustnosti sliznice, což umožňuje průnik potravinových a inhalačních alergenů do subepiteliální vrstvy.
Aktivované epitelové buňky následně uvolňují tzv. epitelové alarminy – cytokiny TSLP (thymic stromal lymphopoietin), IL-25 a IL-33. Ty stimulují Th2-lymfocyty k produkci prozánětlivých cytokinů IL-4, IL-5 a IL-13, které indukují tvorbu eotaxinu-3 – hlavního chemokinu zodpovědného za průnik eozinofilů do sliznice jícnu. Dále dochází k tvorbě transformačního růstového faktoru beta (TGF-ß), který reguluje diferenciaci a proliferaci fibroblastů a myofibroblastů, a tím stimuluje produkci extracelulární matrix (např. kolagenu). Po aktivaci eozinofily uvolňují cytotoxické granulační proteiny, zejména hlavní bazický protein (MBP) a eozinofilní peroxidázu (EPO). Tyto látky poškozují epitel, podporují zánět a přispívají k rozvoji subepiteliální fibrózy a remodelace stěny jícnu a poškození funkce její hladké svaloviny. Důsledkem jsou typické klinické projevy onemocnění – dysfagie, uvíznutí sousta a vznik striktur (schéma 1).
Klinické projevy v dětském věku
Klinické projevy EoE jsou u dětí věkově závislé a často nespecifické, což vede k opožděné diagnostice. U kojenců a batolat převažuje odmítání potravy, zvracení, podrážděnost při krmení a neprospívání. U předškolních dětí se mohou objevovat bolesti břicha, nechutenství a selektivní stravování, zatímco u starších dětí a adolescentů dominují typické příznaky dysfagie, regurgitace a uvíznutí sousta v jícnu. Dlouhodobý průběh může vést ke vzniku potravinových averzí a striktur v důsledku remodelace stěny jícnu.
Diagnostika
Diagnóza EoE je založena na kombinaci klinických obtíží, endoskopického nálezu a histologického potvrzení eozinofilní infiltrace.
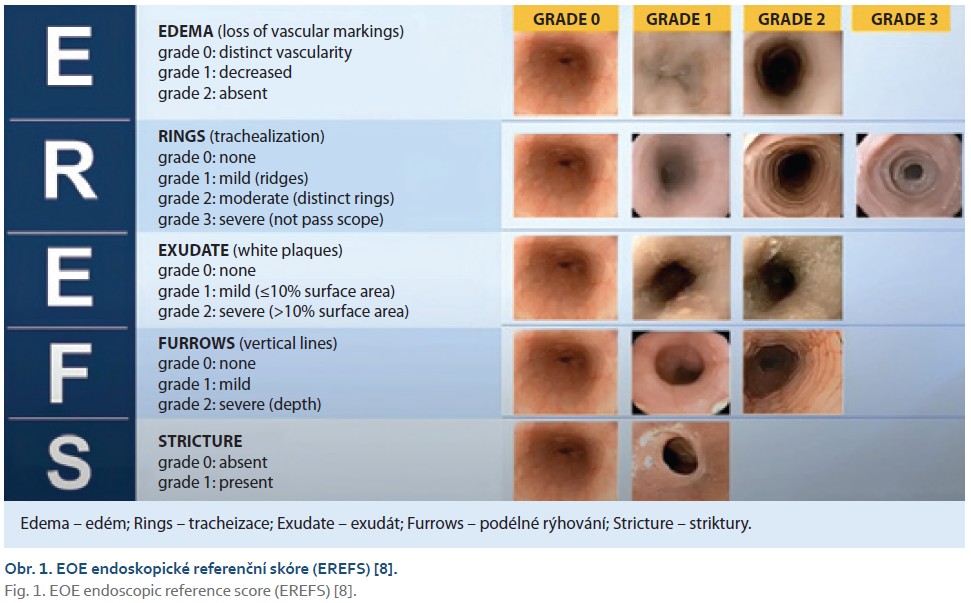
Ezofagogastroduodenoskopie (EGDS) je klíčovým krokem k diagnostice, provádí se makroskopické hodnocení a odběr 2–4 bioptických vzorků alespoň ze dvou etáží jícnu (proximální a distální jícen) bez ohledu na makroskopický nález. Makroskopické hodnocení je standardizováno dle EoE Endoscopic Reference Score (EREFS) (obr. 1) [8]. Hodnotí se tracheizace, podélné rýhování, exsudát, edém a zúžení či striktura. Makroskopický nález může být však u 10–15 % dětských pacientů zcela normální. Proto je mandatorní provádět etážově biopsii z distálního, středního a proximálního jícnu.
Pro potvrzení diagnózy je nutný histologický průkaz ≥ 15 eozinofilů na zorné pole (HPF) v alespoň jednom bioptickém vzorku. Dále můžeme nacházet hyperplazii bazální zóny, fibrózu lamina propria nebo eozinofilní mikroabscesy. Diagnózu lze stanovit až po vyloučení jiných příčin eozinofilní infiltrace, zejména refluxní choroby jícnu, infekce nebo celiakie [9].
Léčba
Terapie EoE je dlouhodobá a vyžaduje multidisciplinární přístup zahrnující spolupráci pediatra, gastroenterologa, alergologa a nutričního terapeuta. Cílem léčby je potlačení eozinofilního zánětu, dosažení klinické i histologické remise a prevence remodelace stěny jícnu. Terapie spočívá v dietním režimu, podávání inhibitorů protonové pumpy (PPI) nebo v podávání topických nebo systémových kortikosteroidů – výsledky jsou u všech modalit srovnatelné [10].
Dietní léčba spočívá v eliminaci jednoho až šesti alergenů s postupným znovuzaváděním – nejčastěji mléka a mléčných produktů, pšenice a vajec. Eventuálně se eskaluje na dietu s vyloučením mléka, pšenice, vajec, sóji, ořechů a mořských plodů. Alternativně lze využít cílenou eliminační dietu podle výsledků alergologického testování nebo elementární (aminokyselinovou) dietu, zejména u menších dětí či při selhání předchozích režimů [10]. Dietní intervence musí být vedena pod dohledem nutričního specialisty, aby se předešlo malnutrici a poruchám růstu.
Farmakoterapie zahrnuje podávání a topických kortikosteroidů. Z PPI se používá omeprazol v dávce 1–2 mg/kg/den rozdělné do dvou denních dávek [3]. PPI snižuje produkci eotaxinu 3, tím tedy i migraci eozinofilů do sliznice. Indukční léčba se podává po dobu 8–12 týdnů s následným zhodnocením histologické aktivity. Remise je dosaženo u cca 25–69 % pacientů [11]. V udržovací léčbě se užívají nejnižší účinné dávky. Každé snižování vyžaduje histologickou kontrolu účinnosti léčby. Mezi zevní faktory, které vedou k lepší odpovědi na PPI, se řadí mužské pohlaví, starší věk dítěte a normální makroskopický vzhled jícnu. U pacientů s prokázaným gastroezofageálním refluxem (GERD), u kterých PPI nevedly k navození remise, pokračujeme v terapii PPI běžnými antirefluxními dávkami, neboť neléčený GERD potencuje rozvoj změn při EoE a zhoršoval by odpověď na následné terapeutické kroky.
Topické kortikosteroidy jsou další léčebnou metodou. Užívá se nejčastěji budesonid a flutikason ve formě suspenze, tablet nebo spreje k polknutí, působí lokálně a vedou ke klinické i histologické remisi. Indukční terapie trvá obvykle 8–12 týdnů. Následně je provedena endoskopická a histologická kontrola, na jejímž základě dochází k úpravě dávkování (snižování) [1]. Nežádoucí účinky jsou většinou mírné, nejčastěji se vyskytuje orofaryngeální kandidóza. Zřídkakdy se mohou vyskytnout i laboratorní známky adrenální insuficience.
Celkové kortikosteroidy se užívají výjimečně, např. při těžké dysfagii nebo při striktuře. Krátkodobé podání (obvykle 1–2 mg/kg/den prednisonu po 2–4 týdny) vede k rychlé klinické i endoskopické odpovědi, avšak relaps po vysazení je častý. Dlouhodobá léčba není doporučena kvůli systémovým nežádoucím účinkům [3].
Z nových terapeutických možností se největší pozornost soustředí na dupilumab. Jedná se o monoklonální protilátku proti receptoru IL-4Rα, která blokuje signalizaci IL-4 a IL-13 a účinně potlačuje eozinofilní zánět. Dupilumab prokázal významné zlepšení klinických i histologických parametrů a je již schválen pro léčbu EoE u dospívajících a dospělých [12]. Další perspektivní molekuly jako mepolizumab, reslizumab (anti-IL-5) a cendakimab (anti-IL-13) jsou aktuálně ve fázi klinického hodnocení [13].
Endoskopická dilatace je indikována u pacientů s významnými strikturami nebo při přetrvávající dysfagii navzdory optimální farmakoterapii. Výkon by měl být prováděn na specializovaném pracovišti.
Prognóza a sledování
Eozinofilní ezofagitida u dětí má chronický průběh, avšak při včasné diagnostice a vhodné léčbě lze dosáhnout dlouhodobé remise.
Po dosažení remise je doporučeno pravidelné klinické, endoskopické a histologické sledování k posouzení aktivity zánětu a prevence strukturálních komplikací. Kontrolní endoskopie se obvykle provádí po 3–6 měsících od zahájení léčby, dále po každé terapeutické změně [1,3]. Dlouhodobé sledování by mělo zahrnovat i monitoraci růstu, výživového stavu a adherence k dietním opatřením.
Soubor
V období let 2017–2025 jsme na našem pracovišti diagnostikovali EoE u 13 pacientů (12 chlapců; medián věku 12 let). Nejčastějším důvodem k provedení endoskopie byly projevy poruch průchodnosti jícnu – uvíznutí sousta (54 %) a dysfagie či nutnost zapíjení sousta (38 %). Bolesti břicha byly přítomny pouze u jednoho pacienta (8 %), projevy typické pro mladší věkové skupiny jako zvracení či neprospívání jsme vzhledem k věkovému složení souboru nezaznamenali.
Histologické remise bylo dosaženo u deseti pacientů (76,9 %). U tří pacientů remise dosažena nebyla – jednou z důvodu odmítnutí léčby, jednou pro selhání terapie a u jednoho pacienta nebyla zatím ověřena odpověď vzhledem k recentní diagnóze.
Přístup k terapii se během sledovaného období postupně vyvíjel a od roku 2023 odpovídal aktuálním doporučením. Dietní léčba byla indikována u sedmi pacientů (53,8 %) a vedla k remisi ve dvou případech (28 %). Většinou šlo o bezmléčnou dietu; ve dvou případech byla dieta řízena alergologem pro polyvalentní potravinovou alergii.
Inhibitory protonové pumpy byly podávány dvanácti pacientům (92 %) a histologická remise pouze na PPI terapii byla navozena u tří pacientů (25 %). Tito pacienti poté pokračovali v monoterapii PPI. U všech pacientů byla před zahájením PPI provedena 24hodinová pH-metrie s impedancí; GERD byl zachycen u sedmi z nich. U pacientů bez odpovědi na PPI s přítomným GERD bylo pokračováno v antirefluxní léčbě PPI.
Viskózní budesonid (2× 1 mg) byl použit u dvanácti pacientů (92 %), vždy v kombinaci s PPI nebo dietní intervencí. U pěti pacientů (41,6 %) bylo možné dávku postupně snížit na 2× 0,5 mg. U dvou pacientů byla léčba ukončena – jednou pro nežádoucí účinky (porucha růstu), jednou pro selhání terapie při fibrotické přestavbě jícnu. Tito pacienti byli následně převedeni na biologickou léčbu dupilumabem, jejíž účinek zatím není zhodnocen.
Závěr
Eozinofilní ezofagitida představuje významné a stále častěji diagnostikované onemocnění dětského věku s potenciálem závažných strukturálních následků při pozdní diagnóze. U pacientů s typickými příznaky (dysfagie, odynofagie, nutnost zapíjení sousta) je nutné na tuto problematiku vždy pomýšlet a je nutné vždy provést endoskopické vyšetření s odběrem bioptických vzorků.
Včasná identifikace onemocnění, správně zvolená léčebná strategie a dlouhodobé sledování jsou zásadní pro prevenci remodelace jícnu a zlepšení kvality života pacientů. Multidisciplinární přístup zahrnující pediatra, gastroenterologa, alergologa a nutričního specialistu je klíčem k úspěšné péči. Rozvoj nových terapeutických možností včetně biologické léčby přináší další perspektivu v managementu tohoto komplexního onemocnění.
ORCID autorů
M. Vebr 0009-0004-5142-5890,
J. Sýkora 0000-0002-1256-4570,
J. Schwarz 0000-0003-4214-8858.
Doručeno/Submitted: 13. 11. 2025
Přijato/Accepted: 24. 11. 2025
Korespondenční autor
MUDr. Marek Vebr
Dětská klinika
LF UK a FN Plzeň
alej Svobody 80
304 60 Plzeň
vebrm@fnplzen.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Lucendo AJ, Molina-Infante J, Arias Á et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J 2017; 5(3): 335–358. doi: 10.1177/2050640616689525.
2. Wiley Online Library. Characterization of eosinophilic esophagitis from the European Pediatric Eosinophilic Esophagitis Registry (pEEr) of ESPGHAN. 2022 [online]. Dostupné z: https: //onlinelibrary.wiley.com/doi/10.1097/MPG.0000000000003530.
3. Melek J, Bělohlávková S, Látalová V et al. Doporučení Sekce dětské gastroenterologie a výživy České pediatrické společnosti pro diagnostiku a léčbu eozinofilní ezofagitidy u dětí. Ces Slov Pediat 2024; 79(90): 5–28. doi: 10.55095.CSPediatrie2024/061.
4. Hahn JW, Lee K, Shin JI et al. Global incidence and prevalence of eosinophilic esophagitis, 1976–2022: a systematic review and meta-analysis. Clin Gastroenterol Hepatol 2023; 21(13): 3270.e77–3284.e77. doi: 10.1016/j.cgh.2023.06.005.
5. Soon IS, Butzner JD, Kaplan GG et al. Incidence and prevalence of eosinophilic esophagitis in children. J Pediatr Gastroenterol Nutr 2013; 57(1): 72–80. doi: 10.1097/MPG.0b013e318291fee2.
6. Kumar S, Choi SS, Gupta SK. Eosinophilic esophagitis: current status and future directions. Pediatr Res 2020; 88(3): 345–347. doi: 10.1038/s41390-020-0770-4.
7. Robson J, O‘Gorman M, McClain A et al. Incidence and Prevalence of Pediatric Eosinophilic Esophagitis in Utah Based on a 5-Year Population-Based Study. Clin Gastroenterol Hepatol 2019; 17(1): 107.e1–114.e1. doi: 10.1016/ j.cgh.2018.06.028.
8. Patel RV, Hirano I, Gonsalves N. Eosinophilic esophagitis: etiology and therapy. Annu Rev Med 2021; 72: 183–197. doi: 10.1146/annurev-med-052819-023848.
9. Alkhowaiter S. Eosinophilic esophagitis. Saudi Med J 2023; 44(7): 640–646. doi: 10.15537/smj.2023.44.7.20220812.
10. Chahuan J, Lucendo AJ. Dietary treatment for children and adults with eosinophilic esophagitis: which patient and which doctor is it suitable for? Inflamm Intest Dis 2024; 9(1): 184–198. doi: 10.1159/000540228.
11. Amil-Dias J, Oliva S, Papadopoulou A et al. Diagnosis and management of eosinophilic esophagitis in children: an update from the European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN). J Pediatr Gastroenterol Nutr 2024; 79(2): 394–437. doi: 10.1002/jpn3.12188.
12. Feo-Ortega S, Lucendo AJ. Evidence-based treatments for eosinophilic esophagitis: insights for the clinician. Ther Adv Gastroenterol 2022; 15: 17562848211068665. doi: 10.1177/17562848211068665.
13. Dellon ES, Spergel JM. Biologics in eosinophilic gastrointestinal diseases. Ann Allergy Asthma Immunol 2023; 130(1): 21–27. doi: 10.1016/j.anai.2022.06.015.