Diagnostika a léčba anémie u nemocných s chorobami gastrointestinálního traktu
Jaroslav Čermák Orcid.org 1
+ Pracoviště
Souhrn
Anémie je v celosvětovém měřítku nejčastějším hematologickým onemocněním vůbec. U nemocných s chronickými zánětlivými chorobami gastrointestinálního traktu (GIT) je často přítomna kombinace několika příčin podílejících se na vzniku anémie. Sideropenická složka vzniká zejména v důsledku zvýšených ztrát z poškozené sliznice GIT, může se na ní podílet i porušená resorpce železa z trávicího traktu. Současně se na anémii u chronických zánětů střevních podílejí i mechanizmy vedoucí k rozvoji anémie při chronickém onemocnění (ACD – anemia of chronic disease). Zvýšená hladina cytokinů (IL-1, IL-6), jež je přítomna u zánětů, vede ke zvýšené sekreci regulačního hormonu hepcidinu, jejímž důsledkem je blokáda výdeje zásobního železa do cirkulace pro potřeby erytropoézy. V diagnostice sideropenie se uplatňuje zejména kombinace hladiny feritinu v séru a saturace transferinu. U stavů s kombinovanou poruchou metabolizmu železa je třeba k odhalení sideropenie většinou použít vyšetření několika parametrů (feritin v séru, cirkulující transferinový receptor, event. hepcidin v séru). V léčbě sideropenie se uplatňuje substituce přípravky obsahujícími železo. Parenterální podávání železa je indikováno u stavů s porušenou resorpcí železa ze střeva, jako velmi efektivní se u těchto stavů ukazuje být podání nových přípravků s vysokou využitelností díky rovnoměrnému postupnému uvolňování i vysokému obsahu železa v molekule (např. Fe3+ v komplexu s karboxymaltózou).
Klíčová slova
anémie, choroby střeva, diagnóza, hepcidin, léčba, nedostatek železaÚvod
Anémie je nejčastějším hematologickým onemocněním a v celosvětovém měřítku nejčastější chorobou vůbec. Nejčastější příčinou anémie je nedostatek Fe, incidence sideropenické anémie je v našem regionu cca 5 % u mužů a 8–20 % u žen, ale v rozvojových zemích je popisován výskyt až u 30–70 % populace. Nedostatek Fe v organizmu je většinou absolutní, tj. je snížena jeho zásoba v organizmu v důsledku jeho nedostatečného přívodu či zvýšených ztrát, na rozvoji anémie při chronickém onemocnění se však podílí relativní nedostatek Fe utilizovatelného pro krvetvorbu při jeho normálním či zvýšeném obsahu v monocyto-makrofágovém systému. U některých onemocnění se mohou tyto příčiny kombinovat, zejména u nemocných se zánětlivým postižením tenkého či tlustého střeva.
Metabolizmus železa a jeho regulace
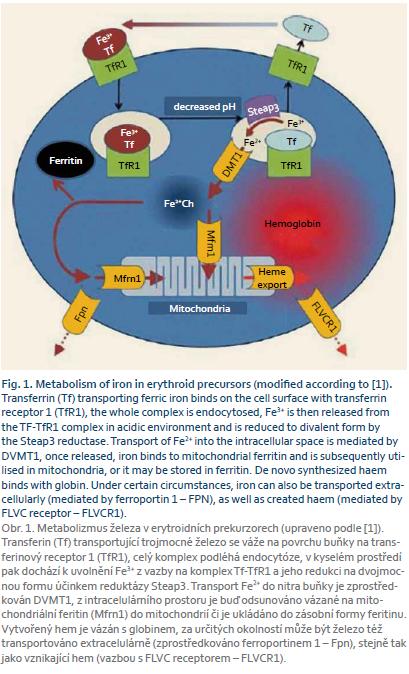
Železo vstřebané z trávicího traktu je dopravováno do cílových tkání v trojmocné formě především ve vazbě na transferin. Transferin se na povrchu buňky váže na transferinový receptor a celý komplex podléhá endocytóze. Při poklesu pH v endocytickém váčku dochází k uvolnění Fe, které je redukováno na dvojmocnou formu reduktázou Steap3 a následně transportováno do nitra buňky pomocí DVMT1 (transportér pro dvojmocné Fe, jenž zprostředkovává i transport Fe ze střeva přes membránu střevního epitelu). Uvolněné Fe se váže buď na mitochondriální feritin a je dále utilizováno v mitochondriích, nebo je ukládáno v zásobní formě feritinu [1]. Metabolizmus Fe v erytroidních prekurzorech je znázorněn na obrázku 1.
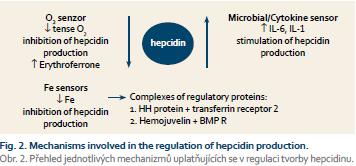
V roce 2000 byl objeven hepcidin, polypeptid syntetizovaný v játrech, jenž hraje klíčovou úlohu v regulaci metabolizmu Fe. Úlohou hepcidinu je degradace feroportinu 1, jenž zprostředkovává přenos Fe extracelulárně, důsledkem stoupající hladiny hepcidinu je tedy snížení výdeje Fe z buňky. Na regulaci tvorby hepcidinu se podílí řada faktorů, tzv. protein dědičné hemochromatózy (HH či HFE protein) se váže v buňce na transferinový receptor kompetitivně s Fe uvolněným z transferinu, volný HFE protein se váže transferinovým receptorem 2 a tento komplex indukuje tvorbu hepcidinu cestou aktivace receptoru kostního morfogenního proteinu (BMP – bone morphogenic protein) a jeho signální dráhy. V poslední době se ukazuje, že zřejmě větší regulační význam má přímá stimulace aktivity BMP receptoru proteinem BMP6, jehož hladina je závislá na koncentraci Fe v parenchymatozních orgánech, zejména v játrech. Dalšími regulačními proteiny simulujícími aktivitu BMP receptoru jsou hemojuvelin a matriptáza-2 (MT-2 neboli TM-PRSS6). Tímto způsobem je citlivě regulován výdej Fe z monocyto-makrofágového systému do cirkulace a druhotně resorpce Fe ze střeva při stoupající intracelulární hladině Fe. Obdobně stimuluje tvorbu hepcidinu hemojuvelin a též zvýšená hladina některých cytokinů (IL-1, IL-6) při zánětu, tento mechanizmus je základním patogenetickým momentem při rozvoji anémie při chronickém onemocnění. Anémie s hypoxií a vystupňovaná erytropoéza naopak tlumí tvorbu hepcidinu, cílem je zvýšení výdeje Fe do cirkulace za účelem přesunu do funkčního poolu v kostní dřeni a v poslední době bylo prokázáno, že tento efekt je zprostředkován proteinem nazvaným erytroferon [2], jehož sekrece je stimulována zvýšenou hladinou endogenního erytropoetinu (EPO). Tento moment se spolupodílí na rozvoji přetížení Fe u některých anémií z vystupňovanou inefektivní erytropoézou (talasemie, myelodysplastický syndrom) (obr. 2).
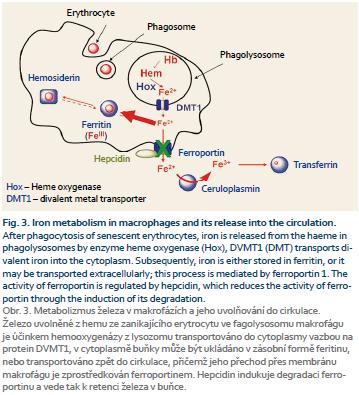
Na obrázku 3 je znázorněn metabolizmus Fe v monocyto-makrofágovém systému po fagocytóze zanikajících erytrocytů. Železo z hemoglobinu fagocytovaného erytrocytu se ve fagolyzozomu uvolňuje z vazby na hem účinkem hemoxygenázy (Hox) a ve dvojmocné formě je transportováno DVMT1 (DMT) do nitra buňky. Následně je buď ukládáno do zásobní formy feritinu, či může být transportováno extracelulárně, tento proces je zprostředkován feroportinem 1. Aktivita feroportinu je ovlivňována vazbou hepcidinu, jenž snižuje aktivitu feroportinu indukcí jeho degradace. Dvojmocné Fe je extracelulárně oxidováno na trojmocnou formu účinkem ceruloplasminu a může se opět vázat na transferin [3].
Příčiny nedostatku železa
Nejčastější příčinou sideropenie jsou nadměrné ztráty Fe z organizmu. U žen je častým zdrojem krvácení urogenitální trakt. Během menstruace činí krevní ztráta v průměru 40–60 ml za cyklus, což odpovídá cca 16–25 mg Fe. U žen se proto již fyziologicky uplatňuje první regulační mechanizmus, kterým se organizmus brání rozvoji sideropenie. Denní resorpce Fe z potravy je zvýšena z 7–10 % na 20–25 % přijaté dávky. Při krevních ztrátách přesahujících 70–80 ml za cyklus však již organizmus nestačí kompenzovat ztráty Fe zvýšenou resorpcí a pokud není dostatečně zvýšen obsah Fe v potravě (z běžných 10–15 mg denně na cca 18–20 mg), dochází k postupnému rozvoji sideropenie. Značné krvácení mohou způsobit jak benigní, tak maligní nádory dělohy. Nefrolitiáza, ureterolitiáza a zánětlivé afekce ledvin a močových cest bývají méně častou, ale nezanedbatelnou příčinou chronických ztrát Fe. Krvácení do trávicího ústrojí je další častou příčinou sideropenie a uplatňuje se zejména u mužů a u žen v menopauze. Z celé řady možných afekcí v GIT je nutno zdůraznit zejména peptický vřed, brániční kýlu s refluxní ezofagitidou, jícnové varixy, hemoroidy, divertikly, Crohnovu chorobu, ulcerózní kolitidu, ale také benigní či maligní nádory. Je třeba připomenout, že krvácení do GIT mohou vyvolávat i některé léky – kyselina acetylsalicylová, glukokortikoidy, nesteroidní antirevmatika, antikoagulancia, vzácněji např. chlorid draselný. Do trávicího ústrojí mohou krvácet i nemocní s krvácivými chorobami vyvolanými poruchou funkce destiček či koagulačních faktorů. Mezi vzácnější příčiny sideropenie patří krvácení z dýchacího ústrojí a artificiální ztráty, např. při hemodialýze či odběrech krve. U dárce je každý odběr krve spojen se ztrátou cca 150–200 mg Fe. Nedostatečný přívod Fe v potravě je v oblastech se skladbou stravy obdobnou naší poměrně vzácný. Kromě přímého nedostatku Fe v potravě se může na jeho sníženém přívodu podílet i nadbytek látek, jež mohou inhibovat jeho resorpci (fosfáty, fytáty, tanáty, oxaláty). U parazitárních onemocnění může jít o kombinaci porušeného vstřebávání s krvácením do GIT. Ke konzumpci Fe s jeho následným nedostatkem může vést i infekce Helicobacter pylori.
Zvýšené nároky na přívod Fe jsou přítomny v těhotenství, kdy jeho potřeba stoupá na 20–25 mg denně. Ztráta Fe během gravidity se odhaduje na 900–1 000 mg a zejména v posledním trimestru vzniká bez substituce Fe sideropenie u více než 70 % těhotných. Během kojení činí ztráty Fe cca 1 mg denně. Zvýšená spotřeba Fe je typická i pro období růstu. U dvouletých dětí by měl přívod Fe činit cca 15 mg denně, menstruující ženy mezi 14. a 30. rokem věku potřebují přibližně 18 mg Fe denně.
Mechanizmy vzniku anémie u chronických zánětlivých onemocnění střeva
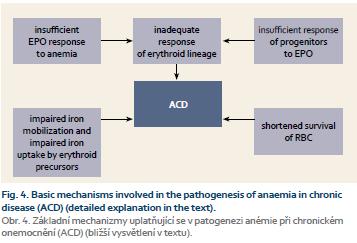
Anémie u chronických zánětlivých onemocnění GIT má charakter anémie vznikající při chronických chorobách, bývá však modifikována dalšími činiteli. Jak již bylo uvedeno výše, společným etiologickým činitelem u chronických onemocnění a nádorů je aktivace imunitního systému, která vede jednak k omezení nabídky Fe přítomným patogenům či nádorovým buňkám, pro něž Fe představuje esenciální růstový faktor, jednak směřuje k udržení optimální koncentrace Fe pro cytotoxickou funkci efektorových buněk imunitního systému. Zvýšená sekrece cytokinů (TNF-α, IL-6, IL-1, IL-4, IL-10, IFN-γ) buňkami aktivovaného imunitního systému vede ke stimulaci tvorby feritinu a hepcidinu. Výsledkem je pokles hladiny Fe v séru s jeho retencí v buňkách monocyto-makrofágového systému a sekundárně i inhibice vstřebávání Fe z GIT. Kromě nedostatku Fe využitelného pro erytropoézu se na rozvoji anémie do určité míry podílí i tlumivý účinek na proliferaci erytroidních prekurzorů, snížená tvorba EPO a zkrácené přežívání erytrocytů v důsledku alterace metabolizmu bílkovin a lipidů erytrocytární membrány (obr. 4) [4]. Snížená tvorba EPO je hlavním patogenetickým činitelem u anémie při chronické nedostatečnosti ledvin, kromě toho u ACD chybí tlumivý efekt EPO na produkci hepcidinu a stimulační efekt na tvorbu transferinových receptorů sloužících k příjmu Fe buňkou.
U řady nemocných s chronickým zánětlivým onemocněním střeva je současně přítomno krvácení do GIT z poškozené střevní sliznice. Současně může být přítomen nedostatečný příjem Fe jako projev malabsorpce zejména při celiakii, Crohnově chorobě či po resekci žaludku nebo střeva, kdy je resorpční plocha omezená a pasáž potravy zrychlená. U infekce Helicobacter pylori se předpokládá i vliv imunitních mechanizmů na metabolizmus Fe. Kvůli multifaktoriální etiologii anémie u chronických střevních zánětů je většinou třeba použít kombinace několika laboratorních vyšetření k odhalení přítomnosti a hloubky skutečného deficitu Fe a ke správné indikaci substituční léčby viz níže.
Diagnostika nedostatku železa
Již v období prelatentního nedostatku Fe, kdy dochází k postupnému vyčerpání zásob Fe, ale dodávka pro potřeby erytropoézy je ještě dostatečná, se uplatňují kompenzační mechanizmy organizmu: zvýšení resorpce Fe z GIT, snížení jeho výdeje a útlum tvorby feritinu – zásobního proteinu Fe. Klesá obsah barvitelného Fe v monocyto-makrofágovém systému kostní dřeně a hladina feritinu v séru se snižuje pod dolní hranici normy u více než 50 % nemocných. Pro klinickou praxi je rozhodující včasná diagnostika latentní sideropenie, kdy jsou zásoby Fe již zcela vyčerpány a je snížena jeho dodávka do erytroblastů kostní dřeně, avšak tento pokles zatím nelimituje proliferaci buněk. V této fázi je snížena hladina feritinu v séru pod 12 µg/l u více než 90 % nemocných, je snížena hladina Fe v séru a zvýšena celková vazebná kapacita transferinu pro Fe, saturace transferinu klesá pod 16 %. Kombinací vyšetření hladiny feritinu v séru a saturace transferinu lze odhalit až 95 % nemocných s latentní sideropenií a obě vyšetření jsou zásadní pro diagnostiku sideropenie. Současně je zvýšena koncentrace solubilních cirkulujících transferinových receptorů v séru (nad 5–8 mg/l) a koncentrace volného protoporfyrinu v erytrocytech. V kostní dřeni klesá počet sideroblastů z 50–60 % pod 30 %. Ve stadiu manifestní sideropenie již nedostatek Fe tlumí proliferaci a vzniká obraz anémie jako důsledek neschopnosti erytropoézy kompenzovat normální či mírně zvýšený zánik erytrocytů. Manifestní sideropenie je charakterizována hypochromní mikrocytární anémií, hladina feritinu v séru je snížena pod 5 µg/l, saturace transferinu klesá pod 10 %, v kostní dřeni chybí zásobní Fe a nalézáme zde méně než 10 % sideroblastů. Současně s diagnózou sideropenie je vždy nutno pátrat po příčině nedostatku Fe, nedílnou součástí vyšetřovacího postupu je proto opakované vyšetření stolice na okultní krvácení, moči a močového sedimentu, gynekologické vyšetření a event. instrumentální vyšetření GIT.
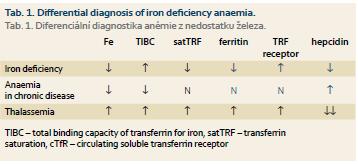
V diferenciální diagnostice je třeba odlišit mírnější formy sideropenie od anémie při chronickém onemocnění a od heterozygotních forem talasemie. U nemocných s heterozygotní β-talasemií je přítomna nápadná mikrocytóza a hypochromie bez výraznější anémie, počet erytrocytů může být naopak i lehce zvýšen. Hladiny Fe a feritinu v séru nejsou zvýšeny, charakteristické jsou změny v elektroforéze hemoglobinu a výrazně je snížena hladina hepcidinu v séru. Vzácně je třeba odlišit kongenitální sideroblastickou anémii. U anémie při chronickém onemocnění je přítomna snížená koncentrace Fe v séru v důsledku poruchy jeho distribuce v organizmu, na rozdíl od pravé sideropenie není snížena hladina feritinu v séru ani saturace transferinu. Počet cirkulujících transferinových receptorů (cTfR) není zvýšen a na rozdíl od sideropenie je zvýšena hladina hepcidinu v séru (tab. 1).
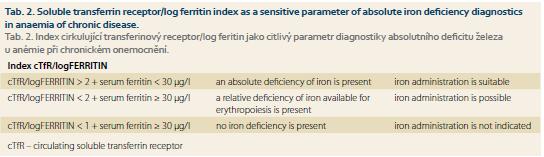
Jak již bylo uvedeno výše, u řady chronických onemocnění, zejména u chronických zánětů střevních, však může být přítomna kombinace zvýšených ztrát Fe, jeho snížené resorpce a distribučních poruch. Snížený výdej Fe do cirkulace představuje u ACD určitý obranný mechanizmus bránící dodávce Fe jako růstového faktoru invadujícím mikroorganizmům či nádorovým buňkám, a proto je třeba Fe do organizmu dodat pouze při jeho prokázaném skutečném deficitu. Hladina feritinu bývá u ACD nespecificky zvýšena díky retenci Fe v monocyto-makrofágovém systému, a proto má pro detekci přítomnosti deficitu Fe u ACD malý význam. Citlivějším ukazatelem je vyšetření hladiny cirkulujících transferinových receptorů, její zvýšení odráží zvýšenou syntézu transferinového receptoru v buňce při nedostatku utilizovatelného Fe (viz výše popsané regulační mechanizmy). Ještě přesnější je stanovení poměru hladiny cTfR k log feritinu. Průkaz zvýšené hladiny hepcidinu v séru může být důležitým diagnostickým ukazatelem převahy distribučních změn, zatím se však toto vyšetření rutinně neprovádí, a většinou jsme tedy u chronických onemocnění pro přesnou diagnostiku stavu zásob Fe odkázáni na užití kombinace několika vyšetření [5]. Doporučená kombinace vyšetření a jejich interpretace jsou uvedeny v tabulce 2.
Léčba nedostatku železa
První zásadou léčby sideropenie je odstranění její příčiny. Druhou zásadou je substituce dostatečným množstvím Fe po dostatečně dlouhou dobu. Optimální léčba sideropenie by měla vést k vzestupu hodnot Hb o 2 g/l denně, k tomu je třeba vstřebat 50–60 mg elementárního Fe, což odpovídá při optimální resorpci dodávce nejméně 180–200 mg prvkového Fe denně per os. Přípravky Fe je nutno podávat rovnoměrně během dne a pokud možno nalačno nejméně půl hodiny před jídlem či nejméně dvě hodiny po jídle. Řada látek v potravě může snižovat resorpci Fe, naopak aminokyseliny, kyselina askorbová a citronová a některé cukry vstřebávání Fe podporují, toho je využíváno v některých přípravcích železa. S resorpcí Fe mohou interferovat i některé léky (antacida, antagonisté H2 receptorů, pankreatická lipáza, penicilamin aj.). Podávání kombinovaných přípravků Fe (většinou s vitaminem B12 a kyselinou listovou) je namístě pouze u skutečně prokázaného kombinovaného deficitu těchto látek či profylakticky v těhotenství. Kontrolu účinnosti léčby provádíme v první fázi vyšetřením hodnot Hb, po normalizaci hodnot Hb je vhodné opakovaně kontrolovat hladinu feritinu v séru a pokračovat v léčbě do naplnění zásob Fe v organizmu na optimální hodnoty, jež činí 300–500 mg, hodnota 1 µg/l feritinu v séru přitom odpovídá cca 8 mg zásobního Fe.
U nemocných s chronickými střevními záněty je v důsledku poškození střevní sliznice jedním z etiologických činitelů anémie snížená resorpce Fe z GIT. U těchto nemocných je indikováno parenterální podávání Fe. Běžné dávkování je 62,5 mg (Fe3+ komplex s glukonátem sodným) nebo 100 mg (Fe3+ sacharózový komplex) elementárního Fe 1× denně. Nevýhodou těchto přípravků je poměrně rychlé uvolnění Fe z komplexu v cirkulaci, což může snižovat jeho utilizaci vzhledem k limitované proliferaci kvůli přítomné sideropenii. Rychlé uvolnění Fe do cirkulace je též nejčastější příčinou vedlejších nežádoucích účinků spojených s parenterálním podáním přípravků Fe. Komplex Fe3+ s karboxymaltózou umožňuje pomalé a rovnoměrné uvolňování i vysokých dávek Fe obsažených v přípravku, což je spojeno s utilizací více než 90 % podaného Fe při minimu vedlejších účinků a možnosti aplikace 1× týdně [6]. Změny metabolizmu Fe u afekcí GIT mají často multifaktoriální příčinu a, jak již bylo uvedeno výše, diagnostika skutečného deficitu Fe vyžaduje většinou kombinaci několika laboratorních vyšetření. Zcela obecně a velmi zjednodušeně lze říci, že pokles hladiny feritinu v séru pod 30–40 µg/l, pokles saturace transferinu pod 16–18 % a vzestup hladiny cTfR nad 3 mg/l může být u těchto onemocnění známkou vznikajícího absolutního deficitu Fe.
Možnosti ovlivnění mechanizmů anémie při chronickém onemocnění
V současné době je předmětem výzkumu ovlivnění zvýšené hladiny hepcidinu jako etiologického faktoru podílejícího se na vzniku ACD. Samotný rekombinantní erytropoetin (rHuEPO) má krom anémie při chronické renální insuficienci u ACD malý efekt, přínosem by mohla být jeho kombinace s podáváním erytroferonu, jenž zprostředkovává tlumivý účinek EPO na tvorbu hepcidinu. Další zkoumané látky lze rozdělit do skupiny protilátek proti hepcidinu či proti stimulačním mechanizmům tvorby hepcidinu (protilátky proti receptoru pro IL-6), skupiny látek, jež interferují se signálními drahami stimulujícími tvorbu mRNA pro hepcidin (signální dráhu BMP) a skupiny látek vážících hepcidin (některé syntetické oligonukleotidy) [7].
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Doručeno/Submitted: 11. 8. 2015
Přijato/Accepted: 20. 8. 2015
doc. MUDr. Jaroslav Čermák, CSc.
Ústav hematologie a krevní transfuze
U nemocnice 2094/ 1
128 20 Praha 2
cermak@uhkt.cz