Diagnostické hodnocení stresem indukovatelného proteinu-1, β-kateninu a cyklinu D1 v prekancerózních lézích tlustého střeva a adenokarcinomu
Emine Sumeyye Atalay1, Tuba Devrim2
+ Pracoviště
Souhrn
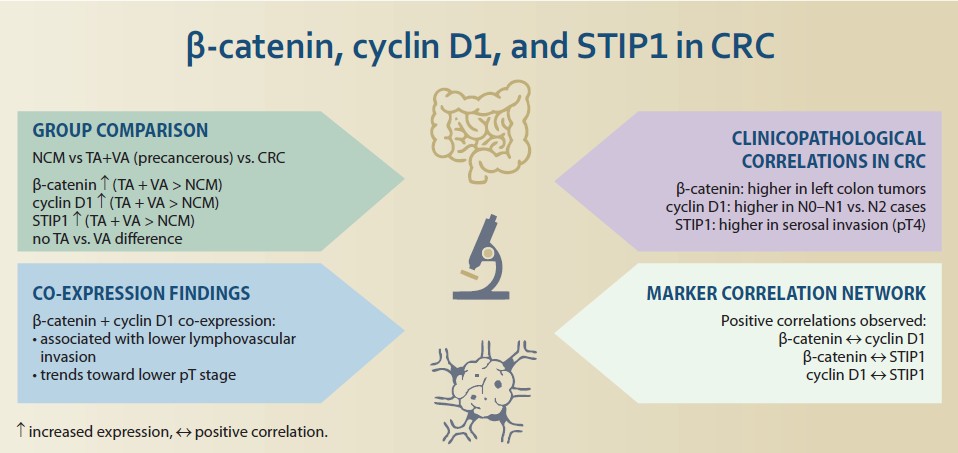
Východiska: Kolorektální karcinom (CRC) se vyvíjí prostřednictvím vícestupňového procesu zvaného adenom-karcinomová sekvence. Cílem této studie bylo vyhodnotit hladiny exprese beta-kateninu, cyklinu D1 a stresem indukovaného fosfoproteinu 1 (STIP1) v progresi z adenomu do karcinomu a zkoumat jejich vztahy s klinicko-patologickými znaky u CRC. Soubor pacientů a metody: Studie zahrnovala 88 vzorků tkáně CRC, 20 tubulárních adenomů (TA), 20 vilózních adenomů (VA) a 10 vzorků tkáně normální sliznice tlustého střeva (NCM), náhodně vybraných z běžných archivních materiálů patologického oddělení. Výsledky: Imunohistochemická exprese ß-kateninu byla vyšší ve skupině TA než ve skupině CRC (p = 0,007). Exprese cyklinu D1 a STIP1 byla vyšší ve skupině TA (p = 0,008; p < 0,001) a VA (p = 0,002) než v CRC. Exprese STIP1 byla zjištěna vyšší ve skupinách TA a VA ve srovnání se skupinou CRC (p < 0,001; p = 0,002). Cyklin D1 byl exprimován na vyšší úrovni ve skupinách TA a VA ve srovnání se skupinou CRC (p = 0,008; p = 0,002). Kromě toho byly zjištěny pozitivní vztahy mezi expresí ß-kateninu a cyklinu D1 (p = 0,025), ß-kateninu a STIP1 (p = 0,014), cyklinu D1 a STIP1 (p = 0,001). Závěr: Naše výsledky naznačují, že exprese ß-kateninu, cyklinu D1 a STIP1 byly v případech CRC vzájemně propojeny. Zjistili jsme, že všechny tři markery byly vysoce exprimovány, zejména během adenomatózní transformace, ale jejich účinky se v invazivní fázi nádoru snižovaly.
Klíčová slova
kolorektální karcinom, stresem indukovatelný protein-1, cyklin D1, beta-katenin, imunohistochemie
Článek je v angličtině, prosím přepněte do originální verze.
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Siegel RL, Giaquinto AN, Jemal A. Cancer statistics, 2024. CA Cancer J Clin 2024; 74(1): 12–49. doi: 10.3322/caac.21820.
2. Pelikán A, Tulinský L, Peteja, M et al. Are there any changes in the surgical management of stenosing rectal cancer? Gastroent Hepatol 2017; 71(1): 62–68. Doi: 10.14735/amgh2016csgh.info16.
3. Myers DJ, Arora K. Villous adenoma. 2024 [online]. Available from: https: //www.ncbi.nlm.nih.gov/books/NBK470272/.
4. Grady WM, Markowitz SD. The molecular pathogenesis of colorectal cancer and its potential application to colorectal cancer screening. Dig Dis Sci 2015; 60(3): 762–772. doi: 10.1007/s10620-014-3444-4.
5. Brabletz T, Jung A, Reu S et al. Variable beta-catenin expression in colorectal cancers indicates tumor progression driven by the tumor environment. Proc Natl Acad Sci 2001; 98(18): 10356–10361. doi: 10.1073/pnas.171610498.
6. Chen W, Luo Y, Liu L et al. Cryptotanshinone inhibits cancer cell proliferation by suppressing mammalian target of rapamycin-mediated cyclin D1 expression and Rb phosphorylation. Cancer Prev Res 2010; 3(8): 1015–1025. doi: 10.1158/1940-6207.
7. Odunuga OO, Longshaw VM, Blatch GL. Hop: more than an Hsp70/Hsp90 adaptor protein. Bioessays 2004; 26(10): 1058–1068. doi: 10.1002/bies.20107.
8. Tsai CL, Chao A, Jung SM et al. Stress-induced phosphoprotein-1 maintains the stability of JAK2 in cancer cells. Oncotarget 2016; 7(31): 50548–50563. doi: 10.18632/oncotarget.10500.
9. Jain D, Chopp WV, Graham RP et al. Protocol for the examination of resection specimens from patients with primary carcinoma of the colon and rectum. 2024 [online]. Available from: https: //www.cap.org/protocols-and-guidelines/cancer-reporting-tools/cancer-protocol-templates.
10. Nosho K, Yamamoto H, Mikami M et al. Overexpression of poly (ADP-ribose) polymerase-1 (PARP-1) in the early stage of colorectal carcinogenesis. Eur J Cancer 2006; 42(14): 2374–2381. doi: 10.1016/j.ejca.2006.01.061.
11. Lee KS, Kwak Y, Nam KH et al. Favorable prognosis in colorectal cancer patients with co-expression of c-MYC and ß-catenin. BMC Cancer 2016; 16(1): 730. doi: 10.1186/s12885-016-2770-7.
12. Disoma C, Zhou Y, Li S et al. Wnt/ß-catenin signaling in colorectal cancer: is therapeutic targeting even possible? Biochimie 2022; 195: 39–53. doi: 10.1016/j.biochi.2022.01.009.
13. Guinney J, Dienstmann R, Wang X et al. The consensus molecular subtypes of colorectal cancer. Nat Med 2015; 21(11): 1350–1356. doi: 10.1038/nm.3967.
14. Macdonald BT, Tamai K, He X. Wnt/beta-catenin signaling: components, mechanisms, and diseases. Dev Cell 2009; 17(1): 9–26. doi: 10.1016/j.devcel.2009.06.016.
15. Wang L, Li D, Liu Y et al. Expression of RUNX3 and ß-catenin in the carcinogenesis of sporadic colorectal tubular adenoma. Tumour Biol 2014; 35(6): 6039–6046. doi: 10.1007/s13277-014-1800-9.
16. Yang B, Mao L, Li Y et al. ß-catenin, leucine-rich repeat-containing G protein-coupled receptor 5 and GATA-binding factor 6 are associated with the normal mucosa-adenoma-adenocarcinoma sequence of colorectal tumorigenesis. Oncol Lett 2018; 15(2): 2287–2295. doi: 10.3892/ol.2017.7566.
17. Uzun S, Isik A, Katipoğlu K et al. Characterization of the subcellular distribution of phospho-ß-catenin in colorectal cancer. In Vivo 2023; 37(4): 1576–1583. doi: 10.21873/invivo.13242.
18. Moradi Binabaj M, Bahrami A, Khazaei M et al. The prognostic value of cyclin D1 expression in the survival of cancer patients: a meta-analysis. Gene 2020; 728: 144283. doi: 10.1016/j.gene.2019.144283.
19. Albasri AM, Elkablawy MA, Ansari IA et al. Prognostic significance of cyclin D1 over-expression in colorectal cancer: an experience from Madinah, Saudi Arabia. Asian Pac J Cancer Prev 2019; 20(8): 2471–2476. doi: 10.31557/APJCP.2019.20.8.2471.
20. Toru S, Bilezikçi B. Early changes in carcinogenesis of colorectal adenomas. West Indian Med J 2012; 61(1): 10–16. doi: 10.7727/wimj.2011.136.
21. Jun SY, Kim J, Yoon N et al. Prognostic potential of cyclin D1 expression in colorectal cancer. J Clin Med 2023; 12(2): 572. doi: 10.3390/jcm12020572.
22. Al-Maghrabi J, Mufti S, Gomaa W et al. Immunoexpression of cyclin D1 in colorectal carcinomas is not correlated with survival outcome. J Microsc Ultrastruct 2015; 3(2): 62–67. doi: 10.1016/j.jmau.2015.01.001.
23. Ogino S, Nosho K, Irahara N et al. A cohort study of cyclin D1 expression and prognosis in 602 colon cancer cases. Clin Cancer Res 2001; 15(13): 4431–4438. doi: 10.1158/1078-0432.CCR-08-3330.
24. Nosho K, Kawasaki T, Chan AT et al. Cyclin D1 is frequently overexpressed in microsatellite unstable colorectal cancer, independent of CpG island methylator phenotype. Histopathology 2008; 53(5): 588–598. doi: 10.1111/j.1365.
25. Palaiologos P, Chrysikos D, Theocharis S et al. The prognostic value of G1 cyclins, p21 and Rb protein in patients with colon cancer. Anticancer Res 2019; 39(11): 6291–6297. doi: 10.21873/anticanres.13839.
26. Kamposioras K, Konstantara A, Kotoula V et al. The prognostic significance of WNT pathway in surgically-treated colorectal cancer: ß-catenin expression predicts for disease-free survival. Anticancer Res 2013; 33(10): 4573–4584.
27. Kubota H, Yamamoto S, Itoh E et al. Increased expression of co-chaperone HOP with HSP90 and HSC70 and complex formation in human colonic carcinoma. Cell Stress Chaperones 2010; 15(6): 1003–1011. doi: 10.1007/s12192-010-0211-0.
28. Zhang Z, Ren H, Yang L et al. Aberrant expression of stress-induced phosphoprotein 1 in colorectal cancer and its clinicopathologic significance. Hum Pathol 2018; 79: 135–143. doi: 10.1016/j.humpath.2018.05.016.
29. Zhai E, Liang W, Lin Y et al. HSP70/HSP90-organizing protein contributes to gastric cancer progression in an autocrine fashion and predicts poor survival in gastric cancer. Cell Physiol Biochem 2018; 47(2): 879–892. doi: 10.1159/000490080.
30. Aamodt R, Jonsdottir K, Andersen SN et al. Differences in protein expression and gene amplification of cyclins between colon and rectal adenocarcinomas. Gastroenterol Res Pract 2009; 2009: 285830. doi: 10.1155/2009/285830.
31. Toncheva D, Petrova D, Tzenova V et al. Tissue microarray analysis of cyclin D1 gene amplification and gain in colorectal carcinomas. Tumour Biol 2004; 25(4): 157–160. doi: 10.1159/000081097.
32. Herbst A, Jurinovic V, Krebs S et al. Comprehensive analysis of ß-catenin target genes in colorectal carcinoma cell lines with deregulated Wnt/ß-catenin signaling. BMC Genomics 2014; 15: 74. doi: 10.1186/1471-2164-15-74.
33. Jang KY, Kim YN, Bae JS et al. Expression of cyclin D1 is associated with ß-catenin expression and correlates with good prognosis in colorectal adenocarcinoma. Transl Oncol 2012; 5(5): 370–378. doi: 10.1593/tlo.12220.
34. Utsunomiya T, Doki Y, Takemoto H et al. Correlation of beta-catenin and cyclin D1 expression in colon cancers. Oncology 2001; 61(3): 226–233. doi: 10.1159/000055379.
35. Huang L, Zhai E, Cai S et al. Stress-inducible protein-1 promotes metastasis of gastric cancer via Wnt/ß-catenin signaling pathway. J Exp Clin Cancer Res 2018; 37(1): 6. doi: 10.1186/s13046-018-0676-8.
36. Luo X, Liu Y, Ma S et al. STIP1 is over-expressed in hepatocellular carcinoma and promotes the growth and migration of cancer cells. Gene 2018; 662: 110–117. doi: 10.1016/j.gene.2018.03.076.
37. Wang K, Jiang S, Huang A et al. GOLPH3 promotes cancer growth by interacting with STIP1 and regulating telomerase activity in pancreatic ductal adenocarcinoma. Front Oncol 2020; 10: 575358. doi: 10.3389/fonc.2020.575358.
38. Li R, Li P, Wang J et al. STIP1 down-regulation inhibits glycolysis by suppressing PKM2 and LDHA and inactivating the Wnt/ß-catenin pathway in cervical carcinoma cells. Life Sci 2020; 258: 118190. doi: 10.1016/j.lfs.2020.118190.