Anální intraepiteliální neoplazie a HD anoskopie
Robert Procházka Orcid.org 1
+ Pracoviště
Souhrn
Anální intraepiteliální neoplazie (AIN) je prekurzurová léze skvamózního karcinomu anu (aSCC). aSCC je řazen mezi vzácné karcinomy, ale jeho incidence je na vzestupu a v některých rizikových skupinách se blíží incidenci kolorektálního karcinomu. Přestože chybí kontrolované randomizované studie, názory expertů podporují vyhledávání a léčbu této anální neoplazie v rizikových skupinách. AIN/aSCC patří mezi neoplazie asociované s HPV infekcí. Jedince s vyšším rizikem AIN/aSCC lze vyšetřit cytologickým stěrem anu nebo citlivějším stěrem na přítomnost HPV DNA, podobně jako při screeningu karcinomu děložního čípku. V případě pozitivního nálezu je doporučována anoskopie s vysokým rozlišením (HR anoskopie). Tento postup však není běžnou praxí. Cílem této studie je obeznámit gastroenterologickou komunitu s nepříliš známou diagnózou AIN a představit nový aktivní přístup v její detekci a terapii. Retrospektivně byl hodnocen soubor 18 pacientů indikovaných k flexibilní endoskopii anu pro jejich vyšší riziko anální neoplazie nebo k dovyšetření rektoragie při normálním koloskopickém nálezu. Využití high- -definition flexibilního endoskopu k vyšetření anu nazýváme novým termínem HD anoskopie. Zjištěné léze byly odstraněny endoskopickou mukózní resekcí (EMR) nebo bioptovány a vzorky odeslány k histopatologickému zhodnocení jedním patologem. Z 18 vyšetřených pacientů byla AIN zjištěna u 12, rizikovější AIN II/III u sedmi. Ve většině případů se jednalo o léze typu IIa nebo Is dle Pařížské klasifikace. U všech AIN lézí byly přítomny změny v morfologii slizničních IPCL cév (intrapapillary capillary loops). Na základě našich výsledků navrhujeme v rizikových skupinách aktivně vyšetřovat často opomíjenou anorektální oblast flexibilním HD endoskopem. Vysoké rozlišení a digitální chromoendoskopie těchto moderních endoskopů nabízí snadnou detekci AIN a navíc umožňuje cílenou terapii bez rizika anální dysfunkce.
Klíčová slova
anální intraepiteliální neoplazie, lidský papilomavirus, skvamózní karcinom anu, anoskopie s vysokým rozlišením
Digestivní endoskopie: původní práce
Úvod
Skvamózní karcinom anu (aSCC) patří mezi vzácné preventabilní karcinomy. Do primární prevence patří sexuální zdrženlivost, zákaz kouření a zejména očkování proti infekci lidským papilomavirem (HPV) mladistvých. Sekundární prevence spočívá ve vyhledávání anální intraepiteliální neoplazie (AIN), tzn. prekurzorové léze aSCC v rizikových populacích. V naší práci představujeme využití flexibilního endoskopu s vysokým rozlišením (HD) v detekci AIN. Toto vyšetření nazýváme novým pojmem HD anoskopie. Zjištěné AIN léze je možné odstranit endoskopickou mukózní resekcí (EMR). Morfologie, chromoendoskopie, histologie AIN a terapeutické možnosti jsou ilustrovány na souboru 18 pacientů.
Metodika
Retrospektivně byl hodnocen soubor 18 pacientů indikovaných k HD anoskopii pro přítomnost jednoho rizikového faktoru nebo více rizikových faktorů AIN/aSCC nebo k vysvětlení rektoragie při normálním koloskopickém nálezu. Pokud byla HD anoskopie součástí koloskopického vyšetření, byli pacienti připraveni ortográdní přípravou, jinak byla dostačující příprava očistným klyzmatem. K vyšetření byly použity HD endoskopy Olympus 190 Exera III s možností blízkého ostření, tzv. near focus, s chromoendoskopickou technologií NBI a s nasazeným 5mm měkkým capem. K insuflaci byl preferenčně použit kysličník uhličitý ke snížení postprocedurálního diskomfortu. Celý anální kanál, a zvláště pak neoplasticky nejrizikovější přechodová zóna epitelů, byly pečlivě prohlédnuty prográdně a v případě nutnosti v inverzi. Nejprve byl anální kanál prohlédnut v bílém světle ke zhodnocení slizničních strukturálních změn a následně ve filtrovaném NBI světle k posouzení přítomnosti hnědého slizničního zbarvení (BCG – background colour sign) a morfologie intramukózních IPCL cév. Elevované léze nebo jen přítomnost hnědého slizničního zbarvení nebo nepravidelný tvar IPCL cév byly hodnoceny jako místa suspektní z AIN. Takto definované léze byly odstraněny v lokálním znecitlivění endoskopickou mukózní resekcí (EMR), ideálně en bloc, a odeslány k histologickému zhodnocení (obr. 1–3). K podpichu byl použit fyziologický roztok s methylenovou modří a s příměsí 1% přípravku Mesocain. Výjimečně při nálezu rozsáhlejšího cirkulárního postižení byl pacient indikován k EMR v hlubší analgosedaci za asistence anesteziologa. V případě velmi diskrétních IPCL změn byla suspektní místa nejprve bioptována. Resekát byl hodnocen jedním patologem jako AIN I (nověji LSIL – low-grade squamous intraepithelial lesion) nebo AIN II/III (nověji HSIL – high-grade squamous intraepithelial lesion). Po endoskopické terapii byl pacient kontrolován HD anoskopií za 3–6 měsíců a dále za dalších 6 měsíců. Případná reziduální neoplazie byla odstraněna opět endoskopicky a pacient byl ponechán v dispenzární péči.
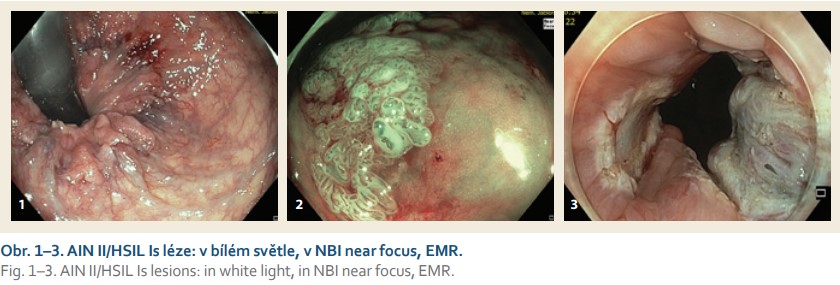
Výsledky
V našem souboru 18 pacientů bylo 12 žen a 6 mužů, ve věku 37–70 let, vyšetřených od roku 2017 po současnost (tab. 1). Při HD anoskopii bylo u 16 pacientů vysloveno podezření na AIN, která byla u 12 pacientů histologicky potvrzena. U čtyř žen a tří mužů se jednalo o pokročilejší změny charakteru AIN II/III/HSIL/ (obr. 4–6), u dvou žen a u tří mužů byla popsána léze typu AIN I/LSIL/. Rozsáhlejší multifokální postižení bylo přítomno u osmi pacientů. Nejčastější indikací k HD anoskopii byla anamnéza perianální AIN / Bowenova choroba / stav po excizi kondylomat, tj. přítomnost HPV infekce. Z dalších rizikových faktorů byl u jedné pacientky přítomen stav po konizaci děložního čípku. Dva pacienti měli sníženou imunitu, konkrétně jeden muž byl HIV pozitivní a jedna pacientka byla na chronické kortikoterapii. Z šesti AIN pozitivních mužů byli dva s MSM (man who have sex with man) preferencí. Jeden z MSM pacientů byl indikován k HD anoskopii na základě preventivího stěru s průkazem HPV sérotypů 16, 18, 31, 33 a 35. Ze dvanácti AIN pozitivních pacientů byli tři kuřáci. Nejčastějším morfologickým typem lézí dle Pařížské klasifikace byl typ IIa u šesti pacientů, Is u pěti pacientů, IIb u dvou pacientů a nejméně zastoupený typ Ip u jednoho pacienta. Nepravidelnost tvaru IPCL cév byla přítomna u všech dvanácti AIN pacientů a predikovala AIN s přesností 80 % (tab. 2). U jednoho pacienta s IPCL nepravidelností byla léze hodnocena pouze jako kondylomata. Hnědé zbarvení sliznice v NBI (tzv. BGC – background colour sign – znamení přítomné u časných skvamózních neoplazií jícnu) nebylo přítomno u žádného z AIN pacientů [1]. Nižší specificita, a tudíž nižší přesnost NBI v diagnostice AIN může být důsledek zánětlivých alterací IPCL.
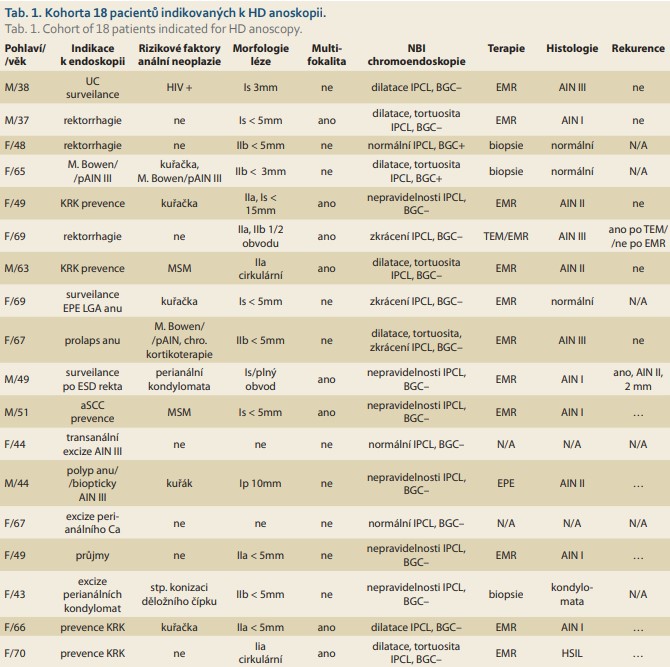

U 16 pacientů s podezřením na AIN bylo 13 lézí primárně odstraněno EMR a 3 léze byly bioptovány. Ze třech bioptovaných lézí dvě nevykazovaly známky AIN, jedna byla hodnocena jako kondylomata. U dvou pacientů byla při tříměsíční kontrole zjištěna recidiva, u jednoho z těchto pacientů se jednalo o recidivu po lokální mikrochirurgické excizi operačním rektoskopem (TEM). Všechny recidivy byly odstraněny EMR, zatím bez další recidivy. Vyjma lehkého periproceduálního krvácení byly výkony prosté komplikací. U žádného z pacientů se neobjevilo klinicky významné odložené krvácení nebo výraznější anální bolest. Při kontrolách nebyl zjištěn žádný chronický postresekční vřed nebo stenóza anu.
Diskuze
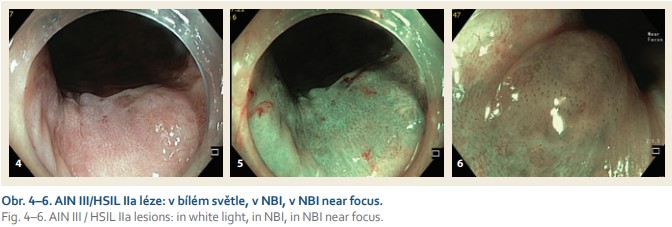
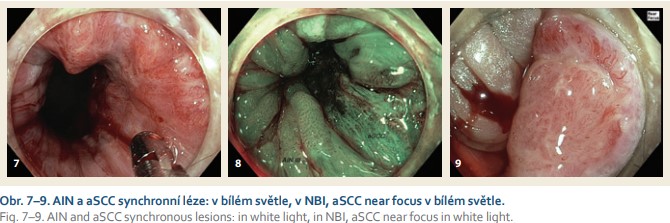
Incidence aSCC je oproti jiným nádorům nízká, v ČR 1,5 pacientů na 100 000 [2]. Prevalence AIN není přesně známá a riziko progrese AIN III v invazivní karcinom dle některých studií může být až 11 % u neléčených pacientů (obr. 7–9) [3]. Je známo, že prevalence AIN a incidence aSCC jsou vyšší v rizikových populacích. Tato neoplazie patří mezi karcinomy asociované s HPV infekcí, dominantně s HPV sérotypy 16 a 18. Není tedy překvapující, že riziková je populace, u které je vyšší pravděpodobností chronické HPV infekce. Do této populace patří jedinci s MSM sexuální preferencí a především s HIV pozitivitou. Dále jedinci s rizikovým sexuálním chováním a imunokompromitovaní pacienti. Významně ohrožení jsou pacienti s anamnézou HPV asociovaných tumorů a především s neoplaziemi děložního čípku. Dle recentní české studie je pravděpodobnost koexistující anální HPV infekce u pacientek s neoplazií děložního čípku CIN2 nebo vyššího stupně 40 %. Koinfekce rizikovým sérotypem HPV 16 byla přítomna ve 21,5 % případů [4]. aSCC a AIN bývá častěji diagnostikována u kuřáků.
V našem souboru patřilo pět z dvanácti AIN pacientů do rizikové populace. Přesto je oportunní screening jedinců s vyšším rizikem AIN/aSCC spíše výjimečný. Patrně pro nižší povědomí o diagnóze, diagnostice a terapeutických možnostech. Dalším důvodem může být i pozorování spontání regrese AIN III v AIN I u malého množství pacientů [5]. Zastánci screeningu prosazují cytologický anální stěr u pacientů ve vyšším riziku, případně ve spojení s molekulární HPV diagnostikou. V případě nálezu AIN nebo potvrzení HPV infekce je doporučena high-resolution anoskopie. Jedná se o anoskopii s použitím gynekologického nástroje kolposkopu po aplikaci kyseliny octové a Lugolova roztoku do anu [6]. Dostupnějším, jednodušším a citlivějším vyšetřením anu může být HD anoskopie. HD anoskopie flexibilním endoskopem s využitím blízkého ostření a stabilizací obrazu pomocí krátkého capu umožňuje přesně posoudit skvamózní sliznici anu a s pomocí NBI i morfologii IPCL cév. IPCL jsou prstencové cévy skvamózních epitelů. Tvarové změny IPCL cév se úspěšně využívají v predikci hloubky invaze skvamózního karcinomu jícnu [7]. Při diagnostice AIN jsme se zaměřili na pravidelnost nebo nepravidelnost tvaru IPCL cév ve skvamózním epitelu anu. Nepravidelnost je diagnostická pro AIN, ale klinický význam charakteru a tíže tvarových změn IPCL (zkrácení, tortuozita nebo dilatace) je u AIN nejasný. Domníváme se, že analogicky ke skvamóznímu karcinomu jícnu mohou těžké alterace až amorfnost IPCL upozornit na invazivní karcinom.
Názory na načasování a formu terapie se liší. Tyto rozpaky jsou patrně důsledkem častých recidiv po chirugických excizích i lokálních ablativních technikách [8]. Například i v našem souboru byla diagnostikována recidiva u pacientky po lokální excizi operačním rektoskopem (TEM). Časté recidivy po chirurgických excizích mohou být důsledkem multifokality a nenápadné morfologie některých AIN lézí. Navíc na rozdíl od konizace děložního čípku se nikdy neodstraňuje nejrizikovější epitelová přechodová zóna kompletně. U ablativních technik se může na častých recidivách podílet i obtížná kontrola nad hloubkou a homogenitou ošetření. Vzhledem k častým recidivám a nutnosti opakované terapie s rizikem anální dysfunkce nebo stenózy lze použít i topickou terapii 5-FU, kyselinou trichloroctovou nebo imiquimodem [9]. Bohužel i tato léčba často selhává.
Endoskopická mukózní resekce (EMR) nabízí alternativu k transanální chirurgické excizi nebo k lokální ablativní terapii. Vysoké rozlišení současných HD endoskopů v kombinaci s digitální chromoendoskopií zvyšuje citlivost diagnostiky AIN a přesnost ohraničení léze. V kombinaci s endoskopickou resekcí může HD anoskopie významně snížit riziko recidiv. Navíc nehrozí funkční postižení anu.
Pro úplnost je důležité zdůraznit, že součástí komplexní terapie pacientů s AIN/aSCC by měla být i HPV vakcinace. Podle některých retrospektivních studií se zdá, že podobně jako u rakoviny děložního čípku jsou HPV vakcíny nejen efektivní v prevenci HPV, ale i ve snížení rizik již přítomné infekce.
Závěr
Skvamózní karcinom anu patří mezi vzácnější karcinomy s velmi dobrou odpovědí na chemoradioterapii. Tato velmi efektivní terapie může vést ke snížení kvality života pro poruchu anální kontinence nebo pro vznik impotence. AIN je prekurzorová léze, kterou lze jednoduše pomocí HD anoskopie detekovat a odstranit EMR, a předejít tak vzniku invazivního karcinomu. HD anoskopie má potenciál stát se novým nástrojem v rukou endoskopistů zajišťující preventivní péči.
Seznam zkratek
AIN: anální intraepiteliální neoplazie
aSCC: skvamózní karcinom anu
HPV: human papillomavirus
EMR: endoskopická mukózní resekce
IPCL: intrapapillary capillary loops
NBI: Narrow Band Imaging
TEM: transanální endoskopická mikrochirurgie
EMR: endoskopická slizniční resekce
LSIL: low-grade squamous intraepithelial lesion
HSIL: high-grade squamous intraepithelial lesion
BCG: background colour sign
MSM: man who have sex with man
Doručeno/Submitted: 9. 5. 2021
Přijato/Accepted: 4. 6. 2021
MUDr. Robert Procházka
Oddělení gastroenterologie
Nemocnice Jablonec nad Nisou, p. o.
Nemocniční 4446/15
466 01 Jablonec nad Nisou
prorobert@seznam.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Minami H, Inoue H, Ikeda H et al. Usefulness of background coloration in detection of esophago-pharyngeal lesions using NBI magnification. Gastroenterol Res Pract 2012; 2012: 529782. doi: 10.1155/2012/529782.
2. Epidemiologie zhoubných nádorů v České republice. 2021 [online]. Dostupné z: http: //www.svod.cz.
3. Watson AJ, Smith BB, Whitehead MR et al. Malignant progression of anal intra-epithelial neoplasia. ANZ J Surg 2006; 76(8): 715–717. doi: 10.1111/j.1445-2197.2006.03837.x.
4. Sehnal B, Zikan M, Nipcova M et al. The association among cervical, anal, and oral HPV infections in high-risk and low-risk women. Eur J Obstet Gynecol Reprod Biol X 2019; 4: 100061. doi: 10.1016/j.eurox.2019.100061.
5. Tong WW, Jin F, McHugh LC et al. Progression to and spontaneous regression of high-grade anal squamous intraepithelial lesions in HIV-infected and uninfected men. AIDS 2013; 27(14): 2233–2243. doi: 10.1097/QAD.0b013e3283633111.
6. Albuquerqu A. High-resolution anoscopy: unchartered territory for gastroenterologists? World J Gastrointest Endosc 2015; 7(13): 1083–1087. doi: 10.4253/wjge.v7.i13. 1083.
7. Bechara R, Inoue H. Magnifying endoscopic diagnosis of tissue atypia and cancer invasion depth in the area of pharyngoesophageal squamous epithelium by NBI enhanced magnification image: IPCL pattern classification. In: Cohen J (ed). Comprehensive atlas of high-resolution endoscopy and narrowband imaging. 2nd ed. USA: Wiley-Blackwell 2017: 49–66.
8. Roberts JR, Siekas LL, KazAM. Anal intraepithelial neoplasia: a review of diagnosis and management. World J Gastrointest Oncol 2017; 9(2): 50–61. doi: 10.4251/wjgo.v9.i2.50.
9. Siddharthan RV, Lanciault C, Tsikitis VL. Anal intraepithelial neoplasia: diagnosis, screening, and treatment. Ann Gastroenterol 2019; 32(3): 257–263. doi: 10.20524/aog.2019.0364.