Zriedkavá príčina nebolestivého obštrukčného ikteru u starších ľudí – séria kazuistík
Tomáš Koller Orcid.org 1, Petra Vrbová1, Viliam Gál2, Iveta Mečiarová2
+ Pracoviště
Souhrn
Séria dvoch kazuistík rozoberá diferenciálnu diagnostiku nebolestivého ikteru u starších ľudí a poukazuje na autoimunitnú pankreatitídu ako jednu z jeho zriedkavejších príčin. V rámci pátrania po príčine je prvým krokom vylúčenie malígneho pôvodu obštrukcie pomocou klinického obrazu, zobrazovacích vyšetrení, a EUS navigovanou biopsiou. Na možnosť diagnózy autoimunitnej pankreatitídy môže spočiatku upozorniť zobrazovacie vyšetrenie, ale pri fokálnom postihnutí je odlíšenie od nádoru nespoľahlivé. Vyšetrenie protilátok IgG4 môže priblížiť diagnostiku IgG4 asociovanej chronickej pankreatitídy 1. typu. Histologické vyšetrenie pankreasu pomôže odhaliť typické črty autoimunitnej pankreatitídy, ako sú lymfoplazmocytárny infiltrát, storiformná fibróza, obliterujúca flebitída a zvýšený počet IgG4 pozitívnych plazmocytov. Na základe týchto kritérií je možné začať liečbu steroidmi, pričom typickou je rýchla odpoveď v zmysle poklesu cholestatických markerov a bilirubínu. Pacienti s autoimunitnou pankreatitídou vyžadujú dlhodobé sledovanie jednak za účelom úpravy liečby v prípade recidív, pre riziko vývoja exokrinnej a endokrinnej insuficiencie, a v prípade IgG4 asociovanej pankreatitídy aj pre riziko systémového orgánového postihnutia. Zvýšené riziko nádoru pankreasu je stále predmetom diskusií.
Klíčová slova
autoimunitná pankreatitída, IgG4, obštrukčný ikterus, kazuistika
Úvod
Diferenciálna diagnostika príčin nebolestivého obštrukčného ikteru môže byť zložitá. Keďže cholelitiáza sa vo väčšine prípadov prejavuje symptomaticky, medzi pravé nebolestivé príčiny nepatrí. Z pravých nebolestivých príčin sú časté expanzívne nádory hlavy pankreasu, priľahlých častí pečene alebo extrahepatálnych žlčových ciest. Medzi menej zvyčajné manifestácie častých príčin patria objemovo malé, pri CT/MR nedetekovateľné periampulárne nádory pankreasu, alebo cholangiokarcinóm [1]. Medzi menej časté príčiny nebolestivého obštrukčného ikteru potom patria kompresie extrahepatálnych žlčovodov z okolitých štruktúr lymfadenopatiou, rozsiahlymi varixami v peribiliárnej oblasti alebo difúznym zápalovým procesom v pankrease. Chronická pankreatitída je rozoznanou príčinou obštrukcie distálneho choledochu, kedy sa najčastejšie predpokladá difúzna fibróza s atrofiou žľazy. Najčastejšou fenotypovou manifestáciou spektra chronickej pankreatitídy je tzv. sporadická chronická pankreatitída, pri ktorej sú typickými nálezmi početné kalcifikácie v parenchýme pankreasu, alebo v pankreatických vývodoch s často, ale nie vždy, prítomnou dilatáciou pankreatického vývodu. Klinický priebeh je variabilný, od asymptomatického až po častejšie sa vyskytujúce bolestivé príznaky. Menej častou príčinou chronickej pankreatitídy je autoimunitná pankreatitída [2]. Jej klinická manifestácia môže byť veľmi variabilná a je často nenápadná.
Kazuistika 1
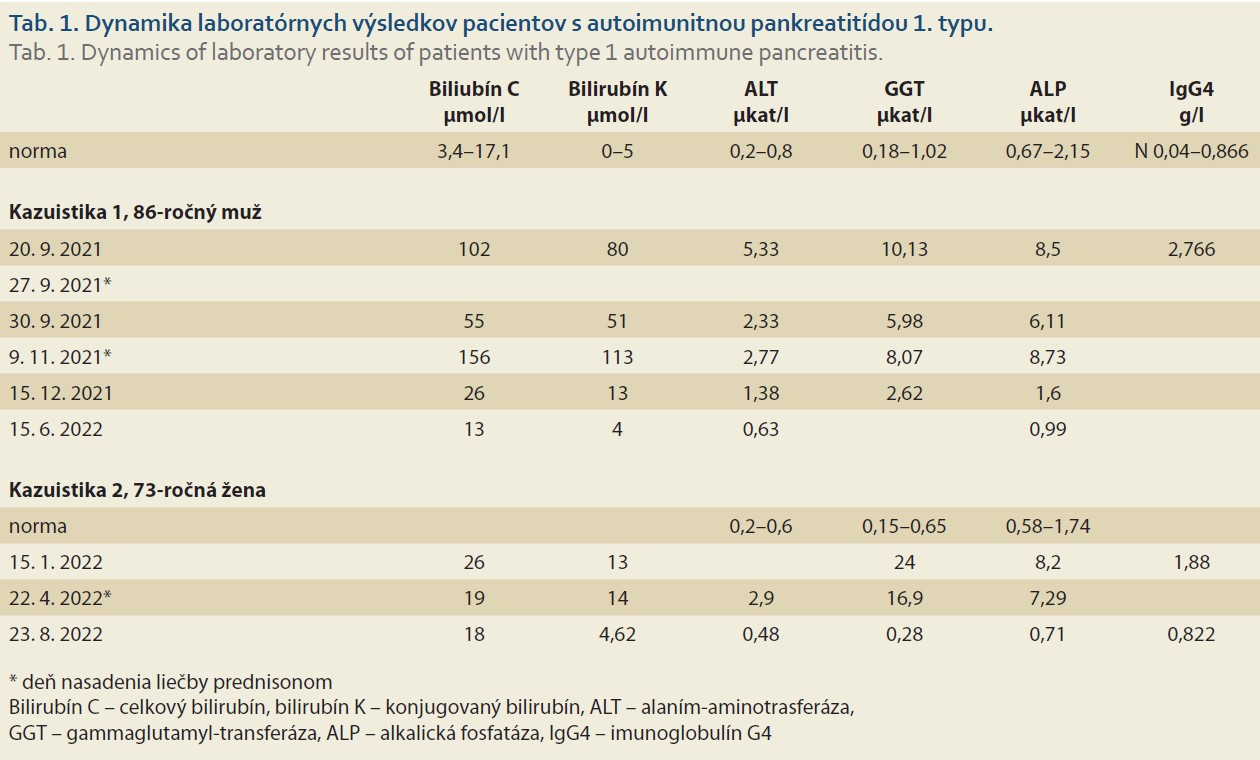
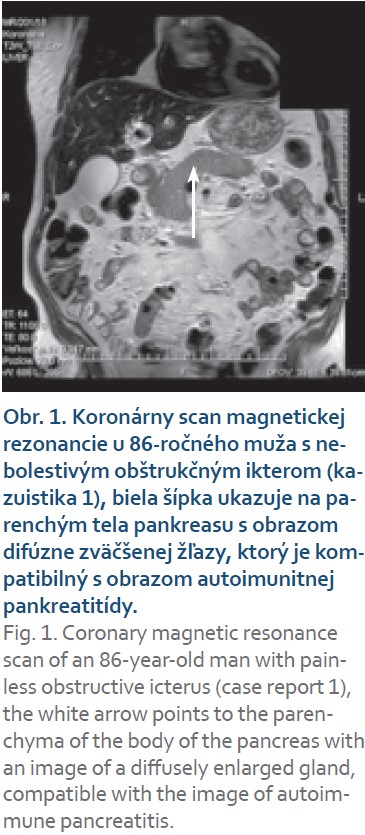
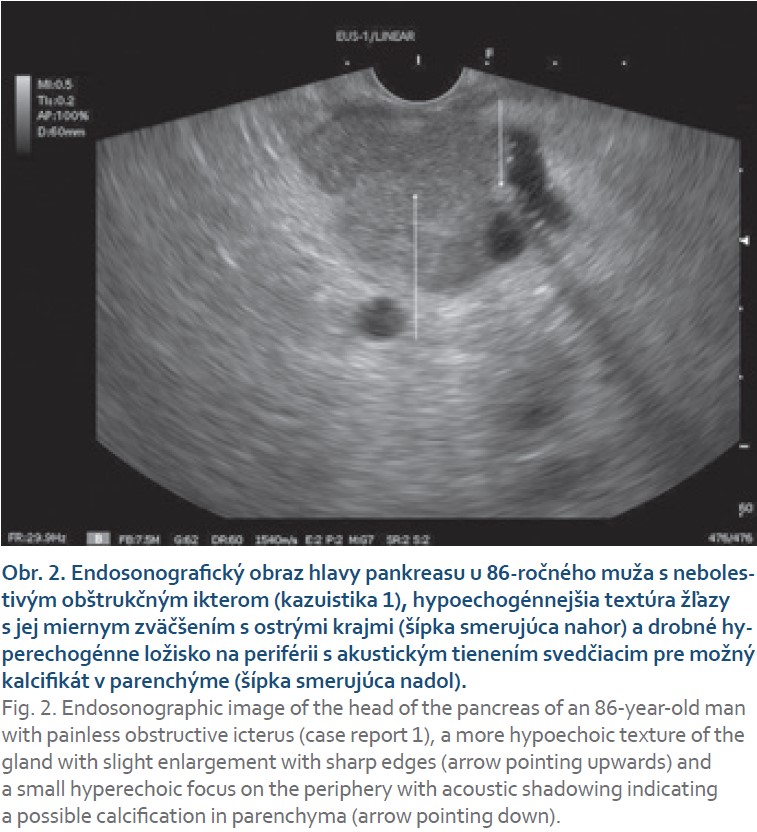
Pacient (86 rokov) bez významnejšieho predchorobia, ktorý bol na svoj vek plne sebestačný, bol hospitalizovaný pre krátku anamnézu úbytku hmotnosti 11 kg, nechutenstva, nauzey a náhle vzniknutého obštrukčného ikteru. Pacient neudával žiadne bolesti ani zvýšenú teplotu, v osobnej ani objektívnej anamnéze sme abúzus alkoholu nezistili. V laboratórnom obraze pri prijatí (tab. 1) bola zistená hyperbilirubinémia s prevažne cholestatickým charakterom elevácie hepatálnych testov. Pri CT aj MR vyšetrení bol celý pankreas zhrubnutý s obrazom difúzneho edému ako pri pankreatitíde alebo difúznej infiltrácii pankreasu (obr. 1). Pankreatický vývod bol popísaný štíhly v úrovni chvosta a tela, ale v terminálnom priebehu v úrovni hlavy pankreasu bol zúžený. Absentujúci bol priebeh d. hepatocholedochus od stenózy po ampulu v dĺžke 21 mm. Pri lineárnom EUS vyšetrení boli hlava, telo aj chvost pankreasu zväčšené, hypoechogénne, v parenchýme s početnými septami s obrazom lobulizácie a ojedinele aj s kalcifikátmi (obr. 2). Hlavný pankreatický vývod nebol viditeľný v oblasti nad ampulou, a proximálne v tele a chvoste pankreasu nebol dilatovaný. Komprimovaný bol aj ductus choledochus v oblasti ampuly a hlavy pankreasu, proximálnejší úsek však už bol dilatovaný na 8 mm bez zreteľného obsahu. V rámci diferenciálnej diagnostiky sme vykonali tenkoihlovú biopsiu tela pankreasu v mieste maxima zhrubnutia žľazy. Po niekoľkých dňoch sme získali výsledok koncentrácie IgG4 protilátok zvýšených na 3,2-násobok normy (2,766; norma 0,04–0,86 g/l). Vzhľadom na absenciu typického obrazu nádoru pankreasu a eleváciu IgG4 sme pre podozrenie na auto- imunitnú pankreatitídu 1. typu nasadili na 7. deň hospitalizácie liečbu prednisonom v dávke 40 mg denne. Po jej nasadení bola dynamika bilirubínu a cholestatických markerov rýchlo priaznivá (tab. 1) a pacient bol na 10. deň hospitalizácie prepustený domov v zlepšenom stave. Histologický nález punkcie tela pankreasu popisoval limitované drobné prúžky pankreatického parenchýmu s fokálne atrofickými zmenami, ložiskovú fibrózou nešpecifického typu bez storiformného usporiadania a fokálne výrazný lymfoplazmocytový inflitrát z malých CD3+ T-lymfocytov a CD138 + plazmocytov, menej CD20+ B-lymfocytmi, bez znakov obliterujúcej flebitídy. Dodatočne ordinované imunohistochemické vyšetrenie pomocou protilátok IgG4 ukázalo fokálne zvýšený počet IgG4 pozitívnych plazmocytov na 15 až 20/HPF (obr. 3). Jednoznačné invazívne nádorové štruktúry neboli zachytené a cytologický nález bol hodnotený podľa Papanicolau Society of Cytopathology v kategórii II, bez suspekcie z malignity. Patológ zhodnotil histologický nález ako pravdepodobné histologické črty autoimunitnej IgG4 asociovanej pankreatitídy.
Po počiatočnej steroidnej liečbe sa pacientovi v domácom prostredí minuli lieky a prednison prestal užívať. Následne došlo ku recidíve ikteru a ťažkostí (tab. 1) a po 5 týždňoch od prepustenia sa dostavil na kontrolu. Pacienta aj s jeho rodinou sme poučili o nutnosti užívania liečby prednisonu v odporúčanej dávke a predpísali lieky. O mesiac neskôr kontrolné USG a laboratórne vyšetrenia zistili významné zlepšenie hyperbilirubinémie a už absenciu dilatácie žlčových ciest (tab. 1). Vzhľadom na sťaženú dostupnosť starostlivosti počas vlny covid-19 a nemožnosť častých kontrol lekárom (pacient dochádzal z iného mesta s príbuzným), sme sa rozhodli u tohto pacienta v liečbe pokračovať nad rámec štandardne odporúčanej indukčnej liečby (40 mg denne počas 1 mesiaca) až do ďalšej ambulantnej kontroly. Normálne hodnoty bilirubínu aj cholestatických markerov potom pretrvávali aj pri ďalšej kontrole (tab. 1). Vtedy sme začali znižovať dávku prednisonu a pacienta sme opäť skontrolovali 9 mesiacov po prepustení, kedy sme konštatovali klinický stav bez výraznejších ťažkostí a normálne hodnoty bilirubínu aj hepatálnych testov (tab. 1).
Kazuistika 2
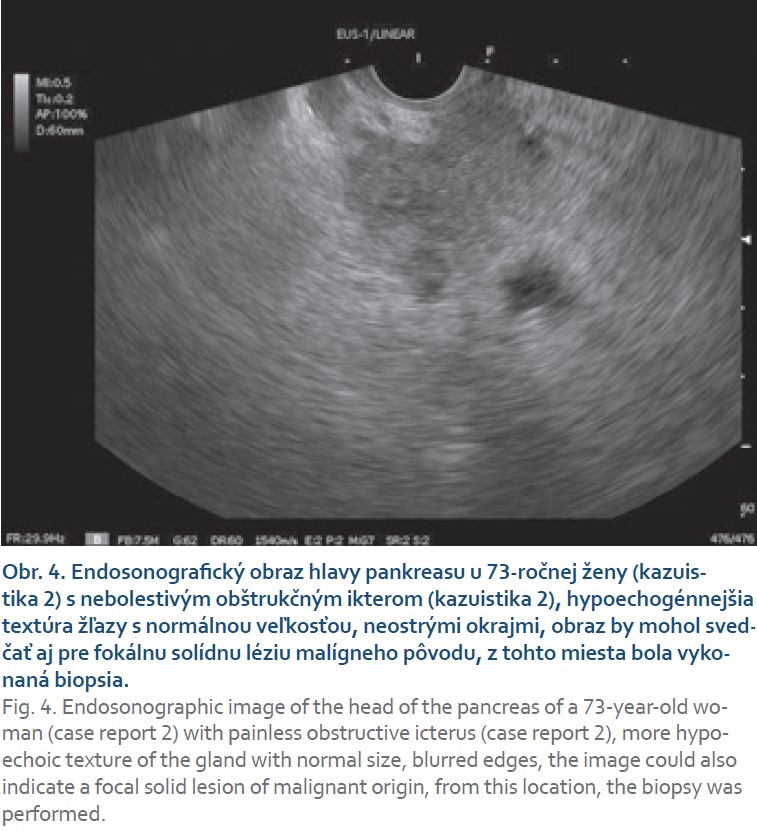
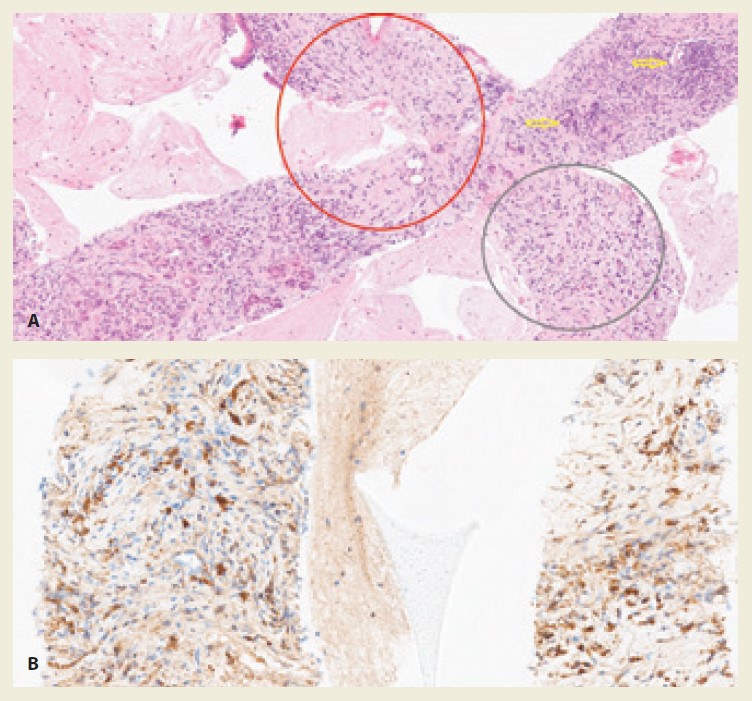
Pacientka (73 rokov) bez významnejšieho predchorobia bola odoslaná na EUS vyšetrenie za účelom opakovanej biopsie predpokladanej solídnej masy hlavy pankreasu. Ťažkosti pacientky sa objavili asi 2 mesiace pred vyšetrením iniciálne v zmysle klinického obrazu nebolestivého obštrukčného ikteru (tmavý moč, svetlá stolica) s laboratórnym pendantom elevácie cholestatických markerov (tab. 1). Pacientka bola hospitalizovaná v regionálnej nemocnici s výsledkom na zobrazovacích vyšetreniach (CT, MR), ktoré popisovali lokálne pokročilú malignitu pankreasu. Na inom pracovisku jej bola tiež vykonaná tenkoihlová biopsia hlavy pankreasu s negatívnym výsledkom v zmysle dokázanej malignity. V klinickom obraze pacientka neudávala chudnutie, bolesti brucha ani svrbenie kože, prakticky bola bez akejkoľvek symptomatológie. V EUS obraze boli hlava a telo pankreasu len mierne zväčšené, zníženej echogenity, s neostrými okrajmi (obr. 4). Hlavný pankreatický vývod nepresahoval 2 mm, ductus choledochus tesne pred sútokom vývodov neobsahoval patologický obsah ani nebol komprimovaný, v oblasti chvosta pankreasu sme zistili dve drobné cystické lézie do 2 mm. Obraz venózneho konfluensu, portálnej vény a lienálnych ciev bol bez znakov invázie alebo trombózy. Z oblasti hlavy pankreasu sme vykonali tenkoihlovú biopsiu. Vzhľadom na diskrepanciu prechádzajúcich nálezov a prakticky nemý klinický obraz bolo doplnené vyšetrenie IgG4, ktorého výsledok sme obdržali niekoľko týždňov po biopsii s 2,2-násobnou eleváciou oproti norme (1,88 g/l, norma 0,04–0,86). Histologický nález popisoval parenchým pankreasu s atrofickými zmenami exokrinnej zložky s rozsiahlou fibrózou pankreatického parenchýmu prevažne nešpecifického typu, iba fokálne s náznakmi storiformného, teda lúčovitého usporiadania fibrózy (obr. 5a). Tiež bol popísaný fokálne výrazný lymfoplazmocytárny zápalový infiltrát z CD3+, menej CD20+ buniek bez jednoznačnej obliterujúcej flebitídy. Dodatočne ordinované imunohistochemické vyšetrenie pomocou protilátok IgG4 ukázalo fokálne zvýšený počet IgG4 pozitívnych plazmocytov viac ako 20/ HPF (obr. 5b). Patológ zhodnotil histologický nález ako pravdepodobné histologické znaky IgG4 asociovanej autoimunitnej pankreatitídy. Pacientke sme preto nasadili liečbu prednisonom v dávke 40 mg denne. Po mesiaci a ďalších piatich týždňoch sme kontrolnými vyšetreniami zistili priaznivú dynamiku cholestatických markerov až do normálnych hodnôt (tab. 1). Po mesiaci liečby pacientka začala so znižovaním dávky prednisonu. Po 4 mesiacoch od nasadenia liečby kontrolné laboratórne testy ukázali už normálne hodnoty cholestatických markerov a bilirubínu (tab. 1) už po úplnom vysadení prednisonu. Kontrolné USG vyšetrenie pankreasu dilatáciu žlčových ciest ani zreteľné zväčšovanie žľazy nezistilo.

Diskusia
V popisovaných kazuistikách sa u oboch pacientov jednalo o podobnú iniciálnu prezentáciu v zmysle nebolestivého obštrukčného ikteru, aj keď v druhom prípade nebol včas laboratórne zdokumentovaný. V oboch prípadoch bolo prvotné klinické podozrenie nasmerované na malígnu príčinu obštrukcie a diagnóza autoimunitnej pankreatitídy bola evokovaná až pri prvom, resp. druhom EUS vyšetrení. V druhej kazuistike bola počiatočná diagnóza v zmysle malignity explicitná. Popisovaná diagnostická neistota zrejme vychádzala zo skutočnosti, že autoimunitná pankreatitída je relatívne zriedkavou diagnózou s popisovanou prevalenciou menej ako 1 % populácie (0,29 prípadov na 100 000 obyvateľov) a trpí ňou len 4 až 9 % spomedzi všetkých pacientov s nealkoholovou príčinou chronickej pankreatitídy [3]. Konsenzus v jej diagnostike sa za posledné roky vyvíjal [4]. Ustálili sa histopatologické kritériá (tab. 2) a v roku 2017 vznikli kritériá (tab. 2) s pokusom unifikovať jej diagnostiku aj mimo ázijskej populácie [5]. Základným pilierom diagnostiky zostalo vylúčenie malígneho nádoru pankreasu (kritérium A). Diagnóza sa potom potvrdí, ak je prítomné aspoň jedno z nasledujúcich B kritérií:
I. typické histologické zmeny svedčiace pre autoimunitnú pankreatitídu,
II. typické morfologické charakteristiky pre autoimunitnú pankreatitídu spolu s eleváciou IgG4 alebo
III. priaznivá odpoveď na kortikosteroidy.

V našich dvoch kazuistikách mal v prvom prípade pacient prítomné všetky kritériá A aj B a v druhom prípade mala pacientka splnené kritérium A a dve kritériá B. V roku 2020 boli predstavené najnovšie Európske odporúčania pre diagnostiku a manažment IgG4 asociovaných chorôb [6], ktoré celú problematiku IgG4 asociovaných chorôb tráviaceho traktu zastrešujú a podľa ktorých sme sa snažili postupovať.
Limitáciou oboch kazuistík bola pandémia, preto odporúčaný interval indukčnej liečby 4 týždne sa nám nepodarilo dodržať. Taktiež, odpoveď na liečbu sme hodnotili klinicky a laboratórne, ale zo zobrazovacích vyšetrení sme si vystačili len s abdominálnou ultrasonografiou so všetkými jej potenciálnymi limitáciami. U pacientov sme nedokázali vypátrať marker Ca 19-9, ktorý by tiež mohol v diferenciálnej diagnostike pomôcť.
Po priaznivej odpovedi na steroidy existuje v ďalšom manažmente pacientov niekoľko výziev. Prvou je redukovať steroidnú liečbu na nutné minimum, resp. vzhľadom na početné nežiaduce účinky ju vysadiť. V prípade relapsov, ktoré sa po vysadení steroidnej liečby udávajú v 22 až 55 %, sa odporúča opätovné nasadenie prednisonu a/alebo imunosupresívnej liečby [6]. K liekom, s ktorými sú skúsenosti v udržiavacej liečby IgG4 asociovaných ochorení, patria azatioprín, metotrexát, kalcineurínové inhibítory, a rituximab [7]. Druhou výzvou je vzhľadom na systémový charakter IgG4 asociovaných chorôb, zistiť postihnutie ostatných orgánov. Autoimunitná pankreatitída (AIP) 1. typu v rámci spektra IgG4 asociovaných chorôb je najčastejšie asociovaná s cholangoitídou, postihnutím slzných a slinných žliaz, retroperitonea, obličiek, pľúc a aorty [6]. V súčasnosti je však otázne, do akej miery má pátranie po orgánovom postihnutí u týchto pacientov siahať, ak sú asymptomatickí. Treťou výzvou je samotné poškodenie pankreasu v zmysle exokrinnej a endokrinnej insuficiencie. Štvrtou výzvou je možná asociácia IgG4 chorôb s malignitami. Okrem extrapankreatických nádorov (pľúca, hrubé črevo, lymfóm, močový mechúr atď.) sa predpokladá aj zvýšené riziko karcinómu pankreasu, aj keď táto asociácia je stále predmetom diskusií. Niektoré štúdie uvádzajú, že nádor sa zistí v období niekoľkých mesiacov pred, alebo po diagnostike AIP. Na jednej strane sa v týchto prípadoch uvažuje o možnej variante paraneoplastickej AIP, na druhej sa prezentácia IgG4 asociovaných chorôb na malignity podobá, a len histopatologické vyšetrenie ich dokáže odlíšiť. Novšie štúdie sa skôr prikláňajú k záveru, že riziko synchrónneho aj metachrónneho adenokarcinómu pankreasu v porovnaní s celou populáciou môže byť o niečo vyššie [8]. Z hľadiska lézií v pankrease sa zistilo, že nádory vznikajú práve v oblastiach, ktoré postihuje autoimunitný zápal [9]. Z horeuvedených dôvodov je u pacientov s IgG4 asociovanou autoimunitnou chorobou odporúčané dlhodobé sledovanie. Modalitami sledovania by mali byť klinické vyšetrenie, zobrazovacie vyšetrenia zacielené na pankreas a limitovaný potenciál má aj dynamika IgG4. Ďalší výskum zrejme v krátkom čase prinesie novšie a citlivejšie sérové markery [10].
ORCID autorov
T. Koller ORCID 0000-0001-7418-0073,
P. Vrbová ORCID 0000-0003-4881-8787,
V. Gál ORCID 0000-0001-9435-7825,
I. Mečiarová ORCID 0000-0002-7385-335X.
Doručené/Submitted: 29. 8. 2022
Prijaté/Accepted: 29. 9. 2022
doc. MUDr. Tomáš Koller, PhD.
Oddelenie gastroenterológie a hepatológie
V. interná klinika
LF UK a UN Bratislava
Ružinovská 6
826 06 Bratislava
koller.tomas@gmail.com
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Zhang L, Sanagapalli S, Stoita A. Challenges in diagnosis of pancreatic cancer. World J Gastroenterol 2018; 24(19): 2047–2060. doi: 10.3748/wjg.v24.i19.2047.
2. Blaho M, Dítě P, Kunovský L et al. Autoimmune pancreatitis – An ongoing challenge. Adv Med Sci 2020; 65(2): 403–408. doi: 10.1016/j.advms.2020.07.002.
3. Schneider A, Michaely H, Weiss C et al. Prevalence and Incidence of Autoimmune Pancreatitis in the Population Living in the Southwest of Germany. Digestion 2017; 96(4): 187–198. doi: 10.1159/000479316.
4. Maruyama M, Watanabe T, Kanai K et al. International Consensus Diagnostic Criteria for Autoimmune Pancreatitis and Its Japanese Amendment Have Improved Diagnostic Ability over Existing Criteria. Gastroenterol Res Pract 2013; 2013: 456965. doi: 10.1155/2013/456965.
5. Schneider A, Michaely H, Rückert F et al. Diagnosing autoimmune pancreatitis with the Unifying-Autoimmune-Pancreatitis-Criteria. Pancreatology 2017; 17(3): 381–394. doi: 10.1016/j.pan.2017.03.005.
6. Löhr JM, Beuers U, Vujasinovic M et al. European guideline on IgG4-related digestive disease – UEG and SGF evidence-based recommendations. United European Gastroenterol J 2020; 8(6): 637–666. doi: 10.1177/2050640620934911.
7. Backhus J, Neumann C, Perkhofer L et al. A Follow-Up Study of a European IgG4-Related Disease Cohort Treated with Rituximab. J Clin Med 2021; 10(6): 1329. doi: 10.3390/jcm10061329.
8. Kunovský L, Dítě P, Blaho M et al. Is autoimmune pancreatitis a risk factor for pancreatic adenocarcinoma? Vnitr Lek 2021; 67(1): 9–13. doi: 10.36290/vnl.2021.011.
9. Macinga P, Bajer L, del Chiaro M et al. Pancreatic cancer in patients with autoimmune pancreatitis: A scoping review. Pancreatology 2021; 21(5): 928–937. doi: 10.1016/j.pan.2021.03.007.
10. Löhr JM, Vujasinovic M, Rosendahl J et al. IgG4-related diseases of the digestive tract. Nat Rev Gastroenterol Hepatol 2022; 19(3): 185–197. doi: 10.1038/s41575-021-00529-y.