Transjugulární intrahepatální portosystémová spojka - 15 let v Hradci Králové: retrospektivní analýza 694 nemocných
Tomáš Fejfar Orcid.org 1, Václav Jirkovský Orcid.org 1, Václav Šafka Orcid.org , Tomáš Vaňásek Orcid.org 2, Petr Hůlek1,3, Antonín Krajina Orcid.org 4, Antonín Michl Orcid.org , Vendelín Chovanec Orcid.org 4, Pavel Ryška Orcid.org , Zdeněk Papík Orcid.org , Miluše Škodová Fendrichová Orcid.org 5, Jozefína Štefánková Orcid.org 6, Miroslav Lojík4, Jan Raupach4, Vlasta Wasyliwová Orcid.org
+ Pracoviště
Souhrn
Autoři v článku podávají obecný přehled o současné problematice terapie komplikací portální hypertenze pomocí transjugulární intrahepatální proto-systémové spojky (TIPS) a přinášejí vlastní výsledky z provádění této metody od jejího zavedení v roce 1992 v Hradci Králové jako prvního pracoviště v tehdejším Československu do současnosti.
Klíčová slova: portální hypertenze - terapie -TIPS.
Věnováno k životnímu jubileu prof. MUDr. Petra Hůlka.
Úvod
Transjugulární intrahepatální portosystémová spojka (TIPS) je perkutánní, minimálně invazivní metoda vytvoření side to side portosystémová anastomózy vedoucí přes jaterní parenchym mezi intrahepatální větví portální žíly a žilou jaterní, která slouží k dekompresi portální hypertenze. První úvahy vytvořit tímto způsobem portosystémový zkrat vznikly v polovině 60. let minulého století. Významným faktem je, že hlavním autorem myšlenky je český lékař J. Rösch, který s kolektivem tuto práci započal v Praze a posléze pokračoval spolu s W. Hanafeem, R. Rossovou a H. Snowem v USA a byl i dále hlavním průkopníkem této metody(1,2). Idea vznikla v experimentu na zvířatech při pokusech o provedení transjugulární cholangiografie, v jejímž rozvoji se dále nepokračovalo, ale možnost punkce portálního systému přes jaterní parenchym se zdála mnohem přínosnější. Ve své době vzhledem k minimální dostupnosti intravaskulárních akcesorií a zejména neexistenci stentů byla však tato metoda v humánní medicíně nerealizovatelná. Až postupem doby s rozvojem endovaskulárního instrumentaria byl TIPS uveden do klinického experimentu v roce 1982 Colapintem(3), kdy pomocí již 9 mm katetrizačního balonu byla spojka provedena u 26 pacientů s uspokojivým poklesem portosystémového gradientu, avšak jen s krátkodobou průchodností a časnou recidivou krvácení. Přelom přineslo až použití expandibilních stentů udržujících předdilatovaný zkrat průchodný po delší dobu. Prvním z nich byl Palmazův balonem expandovaný stent(4).
První transjugulární intrahepatální portosystémová spojka u člověka s použitím stentů byla provedena dr. Richterem v Německu v roce 1988(5). Posléze v Evropě zejména zásluhou freiburského univerzitního pracoviště (M. Richter, M. Rössle, A. Ochs), došlo k rychlému rozvoji tohoto přístupu a postupnému rozšiřování indikačních skupin.
V České republice byl TIPS poprvé do klinické praxe zaveden ve Fakultní nemocnici v Hradci Králové v září v roce 1992 Petrem Hůlkem a Antonínem Krajinou po návratu ze studijního pobytu v Portlandu (Oregon).
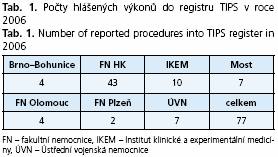
V současné době je TIPS dostupný na několika dalších pracovištích v České republice (tab. 1 vychází z registru TIPS založeného v roce 2006).
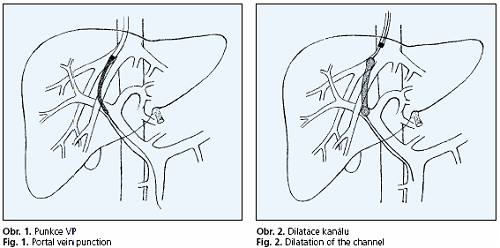
Je prováděn zkušeným intervenčním radiologem. Procento fatálních komplikací z různých pracoviš» je uváděno kolem 1,7 % (0,6-4,3 %)(6,7) a je výrazně závislé na celkovém počtu výkonů v centru prováděných. Signifikantně se snižuje v centrech, kde již bylo provedeno více než 150 výkonů. Před výkonem je indikována počítačová tomografie či magnetické rezonance (obě vyšetření jsou zcela ekvivalentní) k ozřejmění anatomie v oblasti portální žíly a jejímu uložení v rámci jaterního parenchymu. Vždy nutno předem vyloučit jak akutní, tak chronický uzávěr portální žíly (aplikace kontrastní látky při CT vyšetření či ultrasonografie s dopplerovským mapováním). Nemocnému je během výkonu aplikována intravenózní sedace (midazolam, fentanyl). Profylakticky je v den výkonu podáno antibiotikum. Provádí se běžné monitorování EKG, oxygenace a neinvazivní měření arteriálního krevního tlaku. Nemocný a výkon provádějící personál jsou v režimu operačního sálu. V případech hemodynamické nestability, či při výrazném neklidu nemocného (alkoholická encefalopatie, delirantní stavy) je vyžadována přítomnost anesteziologa. Vlastní výkon se dá rozdělit do několika základních kroků(8). Prvním je kanylace pravé vnitřní jugulární žíly pod ultrazvukovou kontrolou standardní Seldingerovou technikou. Nejčastěji se používá přední přístup k jugulární žíle. Následuje katetrizace jaterních žil (nejčastěji pravá jaterní žíla) pomocí vodiče a Roschova celiakálního katétru umožňujícího změnu zakřivení. Vodič a katétr jsou umístěny v jaterní žíle do stabilní polohy a provádí se měření tlaků ve volné a zaklíněné pozici. Dalším a nejobtížnějším krokem je transhepatální punkce hlavní větve portální žíly. Punkce je prováděna pod fluoroskopickou kontrolou polohy jehly (obr. 1) při znalosti anatomických poměrů z CT vyšetření. K upřesnění směru jí předchází také nepřímá CO2 portografie. Na některých pracovištích je tato punkce prováděna pod ultrazvukovou kontrolou. Největším rizikem v tomto okamžiku je lacerace portální žíly v extrahepatálním úseku s následným intraperitoneálním krvácením. Dalšími, méně závažnými riziky jsou punkce žlučovodu, jaterní tepny či poranění jaterního pouzdra. Po dosažení hlavní větve portální žíly (nejčastěji pravá větev) se zavádí vodič a katétr do portálního povodí (slezinná žíla) a provádí se přímá portografie. Po znázornění anatomických poměrů je podle klinického stavu prováděna embolizace portokaválních spojek k prevenci krvácení. Dalším krokem je vytvoření vlastního kanálu mezi větví jaterní a portální žíly pomocí balónového katétru (obr. 2).
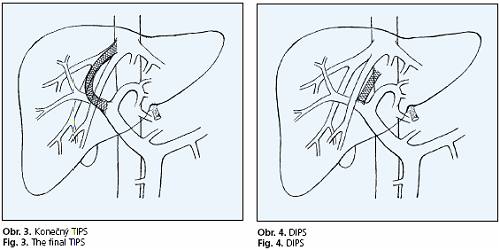
Posledním krokem je zavedení stentu do předdilatovaného kanálu (obr. 3). Pro přímé zkraty býval užíván balonexpadibilní stent s menší ohebností, později lepší výsledky přinesly samoexpandibilní stenty s vyšší flexibilitou.
V současné době je dostupný stent potažený expandovaným polytetrafluroetylenem (ePTFE), přímo určený pro TIPS. Nepotažený konec se zavádí do portální žíly a potažená část vytváří kanál až do žíly jaterní. Po zavedení je stent balonem dodilatován na požadovaný průměr 8, 10 či 12 mm.
V případě trombózyjaterních žil u Budova-Chiariho syndromu se punkce provádí přímo z dolní duté žíly (DIPS - direct intrahepatic portosystemic shunt) (obr. 4).
TIPS indikace a kontra indikace
TIPS je metodou dramaticky snižující portální přetlak. Může tedy ovlivnit komplikace plynoucí z portální hypertenze, která je v Evropě nejčastěji důsledkem jaterní cirhózy Většina nemocných indikovaných k TIPS by ěla být proto primárně vyhodnocena i jako potenciální kandidáti jaterní transplantace. Zavedení TIPS nemá negativní vliv na transplantační léčbu.
Nepochybnou indikací k zavedení TIPS je v současné době endoskopicky a farmakologicky nestavitelné krvácení do trávicí trubice v důsledku symptomatické portální hypertenze, jehož zdrojem jsou nejčastěji jícnové či žaludeční varixy. Další indikací je akutní Buddův-Chiariho syndrom.
Z elektivních indikací je to recidivující varikózní krvácení. TIPS u těchto nemocných jednoznačně snižuje výskyt recidivy krvácení(8), navzdory tomu však nebylo prokázáno delší přežívání nemocných. Další častou indikací je refrakterní ascites. I u těchto nemocných nebyl v multivariantní analýze randomizovaných studií prokázán signifikantní rozdíl v přežívání v porovnání s velkoobjemovou paracentézou s albuminovou substitucí(9). Zdá se však, že kvalita života se zlepšuje a výskyt dalších život ohrožujících komplikací, zejména riziko rozvoje hepatorenálního selhání (HRS) je u nemocných po TIPS nižší(10-12). Méně častou indikací je jaterní hydrothorax. Již rozvinutý hepatorenální a hepatopulmonální syndrom jsou stále indikace diskutované.
Absolutní kontraindikací k výkonu je manifestní srdeční selhávání, sepse a chronická trombóza portální žíly. Relativní kontraindikací je i významná pokročilost vlastního jaterního onemocnění (nemocní nad 12 bodů dle Childovy-Pughovy klasifikace) (13,14).
Cílem práce bylo retrospektivně vyhodnotit soubor nemocných podstupujících transjugulární intrahepatální portosystémovou spojku.
Materiál a metodika
Soubor nemocných
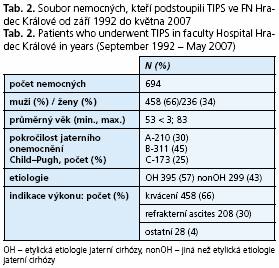
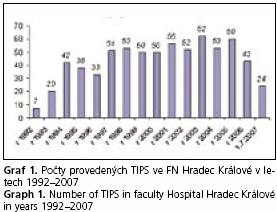
Ve Fakultní nemocnici v Hradci Králové bylo od září roku 1992 do května roku 2007, léčeno touto metodou 694 nemocných (graf 1). V souboru převažovali muži (66 %). Věkové spektrum nemocných bylo značně široké a TIPS byl indikován i u dětských pacientů (průměrný věk nemocných 53 let, nejmladšímu pacientovi v době výkonu byly 3 roky, nejstaršímu 83 let) (tab. 2).
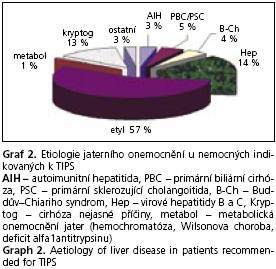
Nejčastější příčinou jaterní cirhózy byl abúzus alkoholu (57 % nemocných), druhou chronická virová hepatitida B a C (14 %). U 13 % nemocných nebyla příčina v době výkonu známa. Méně již byli zastoupeni nemocní s jaterní cirhózou na podkladě cholestatických onemocnění jater (primární biliární cirhóza - PBC, primární sklerozující cholangoitida - PSC) - 5 %, autoimunitní hepatitidy (AIH) - 3 %, metabolických onemocnění 1 % (hemochromatóza, deficit A1AT, Wilsonova choroba) či kongenitální fibrózy 1 %. Ve 4 % případů byl TIPS vytvořen u nemocných s Buddovým-Chiariho syndromem. Poslední procento nemocných zahrnuje vzácnější indikace jako například akutní trombózu portální žíly (graf 2).
U všech nemocných byla pokročilost jaterního onemocnění klasifikována dle Childovy-Pughovy klasifikace a nemocní rozděleni do podskupin (A - 30 %, B - 45 %, C - 25 %).
Nejčastější indikací u 66 % nemocných bylo akutní a recidivující krvácení do zažívacího traktu v důsledku portální hypertenze, přičemž třetina z nich (154 výkonů, 22 %) byla provedena urgentně. Druhou nejčastější indikací byl refrakterní ascites (30 %). Po jednom procentu pak počtem menšinové indikace jako hepatorenální syndrom (HRS), jaterní hydrothorax, akutní Buddův-Chiariho syndrom a již zmiňovaná akutní trombóza portální či mezenterické žíly (tab. 2).
Trombóza portální žíly parciální či kompletní byla jinak při výkonu diagnostikována u 55 nemocných (8 %).
Metodika
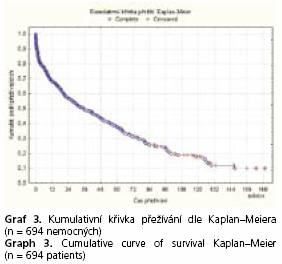
Retrospektivně byla hodnocena klinická data všech nemocných ve výše uvedeném souboru. K vyhodnocení přežívání nemocných byla použita Kaplanova-Meierova analýza. K porovnání rozdílů v přežívání v jednotlivých podskupinách Coxův F test. Ke statistickému zpracování byl použit program Statistica (verze 7.0).
Výsledky
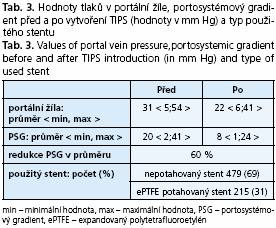
Technická úspěšnost byla 99,9 % (u 3 nemocných se zkrat nepodařilo vytvořit, skupina prvních 200 nemocných - do roku 1997). Průměrný tlak v portální žíle před výkonem byl 31 mm Hg < 5;54 >. Výkonem došlo k redukci portosystémového gradientu v průměru z 20 mm Hg < 2;41 > na 8 mm Hg < 1;24 > (redukce o 60 % ) (tab. 3).
Typ použitého stentu odráží v čase technický pokrok (dostupnost ePTFE potahovaných stentů) i ekonomické aspekty (balonexpandibilní a samoexpandibilní nepotahovanýstent - 479, potahovaný stent - 215 nemocných).
Nejvážnější možnou technickou komplikací výkonu je lacerace portální žíly, která byla v době před zavedením potahovaných stentů většinou fatální. V našem souboru nemocných k této komplikaci došlo u 12 nemocných. U 8 nemocných byla řešena úspěšně chirurgicky či v pozdějších letech direktním zavedením potahovaného stentu. Čtyři nemocní v roce 1993, kdy ještě nebyly potahované stenty dostupné, však na tuto komplikaci zemřeli (periprocedurální mortalita 5,7 promile). Méně častou technickou komplikací je závažná lacerace jaterního pouzdra, která se vyskytla u dvou nemocných a byla řešena embolizací spongostanového materiálu (riziko závažné technické komplikace činí 2 %). U dalších 28 % nemocných byly zaznamenány další, ale klinicky nevýznamné technické komplikace jako punkce žlučovodu, punkce krkavice, menší hematom v místě vpichu.
Nemocní po vytvoření TIPS byli dále dispenzarizováni (klinické a ultrasonografické vyšetření) v intervalech jednoho, třech a dále šesti měsíců. Průměrná doba sledování činila 30,2 měsíce. Nejdelší doba sledování dosáhla téměř 170 měsíců (nemocný stále žije).
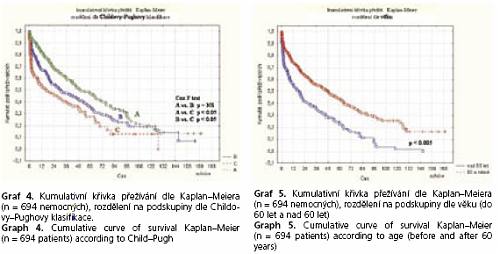
Do jednoho měsíce po výkonu zemřelo 10,2 % nemocných (9 ze skupiny A, 27 ze skupiny B a 35 ze skupiny C dle Childa-Pugha) (graf 3 ,4).
Jednoleté přežití bylo 68%. Negativním, statisticky signifikantním (p < 0,05, Coxův F test) prognostickým ukazatelem byla pokročilost jaterního onemocnění hodnocená podle Childovy-Pughovy klasifikace a věk nemocných (graf 5, 6).
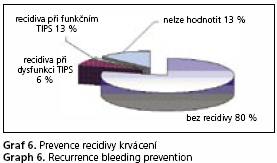
U nemocných s krvácením byl celkový efekt terapie hodnocen od data zavedení po dobu následujícího ambulantním sledování. V dlouhodobém horizontu zabránil TIPS recidivě krvácení u 80 % nemocných. U 6 % nemocných došlo k recidivě v rámci dysfunkce zkratu. U 1 % nemocných došlo k recidivě krvácení i při UZ známkách dobré průchodnosti zkratu. Dlouhodobé hodnocení nebylo možno provést u 13 % nemocných, kteří se na plánované kontroly dále nedostavili a unikli ze sledování.
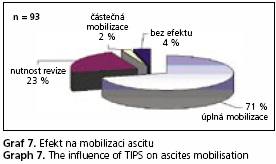
Efekt TIPS na mobilizaci ascitu byl retrospektivně vyhodnocen u podskupiny 110 nemocných, kteří podstoupili výkon v období od roku 1992 do prosince roku 2003. Z hodnocení bylo vyřazeno 17 pacientů (15 %), kteří zemřeli do jednoho měsíce, či se opět nedostavili na první plánovanou kontrolu a z dalšího sledování vypadli. Efekt na ascites byl definován jako zmenšení či úplné vymizení ascitu bez nutnosti provádět paracentézu od třech měsíců po zavedení zkratu. Jako nemocní s částečným efektem byli hodnoceni ti, u kterých zprvu došlo k uspokojivé mobilizaci ascitu, ale během sledování i bez zřejmého rozvoje stenózy zkratu došlo k opětovné manifestaci významného ascitu. Selhání terapie bylo definováno jako přetrvávající přítomnost tenzního ascitu i při funkčním TIPS s nutností provádění velkoobjemových paracentéz. Z 93 hodnocených nemocných byl efekt na ascites celkem pozorován u 94 % nemocných (graf 7). U těchto pacientů ve 23 % případů došlo k recidivě ascitu v souvislosti s rozvojem hemodynamicky významné stenózy zkratu s opětovnou mobilizací po provedení revize. U dvou nemocných došlo k recidivě tenzního ascitu i při funkčním TIPS. U jednoho z těchto dvou nemocných na podkladě generalizovaného hepatocelulárního karcinomu. U druhého nemocného nebyla příčina jasná, tento nemocný byl posléze indikován k jaterní transplantaci a menší ascites přetrvával i po transplantaci.
U čtyř nemocných (4 %) bylo zavedení TIPS bez klinicky patrného efektu na ascites, žádný z těchto nemocných neměl v době výkonu známky spontánní bakteriální peritonitidy, hepatocelulárního karcinomu či jiného maligního onemocnění. Všichni tito čtyři nemocní v průběhu sledování zemřeli, s průměrnou dobou přežití 22,3 měsíce. V jednotlivých parametrech se tito nemocní nelišili od základního souboru. Hodnota portosystémového gradientu (PSG) před výkonem byla u těchto nemocných v průměru 23 mm Hg a bylo dosaženo redukce o 36 % (v základním souboru 60 %). Výsledný gradient byl u nich v průměru 15 mm Hg, tyto hodnoty PSG po TIPS v porovnání se základním souborem byly na hranici statistické významnosti (p = 0,049).
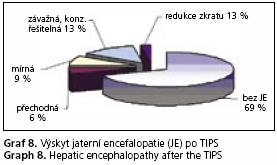
Nejčastější dlouhodobou komplikací po vytvoření portosystémové spojky je rozvoj jaterní encefalopatie (JE). V našem souboru u hodnocených nemocných byla JE zaznamenána u 31 % nemocných, pouze však u 16 % nemocných byla klinicky závažná, vyžadující alespoň jednu hospitalizaci. Pouze u 3 % nemocných z celého souboru muselo být přikročeno k redukci zkratu. U 6 % nemocných šlo o závažnější JE přechodného rázu v době do 3 měsíců od zavedení zkratu či o mírnou JE, nejvýše 1 stupně (graf 8). U 15 % nemocných nebylo možno výskyt JE hodnotit z důvodu časného úmrtí do jednoho měsíce či ztráty nemocného z dispenzarizace.
Diskuze
TIPS je invazivní zákrokem a úspěšnost výkonu i jeho komplikace tak do značné míry závisí na zkušenosti provádějícího radiologa, které jsou dány zejména počtem výkonů prováděných na daném pracovišti. V našem souboru jsme zaznamenali 4 smrtelné technické komplikace. Vyskytly se v souboru prvních 60 nemocných. Další vážné technické komplikace (lacerace porty, lacerace jaterního pouzdra) se podařilo dobře zvládnout a periprocedurální mortalita (5,7 promile) i procento závažných technických komplikací (2 %) jsou i v porovnání s ostatními světovými centry nízké(6-9). Nejdiskutovanější dlouhodobou technickou komplikací je dysfunkce zkratu vznikající na podkladě akutní trombózy (časná dysfunkce), pseudointimální nebo intimální hyperplazie (pozdní dysfunkce)(16). Zhoršení průtoku zkratem většinou vede k opětovné manifestaci portální hypertenze krvácením či recidivou ascitu. Dnes již dostupné ePTFE potahované stenty zaváděné primárně(17,18) či sekundárně při intervenci(19) toto riziko signifikantně snižují.
Nejpodstatnější indikací i v současné době zůstává nestavitelné krvácení z jícnových varixů. V tomto případě není jiná adekvátní alternativa terapie. Též vzhledem k etickým aspektům není možné provést randomizované studie(8,20). V našem souboru do 24 hodin po výkonu zemřelo 11 nemocných, u žádného z nich však nepokračovalo po zavedení TIPS í krvácení. Většina z těchto nemocných zemřela již na ireverzibilní změny v rámci hemoragického šoku a jaterní selhání. Ačkoliv zavedení TIPS u šech nemocných vedlo k zástavě akutního krvácení, zaznamenali jsme v našem souboru 10 nemocných (1 %), u kterých došlo k hemodynamicky významné recidivě krvácení i při průchodném zkratu. Dle dostupných údajů nebyl jiný eventuální zdroj krom jícnových varixů, žaludečních varixů či portální gastropatie nalezen. Naprostá většina těchto nemocných byla primárně endoskopována mimo naše pracoviště. Při následné intervenci byl naměřený portosystémový gradient v hodnotách podlí mm Hg. Lze spekulovat o možném zdroji v žaludečních varixech, které mají tendenci ke krvácení i při gradientu nedosahujícím často citovanou hranici 12 mm Hg(21). V dlouhodobém horizontu stoprocentní prevence recidivy krvácení u 80 % nemocných je hodnota jistě uspokojivá(8). U 6 % nemocných došlo k recidivě krvácení při dysfunkci zkratu, které lze u většiny pacientů zabránit bud kratším intervalem ultrazvukových kontrol s časnější indikací intervence pro dysfunkci zkratu, nebo použitím ePTFE potaženého stentu.
Výsledky u nemocných s refrakterním ascitem jsou též v souladu s publikovanými údaji a ukazují na velice dobrý efekt dané léčby(9-12,22,23). Pouze u 4 nemocných v celém souboru nebylo dosaženo žádné mobilizace ascitu ani do 3 měsíců od výkonu. I když i u těchto nemocných bylo dosaženo redukce portosystémového gradientu o 36 % a literárně je uváděno, že dostatečnou redukcí PSG je snížení 20-25 % (Baveno IV) proti výchozím hodnotám, otázkou zůstává, zdali by mobilizace nebylo dosaženo větším rozšířením zkratu s další redukcí PSG. U těchto čtyř nemocných, v porovnání s celým souborem byla redukce portosystémového gradientu na hladině významnosti (p = 0,05) skutečně nižší (36 % vs. 60 %). Je známo, že u nemocných s portální hypertenzí a s hodnotou HVPG 8 mm Hg a nižší ascites nevzniká. Z randomizovaných studií a jejich multivariantní analýzy přes patrnou tendenci favorizující TIPS(9) nebyl signifikantní rozdíl v přežívání v porovnání s nemocnými léčenými velkoobjemovou paracentézou (LVP) se substitucí albuminem prokázán. Otázkou v tomto případě, vzhledem k farmakoekonomice, ale zůstává skutečná možnost podávání dostatečné dávky albuminu každému nemocnému s LVP. Vždy je též třeba nemocného s takto pokročilou jaterní chorobou zvažovat primárně k transplantačnímu řešení.
Problematickou je též správná indikace u nemocných v pokročilejších stádiích jaterního onemocnění (ve stadiu C dle Childa-Pugha), u nemocných s refrakterním ascitem, či u nemocných se současnou renální insuficiencí. V tomto případě nám k odhadu rizika může být nápomocno MELD skóre zahrnující ve výpočtu i hodnoty kreatininu (dále bilirubin a INR)(24,25).
Kromě vlastního efektu TIPS na komplikace portální hypertenze zůstává často zmiňovaná otázka zhoršení či rozvoje jaterní encefalopatie plynoucí z vytvoření portosystémového zkratu(26). V našem souboru byl pozorován výskyt u 31 % nemocných. U 16 % nemocných činila jaterní encefalopatie potíže významné, s nutností hospitalizace. I tyto výsledky jsou naprosto srovnatelné s literaturou(8,10,22,23). Z pohledu klinika nutno zdůraznit, že s odstupem od výkonu ale riziko závažné JE klesá.
Na zřeteli je třeba mít i oběhové změny plynoucí z hyper dynamické cirkulace při portální hypertenzi, kdy dochází k poklesu systémové cévní rezistence a vzestupu minutového srdečního výdeje. Tento stav se po TIPS ještě prohlubuje(26,27). Přičemž těsně po výkonu jsou zatíženy zejména pravostranné srdeční oddíly. I v našem souboru jsme v prvních letech zaznamenali dvě úmrtí na akutní pravostranné srdeční selhání. U rizikových nemocných by do vyšetřovacího algoritmu před TIPS mělo patřit alespoň ultrazvukové vyšetření srdce.
Závěr
Transjugulární intrahepatální portosystémová spojka se během posledních patnácti let stala nedílnou součástí péče o nemocné se symptomatickou portální hypertenzí. Je jednoznačně indikována u nemocných s nezvladatelným varikózním krvácením a akutním Budově-Chiariho syndromu. Je alternativou u nemocných s recidivujícím krvácení a refrakterním ascitem.
Podpořeno VZ MZO 00179906 a IGA MZ ČR NR8419-4.
Literatura
- 1. Rósch J, Hanafee WN, Snow H. Transjugular portal venography and radiologie portacaval shunt: an experimental study. Radiology 1969; 92: 1112-1114.
- 2. Rösch J, Hanafee W, Snow H, et al. Transjugular intrahepatic portacaval shunt. An experimental work. Am J Surg 1971; 121(5): 588-592.
- 3. Colapinto RF, Stronell RD, Birch SJ, et al. Creation of an intrahepatic portosystemic shunt with a Griint-zig balon catheter. Can Med Assoc J 1982; 126(3): 267-268.
- 4. Palmaz JC, Garcia F, Sibbitt RR, et al. Expandable intrahepatic portacaval shunt stents in dogs with chronic portal hypertension. Am J Roentgenol 1986; 147(6): 1251-1254.
- 5. Richter GM, Palmaz JC, Nóldge G, et al. Transjugular intrahepatic portosystemic stent-shunt (TIPSS): A new nonsurgical percutaneous method. Radiologe 1989; 29(8): 406-411.
- 6. Barton RE, Rósch J, Saxon RR, et al. TIPS: short and long term results: a survey of 175 patients. Semin Intervent Radiol 1995; 12: 364-367.
- 7. Coldwell DM, Ring EJ, Rees CHR, et al. Multicenter investigation of the role of transjugular intrahepatic portosystemic shunt in management of portal hypertension. Radiology 1995; 196: 335-340.
- 8. Hůlek P, Krajina A. Current Practice of TIPS. Hradec Králové: Olga Štambergová Publishing House 2001.
- 9. Deltenre P, Mathurin P, Dharancy S, et al. Transjugular intrahepatic portosystemic shunt in refractory ascites: a meta-analysis. Liver Int. 2005; 25(2): 349-356.
- 10. Sanyal AJ. Genning C, Reddy KR, et al. The North American Study for the Treatment of Refractory Ascites. Gastroenterology 2003; 124(3): 634-641.
- 11. Salerno F, Merli M, Riggio O, et al. Randomised controlled study of TIPS versus paracentesis plus albumin in cirrhosis with severe ascites. Hepatology 2004; 40(3): 629-635.
- 12. Ochs A, Rossle M, Haag K, et al. The transjuglar intrahepatic portosystemic stent-shunt procedure for refractory ascites. N Engl J Med 1995; 332(18): 1992-1197.
- 13. Encarnacion CE, Palmaz JC, Rivera FJ, et al. Transjugular intrahepatic portosystemic shunt placement for variceal bleeding: predictors of mortality. J Vase Interv Radiol 1995; 6(5): 687-694.
- 14. Ferral H, Patel NH. Selection Criteria for Patients Undergoing Transjugular Intrahepatic Portosystemic Shunt Procedures: current status. J Vase Interv Radiol 2005; 16(4): 449-455.
- 15. Petersen BD, Saxon RR, Barton RE, Lakin PC. TIPS: management of major procedural complication. Semin Intervent Radiol 1995; 12: 355-363.
- 16. Jirkovský V, Hůlek P, Fejfar T, et al. Dysfunkce transjugulární intrahepatální portosystémové spojky (TIPS) a její řešení. Vnitř Lék 2007; 53(2): 157-163.
- 17. Hausegger KA, Karnel F, Georgieva B, et al. Transjugular Intrahepatic Portosystemic Shunt Creation with the Viatorr Expended Polytetrafuoroethylene-Covered Stent-Graft. J Vase Interv Radiol 2004; 15(3): 239-248.
- 18. Bureau C, Garcia-Pagan JC, Otal P, et al. Improved Clinical Outcome Using Polytetrafluoroethylene-Coated Stents for TIPS: Results of randomized Study. Gastroenterology 2004; 126(2): 469-475.
- 19. Jirkovský V, Fejfar T, Safka V, et al. Vliv sekundárního zavedení ePTFE potahovaného stentu na udržení průchodnosti TIPS. Vnitř Lék 2007; 53(2): 123-128.
- 20. Azoulay D, Castaing D, Majno P, et al. Salvage transjugular intrahepatic portosystemic shunt for uncontrolled variceal bleeding in patients with decopensated cirrhosis. J Hepatol 2001; 35(5): 590-597.
- 21. Sanyal AJ, Freedman AM, Luketic VA, et al. The natural history of portal hypertension after tranjugular intrahepatic portosystemic shunts. Gastroenterology 1997;112:889-898.
- 22. Gines P, Uriz J, Calahorra B, et al. Transjugular Intrahepatic Portosystemic Shunting Versus Paracentesis Plus Albumin for Refractory Ascites in Cirrhosis. Gastroenterology 2002; 123(6): 1839-1847.
- 23. Rössle M, et al. A Comparison of paracentesis and transjugular intrahepatic portosystemic shunting in patients with ascites. N Engl J Med 2000; 342: 1701-1707.
- 24. Ferral H, Gamboa P, Postoak DW, et al. Survival after elective transjugular intrahepatic portosystemic shunt creation: prediction with model for end-stage liver disease score. Radiology 2004; 231(1): 231-236.
- 25. Fejfar T, Šafka V, Hůlek P, et al. MELD skóre v predikci časné mortality u nemocných s refrakterním ascitem léčených pomocí TIPS. Vnitř Lék 2006; 52(9): 771-776.
- 26. Stefánkova J, Hůlek P, Babu A, et al. Hepatic encephalopathy due to TIPS - retrospective study. Hepatogastroenterology 2007; 54(74): 480-484.
- 27. Huonker M, Schumacher YO, Ochs A, et al. Cardiac function and haemodynamics in alcoholic cirrhosis and effects of the transjugular intrahepatic portosystemic stent shunt. Gut 1999; 44: 743-748.
- 28. Colombato LA, Spahr L, Martinet JP, et al. Hemodynamic adaptation two months after transjugular intrahepatic portosystemic shunt (TIPS) in cirrhotic patients. Gut 1996; 39(4): 600-604.
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené