Topická léčba idiopatických střevních zánětů
Tomáš Douda Orcid.org 1
+ Pracoviště
Souhrn
Optimální medikamentózní léčba idiopatických střevních zánětů je pacientovi šita na míru. Topická léčba u IBD znamená aplikaci léku v účinné formě a dávce přímo do místa postižené zánětem, tedy rektální cestou. Topicky mohou působit i systémově (perorálně) podané léky, které však nejsou předmětem sdělení. Rektálně podávané topické léky jsou účinné zejména v léčbě levostranné ulcerózní kolitidy a proktitidy a mají jen minimum vedlejších účinků. Přesto je topická léčba nedostatečně využívána. Topicky podávaný mesalazin je efektivní jak u proktitidy ve formě čípků, tak u levostranné kolitidy ve formě nálevů. Léčebné výsledky jsou lepší než při orálním podávání a topická léčba mesalazinem je efektivnější než topické steroidy jak z klinického, endoskopického i histologického hlediska. Refrakterní distální kolitidu je velmi obtížné léčit, ani kombinovaná léčba s perorálním mesalazinem, systémovými steroidy nebo imunosupresivy a blokátory TNFα nepřináší vždy uspokojivé výsledky. Jsou popsány i ostatní méně užívané topické preparáty. Efekt těchto léků je nutné opakovaně potvrdit v randomizovaných, dvojitě slepých studiích. Sdělení se dotýká také topické léčby u Crohnovy choroby, pouchitidy a cuffitidy.
Klíčová slova
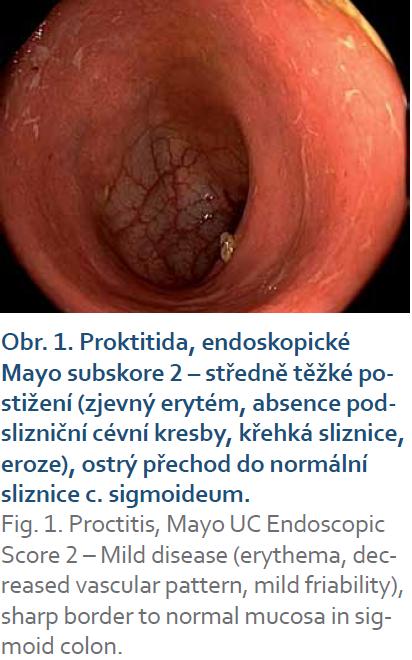
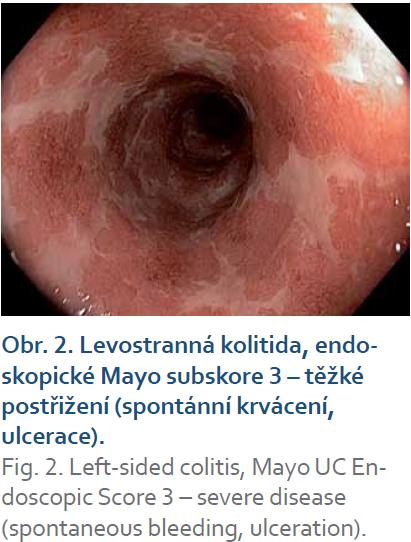
IBD, topická léčbaIdiopatické střevní záněty (IBD) jsou heterogenní klinické jednotky co do klinických projevů, závažnosti průběhu a odpovědi na medikamentózní léčbu. Volba optimální medikamentózní terapie idiopatických střevních zánětů vyžaduje individuální posouzení rozsahu, aktivity a dosavadního vývoje nemoci, předchozí léčby a respektování vůle poučeného pacienta. Rektální podání je indikováno při postižení rekta (proktitidy) (obr. 1), rektosigmatu (distální kolitidy) nebo u levostranného postižení tračníku (po lienální flexuru) (obr. 2), kombinovaná léčba topickým i systémovým mesalazinem má význam i u extenzivní kolitidy. Lokalizace onemocnění je spojena s různými klinickými příznaky. Při postižení rekta se objevuje tzv. rektální syndrom s nutkavým pocitem defekace a odchodem malého množství stolice nebo jen hlenu, krve a hnisu. U levostranného postižení je při nutkavých defekacích přítomna kašovitá až vodnatá stolice s příměsí krve a hlenu. Celkové příznaky (febrilie, váhový úbytek, závažnější anémie a celková alterace stavu) jsou výjimečné a projevují se až při komplikacích. Základní formy léků jsou čípky (účinné v rozsahu rekta) a nálevy ve formě suspenze, která je určena k léčbě konečníku, esovitého a sestupného tračníku. V současné době jsou dostupné léky i ve formě rektální pěny, která je účinná v rozsahu konečníku a esovitého tračníku. Rektální pěna je výhodná pro pacienty s horší tolerancí k léčbě rektálních nálevů.
Ulcerózní kolitida
Použití topické léčby je vhodné nejen u distální a levostranné ulcerózní kolitidy, ale je prospěšné v kombinaci s perorální léčbou i u extenzivní kolitidy. Rektální aplikace léčiva je spojena s menšími vedlejšími nežádoucími účinky a vyšší terapeutickou účinností ve srovnání se systémovou léčbou. Přesto se lokální léčba nedostatečně využívá u proktitidy, kde by tato forma léku měla být první volbou. Ve studii Seibolda et al [1] ze Švýcarska (2013) bylo ukázáno, že pouze 26 % pacientů s proktitidou užívá topickou léčbu, 13 % kombinovanou systémovou a topickou léčbu, zatímco samotnou systémovou (perorální) léčbu užívá 29 % pacientů. U distální kolitidy (proktosigmoiditidy) i levostranné kolitidy užívalo topickou léčbu pouze 11 % pacientů. Snížená adherence pacientů i jejich ošetřujících lékařů k topické léčbě souvisí s obtížemi při zavádění a aplikaci preparátu. Před použitím klyzmatu je vhodné, aby se pacient vyprázdnil a lahvička byla zahřáta ve vodní lázni na tělesnou teplotu. Aplikátor je vhodné potřít lubrikantem. Obsah se aplikuje v poloze na levém boku. Po podání je potřeba tekutinu ve střevu zadržet tak dlouho, jak je to možné. Po aplikaci by měl pacient chvíli ležet (15– 20 min). Pro optimální účinek léčivého přípravku by mělo být zabráněno vyprázdnění co nejdéle, nejlépe po dobu 8 hod po podání. Celý proces je tedy o dost složitější než prosté spolknutí tablety.
Mesalazin
Základním stavebním kamenem v léčbě ulcerózní kolitidy je kyselina 5- aminosalicylová (5- ASA) – mesalazin. Jeho protizánětlivé působení je zprostředkováno útlumem lymfocytární funkce ve střevní sliznici, redukcí aktivace nukleárního faktoru kappa B, který při zánětu spouští genovou expresi cytokinů, enzymů a adhezivních molekul. Mesalazin jako takový také tlumí sekreci prozánětlivých cytokinů včetně anti‑TNF dávkou dependentním způsobem. Mezi slizniční koncentrací 5- ASA a stupněm aktivity ulcerózní kolitidy je inverzní vztah [2,3]. ECCO uvádí ve svém doporučení [4] v léčbě mírné a středně těžké proktitidy vstupní léčbu podání 1 g mesalazinového čípku jednou denně. Nebyly prokázány lepší léčebné výsledky při použití vyšší dávky než 1 g. Čípky jsou efektivnější a lépe tolerované než nálevy. Alternativou k podání čípku je aplikace dobře tolerované mesalazinové pěny, tato léková forma však není v České republice dostupná. Lokální podání čípku jednou denně je stejně efektivní jako rozdělená dávka. Levostranná středně nebo mírně aktivní kolitida by měla být vstupně léčena klyzmaty 5- ASA 1 g/ den v kombinaci s perorálním mesalazinem v dávce vyšší než 2 g denně (v jedné denní dávce, která je stejně účinná jako podání dvakrát nebo třikrát denně) [5– 7]. Také u klyzmatu nebyla prokázána vyšší efektivita než dávka 1 g denně – v České republice je ale dostupná rektální suspenze pouze v dávce 4 g. Nízkoobjemová (60 ml) klyzmata jsou stejně účinná a lépe tolerovaná [8] než u nás dostupné 100ml objemy nálevů. Podání topického mesalazinu je přibližně dvakrát efektivnější než podání topických steroidů, ať už hodnotíme symptomatickou, endoskopickou nebo histologickou remisi [9]. Samostatně perorálně podávaný mesalazin je méně efektivní než kombinovaná léčba topickým i systémovým mesalazinem také u extenzivní kolitidy [7,9].
V udržovací léčbě je rektální podání mesalazinu první linií léčby u proktitidy a alternativou u levostranné kolitidy, kombinovaná léčba mesalazinem je druhou linií udržovací léčby. Při rektálním podání bývá rozdělená dávka 3 g/ týden dostatečná k udržení remise [7,10].
Kortikoidy
Kortikoidy jsou indikovány pro indukční léčbu u pacientů nereagujících na topické 5- ASA. Lokálně se doporučují podávat kortikoidy druhé generace s limitovanou systémovou absorpcí, které mají vysoký stupeň metabolizování při prvním průchodu játry a z toho vyplývající menší počet vedlejších účinků a minimální útlum adrenokortikotropní osy. U nás je dostupný budenosid ve formě klyzmatu nebo rektální pěny v dávce 2 g, v západních zemích je dále dostupný rektální nálev s 2 mg beclomethasone dipropionátu (BDP). Nemáme data svědčící o tom, že by podávání lokálních kortikosteroidů mělo efekt v udržovací léčbě [11].
Topická léčba je většinou kombinovaná s perorální. Pokud pacient nereaguje na kombinovanou léčbu mesalazinem a kortikosteroidy, je dalším stupněm podání systémových imunosupresiv a cílené biologické léčby. Stále však existuje velká kohorta pacientů s proktitidou a distální kolitidou, kteří na standardní léčbu nereagují nebo ji netolerují. U těchto pacientů se zkouší podání méně často užívaných preparátů. Bohužel u většiny potenciálně terapeutických topických přípravků proběhly pouze otevřené studie a randomizované studie u menšiny neprokázaly větší efekt než placebo. Tato skupina léčiv vyžaduje další výzkum a randomizované studie.
Hyaluronát sodný
Mimo standardní postup ve známé léčebné pyramidě stojí rektální přípravek obsahující hyaluronát sodný (IBD98E, komerční název TRUD), který se v současné době dostal na trh jako zdravotnický prostředek, tedy mimo standardní proces schvalování související s možnou úhradou z veřejného zdravotního pojištění (jedna měsíční léčba stojí 10 000 Kč). Rektální nálev obsahuje hustou suspenzi složenou z vysokomolekulárního (1,8 × 106 Daltonů) a nízkomolekulárního (0,35 × 106 Daltonů) hyaluronátu sodného s xanthanovou klovatinou, která při rektálním podání zajišťuje adherenci na sliznici distálního levého tračníku. Léčebný předpoklad vychází z faktu, že hyaluronát sodný je jednou ze základních součástí extracelulární matrix a významně přispívá k udržení integrity střevní sliznice. Střevní sliznice konstantně čelí náloži bakterií a antigenů. Poškozená slizniční vrstva u ulcerózní kolitidy přispívá k zánětu přímou interakcí antigenů a lymfocytů, zvýšenou fagocytózou a dochází ke ztrátě glykosaminoglykanů (GAG) ze subepiteliální bazální membrány, což vede k dalšímu slizničnímu postižení. Obnova ochranné slizniční vrstvy může přispívat k úlevě od symptomů a k indukci remise onemocnění. Hylauronát sodný poskytuje bariéru následkům trvalé antigenní stimulace spouštěné střevním obsahem a obnovou ochranné vrstvy vytváří prostředí k regeneraci střevní sliznice. Do malé prospektivní otevřené nekontrolované studie s IBD98E [12] bylo zařazeno 21 pacientů s aktivní distální ulcerózní kolitidou (UCDAI ≥ 4 a sigmoideoskopické skore ≥ 1). Bylo jim aplikováno 60 ml nálevu denně po dobu 28 dnů. Devět pacientů (42,9 %) mělo klinickou odpověď, deset pacientů (47,6 %) endoskopickou odpověď, osm pacientů (38,1 %) klinickou remisi a deset pacientů (47,6 %) endoskopickou remisi. Došlo k poklesu aktivity UCDAI z 6,1 na 3,81 a průměrného endoskopického skóre ze 4,57 na 1,1. U pacientů s mírnou a středně těžkou ulcerózní kolitidou studie prokázala, že léčba je bezpečná a efektivní. K ověření efektu jsou samozřejmě nutné placebem kontrolované randomizované studie.
Kalcineurinové inhibitory
V léčbě refrakterní distální kolitidy jsou z méně užívaných topických prostředků nejčastěji podávány kalcineurinové inhibitory – takrolimus a cyklosporin. Protein fosfatáza kalcineurin je všudypřítomná, má schopnost defosforylovat široké spektrum proteinů a může regulovat interleukin (IL)- 2, IL‑4 a interferon (IFN)?γ, stejně tak modulovat transkripční faktory, jako je nukleární faktor kappa B (NF‑ κB). Zvýšení aktivity NF‑ κB u Crohnovy choroby i ulcerózní kolitidy indukuje expresi prozánětlivých cytokinů IL‑1β, IL‑6 a TNF. Redukcí hladiny těchto cytokinů lze dosáhnout hojení sliznice a remise onemocnění. Proběhly dvě malé prospektivní otevřené nekontrolované studie týkající se efektu rektálně podaného takrolimu u rezistentní distální kolitidy. Do první studie [13] bylo zařazeno devět pacientů se zánětem maximálního rozsahu 30 cm od svěračů rezistentním na standardní i experimentální léčbu. Po dobu čtyř týdnů užívali topicky 0,9 mg takrolimu dvakrát denně. Remise dosáhlo 75 % pacientů (6 z 8 pacientů) a u většiny pacientů bylo možno vysadit kortikoidy. Do druhé studie [14] bylo zařazeno 19 pacientů. Dvanáct pacientů s proktitidou užívalo 2mg čípky, sedm pacientů s levostrannou kolitidou 4mg klyzmata. Klinické a histologické zlepšení bylo zjištěno u deseti pacientů (83 %) užívajících čípky (příloha 1). Nebylo ale zjištěno zlepšení u většiny pacientů užívajících takrolimové nálevy. Podle autorů byla příčinou nízká koncentrace takrolimu ve střevní sliznici při užití klyzmatu. V uvedených studiích nebyly hlášeny žádné významné vedlejší účinky a preparáty byly dobře tolerovány. Randomizované, placebem kontrolované studie nebyly provedeny. Topické užití cyklosporinu A v nálevu bylo prvně popsáno v roce 1989 [15]. Systémová dostupnost rektálně podaného cyklosporinu A je zanedbatelná a jen výjimečně může být spojena s nežádoucími účinky. Otevřené studie [16,17] prokazovaly účinnost nálevu cyklosporinu jak v dávce 350 mg, tak 250 mg. Jednoduchá, randomizovaná, placebem kontrolovaná studie s nálevem cyklosporinu A prokázala, že po čtyřech týdnech sledování pozitivně reagovalo 40 % pacientů užívajících cyklosporin A a 45 % pacientů užívajících placebo [18]. Tento neúspěšný výsledek je podobný výsledku s takrolimovými nálevy, proto může souviset s nízkou koncentrací léčiva v povrchu sliznice.
Méně časté topické přípravky
Další méně časté topické přípravky jsou v léčbě distální kolitidy užívány raritně. Předpokládaný efekt podání butyrátového klyzmatu vychází z faktu, že poškozená sliznice není schopna produkovat mastné kyseliny s krátkým řetězcem, vychytávat je a utilizovat. Mimo přímého dodání energie mají mastné kyseliny s krátkým řetězcem protizánětlivý efekt a redukují translokaci NF‑ κB z jádra makrofágů ve sliznici tračníku. Slibné výsledky z otevřených studií však nebyly v randomizované studii potvrzeny [19]. Efekt podání ochranného neabsorpčního přípravku z piniové pryskyřice (Ecabet Sodium) byl prokázán u gastritidy a žaludečních vředů. Předpokladem efektu při lokálním rektálním podání je adherence na sliznici a vytvoření bariéry pro translokaci luminálních bakterií do sliznice. Výsledky na animálních modelech byly slibné, ale z otevřených studií kontroverzní [20,21], a ke zhodnocení efektu v topické léčbě distální kolitidy jsou nutné další studie. Efekt klyzmatu s epidermálním růstovým faktorem (EGF) prokázala jedna malá randomizovaná, dvojitě slepá, placebem kontrolovaná studie s 24 pacienty [22]. Lokální užití EGF pomáhá hojení kožních ran, systémové podání EGF bylo efektivní u nekrotizující enterokolitidy. Efektivita preparátu však nebyla dosud prokázána v jiné studii. Podávání nikotinového klyzmatu (6 mg) bylo efektivní u pacientů v otevřené studii, ale randomizovaná studie se 104 pacienty efekt proti placebu neprokázala [23]. První užití arzenových čípků bylo popsáno v roce 1965, mechanizmus účinku ale není dosud znám. Od té doby byla provedena pouze jedna otevřená studie s čípky obsahujícími organický arzen (Acetarsol supp. 250 mg), kdy byla léčba efektivní, ale potenciálně nebezpečná pro přítomnost anorganického arzenu v séru i krvi [24]. V zánětlivé sliznici je v nadbytku produkován tromboxan. Kombinovaný inhibitor syntézy tromboxanu a antagonista jeho receptoru Ridogrel v rektálním nálevu byl zkoušen v malé otevřené studii s částečným efektem [25]. Použití klyzmatu s lidokainem bylo založeno na předpokladu, že hyperreaktivita autonomních nervů může hrát roli v patogenezi ulcerózní kolitidy. Po efektu na zvířecích modelech byl v otevřené studii podáván 2% lidokain gel (400 mg dvakrát denně) s působivými výsledky (klinická odpověď v 83 %) [26], ale další studie nebyly dosud publikovány. Proběhlo několik otevřených studií s rebamipidem [27], inhibitorem produkce volných radikálů, který může stimulovat produkci endogenních prostaglandinů a podpořit hojení sliznice. V otevřených studiích byl efektivní u refrakterní distální kolitidy, ale dosud nebyla provedena randomizovaná, dvojitě slepá, placebem kontrolovaná studie. Podávání bismutového klyzmatu obsahujícího 450 mg citrátu bismutu ve studii u 68 pacientů s levostrannou ulcerózní kolitidou prokázalo srovnatelné výsledky proti topicky podávanému 2g mesalazinu [28]. Preparát však nebyl zkoušen u refrakterní distální kolitidy.
Pouchitida, cuffitida
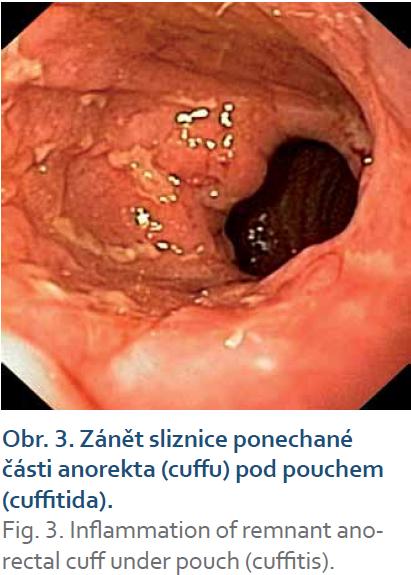
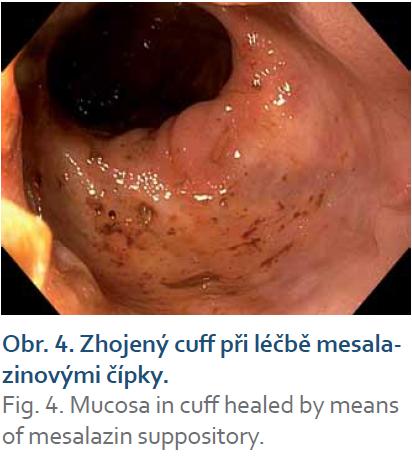
Pouchitida je nejčastější komplikace restorativní proktokolektomie u pacientů s ulcerózní kolitidou a postihuje minimálně jednou za život více než polovinu pacientů. V medikamentózní léčbě má místo i lokální terapie. Lokálně podávané klyzma s budesonidem v randomizované studii bylo u akutní pouchitidy stejně efektivní jako p.o. metronidazol [29]. V pilotní studii byl efektivní u chronické pouchitidy i nálev cyklosporinu. Proběhly také nekontrolované studie s nálevy a čípky s mastnými kyselinami s krátkým řetězcem. Malá otevřená studie s klyzmatem obsahující alicaforsen – inhibitor adhezní molekuly ICAM‑1 (intercelulární adhezní molekula 1) prokázala efektivitu u 58 % pacientů [30]. Zánět sliznice ponechané části anorekta (cuffu) pod pouchem je znám pod názvem cuffitida. Léčí se lokální aplikací mesalazinového čípku 500 mg dvakrát denně (obr. 3, 4) [31].
Crohnova choroba
Lokální léčba je používána zejména u ulcerózní kolitidy. Její užití u Crohnovy choroby je minoritní. Přestože je topicky podávaná léčba mesalazinem u distální Crohnovy choroby často předepisována, neexistují důkazy pro efektivitu léto léčby. Pro fistulující perianální formu onemocnění byl v několika malých (i randomizovaných) studiích sledován efekt topického takrolimu s povzbudivými výsledky [32] (redukce aktivních píštělí o 50 % u 75 % pacientů) bez pozorování významných vedlejších nežádoucích účinků, nutné jsou však další studie. V klinické praxi se často používají metronidazolové čípky u perianální fistulující formy onemocnění. Randomizovaná studie s 10% metronidazolovou mastí prokázala pouze parciální účinnost léčby bez poklesu perianálního indexu aktivity [33].
Závěr
Lokální léčba je spojena s menšími vedlejšími efekty a vyšší terapeutickou účinností ve srovnání se systémovou léčbou. Efekt léčby závisí na koncentraci léčiva ve slizniční vrstvě a době kontaktu se sliznicí. Topicky podávaný mesalazin je první linií léčby proktitidy a distální kolitidy. Lokální kortikoidy jsou indikované při neefektivitě kombinované léčby 5- ASA. Efektivita méně obvyklých lokálních preparátů není podložena dostatkem dat opravňujících k doporučení jejich obecného užívání.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Doručeno/Submitted: 30. 12. 2014
Přijato/Accepted: 29. 1. 2015
MU Dr. Tomáš Douda, Ph.D.
II. interní gastroenterologická klinika
LF UK a FN Hradec Králové
Sokolská 581, 500 05 Hradec Králové
tomas.douda@fnhk.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Seibold F, Fournier N, Beglinger C et al. Topical therapy is underused in patients with ulcerative colitis. J Crohns Colitis 2014; 8(1): 56– 63. doi: 10.1016/ j.crohns.2013.03.005.
2. Liptay S, Bachem M, Häcker G et al. Inhibition of nuclear factor kappa B and induction of apoptosis in T‑lymphocytes by sulfasalazine. Br J Pharmacol 1999; 128(7): 1361– 1369.
3. Kaiser GC, Yan F, Polk DB. Mesalamine blocks tumor necrosis factor growth inhibition and nuclear factor kappaB activation in mouse colonocytes. Gastroenterology 1999; 116(3): 602– 609.
4. Dignass A, Lindsay JO, Sturm A et al. Second European evidence‑based consensus on the diagnosis and management of ulcerative colitis part 2: current management. J Crohns Colitis 2012; 6(10): 991– 1030. doi: 10.1016/ j.crohns.2012.09.002.
5. Kruis W, Kiudelis G, Rácz I et al. Once daily versus three times daily mesalazine granules in active ulcerative colitis: a double‑blind, double‑dummy, randomised, non‑inferiority trial. Gut 2009; 58(2): 233– 240. doi: 10.1136/ gut.2008.154302.
6. Flourié B, Hagège H, Tucat G et al. Randomised clinical trial: once‑ vs. twice‑ daily prolonged‑ release mesalazine for active ulcerative colitis. Aliment Pharmacol Ther 2013; 37(8): 767– 775. doi: 10.1111/ apt.12266.
7. Prokopová L, Ďuricová D, Bortlík M et al.
Doporučené postupy pro podávání aminosalicylátů u nemocných s idiopatickými střevními záněty. Gastroent Hepatol 2012; 66(5): 391– 400.
8. Eliakim R, Tulassay Z, Kupcinskas L et al. Clinical trial: randomized‑ controlled clinical study comparing the efficacy and safety of a low‑ volume vs. a high‑volume mesalazine foam in active distal ulcerative colitis. Aliment Pharmacol Ther 2007; 26(9): 1237– 1249.
9. Probert CS, Dignass AU, Lindgren S et al.
Combined oral and rectal mesalazine for the treatment of mild‑ to‑ moderately active ulcerative colitis: rapid symptom resolution and improvements in quality of life. J Crohns Colitis 2014; 8(3): 200– 207. doi: 10.1016/ j.crohns.2013.08.007.
10. Marshall JK, Thabane M, Steinhart AH et al. Rectal 5– aminosalicylic acid for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev 2012; 11. doi: 10.1002/ 14651858.CD004118.pub2.
11. Lindgren S, Löfberg R, Bergholm L et al.
Effect of budesonide enema on remission and relapse rate in distal ulcerative colitis and proctitis. Scand J Gastroenterol 2002; 37(6): 705– 710.
12. Fiorino G, Gilardi D, Naccarato P et al. Safety and efficacy of sodium hyaluronate (IBD98E) in the induction of clinical and endoscopic remission in subjects with distal ulcerative colitis. Dig Liver Dis 2014; 46(4): 330– 334. doi: 10.1016/ j.dld.2013.12.
008.
13. Lawrance IC, Copeland TS. Rectal tacrolimus in the treatment of resistant ulcerative proctitis. Aliment Pharmacol Ther 2008; 28(10): 1214– 1220. doi: 10.1111/ j.1365‑ 2036.2008.03841.x.
14. Van Dieren JM, van Bodegraven AA, Kuipers EJ et al. Local application of tacrolimus in distal colitis: feasible and safe. Inflamm Bowel Dis 2009; 15(2): 193– 198. doi: 10.1002/ ibd.20644.
15. Ranzi T, Campanini MC, Velio P et al. Treatment of chronic proctosigmoiditis with cyclosporin enemas. Lancet 1989; 2(8654): 97.
16. Sandborn WJ, Tremaine WJ, Schroeder KW et al. Cyclosporine enemas for treatment‑resistant, mildly to moderately active, left‑ sided ulcerative colitis. Am J Gastroenterol 1993; 88(5): 640– 645.
17. Winter TA, Dalton HR, Merrett MN et al. Cyclosporin A retention enemas in refractory distal ulcerative colitis and „pouchitis“. Scand J Gastroenterol 1993; 28(8): 701– 704.
18. Sandborn WJ, Tremaine WJ, Schroeder KW et al. A placebo‑ controlled trial of cyclosporine enemas for mildly to moderately active left‑ sided ulcerative colitis. Gastroenterology 1994; 106(6): 1429– 1435.
19. Breuer RI, Soergel KH, Lashner BA et al. Short chain fatty acid rectal irrigation for left‑ sided ulcerative colitis: a randomised, placebo controlled trial. Gut 1997; 40(4): 485– 491.
20. Kono T, Nomura M, Kasai S et al. Effect of ecabet sodium enema on mildly to moderately active ulcerative proctosigmoiditis: an open‑ label study. Am J Gastroenterol 2001; 96(3): 793– 797.
21. Monteleone G, Caprioli F. Drug evaluation: TA‑ 2711E in the treatment of active distal ulcerative colitis. Curr Opin Investig Drugs 2007; 8(5): 423– 428.
22. Sinha A, Nightingale J, West KP et al. Epidermal growth factor enemas with oral mesalamine for mild‑ to‑ moderate left‑ sided ulcerative colitis or proctitis.
N Engl J Med 2003; 349(4): 350– 357.
23. Ingram JR, Thomas GA, Rhodes J et al. A randomized trial of nicotine enemas for active ulcerative colitis. Clin Gastroenterol Hepatol 2005; 3(11): 1107– 1114.
24. Forbes A, Britton TC, House IM et al. Safety and efficacy of acetarsol suppositories in unresponsive proctitis. Aliment Pharmacol Ther 1989; 3(6): 553– 556.
25. Auwerda JJ, Zijlstra FJ, Tak CJ et al. Ridogrel enemas in distal ulcerative colitis. Eur J Gastroenterol Hepatol 2001; 13(4): 397– 400.
26. Lawrance IC. Topical agents for idiopathic distal colitis and proctitis. J Gastroenterol Hepatol 2011; 26(1): 36– 43. doi: 10.1111/ j.1440‑ 1746.2010.06497.x.
27. Furuta R, Ando T, Watanabe O et al.
Rebamipide enema therapy as a treatment for patients with active distal ulcerative colitis. J Gastroenterol Hepatol 2007; 22(2): 261– 267.
28. Pullan RD, Ganesh S, Mani V et al. Comparison of bismuth citrate and 5- aminosalicylic acid enemas in distal ulcerative colitis: a controlled trial. Gut 1993; 34(5): 676– 679.
29. Sambuelli A, Boerr L, Negreira S et al. Budesonide enema in pouchitis – a double‑blind, double‑dummy, controlled trial. Aliment Pharmacol Ther 2002; 16(1): 27– 34.
30. Miner P, Wedel M, Bane B et al.
An enema formulation of alicaforsen, an antisense inhibitor of intercellular adhesion molecule‑ 1, in the treatment of chronic, unremitting pouchitis. Aliment Pharmacol Ther 2004; 19(3): 281– 286.
31. Van Assche G, Dignass A, Bokemeyer B
et al. Second European evidence‑based consensus on the diagnosis and management of ulcerative colitis part 3: special situations. J Crohns Colitis 2013; 7(1): 1– 33. doi: 10.1016/ j.crohns.2012.09.005.
32. Hart AL, Plamondon S, Kamm MA. Topical tacrolimus in the treatment of perianal Crohn‘s disease: exploratory randomized controlled trial. Inflamm Bowel Dis 2007; 13(3): 245– 253.
33. Maeda Y, Ng SC, Durdey P et al. Randomized clinical trial of metronidazole ointment versus placebo in perianal Crohn‘s disease. Br J Surg 2010; 97(9): 1340– 1347. doi: 10.1002/ bjs.7121.