Význam sarkopénie a krehkosti v manažmente cirhózy
Petra Vrbová1, Tomáš Koller Orcid.org 1
+ Pracoviště
Souhrn
V súčasnosti máme dosť nástrojov na relatívne rýchle a presné zhodnotenie svalovej sily a funkčného stavu u pacienta s cirhózou. Je možné konštatovať, že diagnostické kritériá sarkopénie a krehkosti sa postupne z praktických dôvodov približujú. Obe sú rovnako negatívnym prediktorom priebehu choroby u hospitalizovaných pacientov s cirhózou pred rozhodnutím o indikácii transplantácie pečene, u pacientov na čakacej listine a tiež po transplantácii. Sarkopénia a krehkosť predstavujú silný a od štádia choroby nezávislý prediktívny faktor mortality u všetkých pacientov s cirhózou. Nediagnostikovaná a neliečená sarkopénia a krehkosť zvyšujú aj riziko pádov a zlomenín, narušujú prirodzenú schopnosť vykonávať činnosti každodenného života, zvyšujú mieru závislosti od iných, sú asociované so znížením kognitívnych funkcií, s vyšším rizikom objavenia sa komplikácií choroby, so zníženou kvalitou života a s predĺženou hospitalizáciou. Ich včasná identifikácia umožní optimalizáciu manažmentu pacienta s neodkladným nasadením nutričnej podpory a prehabilitácie s cieľom zabrániť ďalšiemu zhoršeniu funkčného stavu a vyhnúť sa nepriaznivým dôsledkom choroby.
Klíčová slova
cirhóza pečene, nutričný stav, sarkopénia, krehkosť, diagnostika, prognóza
Úvod
Cirhóza pečene je rastúcou príčinou morbidity a mortality vo vyspelých krajinách. Patrí medzi jednu z najčastejších príčin predčasných úmrtí v krajinách strednej Európy. Vedúcou príčinou cirhózy pečene je na Slovensku alkoholová choroba pečene, nasledovaná najrýchlejšie rastúcou nealkoholovou tukovou chorobou pečene, ďalej kryptogénnou cirhózou pečene, infekciou vírusom hepatitídy B a v menšej miere aj C. V rámci Európy patrí Slovensko na štvrté miesto v miere mortality na choroby pečene, s 23 úmrtiami na 100 000 obyvateľov ročne [1]. Cirhóza tiež patrí medzi tretiu najčastejšiu príčinu smrti medzi 45- až 65-ročnými a prvú najčastejšiu príčinu medzi 25- až 44-ročnými [2]. Prirodzený priebeh cirhózy je charakterizovaný asymptomatickou kompenzovanou fázou, ktorá môže prejsť do dekompenzovanej fázy s pridruženými komplikáciami, akými sú ascites, varikózne krvácanie, encefalopatia, ikterus a zhoršený nutričný stav. Prechod z kompenzovanej do dekompenzovanej formy sa udeje u 5–7 % pacientov za rok. Medián prežitia klesá z viac ako 12 rokov u kompenzovanej formy na približne dva roky podekompenzácii [3]. Malnutrícia je častá, vyskytuje sa u 46 až 95 % prípadov hospitalizovaných pacientov s cirhózou. Je spôsobená poruchou vstrebávania živín, zníženým príjmom potravy a zvýšenými energetickými potrebami. Dochádza k dysbalancii svalovej homeostázy v prospech svalovej degradácie. Toto všetko vedie ku katabolizmu, ktorého obeťou sú najmä svaly, pre ich najvýznamnejší zdroj proteínov [4–7].
Sarkopénia
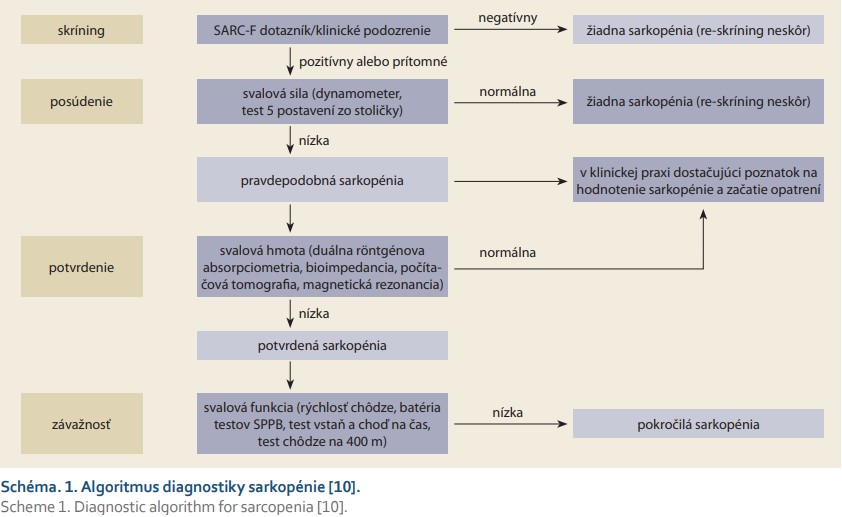
Termín sarkopénia (z gréčtiny sarx – mäso, penia – nedostatok, strata) prvýkrát použil v roku 1989 Irwin Rosenberg, ktorý týmto pojmom opísal vekom podmienenú stratu svalovej hmoty [8]. Európska pracovná skupina pre sarkopéniu u starších ľudí EWGSOP (European Working Group on Sarcopenia in Elderly People) definovala sarkopéniu ako syndróm charakterizovaný progresívnou, generalizovanou stratou svalovej hmoty, svalovej sily a svalovej funkcie spojený s väčším rizikom výskytu nepriaznivých dôsledkov, akými sú znížená fyzická výkonnosť až imobilita, pády, zlomeniny, opakované hospitalizácie, nízka kvalita života či smrť [9]. Podľa aktualizovaných odporúčaní z roku 2019 definuje EWGSOP sarkopéniu nie ako syndróm, ale ako progresívné a generalizované ochorenie svalov, resp. svalové zlyhanie [10].
Rozlišujeme sarkopéniu primárnu, teda vekom podmienenú, a sekundárnu, ktorá sprevádza chronické choroby, stavy spojené s imobilizáciou alebo neadekvátnym príjmom či trávením živín. Sarkopéniu môžeme rozdeliť aj podľa dĺžky trvania na akútnu (trvajúcu < 6 mesiacov) a chronickú (trvajúcu ≥ 6 mesiacov). EWGSOP rozdeľuje jednotlivcov na základe prítomnosti zníženej svalovej sily, funkcie a/alebo hmoty do troch štádií. Prvým je pravdepodobná sarkopénia (znížená svalová sila), druhým je potvrdená sarkopénia (znížená svalová sila a hmota) a tretím je pokročilá sarkopénia (znížená svalová sila, hmota a funkcia) [9].
Diagnostika sarkopénie
Medzi rýchle orientačné metódy hodnotenia nutričného stavu patria v prvom rade anamnestické údaje o alterovanom príjme potravy a dĺžke jeho trvania, o intervaloch medzi jednotlivými pokrmami, nechutenstve, dyspeptických ťažkostiach, redukcii hmotnosti (> 5 % hmotnosti za 3 mesiace), slabosti, únave či anorexii. EWGSOP odporúča na skríning sarkopénie použitie dotazníka ,,SARC-F“ (skóre ≥ 4/10 predikuje k sarkopénii) [10,11]. Pokračuje sa fyzikálnym vyšetrením, hodnotením štádia choroby a prítomných komplikácií. Nápomocné môžu byť aj laboratórne markery nutričného stavu: C-reaktívny proteín (CRP), interleukín 6 (IL-6), leukocyty, tumor nekrotizujúci faktor alfa (TNF-alfa), hemoglobín, albumín, prealbumín, transferín, myostatín, inzulínu podobný rastový faktor jeden (IGF-1), vitamín D, hormóny a ďalšie, ktorých relevancia sa stále skúma [10,12].
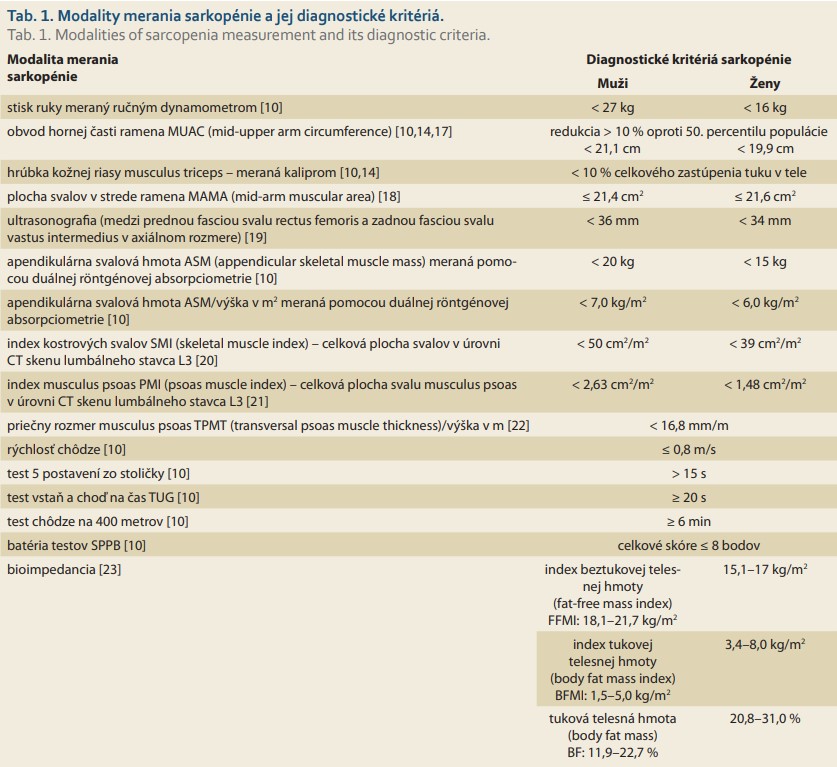
Objektívna diagnostika sarkopénie nie je zatiaľ úplne jednotná, ale je založená na prevedení niektorého z možných testov, ktoré merajú parametre svalovej sily, hmoty a funkcie. V klinickej praxi sa prikláňame často k najjednoduchším metódam, akými sú napr. antropometrické merania. U pacientov s retenciou tekutín sa však hodnotenie nutričného stavu pomocou indexu telesnej hmotnosti BMI (body mass index) považuje za nepresné. Napríklad u série 1 313 pacientov čakajúcich na transplantáciu pečene Leonard et al preukázali, že po úprave objemu ascitu sa 11 až 20 % pacientov presunulo do nižšej klasifikácie BMI [13]. Svalová sila sa najčastejšie meria prostredníctvom stisku ruky ručným dynamometrom. Medzi presnejšie spôsoby merania svalovej hmoty sa považuje bioimpedančná metóda (BIA – bioelectrical impedance analysis), duálna röntgénová absorpciometria (DXA – dual-energy x-ray absorptiometry), ultrasonografické meranie rozmerov svalov, počítačová tomografia (CT – computed tomography) a magnetická rezonancia (MR – magnetic resonance imaging) [10,14].
Na zhodnotenie funkčného stavu pacienta môžeme použiť aj batériu testov (SPPB – Short Physical Performance Battery), ktorá pozostáva z merania času chôdze na 4 metre, z ktorého vypočítame rýchlosť chôdze, z merania času udržania rovnováhy (maximálne 10 sekúnd) v troch pozíciách chodidiel (vedľa seba, v šikmej a tandemovej polohe) a z času potrebného na päť postavení zo stoličky bez pomoci rúk (antigravitačná doména) [15,16]. Alternatívou môže byť test vstaň a choď (Timed-Up and Go), ktorý meria čas od postavenia do prejdenia vzdialenosti 3 metre, otočenia sa a posadenia naspäť. O niečo náročnejšie je prevedenie testu chôdze na 400 metrov, ktorý testuje aj výdrž, avšak vyžaduje dráhu dlhú viac než 20 metrov [10,14]. Podmienkou praktickej diagnostiky sarkopénie je najmä klinický kontext, z ktorého vyplýva jej riziko. Pomocným nástrojom na identifikáciu rizika je voľne dostupný dotazník SARC-F [11]. Prvou podmienkou diagnózy sarkopénie podľa EWGSOP2 konsenzu je dôkaz zníženej svalovej sily. Ak sa potvrdí aj zníženie svalovej hmoty, tak sa diagnóza sarkopénie považuje za potvrdenú. Tab. 1 sumarizuje dostupné modality diagnostiky sarkopénie a na schéme 1 je uvedený aktuálny algoritmus diagnostiky sarkopénie podľa EWGSOP2.
Krehkosť
Krehkosť bola prvýkrát opísaná v oblasti geriatrie [24,25]. Je definovaná ako klinicky rozpoznateľný stav zvýšenej zraniteľnosti voči každodenným alebo akútne vzniknutým stresorom vonkajšieho prostredia vyplývajúci zo zníženej funkčnej rezervy spojenej s fyziologickým starnutím orgánových systémov [26–29]. Krehkosti zvyčajne predchádza sarkopénia, ktorá sa považuje za jej hnaciu silu. V posledných rokoch sa chápanie významu krehkosti posúva z oblasti geriatrie do ostatných odborov internej medicíny, kde sa skúma význam krehkosti navodenej chronickými chorobami (cirhóza, srdcové zlyhávanie, ochorenie obličiek, malígne ochorenia a ďalšie) [24]. Krehkosť bola historicky definovaná skôr globálnym zhodnotením pozorovateľného funkčného stavu a sarkopénia skôr ako súbor exaktných parametrov svalovej hmoty alebo sily. V posledných rokoch sa definícia sarkopénie (viď vyššie) posúva viac ku hodnoteniu svalovej funkcie a celkového funkčného statusu, čím sa definície krehkosti a sarkopénie k sebe značne približujú [24,29].
Diagnostika krehkosti
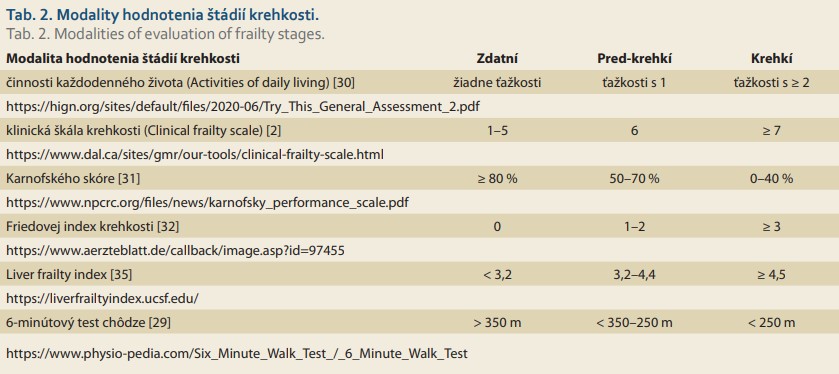
Meranie činností každodenného života (ADL – activities of daily living), patrilo k prvým hodnoteniam funkčného stavu staršej populácie. Spočiatku zahŕňalo schopnosť vykonávania šiestich činností: kúpanie, obliekanie, prejdenie na toaletu, postavenie sa a pohyb, kontinenciu a kŕmenie [30]. Rockwood neskôr zaviedol tzv. index krehkosti (Rockwood frailty index), ktorý bol neskôr modifikovaný na tzv. Klinickú škálu krehkosti (CFS – Clinical frailty scale), ktorá rozdeľuje pacientov na 9 skupín od 1 = zdatní (very fit) až po 9 = terminálne chorí (terminally ill) [28,29]. Tzv. Karnofského skóre KPS (Karnofsky Performance Scale) hodnotí celkový stav pacienta a využíva sa najmä v onkológii. Pohybuje sa od 100 % (označujúci normálny funkčný stav bez ťažkostí) až po 0 % (označujúci smrť). Rozdeľuje pacientov na tri kategórie: A (80–100 %), B (70–50 %) a C (40–0 %) [31]. Na základe rozsiahlej kohortovej štúdie s viac ako 5 300 staršími mužmi a ženami žijúcimi v komunite v USA sa Friedová et al zaslúžili o jednoduchšiu fenotypovú definíciu – tzv. fenotyp krehkosti podľa Friedovej FFP (Fried frailty phenotype). Za definovanie fenotypu krehkosti je nutné splnenie troch alebo viac z piatich fenotypových kritérií (slabosť stisku ruky, rýchlosť bežnej chôdze, úroveň fyzickej aktivity meraná spotrebou energie, subjektívne udávaná únava a neúmyselná strata hmotnosti). Vo fáze, v ktorej sú prítomné jedno alebo dve kritériá, sa označuje táto podskupina ako predstupeň krehkosti – tzv. predkrehkí pacienti (pre-frail) s vysokým rizikom progresie do krehkosti. Starší jedinci, ktorí majú tri a viac kritérií, sa považujú za krehkých, a tí, ktorí nemajú žiadne z vyššie uvedených kritérií, sú klasifikovaní ako zdatní (robust, non-frail) [25,32–34]. V kontexte starostlivosti o pacientov s chronickými chorobami pečene, ktorí sú čakateľmi na transplantáciu pečene, boli na základe záverov štúdie FRAILT identifikované tri funkčné domény, ktoré najlepšie predpovedali osud pacientov na čakacej listine. Bola to sila stisku ruky, čas udržania rovnováhy v troch polohách chodidiel a čas potrebný na päť postavení zo stoličky. Takto objektívne stanovené parametre boli matematicky vyhodnotené do tzv. Liver frailty index [35], ktorý číselne vyjadroval stupeň krehkosti čakateľa. V tab. 2 sú zhrnuté dostupné modality hodnotenia štádií krehkosti.
Vplyv sarkopénie a krehkosti na prognózu chronickej choroby pečene
Sarkopénia
Zhoršený nutričný stav negatívne ovplyvňuje prognózu a prežívanie pacientov s chronicky prebiehajúcimi chorobami. Záťaž na spoločnosť potrebou zvýšenej starostlivosti a vynaložením ekonomických nákladov je signifikantná [36]. Sarkopénia pri cirhóze je jednou z najčastejšie prehliadaných komplikácií, ktorá sa vyskytuje až u 40–70 % pacientov [37]. Má negatívny dopad na kvalitu života postihnutých a ich okolie, ale aj na prognózu primárnej choroby pečene, na výskyt ostatných komplikácií a z nich vyplývajúcej stúpajúcej mortality [9,10,14,38].
V systematickej review s metaanalýzou 20 štúdií realizovanými medzi rokmi 2010 a 2016 so 4 037 pacientmi s cirhózou bola sarkopénia spojená so zvýšeným rizikom infekcie, zvýšenou dĺžkou hospitalizácie a nižším prežívaním nezávisle od iných rizikových faktorov, akými boli vek a skóre MELD (Model for End Stage Liver Disease) [39]. Porovnaním geografických rozdielov bola vyššia úmrtnosť zistená v ázijských populáciách v porovnaní so západnými [39]. V štúdií Montano-Loza et al z roku 2012 bola sarkopénia zistená prostredníctvom indexu kostrových svalov SMI (skeletal muscle index) v úrovni CT skenu lumbálneho stavca L3 u takmer 40 % pacientov s cirhózou pečene na čakacej listine na transplantáciu. Zistili, že riziko mortality bolo viac ako dvojnásobne vyššie u sarkopenických pacientov ako u pacientov nesarkopenických [40]. To súviselo neskôr s vyšším výskytom pooperačnej sepsy, neurologických komplikácií, dlhšieho pobytu na jednotke intenzívnej starostlivosti a ventilačnej podpory [41]. Hodnotením svalovej hmoty pomocou celkovej plochy prierezu musculus psoas (PMA) v úrovni lumbálneho stavca L3 u 256 pacientov čakajúcich na transplantáciu pečene sa ukázala v retrospektívnej štúdii autorov Golse et al signifikantne vyššia mortalita u sarkopenických pacientov než nesarkopenických (3-mesačné prežitie 82 vs. 98 %, 1-ročné prežitie 59,2 vs. 94,5 %, 5-ročné prežitie 53,6 vs. 79,8 %). Sarkopenickí pacienti tiež vykazovali dlhší pobyt na jednotke intenzívnej starostlivosti, vyššiu morbiditu (63 vs. 37 %) a pooperačnú úmrtnosť (21 vs. 1,5 %) [42]. Tieto výsledky potvrdila aj multicentrická štúdia autorov Carey et al u 396 pacientov tiež pomocou SMI. Najčastejším dôvodom na vyradenie pacientov z čakacej listiny u sarkopenických pacientov bola v 68 % prípadoch sepsa s multiorgánovým zlyhávaním [20]. Hodnotenie celkovej plochy kostrových svalov na CT skene v úrovni L3 ku výške jedinca, tzv. skeletal muscle index alebo psoas muscle index [42] sa preto v súčasnosti považujú za zlatý štandard merania svalovej hmoty u pacientov čakajúcich na transplantáciu pečene s normálnymi hodnotami SMI definovanými u mužov ≥ 50 cm2 /m2 a u žien ≥ 39 cm2 /m2 [20] a PMA > 1 561 mm2 u mužov a > 1 464 mm2 u žien. Naviac, z týchto prác sa ukazuje, že negatívny vplyv sarkopénie na riziko komplikácií a úmrtia je vyšší u pacientov s pokročilou chorobou pečene s MELD skóre viac ako 12–15 [22]. Špekuluje sa preto, že sarkopénia takto môže byť jednou z hlavných hnacích síl v začarovanom kruhu komplikácií pri terminálnom štádiu cirhózy.
Štúdie priniesli aj dôkazy o rodovej nerovnosti v tom, ako vplýva sarkopénia na priebeh choroby a prognózu pacientov. V skupine 200 funkčne nezávislých dospelých vo veku ≥ 50 rokov bola sarkopénia, diagnostikovaná kritériami EWGSOP, významne asociovaná u oboch pohlaví so zvyšujúcim sa vekom. Riziko vzniku sarkopénie u žien, ktoré bolo 6-násobne vyššie, súviselo s pridruženou malnutríciou. Vyššie ale prijateľné rozmedzie sérových triglyceridov predstavovalo ochrannú úlohu pred sarkopéniou u mužov [43]. U 677 pacientov indikovaných na transplantáciu pečene Ebadi et al zistili, že u žien je nižšie množstvo podkožného tuku, ale nie viscerálneho tuku alebo plochy kostrových svalov, spojené s vyššou úmrtnosťou [44]. Skladaný et al tiež skúmali úlohu myostatínu a sarkopénie vo vzťahu ku prognóze hospitalizovaných pacientov s cirhózou v registri RH7 a zistili, že nízka hodnota myostatínu aj sarkopénia boli asociované s horšou prognózou u mužov, ale nie u žien [45].
Štúdia Praktiknjo et al prvýkrát v roku 2019 skúmala úlohu sarkopénie vo vývoji akútneho zlyhania pečene na podklade chronického poškodenia ACLF (acute-on-chronic liver failure) u 186 pacientov s dekompenzovanou cirhózou pečene, ktorí dostali transjugulárny intrahepatálny portosystémový shunt (TIPS). U pacientov so sarkopéniou definovanou CT skenom prierezu plochy musculus psoas sa po TIPS v porovnaní so skupinou bez sarkopénie preukázala významne vyššia miera úmrtnosti, ascitu, hepatálnej encefalopatie a ACLF [46].
Krehkosť
Podľa slovenskej štúdie Skladaný et al z roku 2019 sa zo 104 mužov prijatých na interné oddelenie zistila krehkosť na základe dotazníku PRISMA 7 a testu rýchlosti chôdze u 77 % pacientov. S krehkosťou bol asociovaný vyšší vek, vyšší výskyt infekcií, hyponatriémia pri príjme do nemocnice, dlhšie trvanie hospitalizácie, tendencia k rehospitalizáciám a celková vyššia úmrtnosť [47]. Krehkosť sa vyskytuje aj u 17–43 % pacientov čakajúcich na transplantáciu pečene, a predpovedá zvýšenú morbiditu a mortalitu, zahrňujúc zvýšený výskyt dekompenzácie choroby, hospitalizácií, predĺžený pobyt v nemocnici, vyradenie z transplantačného programu a viac post transplantačných komplikácii [29].
Podľa výsledkov transplantačného registra štúdie Malinisa et al z roku 2014 bola zistená asociácia pacientov s Karnofského skóre B až C s 5-ročnou mortalitou [34,48]. V štúdii Ormana et al z roku 2016 1-ročná mortalita stúpala podľa kategórie Karnofského skóre A 11,4 %, B 15,5 % a C 27,4 % [34,49]. Štúdia zameraná na hospitalizovaných pacientov s dekompenzovanou formou cirhózy ukázala 3-mesačnú mortalitu v kategórií A u 5 % pacientov, v B u 11 % a v C u 23 % [34]. Klinickú škálu krehkosti (CFS) vyhodnotili Tandon et al ako rýchly skríningový nástroj, ktorý by sa dal ľahko aplikovať na identifikáciu pacientov s cirhózou pečene, u ktorých je prítomné vyššie riziko nežiaducich udalostí [50]. Viaceré štúdie dokázali, že krehkosť, ktorá se odráža od skóre činností každodenného života (ADL), je nezávislým prediktorom úmrtnosti u pacientov s cirhózou [33,51,52].
Laiová et al preukázali vo svojej štúdii s 294 pacientmi s cirhózou na čakacej listine na transplantáciu s MELD skóre ≥ 12 u krehkých pacientov definovaných na základe Friedovej indexu krehkosti (FFI ≥ 3) štatisticky významne vyššie skóre MELD, vyšší výskyt ascitu a hepatálnej encefalopatie, ako aj nezávislé spojenie medzi krehkosťou a mortalitou [33]. Podobne aj Sinclair et al sledovali 587 pacientov s cirhózou pečene na čakacej listine na transplantáciu, z ktorých 31,6 % bolo na základe Friedovej indexu krehkosti FFI (Fried frailty index) klasifikovaných ako krehkých (FFI ≥ 3). Počas 12-mesačného sledovania vyžadovalo 43 % pacientov najmenej jednu hospitalizáciu, pričom vyššie riziko rehospitalizácie s vyšším počtom strávených dní v nemocnici bolo pozorované u krehkých pacientov. Hlavným dôvodom hospitalizácie bola infekcia u 39 %, hepatálna encefalopatia u 19 %, akútna renálna insuficiencia alebo ascites u 16 %, krvácanie do gastrointestinálneho traktu u 8 % a iná príčina u 19 % [53]. U pacientov s cirhózou pečene je na čakacej listine transplantácie miera úmrtnosti signifikantne vyššia u krehkých pacientov v porovnaní so zdatnými (non-frail) (19 % krehkí vs. 4 % zdatní). Ako komorbidita krehkých čakateľov bola zistená aj pridružená depresia (54 % krehkí vs. 29 % zdatní) [29]. U pacientov čakajúcich na transplantáciu bolo zistené vyššie riziko mortality aj prostredníctvom testu merania prechodenej vzdialenosti počas 6-minútovej chôdze < 250 m [54–56].
Z údajov FRAILT štúdie Laiová et al odhalili, že funkčný stav sa na čakacej listine zhoršil za 3 mesiace nasledovne: –0,38 kg pri sile stisku ruky; –0,05 m/s pri chôdzi, –0,03 s pri vstávaní zo stoličky a celkovo o –0,16 skóre batérie testov SPPB, čo bolo spojené so zvýšeným rizikom úmrtia, ako aj s rizikom vyradenia z čakacej listiny nezávisle od závažnosti choroby pečene [57]. Dunn et al zistili, že každé zníženie rýchlosti chôdze o 0,1 m/s bolo spojené s 22% nárastom počtu dní strávených v nemocnici. Krehkosť meraná rýchlosťou chôdze predstavovala nezávislý a potenciálne modifikovateľný rizikový faktor komplikácií cirhózy pečene, ktoré vyžadujú hospitalizáciu [58].
Niekoľko štúdií zistilo, že krehkosť je u pacientov s cirhózou spojená s významne zvýšeným rizikom dekompenzácie. To zahŕňa vyššie riziko vzniku ascitu (57 % krehkí vs. 34 % zdatní) a encefalopatie (26 % krehkí vs. 17 % zdatní), ako aj významne nižšie hladiny sérového albumínu (31,2 g/l krehkí vs. 35,1 g/l zdatní). Krehkosť tak nezvyšuje pravdepodobnosť výskytu akejkoľvek konkrétnej komplikácie cirhózy pečene, ale skôr znižuje fyziologickú rezervu pacientov čeliť interkurentným komplikáciám tak, ako vyplýva z jej definície [29].
Najnovším prírastkom hodnotenia krehkosti sa stal Liver frailty index (LFI). LFI vyšší ako medián súboru (3,8) dokázal v štúdiách predpovedať riziko mortality na čakacej listine pacientov s cirhózou lepšie než samotné skóre MELD-Na (sodík) [35]. Udáva sa, že zatiaľ čo pri sarkopénii je riziko mortality dva až štyrikrát vyššie, tak u krehkých pacientov je až päťnásobne [35,59,60]. Tento index sa preto v súčasnosti považuje za jednu z modalít voľby hodnotenia krehkosti pri cirhóze [34]. Hlavnú výhodu predstavuje oproti subjektívnym hodnoteniam krehkosti, ako sú napríklad Klinická škála krehkosti (CFS), Friedovej index krehkosti (FFS) či činnosti každodenného života (ADL), vo svojej objektivite. V porovnaní s batériou testov SPPB je kontinuálnejší a lepšie dokáže zachytiť zmeny funkčného statusu v čase, čo sú z hľadiska sledovania priebehu choroby a rozhodovania v manažmente vysoko relevantné údaje. LFI má výhodu aj oproti kardiopulmonálnym funkčným testom alebo 6-minútovému testu chôdze, pretože sa môže vykonávať pri lôžku pacienta zaškoleným zdravotníckym pracovníkom, čo trvá približne 2 minúty. V praxi je hlavným cieľom najmä identifikácia pacientov, u ktorých je naliehavá potreba zahájenia nutričnej podpory a cvičebného programu – tzv. prehabilitácie [61]. LFI bol využitý aj v rámci hodnotenia funkčného stavu u 83 pacientov s cirhózou zapojených do 12-týždňového domáceho silového tréningu, kde sa jeho medián ku koncu pilotnej štúdie zlepšil z 3,8 na 3,6 a súvisel s podstatným zlepšením kvality života pacientov [62]. Laiová et al sledovali vývoj krehkosti v čase u 1 093 ambulantných pacientov s cirhózou zaradených na čakaciu listinu po dobu 11 mesiacov, pričom zhoršenie LFI o 0,1 jednotky za 3 mesiace bolo spojené s 2,04-násobne zvýšeným rizikom úmrtia, resp. vyradenia z čakacej listiny. Naopak, u pacientov, u ktorých došlo k zlepšeniu krehkosti vyhodnotenej prostredníctvom LFI, bolo toto riziko nižšie. Štúdia priniesla jeden z prvých dôkazov o možnosti zvratu krehkosti u čakateľov na transplantáciu [63]. Číselné prahy, na základe ktorých sa hodnotí krehkosť, sú však arbitrárne a v praxi je lepšie používať hodnotu LFI ako číslo. Samotná autorka Liver frailty indexu definovala číselný prah pre krehkosť na úrovni viac ako 80. percentilu [35], pričom u pacientov na čakacej listine bol na úrovni > 4,5. V populácii všetkých hospitalizovaných pacientov z HEGITO v Banskej Bystrici bol však prah 80. percentilu až > 5,4, pretože sa jednalo o pacientov vo vyššom štádiu choroby [64]. Prognóza pacientov bola však u oboch prahov (4,5 – 5,4 oproti > 5,4) signifikantne odlišná. Toto poukazuje aj na ďalšiu výhodu LFI oproti iným indexom, teda jeho absenciu efektu stropu, hodnoty nad ktorú sa so zvyšujúcou hodnotou už nezvyšuje riziko úmrtia. Tieto vlastnosti ho predurčujú ako najvhodnejší nástroj na dynamické monitorovania funkčného stavu pacientov na čakacej listine, pretože dokáže zachytiť aj malé zmeny. V bežnej klinickej praxi u pacientov s cirhózou pečene je však na definíciu krehkosti možné použiť všetky validované nástroje (Friedová, CFS, SPPB, Karnovski, LFI), pokiaľ je ich použitie správne aplikované a konzistentné [34,64].
Záver
V súčasnosti máme dosť nástrojov na relatívne rýchle a presné zhodnotenie svalovej sily a funkčného stavu pacienta s cirhózou. Je možné konštatovať, že diagnostické kritériá sarkopénie a krehkosti sa postupne z praktických dôvodov približujú. V klinickej praxi je však jednoduchšie diagnostikovať krehkosť v porovnaní so sarkopéniou, ktorá vyžaduje náročnejšie vyšetrenia. V súčasnosti by bolo žiaduce zjednotiť diagnostické kritériá pre krehkosť, pričom najlepší nástroj v praxi hepatologických aj transplantačných pracovísk sa ukazuje LFI [64]. Sarkopénia a krehkosť predstavujú silný a od štádia choroby nezávislý prediktívny faktor mortality u všetkých pacientov s cirhózou. Nediagnostikovaná a neliečená sarkopénia a krehkosť zvyšujú aj riziko pádov a zlomenín, narušujú prirodzenú schopnosť vykonávať činnosti každodenného života, zvyšujú mieru závislosti od iných, sú asociované so znížením kognitívnych funkcií, s vyšším rizikom objavenia sa komplikácií choroby, so zníženou kvalitou života a s predĺženou hospitalizáciou. Ich včasná identifikácia umožní optimalizáciu manažmentu pacienta s neodkladným nasadením nutričnej podpory a prehabilitácie s cieľom najmä zabrániť ďalšiemu zhoršovaniu funkčného stavu. Dôkazy o možnosti zlepšenia štádia krehkosti u čakateľov na transplantáciu pribúdajú. Zlepšeniu funkčného stavu pacienta vedie ku zlepšeniu celkového priebehu choroby a jej komplikácií.
MUDr. Petra Vrbová
V. interná klinika
LF UK a UN Bratislava
Ružinovská 6
826 06 Bratislava
Slovenská republika
petra5.vrbova@gmail.com
Doručené/Submitted: 14. 1. 2021
Prijaté/Accepted: 20. 2. 2021
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Pimpin L, Cortez-Pinto H, Negro F et al. Burden of liver disease in Europe: epidemiology and analysis of risk factors to identify prevention policies. J Hepatol 2018; 69(3): 718–735. doi: 10.1016/j.jhep.2018.05.011.
2. Zdravotnícka ročenka Slovenskej republiky 2018. Bratislava: Národné centrum zdravotníckych informácií 2019.
3. European Association fot the Study of the Liver. EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol 2018; 69(2): 406–460. doi: 10.1016/j.jhep.2018.03.024.
4. Skladaný L, Vnenčáková J, Laffers L et al. Adherence to oral nutritional supplements after being discharged from the hospital is low but improves outcome in patients with advanced chronic liver disease. Patient Prefer Adherence 2020; 14: 2559–2572. doi: 10.2147/PPA.S283034.
5. Kasper H. Výživa v medicíně a dietetika. 11. vyd. Praha: Grada 2015.
6. Kohout P et al. Vybrané kapitoly z klinické výživy II. Svazek IV. 1. vyd. Praha: Forsapi 2016.
7. Krajčík Š, Mikus P, Bajanová E et al. Výživa vo vyššom veku. Bratislava: Herba 2018.
8. Liguori I, Russo G, Aran L et al. Sarcopenia: assessment of disease burden and strategies to improve outcomes. Clin Interv Aging 2018; 14(13): 913–927. doi: 10.2147/CIA.S149232.
9. Cruz-Jentoft AJ, Baeyens JP, Bauer JM et al. Sarcopenia: European consensus on definition and diagnosis: report of the European working group on sarcopenia in older people. Age Ageing 2010; 39(4): 412–423. doi: 10.1093/ageing/afq034.
10. Cruz-Jentoft AJ, Bahat G, Bauer J et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing 2019; 48(4): 16– 31. doi: 10.1093/ageing/afy169.
11. Malmstrom TK, Miller DK, Simonsick EM et al. SARC‐F: a symptom score to predict persons with sarcopenia at risk for poor functional outcomes. J Cachexia Sarcopenia Muscle 2016; 7(1): 28–36. doi: 10.1002/jcsm.12048.
12. Bharadwaj S, Ginoya S, Tandon P et al. Malnutrition: laboratory markers vs nutritional assessment. Gastroenterol Rep (Oxf) 2016; 4(4): 272– 280. doi: 10.1093/gastro/gow013.
13. Leonard J, Heimbach JK, Malinchoc M et al. The impact of obesity on long-term outcomes in liver transplant recipients – results of the NIDDK liver transplant database. Am J Transplant 2008; 8(3): 667–672. doi: 10.1111/j.1600-6143.2007.02100.x.
14. Topinková E. Sarkopenie jako závažné orgánové selhání, její diagnostika a současné možnosti léčby. Vnitř Lék 2018; 64(11): 1038–1052.
15. Guralnik JM, Simonsick EM, Ferrucci L et al. A short physical performance battery assessing lower extremity function: association with self -reported disability and prediction of mortality and nursing home admission. J Gerontol 1994; 49(2): M85–M94. doi: 10.1093/geronj/49.2.m85.
16. Bergland A, Strand BH. Norwegian reference values for the Short Physical Performance Battery (SPPB): the Tromsø Study. BMC Geriatr 2019; 19(1): 216. doi: 10.1186/s12877-019-1234-8.
17. Akin S, Mucuk S, Öztürk A et al. Muscle function-dependent sarcopenia and cut-off values of possible predictors in community-dwelling Turkish elderly: calf circumference, midarm muscle circumference and walking speed. Eur J Clin Nutr 2015; 69(10): 1087–1090. doi: 10.1038/ejcn.2015.42.
18. Miller MD, Crotty M, Giles LC et al. Corrected arm muscle area: an independent predictor of long-term mortality in community-dwelling older adults? J Am Geriatr Soc 2002; 50(7): 1272–1277. doi: 10.1046/j.1532-5415.2002.50316.x.
19. Hida T, Ando K, Kobayashi K et al. Ultrasound measurement of thigh muscle thickness for assessment of sarcopenia. Nagoya J Med Sci 2018; 80(4): 519–527. doi: 10.18999/nagjms.80.4.519.
20. Carey EJ, Lai JC, Wang CW et al. A multicenter study to define sarcopenia in patients with end-stage liver disease. Liver Transpl 2017; 23(5): 625–633. doi: 10.1002/lt.24750.
21. Walowski CO, Braun W, Maisch MJ et al. Reference values for skeletal muscle mass – crrent concepts and methodological considerations. Nutrients 2020; 12(3): 755. doi: 10.3390/nu12030755.
22. Durand F, Buyse S, Francoz C et al. Prognostic value of muscle atrophy in cirrhosis using psoas muscle thickness on computed tomography. J Hepatol 2014; 60(6): 1151–1157. doi: 10.1016/j.jhep.2014.02.026.
23. Bahadori B, Uitz E, Tonninger-Bahadori K et al. Body composition: The fat-free mass index (FFMI) and distribution among the adult Austrian population-results of cross-sectional pilot study. Int J Body Compos Res 2006; 4(3): 123–128.
24. Skladaný Ľ, Kassová S, Šváč J. Syndróm krehkosti (frailty) v internej medicíne. Interná Med 2018; 18(6): 283–286.
25. Hoozová J. Krehkosť (frailty): spoločná téma geriatra a paliatológa. Onkológia 2014; 9(6): 349–354.
26. Li H, Manwani B, Leng SX. Frailty, inflammation, and immunity. Aging Dis 2011; 2(6): 466–473.
27. Xue QL. The frailty syndrome: definition and natural history. Clin Geriatr Med 2011; 27(1): 1–15. doi: 10.1016/j.cger.2010.08.009.
28. Chen X, Mao G, Leng SX. Frailty syndrome: an overview. Clin Interv Aging 2014; 19(9): 433– 441. doi: 10.2147/CIA.S45300.
29. Laube R, Wang H, Park L et al. Frailty in advanced liver disease. Liver Int 2018; 38(12): 2117–2128. doi: 10.1111/liv.13917.
30. Katz S, Ford AB, Moskowitz RW et al. Studies of illness in the aged. The index of ADL: a standardized measure of biological and psychosocial function. JAMA 1963; 185: 914–919. doi: 10. 1001/jama.1963.03060120024016.
31. Péus D, Newcomb N, Hofer S. Appraisal of the Karnofsky Performance Status and proposal of a simple algorithmic system for its evaluation. BMC Med Inform Decis Mak 2013; 13: 72. doi: 10.1186/1472-6947-13-72.
32. Fried LP, Tangen CM, Walston J et al. Frailty in older adults: evidence for a phenotype. J Gerontol A Biol Sci Med Sci 2001; 56(3): M146–M156. doi: 10.1093/gerona/56.3.m.146.
33. Lai JC, Feng S, Terrault NA et al. Frailty predicts waitlist mortality in liver transplant candidates. Am J Transplant 2014; 14(8): 1870–1879. doi: 10.1111/ajt.12762.
34. Lai JC, Sonnenday CJ, Tapper EB et al. Frailty in liver transplantation: an expert opinion statement from the American Society of Transplantation Liver and Intestinal Community of Practice. Am J Transplant 2019; 19(7): 1896–1906. doi: 10.1111/ajt.15392.
35. Lai JC, Covinsky KE, Dodge JL et al. Development of a novel frailty index to predict mortality in patients with end-stage liver disease. Hepatology 2017; 66(2): 564–574. doi: 10.1002/hep.29219.
36. Steffl M, Sima J, Shiells K et al. The increase in health care costs associated with muscle weakness in older people without long-term illnesses in the Czech Republic: results from the Survey of Health, Ageing and Retirement in Europe(SHARE). Clin Interv Aging 2017; 12: 2003–2007. doi: 10.2147/CIA.S150826.
37. Cederholm T, Barazzoni R, Austin P et al. ESPEN guidelines on definitions and terminology of clinical nutrition. Clin Nutr 2017; 36(1): 49–64. doi: 10.1016/j.clnu.2016.09.004.
38. Vrbová P, Koller T. Sarkopénia v internej medicíne. Via Practica 2019; 16(2): 58–60.
39. Kim G, Kang SH, Kim MY et al. Prognostic value of sarcopenia in patients with liver cirrhosis: a systematic review and meta-analysis. PloS One 2017; 12(10): e0186990. doi: 10.1371/journal.pone.0186990.
40. Montano-Loza AJ, Meza-Junco J, Prado CM et al. Muscle wasting is associated with mortality in patients with cirrhosis. Clin Gastroenterol Hepatol 2012; 10(2): 166–173. doi: 10.1016/j.cgh.2011.08.028.
41. Kumar V, Benjamin J, Shasthry V et al. Sarcopenia in cirrhosis: fallout on liver transplantation. J Clin Exp Hepatol 2020; 10(5): 467–476. doi: 10.1016/j.jceh.2019.12.003.
42. Golse N, Bucur PO, Ciacio O et al. A new definition of sarcopenia in patients with cirrhosis undergoing liver transplantation. Liver Transpl 2017; 23(2): 143–153. doi: 10.1002/lt.24671.
43. Tay L, Ding YY, Leung BP et al. Sex-specific differences in risk factors for sarcopenia amongst community-dwelling older adults. Age (Dordr) 2015; 37(6): 121. doi: 10.1007/s11357-015-9860-3.
44. Ebadi M, Tandon P, Moctezuma-Velazquez C et al. Low subcutaneous adiposity associates with higher mortality in female patients with cirrhosis. J Hepatol 2018; 69(3): 608–616. doi: 10.1016/j.jhep.2018.04.015.
45. Skladaný Ľ, Koller T, Molčan P et al. Prognostic usefulness of serum myostatin in advanced chronic liver disease: its relation to gender and correlation with inflammatory status. J Physiol Pharmacol 2019; 70(3): 357–368. doi: 10.26402/jpp.2019.3.03.
46. Praktiknjo M, Clees C, Pigliacelli A et al. Sarcopenia is associated with development of acute-on-chronic liver failure in decompensated liver cirrhosis receiving transjugular intrahepatic portosystemic shunt. Clin Transl Gastroenterol 2019; 10(4): e00025. doi: 10.14309/ctg000000000000025.
47. Skladaný Ľ, Kassová S, Šváč J. Syndróm krehkosti (frailty) u mužov hospitalizovaných na internom oddelení. Lekársky Obzor 2019; 68(8): 238–244.
48. Malinis MF, Chen S, Allore HG et al. Outcomes among older adult liver transplantation recipients in the model of end stage liver disease (MELD) era. Ann Transplant 2014; 19: 478–487. doi: 10.12659/AOT.890934.
49. Orman ES, Ghabril M, Chalasani N. Poor performance status is associated with increased mortality in patients with cirrhosis. Clin Gastroenterol Hepatol 2016; 14(8): 1189–1195. doi: 10.1016/j.cgh.2016.03.036.
50. Tandon P, Tangri N, Thomas L et al. A rapid bedside screen to predict unplanned hospitalization and death in outpatients with cirrhosis: a prospective evaluation of the clinical frailty scale. Am J Gastroenterol 2016; 111(12): 1759–1767. doi: 10.1038/ajg.2016.303.
51. Tapper EB, Finkelstein D, Mittleman MA et al. Standard assessments of frailty are validated predictors of mortality in hospitalized patients with cirrhosis. Hepatology 2015; 62(2): 584–590. doi: 10.1002/hep.27830.
52. Samoylova ML, Covinsky KE, Haftek M et al. Disability in patients with end-stage liver disease: results from the functional assessment in liver transplantation study. Liver Transpl 2017; 23(3): 292–298. doi: 10.1002/lt.24684.
53. Sinclair M, Poltavskiy E, Dodge JL et al. Frailty is independently associated with increased hospitalisation days in patients on the liver transplant waitlist. World J Gastroenterol 2017; 23(5): 899–905. doi: 10.3748/wjg.v23.i5.899.
54. Carey EJ, Steidley DE, Aqel BA et al. Six-minute walk distance predicts mortality in liver transplant candidates. Liver Transpl 2010; 16(12): 1373–1378. doi: 10.1002/lt.22167.
55. Yadav A, Chang YH, Carpenter S et al. Relationship between sarcopenia, six-minute walk distance and health-related quality of life in liver transplant candidates. Clin Transplant 2015; 29(2): 134–141. doi: 10.1111/ctr.12493.
56. Faustini Pereira JL, Galant LH, Rossi D et al. Functional capacity, respiratory muscle strength, and oxygen consumption predict mortality in patients with cirrhosis. Can J Gastroenterol Hepatol 2016; 2016: 6940374. doi: 10.1155/2016/6940374.
57. Lai JC, Dodge JL, Sen S et al. Functional decline in patients with cirrhosis awaiting liver transplantation: results from the functional assessment in liver transplantation (FrAILT) study. Hepatology 2016; 63(2): 574–580. doi: 10.1002/hep.28316.
58. Dunn MA, Josbeno DA, Tevar AD et al. Frailty as tested by gait speed is an independent risk factor for cirrhosis complications that require hospitalization. Am J Gastroenterol 2016; 111(12): 1768–1775. doi: 10.1038/ajg.2016.336.
59. Tapper EB, Finkelstein D, Mittleman MA et al. Standard assessments of frailty are validated predictors of mortality in hospitalized patients with cirrhosis. Hepatology 2015; 62(2): 584–590. doi: 10.1002/hep.27830.
60. Bhanji RA, Carey EJ, Yang L et al. The long winding road to transplant: how sarcopenia and debilityimpact morbidity and mortality on the waitlist. Clin Gastroenterol Hepatol 2017; 15(10): 1492–1497. doi: 10.1016/j.cgh.2017.04.004.
61. Lai JC, Covinsky KE, McCulloch CE et al. The liver frailty index improves mortality prediction of the subjective clinician assessment in patients with cirrhosis. Am J Gastroenterol 2018; 113(2): 235–242. doi: 10.1038/ajg.2017.443.
62. Lai JC, Dodge JL, Kappus MR et al. A multicenter pilot randomized clinical trial of a home -based exercise program for patients with cirrhosis: the strength training intervention (STRIVE). Am J Gastroenterol 2020. Publish ahead of print. doi: 10.14309/ajg.0000000000001113.
63. Lai JC, Dodge JL, Kappus MR et al. Changes in frailty are associated with waitlist mortality in patients with cirrhosis. J Hepatol 2020; 73(3): 575–581. doi: 10.1016/j.jhep.2020.03.029.
64. Skladaný Ľ, Drotárová Z, Vnenčáková J et al. Applicability and prognostic value of frailty assessment tools among hospitalized patients with advanced chronic liver disease. Croat Med J 2021; 62(1): 8–16. doi: 10.3325/cmj.2021.62.