Telomery, telomerázový komplex a kolorektální karcinom
Jiří Švec1
+ Pracoviště
SOUHRN
Švec J. Telomery, telomerázový komplex a kolorektální karcinom
Zvyšující se incidence nádorových onemocnění, zejména malignit gastrointestinálního traktu je zaznamenána nejen v České republice, ale i celosvětově. Stále jsou hledány spolehlivé diagnostické postupy umožňující časnou detekci nádorového procesu. Jedním z nich je telomerázový enzymatický komplex, který se uplatňuje v nádorové transformaci a v rozvoji kancerogeneze. Zvýšená exprese telomerázy je prokazatelná až u 90 % maligních nádorů. Uvádíme proto možnosti průkazu komponent telomerázového komplexu jako užitečných diagnostických nádorových markerů. Možnosti současného i perspektivního užití terapeutických prostředků zaměřených na telomerázový komplex jsou uvedeny ve stručném přehledu.
Klíčová slova: kolorektální karcinom - telomery - telomerázový komplex.
SUMMARY
Švec J. Telomeres, telomerase complex and colorectal cancer
An increasing incidence of tumor disease, including GIT malignancies, are well documented not only in the Czech Republic, but also in other countries worldwide. A remarkable effort has been directed toward the development of novel diagnostic approaches leading to early detection of tumorigenesis and cancer formation. Since the discovery that telomerase is strongly expressed in the vast majority of malignancies and contributes to genome instability in the cells, this enzymatic complex emerged as a promising target for early diagnostic and therapeutic purposes. According to many authors cancer treatment based on telomerase inhibition could be relatively specific, effective and safer. In this review I summarize the current knowledge concerning the telomerase complex and colon cancer, focusing on the role of telomerase in early diagnosis and prognosis of this malignant disease.
Key words: colorectal cancer - telomeres - telomerase.
TELOMERY A TELOMERÁZOVÝ KOMPLEX
Prvé poznatky o morfologických a funkčních vlastnostech telomer byly uveřejněny již v roce 1978(1). Následné významné objevy v oblasti molekulární biologie a biochemie (tab. 1) postupně prokázaly zásadní význam telomerázového komplexu v buněčné replikaci, senescenci, v procesu celulární imortalizace a nádorové proliferace, čímž se otevřela možnost k jejich diagnostickému a terapeutickému využití.
Telomery, specializované struktury eukaryotických buněk obratlovců, jsou tvořeny dvojitě vinutou DNA s hexa-merickými sekvencemi 5'-(TTAGGG)n-3', uložené na koncích lineárních chromosomů spolu s asociovanými proteiny. Stabilizují integritu chromosomů, chrání před enzymatickou degradací, před ztrátou genetické informace, senescenci a apoptózou. Telomery jsou zakončeny jednořetězcovým úsekem (3'-overhang), který je nezbytný pro vytvoření strukturálního zakončení telomery pomocí T-kličky (T-loop). V důsledku nekompletní replikace lineární DNA (end-replication problem) dochází při každém buněčném cyklu ke zkracování telomer somatických buněk(10).
Výrazné zkrácení telomer bylo prokázáno u nádorových buněk(11-16). Délku telomer buněk kolorektálního karcinomu a normální střevní sliznice v různých věkových skupinách stanovil Nakamura et al.(14) a jsou uvedeny v tabulce 2.

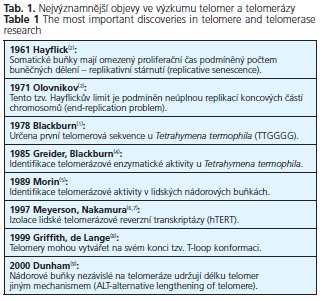
K replikaci koncových částí telomer dochází pomocí enzymu telomerázy. Mechanismus prodlužování 3'-konce je zobrazen na obrázku 1.
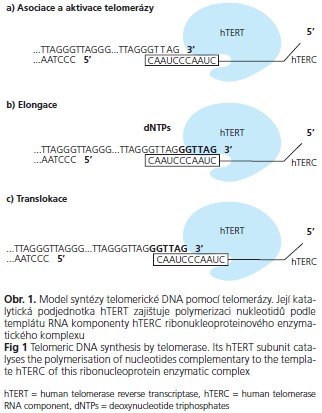
Telomeráza je ribonukleoproteinový enzymatický komplex, který se skládá z telomerázové reverzní transkriptázy (hTERT), vlastní RNA komponenty (hTERC, hTR) a asociovaných proteinů (dyskerin, p23, hsp90, hStau a další). Model sekundární struktury hTR, navržený pomocí fylogenetické kovariační a mutační analýzy, obsahuje tři vysoce konzervované strukturální a funkční oblasti: templát/pseudoknot, CR4-CR5 ascaRNA (small Cajal-body RNAs) doménu, znázorněné na obrázku 2(17-19). Pseudoknot doména s krátkým templátovým úsekem je nezbytná pro tvorbu DNA telomerových sekvencí(20), doména CR4-CR5 s vazebnými místy pro hTERT protein je rozhodující pro zachování enzymatické aktivity(01). Doména scaRNA obsahuje tři konzervované motivy box H, box ACA a CAB box, které udržují nukleolární lokalizaci, strukturální stabilitu RNA, dále se podílejí na akumulaci a maturaci hTERC a na vazbě asociovaných proteinů(18,19).
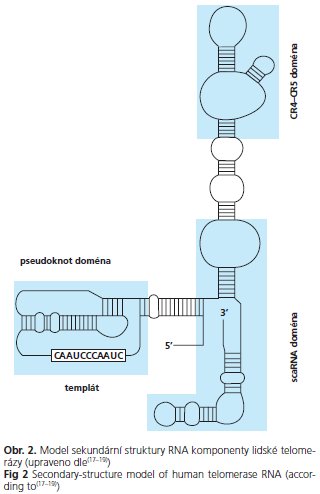
Jak telomerická DNA, tak s telomerou asociované proteiny mají klíčovou roli ve stabilizaci chromosomových konců pomocí utváření čepičkové struktury, která chrání koncové části lineární DNA před exonukleolytickou degradací a možnou fúzí chromosomů. Proteiny TRF1 a TRF2 se vážou na dvouvláknovou telomerovou DNA, zatímco protein POT 1 se váže na jednořetězcové vlákno, stabilizuje D-kličku a brání telomeráze v asociaci s 3'-koncem. Významně se spolupodílejí na regulaci telomerové délky(02). Na TRF1 a TRF2 se vážou další faktory a utvářejí proteinové komplexy, z nichž některé jsou schematicky uvedené na obrázku 3.
Mnohé z těchto proteinů jsou součástí mechanismů reparace poškozené DNA a jejich mutace byly zjištěny u syndromů chromosomové instability, předčasného stárnutí, jsou spojené s výrazně zkrácenými telomerami a vysokou incidencí nádorů. Mutace v NBS 1 (Nijmegen breakage syndrome 1) a MRE 11 (meiotic recombination 11) byly nalezeny u stejnojmenného syndromu. Podobně Wernerův a Bloomův syndrom jsou podmíněny mutacemi v genech WRN a BLM. ERCC1 (excision repair cross-complemen-tingl) je mutován u xeroderma pigmentosum a porucha genu ATM podmiňuje syndrom ataxia telangiectasia(25).
MOŽNOSTI DETEKCE TELOMERÁZOVÉHO KOMPLEXU
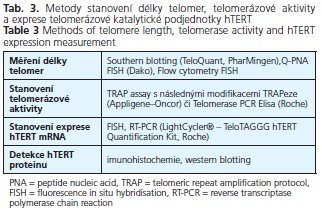
Význam stanovení telomerázové aktivity a podjednotek telomerázového enzymatického komplexu jako tumorového markeru je popisován v časné detekci nádorových buněk u tumorů, kde je telomerázová aktivita reaktivována v časných stadiích tumorogeneze, dále jako prognostický faktor u malignit, u nichž dochází k nárůstu telomerázy během progrese onemocnění, v rozpoznávání prekancerózních lézí a možné detekci nádorových elementů v krvi pacientů(26). V současné době jsou k dispozici velice citlivé detekční metody na stanovení telomerázové aktivity i podjednotek telomerázového komplexu již z několika buněk. Přehled těchto metod je uveden v tabulce 3.
TELOMERÁZA V ETIOLOGII A PATOGENEZI KOLOREKTÁLNÍHO KARCINOMU
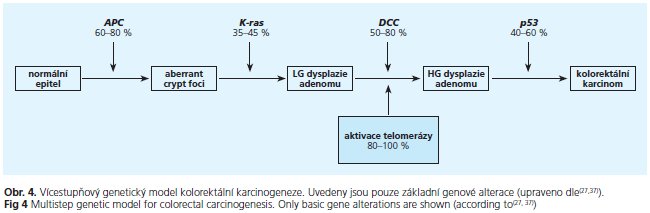
Podle klasického modelu kolorektální karcinogeneze dle Fearona a Vogelsteina(27) dochází během vícestupňové buněčné transformace nejprve k mutaci genu APC s dysfunkční Wnt signalizací následované aktivační mutací onkogenu K-ras, alelickou ztrátou genu DCC na 18q chromosomu a ztrátou části chromosomu 17p obsahující alelu pro gen p53.
Byly stanoveny dva hlavní mutační mechanismy, chromosomová instabilita (CIN) a mikrosatelitní instabilita (MIN), podmíněná mutacemi v mismatch repair genech. Převažující chromosomová instabilita vedoucí k aneuploidii je dávána do souvislosti s mutacemi v regulátorech buněčného cyklu (hCDC4) (28) či v defektech mechanismu dělícího vřeténka(29).
Také dysfunkce telomerové homeostázy je dávána do přímé příčinné souvislosti s chromosomovou instabilitou(30). Tento poznatek vychází ze zjištění, že kritické zkrácení délky telomer a narušení capping funkce 3'-konce, který není schopen nadále vytvářet T-loop konformaci, může vést k fúzím těchto nekrytých částí chromatid se vznikem dicentrických chromosomu. Tyto struktury jsou vysoce nestabilní a v procesu bridge-fusion-breakage cyklech dochází k chromosomálním translokacím, delecím a amplifikacím, tedy ke změnám, které jsou typicky nacházeny v karyotypu většiny solidních karcinomů.
Zvýšená exprese či reaktivace telomerázy byla zjištěna u 80 - 100 % maligních nádorů(31,32) a spolu s ALT mechanismem(9) je předpokladem k imortalizaci a následné maligní transformaci. Význam telomerázy v procesu neoplastické transformace potvrdila práce Hahna et al. (33), kdy k maligní přeměně lidských epiteliálních a mezenchymálních buněk byla dostačující ektopická exprese proteinu hTERT v kombinaci se dvěma onkogeny (onkoproteinem SV40T a onkogenní H-ras alelou).
Nově se předpokládá, že regulace hTERT a telomerázy je dynamický proces nejen v nádorových buňkách, zárodečných buňkách, aktivovaných lymfocytech, bazálních keratinocytech, kryptálních buňkách střevní sliznice, ale i normálních somatických buňkách během S-fáze(34). Stabilní délka telomer úzce souvisí s konstitutivní expresí hTERT pozorovanou v maligních buňkách, naopak cyklická exprese telomerázy v somatických buňkách stabilizaci délky telomer není schopna zajistit.
Rozdíl mezi normální a maligní buňkou s ohledem na telomerázu není tedy v tom, zda-li ji exprimuje, či ne, ale spíše v kvantitě a v časovém průběhu její exprese. Navíc se ukazuje, že hTERT může přispívat k tumorogenezi také na délce telomer-nezávislým mechanismem(35). Konstitutivní exprese hTERT vykazuje antiapoptotické působení, a to nezávisle na její aktivitě(36).
Otázkou, ve kterém stadiu vícestupňové kolorektální tumorogeneze dochází k aktivaci telomerázy, se zabývala práce Yan et al. (37). Autoři analyzovali 25 vzorků kolorektálního karcinomu, 30 adenomových vzorků a 15 vzorků normální sliznice. Telomerázová aktivita měřená metodou TRAP (telomeric repeat amplification protocol) byla zjištěna ve 100 % karcinomů, 47 % adenomů a v žádném vzorku normální sliznice. Všechny adenomy s high-grade dysplazií vykazovaly telomerázovou aktivitu ve srovnání s 20 % v případě adenomů s low-grade dysplazií. Navíc stupeň dysplazie výrazně koreloval s aktivací telomerázy (p < 0,0001). Také Niiyama et al. (38) na velkém souboru 140 vzorků kolorektálního karcinomu, 140 normální okolní tkáně a 20 adenomů potvrdili signifikantní nárůst telomerázové aktivity i exprese hTERT během vícestupňové kolorektální karcinogeneze. Telomerázová aktivita byla naměřena ve 2,1 % normální tkáně, 30 % adenomů a 81,4 % karcinomů (p < 0,0001). Kvantitativní exprese hTERT mRNA byla stanovena pomocí kompetitivní polymerázové řetězcové reakce (RT-PCR) oproti (3-aktinu. Medián exprese hTERT mRNA byl u zdravé tkáně 3400, u adenomů 7500 a u karcinomu 31 000 kopií mRNA/ugRNA (p < 0,0001), přičemž relativní exprese hTERT mRNA u adenomů i karcinomů signifikantně korelovala s relativní telomerázovou aktivitou (p = 0,03). Klasické schéma genetických změn během vývoje sporadického kolorektálního karcinomu doplněné o aktivaci telomerázy je uvedeno na obrázku 4.
TELOMERÁZA A SPORADICKÝ KOLOREKTÁLNI KARCINOM
Úlohou telomerázy v patogenezi kolorektálního karcinomu se zabývá velké množství publikovaných prací (13,39-52), které většinou potvrzují její klíčovou roli v buněčné imortalizaci v průběhu iniciace a progrese maligního onemocnění. Studie Engelhartové et al.(13)zahrnovala 130 tkáňových resekátů (50 vzorků kolorektálního karcinomu, 50 vzorků okolní nepostižené střevní sliznice, 20 adenomových polypů a 10 vzorků kolitidy - ulcerózní kolitida - UC, divertikulitida). Telomerázová aktivita byla zjištěna u 90 % karcinomů, 60 % adenomů, 40 % kolitických vzorků a v žádném vzorku normální sliznice. Aktivita v nádorových buňkách byla 25krát vyšší v porovnání s adenomy a 54krát vyšší oproti kolitidě (p < 0,0001). Byla též prokázána signifikantní pozitivní korelace mezi stupněm nádorové infiltrace a telomerázové aktivity (p < 0,0001).
Vztahem telomerázové aktivity a pooperační prognózou se zabývala studie Tatsumoto et al. (53). Stanovila telomerázovou aktivitu v párových vzorcích u 100 pacientů a sledovala tyto nemocné déle než 3 roky po operačním výkonu. Telomerázová aktivita byla pozitivní u 96 karcinomů s průměrnou relativní telomerázovou aktivitou 55,2 oproti 1,1 u normální střevní tkáně (p < 0,001). U pacientů s vysokou telomerázovou aktivitou (RTA > 50) bylo 5leté přežití 43 % ve srovnání s 81 % zbývajících pacientů a prognóza těchto pacientů byla signifikantně horší (p < 0,01). Také recidiva u pacientů s RTA > 50 byla signifikantě častější (p < 0,016) než u ostatních nemocných. Protože telomerázová aktivita signifikantně nekorelovala se stadiem choroby ani s Dukesovou klasifikací v této studii, autoři považují telomerázovou aktivitu za nezávislý prognostický faktor, který by v časných stadiích choroby mohl přesněji odhadnout riziko rekurence, a tím zlepšit prognózu u pacientů s kolorektálním karcinomem.
Výsledky studií zkoumající roli katalytické podjednotky hTERT nejsou jednotné. Analýzy pomocí hybridizace in situ prokázaly přítomnost nízké hladiny exprese hTERT mRNA v buňkách proliferativní zóny krypt, naopak zvýšenou expresi v dysplastickém epitelu adenomů a všechny karcinomy vykazovaly střední až vysokou expresi v 70 - 80 % nádorových buněk. Exprese hTERT mRNA byla přítomna již v časných stadiích vývoje kolorektálního karcinomu a jak frakce buněk, tak hladina exprese plynule narůstaly během vývoje v invazivní karcinom(54). Existují ale i sporadické práce, které naopak naměřily vyšší expresi hTERT mRNA v okolní zdravé tkáni (v 78,9 % párových vzorků), a pouze ve 21,1 % byla vyšší exprese ve tkáni kolorektálního karci-nomu(55). Tento neočekávaný výsledek může být vysvětlen možností detekce i těch izoforem mRNA, které nezpro-středkovávají telomerázovou aktivitu(56), či dalšími post-transkripčními a posttranslačními mechanismy komplexní regulace telomerázové aktivity(57,58), která v této práci nebyla bohužel měřena. V neposlední řadě je nutno si uvědomit, že během izolace RNA byly zpracovávány celé kryostatové řezy vzorků. Jak naznačuje práce amerických autorů z Bostonu(59), kteří ve vzorcích karcinomu prostaty získali a analyzovali čisté nádorové a normální prostatické epiteliální buňky pomocí laserové mikrodisekce a naměřili expresi hTERT v 94,4 % nádorových buněk a v 0 % normálních prostatických epiteliálních buněk, stanovení genové exprese ve směsné buněčné populaci může vést k nepřesné interpretaci výsledků.
Recentní multicentrická studie(60) posuzovala prognostickou roli hTERT u 201 pacientů po resekci jaterních metastáz kolorektálního karcinomu pomocí imunohistochemické detekce primární monoklonální protilátkou. Multivariační analýza identifikovala 3 faktory, které nezávisle určovaly délku přežití: počet jaterních metastáz, disease-free interval a nukleolární pozitivitu hTERT. Pacienti s hTERT pozitivními jaterními metastázami měli medián přežití 23 měsíců v porovnání se 46 měsíci u pacientů s hTERT-negativními metastázami (p < 0,0001). Tyto výsledky podporují význam testování hTERT v metastázách kolorektálního karcinomu, což poskytuje další důležité prognostické informace.
V komplexní práci českých autorů Maláska et al.(61) byla stanovena telomerázová aktivita a exprese hTERT ve 41 párových vzorcích kolorektálního karcinomu a přilehlé makroskopicky nepostižené tkáně. Telomerázová aktivita byla přítomna u 83 % karcinomů a dosahovala průměrné hodnoty 47,6 TU. (telomerase units), zatímco 61 % normální střevní tkáně bylo negativní a 39 % slabě pozitivní 1,5 TU. Navíc u pacientů s postižením lymfatických uzlin (pTl, pT2) byla telomerázová aktivita výrazně vyšší s průměrnou hodnotou 60,2 TU (p < 0,05). Exprese hTERT detekovaná pomocí semikvantitativní PCR byla zjištěna ve všech vzorcích kolorektálního karcinomu s pozitivní aktivitou a také v 19 vzorcích okolního makroskopicky normální střeva, které vykazovaly slabou telomerázovou aktivitu. Autoři dále upozorňují na důležitost podrobné znalosti splicingových variant hTERT mRNA a nezbytnost velmi přesného výběru analyzovaného buněčného materiálu pro genovou expresi této telomerázové podjednotky zajiš»ující enzymatickou aktivitu.
TELOMERÁZA A KOLOREKTÁLNI KARCINOM ASOCIOVANÝ S NESPECIFICKÝMI STŘEVNÍMI ZÁNĚTY
V poslední době je velmi diskutována etiologie a patogeneze kolorektálního karcinomu asociovaného s nespecifickými střevními záněty. Zvýšené riziko vzniku dysplazie a karcinomu je úzce vázáno na intenzitu, rozsah a trvání chronického slizničního zánětu(62). Kolorektální karcinom asociovaný s kolitidou (CAC) vykazuje analogické genetické alterace jako sporadický karcinom, ale časová posloupnost je odlišná(63). Zejména k mutacím či delecím p53 dochází v časných stadiích dysplastických změn(64). Jsou neustále hledány takové molekulární markery, které by pomohly identifikovat pacienty s vysokým rizikem neoplastické transformace(65). Mezi nejvýznamnější z nich patří alterace genu p53, DNA aneuploidita a nověji i stanovení délky telomer.
Tu stanovili Kinouchi et al. (66) v biopsiích u 17 pacientů s UC, kteří vykazovali signifikantní zkrácení oproti kontrolní skupině bez zánětu. U dvou pacientů se zjištěnou low-grade dysplazií bylo zkrácení ještě výraznější. Významná práce O'Sullivanove et al. (67) potvrdila užitím kvantitativní fluorescenční hybridizace in situ (Q-FISH) s peptide nucleic acid (PNA) telomerickou próbou a detekcí pomocí konfokální mikroskopie signifikantní zkrácení průměrné telomerické délky u 15 pacientů se zjištěnou dysplazií či karcinomem u UC. V tomto souboru byla v okolním dysplazií nepostiženém epitelu průměrná délka telomer zkrácena o 47 % v porovnání s kontrolní skupinou (p < 0,001).
Dále byla zjištěna zvýšená chromosomální instabilita v biopsiích těchto pacientů a prokázané telomerické zkrácení signifikantně korelovalo se ztrátami jak chromosomových ramének (p < 0,001), tak i centromer (p < 0,001). Typické pro telomerickou dysfunkci jsou anafázické chromatinové můstky(68), jejichž frekvence byla v epitelu pacientů s již zjištěnou dysplazií či karcinomem o 67 % vyšší než v kontrolní skupině (p < 0,0002). Autoři předpokládají, že chronický zánět a oxidativní poškození u UC urychluje zkracování telomer(69), což podmiňuje vznik chromosomální instability a následných chromosomálních aberací. Vysoký výskyt anafázických můstků v non-dysplastickém epitelu u pacientů s již zjištěnou dysplazií či karcinomem u UC potvrzuje, že telomerická dysfunkce se objevuje již v časných stadiích neoplastické transformace.
Studií, zabývajících se telomerázovou aktivitou a expresí katalytické podjednotky hTERT u UC a kolorektálního karcinomu asociovaného s kolitidou, je překvapivě málo.
Kleideiter et al. (70) stanovili telomerázovou aktivitu u 18 pacientů s UC (62 biopsií), 10 pacientů s Crohnovou chorobou (35biopsií) a 14 kontrolních (17 biopsií). Pouze u jediného pacienta s UC byla zachycena low-grade dysplazie. Zjištěná telomerázová aktivita se významně nelišila u pacientů s IBD ani v závislosti na délce trvání choroby či stupni zánětu a dosahovala obdobných nízkých hodnot jako v kontrolním souboru. Usselmann et al. (71) naměřili v biopsiích na souboru 25 nemocných s UC dokonce signifikantně nižší telomerázovou aktivitu než v kontrolní zdravé skupině a telomerázová aktivita korelovala negativně se stupněm zánětlivého postižení (p < 0,001). Dysplazie ale v žádné z biopsií zachycena nebyla.
Naopak Holzmann et al. (72) testovali telomerázovou aktivitu pomocí systému Telomerase PCR Elisa na 128 biopsiích, odebraných z proktokolektomických resekátů 3 pacientů s pankolitidou a trváním choroby déle než 20 let, operovaných pro zjištěný karcinom či dysplazií. Čtvrtý pacient zahrnutý do studie byl operován pro farmakorezistentní průběh onemocnění bez zjištěných dysplastických změn. Zvýšená telomerázová aktivita byla detekována v místech s prokázanou dysplazií/karcinomem (68 % biopsií s naměřenou aktivitou), či v jejím těsném okolí, přičemž ze dvou zachycených biopsií karcinomu asociovaným s kolitidou vykazoval telomerázovou aktivitu pouze jeden. U čtvrtého pacienta bez zachycených dysplastických změn nebyla v odebraných biopsiích telomerázová aktivita prokázána.
Recentní studie korejských pracovníků(73) testovala užitečnost telomerázové aktivity a exprese hTERT v diagnostice kolorektálního karcinomu u UC. Telomerázová aktivita byla zjištěna v 97 % biopsií kolorektálního karcinomu, 67 % biopsií UC a 27 % normálních kontrol. Exprese hTERT mRNA byla naměřena u 94 % biopsií kolorektálního karcinomu, 57 % biopsií UC a 45 % kontrol. Při analýze luminálních výplachů byla prokázána telomerázová aktivita pouze u 62 % pacientů s kolorektálním karcinomem, ale u žádného s UC či kontrol. Vysoké procento pozitivity u vzorků UC na rozdíl od výsledků části předchozích studií autoři vysvětlují tím, že studovaný soubor tvořili pacienti s vysoce aktivní kolitidou a naměřená telomerázová aktivita v celé biopsii je podmíněna masivní infiltrací aktivovanými lymfocyty. Dále zdůrazňují nutnost ověřit tyto slibné výsledky na souboru pacientů s UC a asociovanými neoplaziemi.
Schopnost sestavit dostatečně reprezentativní soubor pacientů s neoplaziemi asociovanými s kolitidou je podmíněna efektivní detekcí těchto slizničních změn. Efektivitu metody necílené kvadrantové biopsie ve srovnání s chromoendoskopií přesvědčivě demonstruje Rutter et al. (74), kdy u 100 endoskopicky vyšetřených pacientů s dlouhotrvající extenzivní UC bylo odebráno 2904 necílených kvadrantových biopsii bez nálezu jediné dysplazie. Následně bylo vyšetření zopakováno pomocí panchromoendoskopie s již cílenými 157 bioptickými odběry, v nichž bylo prokázáno 9 dysplastických změn.
TELOMERÁZA A PROTINÁDOROVÁ TERAPIE
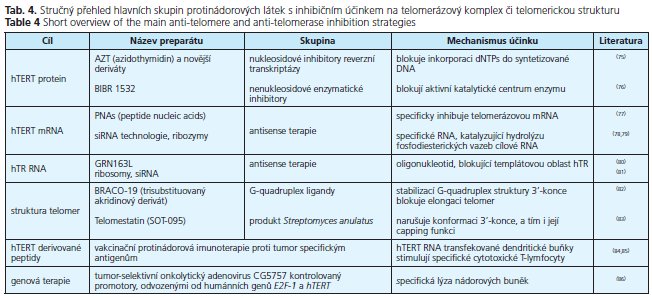
Nové poznatky, které prokázaly rozhodující úlohu telomerické dysfunkce a telomerázy v buněčné imortalizaci a nádorové proliferaci prakticky všech maligních nádorů včetně kolorektálního karcinomu, umožnily syntézu inhibitorů, z nichž mnohé jsou již v časných fázích klinického testování. Tabulka 4 uvádí stručný přehled hlavních skupin protinádorových látek s inhibičním účinkem na telomerázový komplex či telomerickou strukturu.
Antagonisté telomer a telomerázového komplexu představují novou generaci antitumorózních léčiv, které při svém rychlém rozvoji mohou významně přispět k účinné a specifické terapii kolorektálního karcinomu a dalších malignit.
ZÁVĚR
Udržení funkčních telomer na chromosomálních koncích je klíčové pro všechny proliferující buňky. Vedle progresivního telomerického zkracování jako následku nekompletní replikace DNA může být telomerická dysfunkce způsobena též změnou funkčního stavu 3'-konce se ztrátou capping funkce vedoucí k fúzím chromosomů a chromosomální instabilitě, která aktivuje "DNA damage checkpoints", což vede k rychlé zástavě buněčného cyklu a apoptóze, nebo při vyřazení těchto tumor supresorických genů urychluje maligní transformaci.
Klíčovou vlastností maligních nádorů je jejich nesmrtelnost a neomezený replikační potenciál, který v naprosté většině nádorových buněk zajiš»uje konstitutivní reaktivace telomerázy a následná stabilizace délky telomer. Tato skutečnost činí z telomerázy téměř univerzální tumorový marker a nadějný terapeutický cíl.
Podpořeno grantem IGA 1A/8651-4.
Literatura
- 1. Blackburn EH, Gall JG. A tandemly repeated sequence at the termini of the extrachromosomal ribosomal RNA genes in Tetrahymena. J Mol Biol 1978; 120: 33-53.
- 2. HayflickL, Moorhead PS. The serial cultivation of human diploid cell strains. Exp Cell Res 1961; 25: 585-621.
- 3. Olovnikov AM. Principles of marginotomy in template synthesis of polynucleotides. Doklady Akad Nauk SSSR 1971; 201: 1496-1499.
- 4. Greider CW, Blackburn EH. Identification of a specific telomere terminal transferase activity in Tetrahymena extracts. Cell 1985; 43: 405-413.
- 5. Morin GB. The human telomere terminal transferase is a ribonucleo-protein that synthesizes TTAGGG repeats. Cell 1989; 59: 521-529.
- 6. Meyerson M., Counter CM, Eaton EN, et al. hEST2, the putative human telomerase catalytic subunit gene, is up-regulated in tumor cells and during immortalization. Cell 1997; 90: 785-795.
- 7. Nakamura TM, Morin GB, Chapman KB, et al. Telomerase catalytic subunit homologs from fission yeast and human. Science 1997; 277: 955-959.
- 8. Griffith JD, Comeau L, Rosenfield S, et al. Mammalian telomeres end in a large duplex loop. Cell 1999; 97: 503-514.
- 9. Dunham MA, Neumann AA, Fasching CL, Reddel RR. Telomere maintenance by recombination in human cells. Nat Genet 2000; 26: 447-450.
- 10. Harley CB, Futcher AB, Greider CW. Telomeres shorten during ageing of human fibroblasts. Nature 1990; 345:458-460.
- 11. Hastie ND, Dempster M, Dunlop MG, et al. Telomere reduction in human colorectal carcinoma and with ageing. Nature 1990; 346: 866-868.
- 12. Takagi S, Kinouchi Y, Hiwatashi N, et al. Telomere shortening and the clinicopathologic characteristics of human colorectal carcinomas. Cancer 1999; 86: 1431-1436.
- 13. Engelhardt M, Drullinsky P, Guillem J, Moore MA. Telomerase and telomere length in the development and progression of premalignant lesions to colorectal cancer. Clin Cancer Res 1997; 3: 1931-1941.
- 14. Nakamura K, Furugori E, Esaki Y, et al. Correlation of telomere lengths in normal and cancers tissue in the large bowel. Cancer Lett 2000; 158: 179-184.
- 15. Meeker AK, Hicks JL, Iacobuzio-Donahue CA, et al. Telomere length abnormalities occur early in the initiation of epithelial carcinogene-sis. Clin Cancer Res 2004; 10: 3317-3326.
- 16. Plentz RR, Wiemann SU, Flemming P, et al. Telomere shortening of epithelial cells characterises the adenoma-carcinoma transition of human colorectal cancer. Gut 2003; 52: 1304-1307.
- 17. Chen JL, Blasco MA, Greider CW. Secondary structure of vertebrate telomerase RNA. Cell 2000; 100: 503-514.
- 18. Chen JL, Greider CW. Telomerase RNA structure and function: implications for dyskeratosis congenita. Trends Biochem Sci 2004; 29: 183-192.
- 19. Theimer CA, Feigon J. Structure and function of telomerase RNA. Curr Opin Struct Biol 2006; 16: 307-318.
- 20. Chen JL, Greider CW. Functional analysis of the pseudoknot structure in human telomerase RNA. Proc Natl Acad Sci USA 2005; 102: 8080-8085.
- 21. Chen JL, Opperman KK, Greider CW. A critical stem-loop structure in the CR4-CR5 domain of mammalian telomerase RNA. Nucleic Acids Res 2002; 30: 592-597.
- 22. Smogorzewska A, de Lange T. Regulation of telomerase by telomeric proteins. Annu Rev Biochem 2004; 73: 177-208.
- 23. de Lange T. T-loops and the origin of telomeres. Nat Rev Mol Cell Biol 2004; 5: 323-329.
- 24. Blasco MA. Telomeres and human disease: ageing, cancer and beyond. Nat Rev Genet 2005; 6: 611-622.
- 25. Callen E, Surralles J. Telomere dysfunction in genome instability syndromes. Mutat Res 2004; 567: 85-104.
- 26. Hiyama E, Hiyama K. Telomerase as tumor marker. Cancer Lett 2003; 194: 221-233.
- 27. Fearon ER, Vogelstein B. A genetic model for colorectal tumorigene-sis. Cell 1990; 61: 759-767.
- 28. Rajagopalan H, Jallepalli PV, Rago C, et al. Inactivation of hCDC4 can cause chromosomal instability. Nature 2004; 428: 77-81.
- 29. Green RA, Kaplan KB. Chromosome instability in colorectal tumor cells is associated with defects in microtubule plus-end attachments caused by a dominant mutation in APC. J Cell Biol 2003; 163: 949-961.
- 30. Bailey SM, Murnane JP. Telomeres, chromosome instability and cancer. Nucleic Acids Res 2006; 34: 2408-2417.
- 31. Kim NW, PiatyszekMA, Prowse KR, et al. Specific association of human telomerase activity with immortal cells and cancer. Science 1994; 266:2011-2015.
- 32. Shay JW, Bacchetti S. A survey of telomerase activity in human cancer. Eur J Cancer 1997; 33: 787-791.
- 33. Hahn WC, Counter CM, Lundberg AS, et al. Creation of human tumour cells with defined genetic elements. Nature 1999; 400:464-468.
- 34. Masutomi K, Yu EY, Khurts S, et al. Telomerase maintains telomere structure in normal human cells. Cell 2003; 114: 241-253.
- 35. Stewart SA, Hahn WC, O'Connor BF, et al. Telomerase contributes to tumorigenesis by a telomere length-independent mechanism. Proc Natl Acad Sci USA 2002; 99: 12606-12611.
- 36. Rahman R, Latonen L, Wiman KG. hTERT antagonizes p53-induced apoptosis independently of telomerase activity. Oncogene 2005; 24: 1320-1327.
- 37. Yan P, Saraga EP, Bouzourene H, et al. Telomerase activation in colorectal carcinogenesis. J Pathol 1999; 189: 207-212.
- 38. Niiyama H, Mizumoto K, Sato N, et al. Quantitative analysis of hTERT mRNA expression in colorectal cancer. Am J Gastroenterol 2001; 96: 1895-1900.
- 39. Yan P, Saraga EP, Bouzourene H, et al. Expression of telomerase genes correlates with telomerase activity in human colorectal carcinogenesis. J Pathol 2001; 193: 21-26.
- 40. Okayasu I, Mitomi H, Yamashita K, et al. Telomerase activity significantly correlates with cell differentiation, proliferation and lymph node metastasis in colorectal carcinomas. J Cancer Res Clin Oncol 1998; 124:444-449.
- 41. Tahara H, Kuniyasu H, Yokozaki H, et al. Telomerase activity in pre-neoplastic and neoplastic gastric and colorectal lesions. Clin Cancer Res 1995; 1: 1245-1251.
- 42. Liu JL, Ge LY, Zhang GN. Telomerase activity and human telomerase reverse transcriptase expression in colorectal carcinoma. World J Gastroenterol 2006; 12:465-467.
- 43. Boldrini L, Faviana P, Gisfredi S, et al. Evaluation of telomerase in the development and progression of colon cancer. Int J Mol Med 2002; 105: 589-592.
- 44. Shoji Y, Yoshinaga K, Inoue A, et al. Quantification of telomerase activity in sporadic colorectal carcinoma: association with tumor growth and venous invasion. Cancer 2000; 88: 1304-1309.
- 45. Naito Y, Takagi T, Handa O, et al. Telomerase activity and expression of telomerase RNA component and catalytic subunits in precancerous and cancerous colorectal lesions. Tumour Biol 2001; 22: 374-382.
- 46. Abe N, Watanabe T, Nakashima M, et al. Quantitative analysis of telomerase activity: a potential diagnostic tool for colorectal carcinoma. Hepatogastroenterology 2001; 48: 692-695.
- 47. Tang R, Cheng AJ, Wang JY, Wang TC. Close correlation between telomerase expression and adenomatous polyp progression in mul-tistep colorectal carcinogenesis. Cancer Res 1998; 58:4052-4054.
- 48. Yoshida K, Sugino T, Goodison S, et al. Detection of telomerase activity in exfoliated cancer cells in colonic luminal washings and its related clinical implications. Br J Cancer 1997; 75: 548-553.
- 49. Yoshida R, Kiyozuka Y, Ichiyoshi H, et al. Change in telomerase activity during human colorectal carcinogenesis. Anticancer Res 1999; 19: 2167-2172.
- 50. Chadeneau C, Hay K, Hirte HW, et al. Telomerase activity associated with acquisition of malignancy in human colorectal cancer. Cancer Res 1995; 55: 2533-2536.
- 51. Yan P, Saraga EP, Bouzourene H, et al. Expression of telomerase genes correlates with telomerase activity in human colorectal carcinogenesis. J Pathol 2001; 193: 21-26.
- 52. Gertler R, Rosenberg R, Strieker D, et al. Telomere length and human telomerase reverse transcriptase expression as markers for progression and prognosis of colorectal carcinoma. J Clin Oncol 2004; 22: 1807-1814.
- 53. Tatsumoto N, Hiyama E, Murakami Y, et al. High telomerase activity is an independent prognostic indicator of poor outcome in colorectal cancer. Clin Cancer Res 2000; 6: 2696-2701.
- 54. Kolquist KA, Ellisen LW, Counter CM, et al. Expression of TERT in early premalignant lesions and a subset of cells in normal tissues. Nat Genet 1998; 19: 82-86.
- 55. Gertler R, Rosenberg R, Strieker D, et al. Prognostic potential of the telomerase subunit human telomerase reverse transcriptase in tumor tissue and nontumorous mucosa from patients with colorectal carcinoma. Cancer 2002; 95: 2103-2111.
- 56. Saeboe-Larssen S, Fossberg E, Gaudernack G. Characterization of novel alternative splicing sites in human telomerase reverse transcriptase hTERT: analysis of expression and mutual correlation in mRNA isoforms from normal and tumour tissues. BMC Mol Biol 2006; 7: 26.
- 57. Ducrest AL, Szutorisz H, Lingner J, Nabholz M. Regulation of the human telomerase reverse transcriptase gene. Oncogene 2002; 21:541-552.
- 58. Cong YS, Wright WE, Shay JW. Human telomerase and its regulation. Microbiol Mol Biol Rev 2002; 66:407-425.
- 59. Liu BC, LaRose I, Weinstein LJ, et al. Expression of telomerase sub-units in normal and neoplastic prostate epithelial cells isolated by laser capture microdissection. Cancer 2001; 92: 1943-1948.
- 60. Domont J, Pawlik TM, Boige V, et al. Catalytic subunit of human telomerase reverse transcriptase is an independent predictor of survival in patients undergoing curative resection of hepatic colorectal meta-stases: a multicenter analysis. J Clin Oncol 2005; 23: 3086-3093.
- 61. Malaska J, Kunicka Z, Borsky M, et al. Telomerase as a diagnostic and predictive marker in colorectal carcinoma. Neoplasma 2004; 51: 90-96.
- 62. Ekbom A, Helmick C, Zack M, Adami HO. Ulcerative colitis and colorectal cancer. A population-based study. N Engl J Med 1990; 323: 1228-1233.
- 63. Rhodes JM, Campbell BJ. Inflammation and colorectal cancer: IBD-associated and sporadic cancer compared. Trends Mol Med. 2002; 8: 10-16.
- 64. Brentnall TA, Crispin DA, Rabinovitch PS, et al. Mutations in the p53 gene: an early marker of neoplastic progression in ulcerative colitis. Gastroenterology 1994; 107: 369-378.
- 65. Fujii S, Fujimori T, Chiba T, Terano A. Efficacy of surveillance and molecular markers for detection of ulcerative colitis-associated colorectal neoplasia. J Gastroenterol 2003; 38: 1117-1125.
- 66. Kinouchi Y, Hiwatashi N, Chida M, et al. Telomere shortening in the colonic mucosa of patients with ulcerative colitis. J Gastroenterol 1998; 33: 343-348.
- 67. O'Sullivan JN, Bronner MP, Brentnall TA, et al. Chromosomal instability in ulcerative colitis is related to telomere shortening. Nat Genet 2002; 32: 280-284.
- 68. Stewenius Y, Gorunova L, Jonson T, et al. Structural and numerical chromosome changes in colon cancer develop through telomere-me-diated anaphase bridges, not through mitotic multipolarity Proc Natl Acad Sci USA 2005; 102: 5541-5546.
- 69. von Zglinicki T. Oxidative stress shortens telomeres. Trends Biochem Sci 2002; 27: 339-344.
- 70. Kleideiter E, Friedrich U, Mohring A, et al. Telomerase activity in chronic inflammatory bowel disease. Dig Dis Sci 2003; 48: 2328-2332.
- 71. Usselmann B, Newbold M, Morris AG, Nwokolo CU. Deficiency of colonic telomerase in ulcerative colitis. Am J Gastroenterol 2001; 96: 1106-1112.
- 72. Holzmann K, Klump B, Weis-Klemm M, et al. Telomerase activity in long-standing ulcerative colitis. Anticancer Res 2000; 20: 3951-3955.
- 73. Myung SJ, Yang SK, Chang HS, et al. Clinical usefulness of telomerase for the detection of colon cancer in ulcerative colitis patients. J Gastroenterol Hepatol 2005; 20: 1578-1583.
- 74. Rutter MD, Saunders BP, Schofield G, et al. Pancolonic indigo carmine dye spraying for the detection of dysplasia in ulcerative colitis. Gut 2004; 53: 256-260.
- 75. Melana SM, Holland JF, Pogo BG. Inhibition of cell growth and telomerase activity of breast cancer cells in vitro by 3'-azido-3'-deoxythy-midine. Clin Cancer Res 1998; 4: 693-696.
- 76. Pascolo E, Wenz C, Lingner J, et al. Mechanism of human telomerase inhibition by BIBR1532, a synthetic, non-nucleosidic drug candidate. J Biol Chem 2002; 277: 15566-15572.
- 77. Folini M, Berg K, Millo E, et al. Photochemical internalization of a peptide nucleic acid targeting the catalytic subunit of human telomerase. Cancer Res 2003; 63: 3490-3494.
- 78. Kosciolek BA, Kalantidis K, Tabler M, Rowley PT. Inhibition of telomerase activity in human cancer cells by RNA interference. Mol Cancer Ther 2003; 2: 209-216.
- 79. Ludwig A, Saretzki G, Holm PS, et al. Ribozyme cleavage of telomerase mRNA sensitizes breast epithelial cells to inhibitors of topoisome-rase. Cancer Res 2001; 61: 3053-3061.
- 80. Asai A, Oshima Y, Yamamoto Y, et al. A novel telomerase template antagonist (GRN163) as apotential anticancer agent. Cancer Res 2003; 63: 3931-3939.
- 81. Li S, Crothers J, Haqq CM, Blackburn EH. Cellular and gene expression responses involved in the rapid growth inhibition of human cancer cells by RNA interference-mediated depletion of telomerase RNA. J Biol Chem 2005; 280: 23709-23717.
- 82. Burger AM, Dai F, Schultes CM, et al. The G-quadruplex-interactive molecule BRACO-19 inhibits tumor growth, consistent with telomere targeting and interference with telomerase function. Cancer Res 2005; 65: 1489-1496.
- 83. Gomez D, Paterski R, Lemarteleur T, et al. Interaction of telomestatin with the telomeric single-strand overhang. J Biol Chem 2004; 279: 41487-41494.
- 84. Su Z, Dannull J, Heiser A, et al. Immunological and clinical responses in metastatic renal cancer patients vaccinated with tumor RNA-trans-fected dendritic cells. Cancer Res 2003; 63: 2127-2133.
- 85. Vonderheide RH, Domchek SM, Schultze JL, et al. Vaccination of cancer patients against telomerase induces functional antitumor CD8+ T lymphocytes. Clin Cancer Res 2004; 10: 828-839.
- 86. Li Y, Idamakanti N, Arroyo T, et al. Dual promoter-controlled oncolytic adenovirus CG5757 has strong tumorselectivity and significant antitumor efficacy in preclinical models. Clin Cancer Res 2005; 11: 8845-8855.
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené