Subskvamózní neoplazie po radiofrekvenční ablaci Barrettova jícnu
Tomáš Tichý1, Ondřej Urban1, Peter Slodička1
+ Pracoviště
Souhrn
Termín subskvamózní neoplazie neboli „buried karcinom“ je označení pro neoplastický proces vznikající v ložiscích intestinální metaplazie, které jsou lokalizovány v lamina propria pod skvamózním epitelem jícnu. Subskvamózní intestinální metaplazie se nachází v oblasti přechodu Barrettova a skvamózního epitelu a dále pod tzv. neoskvamózním epitelem, který vzniká po endoskopické ablační terapii. V databázi MedLine je popsáno méně než 20 případů subskvamózní neoplazie vzniklé po úspěšné radiofrekvenční ablaci Barrettova jícnu. Znalost této problematiky je významná pro adekvátní sledování nemocných a včasný záchyt této potenciálně fatální komplikace.
Klíčová slova
Barrettův jícen, radiofrekvenční ablace, adenokarcinom jícnu, buried karcinom
Úvod
Barrettův jícen (BJ) je prekanceróza, která vzniká jako komplikace refluxní choroby jícnu. Je definována jako náhrada skvamózního epitelu distálního jícnu epitelem s intestinální metaplazií, a to v makroskopicky patrném segmentu o délce minimálně 1 cm. BJ je jediným známým prekurzorem adenokarcinomu jícnu, který se v něm postupně vyvíjí přes stadia lehké a těžké dysplazie [1]. Znalost průběhu kancerogeneze umožňuje sekundární prevenci. Rychlost progrese BJ do adenokarcinomu byla předmětem řady studií. Například Sharma et al prokázali riziko progrese nondysplastického BJ do adenokarcinomu 0,5 % za rok [2]. V České republice Martínek et al pozorovali roční incidenci vysokého stupně dysplazie (HGD) nebo adenokarcinomu 0,21 % [3]. Potvrzená LGD s sebou nese vyšší riziko vzniku pokročilé neoplazie (HGD nebo karcinomu) oproti BJ bez dysplazie, konkrétně 13,4 % za rok [1]. Při hodnocení LGD však hraje významnou roli vysoká interobservační variabilita histologického vyšetření [4]. U značné části pacientů není LGD při následných kontrolách nalezena [2,3,5]. Přítomnost HGD v terénu BJ je zatížena 10–18% rizikem progrese do adenokarcinomu za rok [1]. Zatímco medikamentózní ani chirurgická terapie neprokázaly zásadní dopad na riziko vývoje adenokarcinomu v BJ [6], techniky endoskopické ablace jsou vysoce účinné. Jedná se o metody:
- fotodynamická terapie (PTD);
- radiofrekvenční ablace (RFA);
- hybridní argonová plazmakoagulace (H-APC);
- kryoablace.
V průběhu hojení po endoskopických ablačních metodách může dojít k překrytí ložisek intestinální metaplazie nově vznikajícím dlaždicovým epitelem. V jiných případech byla subskvamózní intestinální metaplazie pozorována na přechodu Barrettova a skvamózního epitelu. Tato ložiska jsou endoskopicky obtížně diagnostikovatelná a jsou potenciálním fokusem vzniku adenokarcinomu.
Indikace k léčbě BJ
U pacientů s BJ bez dysplazie není endoskopická léčba indikována [1]. Nemocní s definitivní diagnózou LGD jsou indikováni k endoskopické léčbě, většinou RFA [7]. K léčbě BJ s HGD lze použít endoskopickou mukózní resekci (EMR), RFA nebo kombinaci obou metod. Platí zásada, že jakákoli viditelná léze má být odstraněna EMR za účelem histopatologického stagingu [1]. Na základě histologického vyšetření resekátu je zhodnoceno riziko lokální rekurence a metastazování do lymfatických uzlin a je rozhodnuto, zda byla endoskopická léčba dostatečná, či je nezbytné chirurgické řešení [8]. U všech pacientů po EMR/ESD (v případě, že není posléze indikováno chirurgické řešení) je indikováno další pokračování léčby (RFA, EMR/ESD nebo kombinace obou) k docílení kompletní eradikace BJ. Při kombinaci EMR + RFA bylo prokázáno velmi nízké procento lokálních recidiv neoplazie [1,9]. Například Krajčiová et al ve své studii o výsledcích léčby BJ v České republice zjistili, že kompletní remise neoplazie bylo dosaženo v 98,5 % a kompletní remise intestinální metaplazie v 77,9 %. K rekurenci intestinální metaplazie došlo u 15 % nemocných a k rekurenci neoplazie u 4,5 % nemocných. U žádného pacienta nebyl diagnostikován výskyt subskvamózní neoplazie [10].
RFA a další metody ablační terapie BJ
Hlavní výhodou endoskopické terapie oproti chirurgické resekci jícnu je minimální invazivita s nulovou letalitou, velmi nízkou mortalitou, a to při současném zachování orgánu [11]. Endoskopické metody léčby se dělí na resekční a ablační. K resekčním technikám řadíme endoskopickou slizniční resekci (EMR) a endoskopickou submukózní disekci (ESD). Jejich hlavní výhodou je, že poskytují resekát k histologickému vyšetření. Naopak endoskopické ablační metody sice odstraňují metaplastickou sliznici, ale neposkytují tkáň k histologickému vyšetření [12].
Po resekci či ablaci je ve tkáni indukován hojivý proces, který při současném zvýšení pH medikamentózní blokádou kyselé žaludeční sekrece vede k náhradě sneseného epitelu neoskvamózním. Tak je přerušen proces kancerogeneze na úrovni prekancerózy.
Mezi řadou ablačních modalit se pozornost v poslední době soustředila především na PDT a RFA. V případě PDT je pacientům podána fotosenzitizující látka (např. porfimer sodný), která je absorbována metaplastickým jícnovým epitelem [13]. Po následném osvitu laserovým světlem dochází k oxidativnímu poškození epitelových buněk. PDT je omezeně účinná a ekonomicky nákladná metoda, která je navíc zatížena nežádoucími účinky [13]. Například Overholt et al ve své randomizované multicentrické studii uvádějí, že u 36 % pacientů léčených pro BJ s HGD se po PDT vyvinuly striktury jícnu a u 15 % se vyvinul adenokarcinom jícnu do 5 let [14]. Problémem je dále fotosenzitivita potenciálně poškozující nechráněnou kůži [15].
Metoda RFA využívá vysokofrekvenční elektromagnetickou energii k rovnoměrné termické destrukci tkání do hloubky 1 000 µm. Postihuje epitel, lamina propria a lamina muscularis mucosae [16]. RFA HALO 360 se provádí endoskopicky kontrolovaným balonkem s obvodovým pólem elektrod na povrchu a slouží k cirkumferenční aplikaci [17]. Při RFA HALO 90 se používá speciální obdélníková plochá elektroda, předem připevněná na endoskop sloužící pro fokální ablaci. První RFA v České republice byla provedena v roce 2009 a v současnosti je běžně dostupná v několika centrech [18].
Klíčovou studii o RFA publikovali Shaheen et al. V jejich studii se 127 pacienty s BJ s dysplazií (LGD a HGD) došlo ke kompletní remisi intestinální metaplazie u 77,4 % v RFA skupině ve srovnání s 2,3 % v kontrolní skupině. Progrese do karcinomu byla pozorována u 1,2 % v RFA skupině ve srovnání s 9,3 % v kontrolní skupině [19]. RFA má relativně nízkou míru komplikací, stenózy vznikají v méně než v 3 % případů a perforace u 0,2 % případů [20,21]. Ačkoli byla RFA nedávno navržena rovněž pro léčbu nedysplastického BJ, není tato indikace všeobecně akceptována [23]. V současnosti nejsou jasně určeny intervaly dispenzárních endoskopických kontrol po RFA. U pacientů s nálezem BJ s LGD, u nichž je následně provedená úspěšná RFA s kompletní eradikací BJ, bylo navrženo provádět endoskopickou dispenzarizaci každý rok první dva roky po ablaci a poté každé 3 roky [23]. Při dispensární endoskopii je doporučeno aplikovat Seattleský bioptický protokol v rozsahu původního BJ.
Dle doporučeného postupu České gastroenterologické společnosti pro endoskopickou léčbu pacientů s BJ a časnými neoplaziemi jícnu není metoda kryoterapie toho času považována za zavedenou metodu. Také APC není indikována jako ablační terapie u pacientů s časnými neoplaziemi jícnu a její použití je v této indikaci non lege artis. Důvodem je nedostatečná radikalita této léčby. Novinku představuje tzv. hybridní APC (podpich sliznice BJ tekutinou a následná ablace APC). V současné době se jedná o metodu, která je v praxi používána jen v rámci klinických studií [1].
Etiopatogeneze subskvamózní neoplazie
Pokud ablační procedura neodstraní celý metaplastický epitel, může dojít k překrytí perzistujícího ložiska metaplastické sliznice novotvořeným skvamózním epitelem. Dojde-li v něm k rozvoji neoplazie, označujeme ji jako buried karcinom [24,25].
Míra rizika neoplazie spojené se subskvamózní metaplazií je nejasná, ale existují hypotézy, proč by toto riziko mohlo být větší nebo menší než u původního povrchového metaplastického epitelu. Například Prasad et al uvádějí, že genetické abnormality získané během karcinogeneze mohou nádorové buňce přinést vlastnosti, díky nimž je odolnější vůči ablační terapii než nenádorové buňky [26]. Naopak jiná hypotéza uvádí, že vrstva neoskvamózního epitelu chrání subskvamózní metaplastické buňky před karcinogenními účinky refluxátu [27]. Tuto hypotézu podporuje také zjištění, že množství abnormalit DNA a míra proliferace krypt v subskvamózní metaplazii je menší než v povrchovém metaplastickém epitelu, jak popisují ve své studii Hornick et al [27].
Jedinou široce dostupnou metodou k in vivo diagnostice subskvamózní neoplazie je endoskopie. Nicméně endoskopický obraz je málo specifický. Například Yang et al popisují typický endoskopický obraz subskvamózní dysplazie při vyšetření v bílém světle jako tmavěji růžová ložiska, která mohu být mírně vyvýšená, někdy nodulárního vzhledu. Při vyšetření v NBI módu jsou tato ložiska tmavěji hnědá. Autoři dále uvádějí, že uvedené změny se histologicky častěji vyskytují v sousedství ostrůvku BJ [28].
V této indikaci je slibnou metodou volumetrická laserová endomikroskopie (VLE). Jedná se o systém optické koherentní tomografie druhé generace schopné scanovat velký povrch stěny jícnu s mikroskopickým rozlišením [29–32].
Subskvamózní neoplazie ve světové literatuře
Literární údaje o subskvamózní neoplazii nejsou početné. Jak často se vyskytuje po endoskopické ablaci, není jasné, stejně jako není známa její četnost mimo případy endoskopické terapie [33]. Gray et al uvádějí, že 31 ze 34 případů subskvamózní neoplazie se vyskytlo po PDT, zatímco 3 se vyskytly po APC nebo laserové ablaci [33]. Autoři dále uvádějí, že ve 22 publikacích popisujících výsledky PDT u 953 pacientů s BJ byla nalezena subskvamózní metaplazie u 135 pacientů (14,2 %) v průběhu sledování, které trvalo od 4 týdnů do více než 5 let [33]. V 18 studiích popisujících výsledky RFA pro 1 004 pacientů byla naopak subskvamózní metaplazie nalezena pouze u 9 pacientů (0,9 %) v průběhu sledování, které trvalo od 8 týdnů do 5 let [33].
Subskvamózní metaplazie byla popsána rovněž u pacientů s BJ, kteří nepodstoupili endoskopickou ablaci [34]. Chennat et al předpokládají, že metaplastické žlázy rostou pod skvamózním epitelem spontánně v oblastech skvamózních spojů, kde metaplastický epitel přiléhá k dlaždicovému epitelu. K tomu dochází na Z-linii, kde byla subskvamózní metaplazie pozorována ve 28 % a dále na ložiscích dlaždicového epitelu na pozadí BJ, kde byla nalezena až ve 38,5 % [35,36].
První výskyt subskvamózní neoplazie pro RFA publikovali Chabrun et al. Pětapadesátiletý muž s anamnézou alkoholické cirhózy byl přijat k léčbě BJ C0M3 s povrchovým adenokarcinomem resekovaným EMR. Následně byla provedena komplementární RFA za účelem eradikace zbývající sliznice BJ s dysplazií vysokého stupně. Endoskopické sledování po dvou sezeních RFA (s 360° a 90° sondou) odhalilo 10mm ostrůvek BJ bez dysplazie. Další endoskopické sledování o 10 měsíců později ukázalo 7mm uzlík v dlaždicovém epitelu jícnu, který byl odstraněn pomocí endoskopické resekce. Histologická analýza odhalila invazivní adenokarcinom vyvíjející se pod dlaždicovým epitelem. Rekurence dříve resekovaného adenokarcinomu byla považována za nepravděpodobnou, protože resekce byla kompletní [37].
Studie Titi et al (2012) uvádí vývoj neoplazie pod dlaždicovým epitelem u tří pacientů, kteří byli léčeni RFA pro BJ (u dvou se vyvinul adenokarcinom a u jednoho se vyvinula dysplazie vysokého stupně). Dva pacienti podstoupili EMR před RFA, ale k výskytu subskvamózní neoplazie došlo mimo původní místo EMR [6].
Castela et al ve své publikaci popisují případ 63letého muže, u něhož úspěšně aplikovali RFA 360 a následně RFA 90 na BJ C4M5 dle Pražské klasifikace. Po 4 letech následné endoskopické dispenzarizace detekovali 6mm ložiskovou lézi nad gastroezofageální junkcí, kterou odstranili EMR. Histologický nález byl subskvamózní intestinální metaplazie s HGD [23]. Další publikované případy uvádí tab. 1.
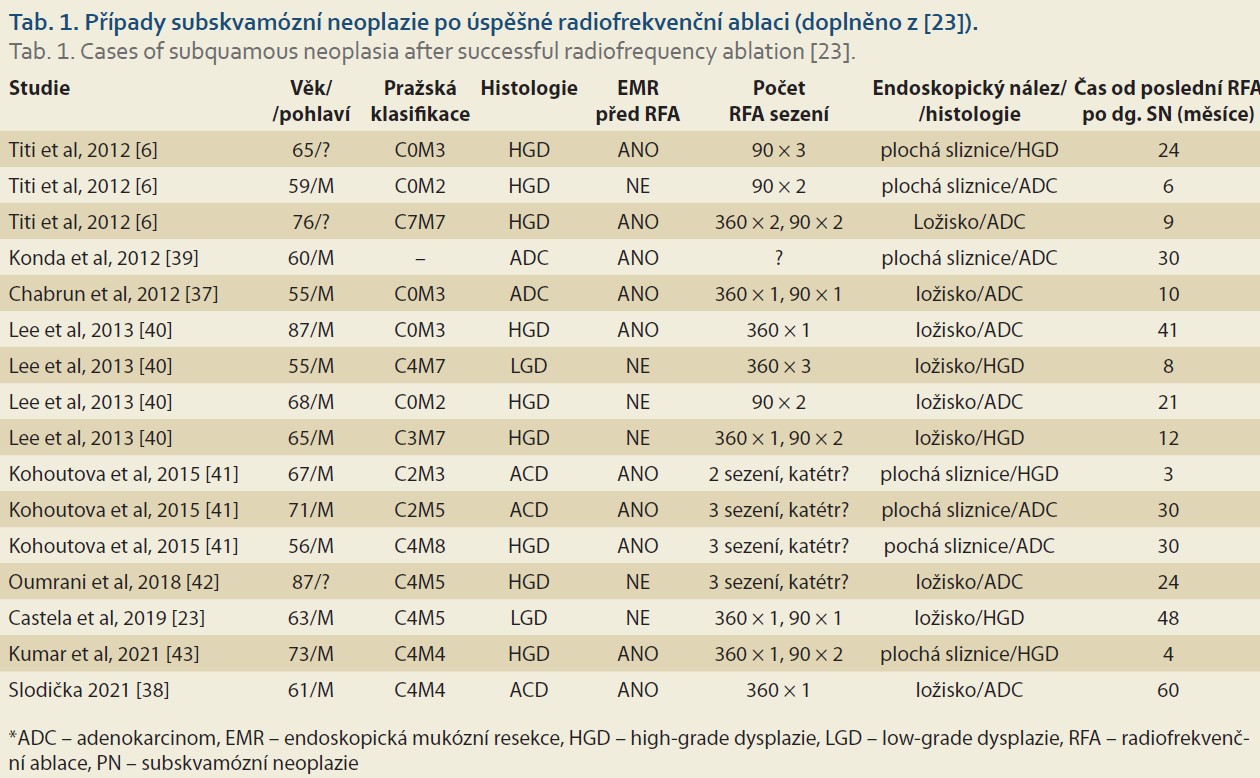
První případ subskvamózního adenokarcinomu v ČR jsme popsali v roce 2021. Jednalo se o nález u 61letého muže, u něhož byl v roce 2016 léčen intramukózní karcinom typu 0–IIa o průměru 8 mm v terénu BJ C4M0 metodami EMR a RFA HALO 360. Pacient byl poté endoskopicky dispenzarizován v jednoročních intervalech. V roce 2021 bylo nalezeno subepiteliální ložisko o průměru 8 mm v segmentu neoskvamózního epitelu jícnu. Histologicky byla z klešťové biopsie popsána sliznice jícnu s rozsáhlou infiltrací středně- až nízcediferencovaným adenokarcinomem. Léze byla odstraněna metodou EMR způsobem „suck and cut“. Endoskopicky se jednalo o úplnou resekci [38]. Vzhledem k histologickému nálezu byla provedena ezofagektomie s náhradou jícnu žaludkem. V resekátu jícnu ani v disekovaných lymfatických uzlinách nebyl zjištěn karcinom.
Závěr
Výskyt subskvamózní neoplazie představuje významnou limitaci léčby BJ RFA. Jakkoli se výskyt této komplikace jeví nízký, její včasný záchyt a následná terapie mohou významně ovlivnit osud nemocného. Výše uvedená zjištění mají zásadní dopad do klinické praxe. Zdůvodňují nutnost pečlivé endoskopické dispenzarizace nemocných po této terapii, včetně biopsií.
ORCID autorů
P. Slodička ORCID 0000-0002-1385-262X,
P. Vaněk ORCID 0000-0001-9573-5277,
T. Tichý ORCID 0000-0003-0755-1107,
O. Urban ORCID 0000-0002-6705-7912.
Doručeno/Submitted: 1. 4. 2022
Přijato/Accepted: 28. 4. 2022
MUDr. Peter Slodička
II. interní klinika – gastroenterologická a geriatrická
LF UP a FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
peter.slodicka@fnol.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Martínek J, Falt P, Gregar J et al. Standardy České gastroenterologické společnosti – endoskopická léčba pacientů s Barrettovým jícnem a časnými neopláziemi jícnu. Gastroent Hepatol 2013; 67(6): 479–487.
2. Sharma P, Falk GW, Weston AP et al. Dysplasia and cancer in a large multicenter cohort of patients with Barrett‘s esophagus. Clin Gastroenterol Hepatol 2006; 4(5): 566–572. doi: 10.1016/j.cgh.2006.03.001.
3. Martinek J, Benes M, Brandtl P et al. Low incidence of adenocarcinoma and high-grade intraepithelial neoplasia in patients with Barrett‘s esophagus: a prospective cohort study. Endoscopy 2008; 40(9): 711–716. doi: 10.1055/s-2008-1077502.
4. Spechler SJ. Dysplasia in Barrett‘s esophagus: limitations of current management strategies. Am J Gastroenterol 2005; 100(4): 927–935. doi: 10.1111/j.1572-0241.2005.41201.x.
5. Falt P, Urban O, Fojtík P et al. Radiofrekvenční ablace v terapii Barrettova jícnu – naše první zkušenosti. Endoskopie 2009; 18(3): 118–123.
6. Titi M, Overhiser A, Ulusarac O et al. Development of subsquamous high-grade dysplasia and adenocarcinoma after successful radiofrequency ablation of Barrett’s esophagus. Gastroenterology 2012; 143(3): 564–566. doi: 10.1053/j.gastro.2012.04.051.
7. Nadine Phoa K, van Vilsteren FGI, Weusten BLAM et al. Radiofrequency ablation vs endoscopic surveillance for patients with Barrett esophagus and low-grade dysplasia: a randomized clinical trial. JAMA 2014; 311(12): 1209–1217. doi: 10.1001/jama.2014.2511.
8. Zavoral M. Mařatkova gastroenterologie: Patofyziologie. Diagnostika. Léčba. Praha: Karolinum 2021: 428–448.
9. Phoa KN, Pouw RE, van Vilsteren FGI et al. Remission of Barrett‘s esophagus with early neoplasia 5 years after radiofrequency ablation with endoscopic resection: a Netherlands cohort study. Gastroenterology 2013; 145(1): 96–104. doi: 10.1053/j.gastro.2013.03.046.
10. Krajciova J, Janicko M, Falt P et al. Radiofreqency ablation in patients with Barrett’s esophagus related neoplasia – long-term outcomes of the Czech national RFA database. J Gastrointest Liver Dis 2019; 28: 149–155. doi: 10.15403/jgld-174.
11. Vrba R. Karcinom jícnu: Průvodce pro chirurgickou a gastroenterologickou praxi. Praha: Maxdorf 2021: 49–72.
12. Spechler SJ, Fitzgerald RC, Prasad GA et al. History, molecular mechanisms, and endoscopic treatment of Barrett‘s esophagus. Gastroenterology 2010; 138(3): 854–869. doi: 10.1053/j.gastro.2010.01.002.
13. Spechler SJ, Souza RF. Biomarkers and photodynamic therapy for Barrett‘s esophagus: time to FISH or cut bait? Gastroenterology 2008; 135(2): 354–357. doi: 10.1053/j.gastro.2008.06.065.
14. Overholt BF, Wang KK, Burdick JS et al. Five-year efficacy and safety of photodynamic therapy with Photofrin in Barrett‘s high-grade dysplasia. Gastrointest Endosc 2007; 66(3): 460–468. doi: 10.1016/j.gie.2006.12.037.
15. Qumseya BJ, David W, Wolfsen HC. Photodynamic therapy for Barrett‘s esophagus and esophageal carcinoma. Clin Endosc 2013; 46(1): 30–37. doi: 10.5946/ce.2013.46.1.30.
16. Kajzrlikova I, Vitek P, Falt P et al. Recurrent oesophageal intramucosal squamous carcinoma treated by endoscopic mucosal resection and subsequent radiofrequency ablation using HALO system. BMJ Case Rep 2010; 2010: bcr0820103211. doi: 10.1136/bcr.08.2010.3211.
17. Spechler SJ, Souza RF. Stem cells in Barrett‘s esophagus: HALOs or horns? Gastrointest Endosc 2008; 68(1): 41–43. doi: 10.1016/j.gie.2008.02.080.
18. Suchánek Š, Martínek J, Zavoral M. První radiofrekvenční ablace Barrettova jícnu s využitím HALO systému v České republice. Endoskopický workshop. Čes a Slov Gastroent a Hepatol 2009; 63(4): 195–196.
19. Shaheen NJ, Overholt BF, Sampliner RE et al. Durability of radiofrequency ablation in Barrett’s esophagus with dysplasia. Gastroenterology 2011; 141(2): 460–468. doi: 10.1053/j.gastro.2011.04.061.
20. Fleischer DE, Overholt BF, Sharma VK et al. Endoscopic radiofrequency ablation for Barrett‘s esophagus: 5-year outcomes from a prospective multicenter trial. Endoscopy 2010; 42(10): 781–789. doi: 10.1055/s-0030-1255779.
21. Lyday WD, Corbett FS, Kuperman DA et al. Radiofrequency ablation of Barrett‘s esophagus: outcomes of 429 patients from a multicenter community practice registry. Endoscopy 2010; 42(4): 272–278. doi: 10.1055/s-0029-1243883.
22. Hernandez JC, Reicher S, Chung D et al. Pilot series of radiofrequency ablation of Barrett’s esophagus with or without neoplasia. Endoscopy 2008; 40(5): 388–392. doi: 10.1055/ s-2007-995747.
23. Castela J, Serrano M, Mão de Ferro S et al. Buried Barrett’s esophagus with high-grade dysplasia after radiofrequency ablation. Clin Endosc 2019; 52(3): 269–272. doi: 10.5946/ce.2018.124.
24. Shand A, Dallal H, Palmer K et al. Adenocarcinoma arising in columnar lined oesophagus following treatment with argon plasma coagulation. Gut 2001; 48(4): 580–581. doi: 10.1136/gut.48.4.580b.
25. Van Laethem JL, Peny MO, Salmon I et al. Intramucosal adenocarcinoma arising under squamous re-epithelialisation of Barrett‘s oesophagus. Gut 2000; 46(4): 574–577. doi: 10.1136/gut. 46.4.574.
26. Prasad GA, Wang KK, Halling KC et al. Utility of biomarkers in prediction of response to ablative therapy in Barrett‘s esophagus. Gastroenterology 2008; 135(2): 370–379. doi: 10.1053/j.gastro.2008.04.036.
27. Hornick JL, Mino-Kenudson M, Lauwers GY et al. Buried Barrett‘s epithelium following photodynamic therapy shows reduced crypt proliferation and absence of DNA content abnormalities. Am J Gastroenterol 2008; 103(1): 38–47. doi: 10.1111/j.1572-0241.2007.01560.x.
28. Yang LS, Holt BA, Williams R et al. Endoscopic features of buried Barrett‘s mucosa. Gastrointest Endosc 2021; 94(1): 14–21. doi: 10.1016/j.gie.2020.12.031.
29. Kaul V. Optical coherence tomography for Barrett esophagus. Gastroenterol Hepatol (N Y) 2018; 14(4): 253–255.
30. Kirtane TS, Wagh MS. Endoscopic optical coherence tomography (OCT): advances in gastrointestinal imaging. Gastroenterol Res Pract 2014; 2014: 376367. doi: 10.1155/2014/376 367.
31. Leggett CL, Gorospe EC, Chan DK et al. Comparative diagnostic performance of volumetric laser endomicroscopy and confocal laser endomicroscopy in the detection of dysplasia associated with Barrett’s esofagus. Gastrointest Endosc 2016; 83(5): 880–888. doi: 10.1016/j.gie.2015.08.050.
32. Swager AF, de Groof AJ, Meijer SL et al. Feasibility of laser marking in Barrett‘s esophagus with volumetric laser endomicroscopy: first-in-man pilot study. Gastrointest Endosc 2017; 86(3): 464–472. doi: 10.1016/j.gie.2017.01.030.
33. Gray NA, Odze RD, Spechler SJ. Buried metaplasia after endoscopic ablation of Barrett‘s esophagus: a systematic review. Am J Gastroenterol 2011; 106(11): 1899–1908. doi: 10.1038/ajg.2011.255.
34. Bronner MP, Overholt BF, Taylor SL et al. Squamous overgrowth is not a safety concern for photodynamic therapy for Barrett‘s esophagus with high-grade dysplasia. Gastroenterology 2009; 136(1): 56–64. doi: 10.1053/j.gastro.2008.10.012.
35. Chennat J, Ross AS, Konda VJ et al. Advanced pathology under squamous epithelium on initial EMR specimens in patients with Barrett‘s esophagus and high-grade dysplasia or intramucosal carcinoma: implications for surveillance and endotherapy management. Gastrointest Endosc 2009; 70(3): 417–421. doi: 10.1016/j.gie.2009.01.047.
36. Sharma P, Morales TG, Bhattacharyya A et al. Squamous islands in Barrett‘s esophagus: what lies underneath? Am J Gastroenterol 1998; 93(3): 332–335. doi: 10.1111/j.1572-0241.1998.00332.x.
37. Chabrun E, Marty M, Zerbib F. Development of esophageal adenocarcinoma on buried glands following radiofrequency ablation for Barrett’s esophagus. Endoscopy 2012; 44(Suppl 2): E392. doi: 10.1055/s-0032-1310245.
38. Slodička P. Kvíz z klinické praxe. Gastroent Hepatol 2021; 75(4): 284–285.
39. Konda VJA, Gonzalez M, Ruiz H et al. Development of subsquamous cancer after hybrid endoscopic therapy for intramucosal Barrett‘s cancer. Endoscopy 2012; 44(Suppl 2): E390–391. doi: 10.1055/s-0032-1310139.
40. Lee JK, Cameron RG, Binmoeller KF et al. Recurrence of subsquamous dysplasia and carcinoma after successful endoscopic and radiofrequency ablation therapy for dysplastic Barrett‘s esophagus. Endoscopy 2013; 45(7): 571–574. doi: 10.1055/s-0032-1326419.
41. Kohoutova D, Haidry R, Banks M et al. Esophageal neoplasia arising from subsquamous buried glands after an apparently successful photodynamic therapy or radiofrequency ablation for Barrett‘s associated neoplasia. Scand J Gastroenterol 2015; 50(11): 1315–1321. doi: 10.3109/00365521.2015.1043578.
42. Oumrani S, Barret M, Beuvon F et al. Buried esophageal adenocarcinoma after radiofrequency ablation. Clin Res Hepatol Gastroenterol 2019; 43(1): 3–4. doi: 10.1016/j.clinre.2018.02.006.
43. Kumar P, Gordon IO, Thota PN. Post-ablation buried neoplasia in Barrett‘s esophagus. Scand J Gastroenterol 2021; 56(5): 624–628. doi: 10.1080/00365521.2021.1896774.