Screening karcinomu pankreatu: nastal čas vykročit?
Peter Slodička1, Tomáš Tichý1, Jana Tesaříková2, Hana Švébišová3, Radim Kovář4, Daniela Kurfürstová5, Mária Janíková6, Veroniko Woitková6, Martin Procházka6, Přemysl Falt Orcid.org 1,7, Vincent Zoundjiekpon Orcid.org 1, Ondřej Urban1
+ Pracoviště
Souhrn
Včasná detekce karcinomu pankreatu je považována za nejúčinnější způsob, jak zvýšit míru přežití u pacientů s tímto onemocněním. Jedinci s familiárním výskytem nebo syndromy genetické náchylnosti mají prokazatelně zvýšené riziko vzniku karcinomu pankreatu. Současná odborná doporučení vycházejí z důkazů o přínosech systematického sledování těchto rizikových jedinců a zdůrazňují potenciál screeningu k ovlivnění tohoto onemocnění. Takový screeningový program nebyl v České republice zatím zaveden, nicméně v některých zemích se tomu tak již děje. Cílem naší přehledové práce je shrnout poznatky o hereditárním a familiárním karcinomu pankreatu a vyzvat ke spolupráci na pilotním screeningovému programu.
Klíčová slova
karcinom pankreatu, hereditární karcinom pankreatu, onkologický screeningVýzkumná skupina HEPACAS: P. Vaněk1, V. Zoundjiekpon1, P. Slodička1, T. Tichý1, P. Falt1, O. Urban1, J. Tesaříková2, P. Skalický2, M. Loveček2, D. Klos2, R. Havlík2, H. Švébišová3, B. Mohelníková-Duchoňová3, B. Melichar3, R. Kovář4, M. Heřman4, D. Kurfürstová5, D. Skanderová5, J. Ehrmann5, M. Janíková6, V. Woitková6, M. Procházka6, R. Vrtěl6
Úvod
Karcinom pankreatu (PC – pancreatic cancer) má mezi zhoubnými onemocněními jednu z nejhorších prognóz a jeho incidence dlouhodobě narůstá. V roce 2018 bylo toto onemocnění sedmým nejčastěji diagnostikovaným zhoubným novotvarem (ZN) v České republice s celkovým počtem 2 332 případů. Při mezinárodním srovnání výskytu stojí ČR na třetím místě v Evropě [1]. Křivka úmrtnosti těsně kopíruje křivku incidence a v roce 2018 byl PC třetí nejčastější příčinou úmrtí v rámci onkologických diagnóz se 2 159 zemřelými (7,8 % všech úmrtí na ZN). Při mezinárodním srovnání úmrtnosti obsazuje ČR v Evropě 2.–3. příčku [1,2].
Současnými prostředky bývá PC diagnostikován často až v pozdním stadiu, jelikož zůstává zpravidla dlouho bezpříznakový nebo jsou příznaky natolik nenápadné, že nevzbudí pozornost pacienta ani ošetřujícího lékaře. Většina pacientů má při záchytu pokročilé a nevyléčitelné onemocnění [3]. Pětiletá míra přežití u metastatického onemocnění je 3,0 %, přičemž se zvyšuje na 14,4 % u regionálního a 41,6 % u lokalizovaného postižení [4]. Vzhledem k tomu, že chirurgická resekce lokalizovaného onemocnění představuje jedinou šanci na kurativní terapii [5,6], předpokládá se, že screening s detekcí asymptomatických a časných stadií PC a jeho prekurzorů výsledky zlepší. US Preventive Services Task Force (USPSTF) vydala doporučení proti screeningu běžné populace vzhledem k nízkému výskytu onemocnění u osob v průměrném riziku, absenci jednoduchých screeningových nástrojů a přínosům nepřevažujícím potenciální poškození [7]. Naproti tomu jedinci se zvýšeným rizikem PC na základě rodinné anamnézy (RA) nebo identifikovatelné genetické predispozice jsou jednoznačnými cíli pro selektivní screening a kurativní nebo preventivní léčbu [6,8–10].
V našem přehledovém článku popíšeme faktory asociované s predispozicí pro PC, jednotlivé genetické syndromy, princip screeningu a jeho cíle, indikace k chirurgické terapii, algoritmy sledování a vlastní přístup.
Rizikové faktory
Celoživotní riziko vzniku PC je v běžné populaci přibližně 1,5 % [4]. K definování vysoce rizikových jedinců (HRI – high-risk individuals) se obecně uplatňuje hodnota absolutního rizika > 5 % nebo relativního rizika (RR) > 5 [11]. Většina případů PC je sporadických, ale odhaduje se, že 10–15 % je způsobeno dědičnými příčinami [8,12,13]. V některých rodinách se PC vyskytuje ve zvýšené míře a přibližně 5–10 % jedinců s PC má pozitivní RA [12,13]. V rámci hereditárního rizika PC rozlišujeme dvě základní kategorie. Do první řadíme vzácné definované syndromy genetické predispozice, které se podílejí na cca 20 % dědičných forem PC. Druhou kategorií je familiární PC (FPC), který se podílí na zbylých 80 %. V případě syndromů genetické predispozice je míra rizika variabilní v závislosti na typu mutace, u FPC se riziko onemocnění zvyšuje s počtem postižených příbuzných [12].
Mezi tzv. environmentální rizikové faktory PC se řadí abúzus tabáku a alkoholu, chronická pankreatitida (CP), obezita a diabetes mellitus (DM) 2. typu. Obecně se předpokládá, že jeden ze čtyř PC souvisí s kouřením tabáku a v případě HRI bylo kouření spojeno s dřívější diagnózou až o 20 let [14,15]. Riziko vzniku PC se dále zvyšuje s věkem, medián výskytu je 65 let [1].
Syndromy genetické predispozice
Peutz-Jeghersův syndrom
Zárodečné mutace v genu STK11 (LKB1) jsou spojeny s Peutz-Jeghersovým syndromem (PJS), autozomálně dominantní chorobou, při které vznikají četné hamartomatózní polypy gastrointestinálního traktu, orofaciální melaninové pigmentace a různé malignity. Pacienti s PJS mají celoživotní riziko PC 11–36 %, RR 132 [16–19].
Syndrom familiárního melanomu
Mutace v genu CDKN2A charakterizují syndrom familiárního melanomu a mnohočetných névů (FAMMM). Tato autozomálně dominantní genodermatóza je spojena s četnými dysplastickými névy a maligními melanomy. Variantní FAMMM zvyšuje kumulativní riziko PC na 17 %, RR 13–39 [19–21].
Hereditární karcinom prsu a vaječníků
Mutace v genech BRCA1 a BRCA2 zvyšují riziko vzniku nádorových onemocnění, zejména karcinomu prsu a vaječníků. V rodinách se dědí autozomálně dominantně s vysokou penetrancí. Oproti běžné populaci se riziko PC u nosičů zárodečných mutací BRCA1 udává trojnásobné, u BRCA2 je spojené s RR 3–9 [19]. Mutace genu PALB2, partnerského genu BRCA2, rovněž zvyšují riziko PC. Ve studii Yanga et al byl tento typ mutací asociován s 2–3% rizikem PC [22].
Lynchův syndrom
Podkladem Lynchova syndromu (LS) jsou zárodečné mutace v mismatch repair genech, zejména MLH1, MSH2 a MSH6, případně PMS2 a EPCAM. Jedná se o onemocnění s autozomálně dominantním typem dědičnosti s vysokou penetrancí, při kterém dochází k časnému rozvoji kolorektálního a endometriálního karcinomu, ale i dalších karcinomů včetně PC. Kastrinos et al prokázali u nemocných s LS kumulativní riziko PC 3,7 %, v jiné studii stanovili DaVee et al RR 9–11 [19,23].
Syndrom Li-Fraumeni
Zárodečné mutace tumor supresorového genu TP53 způsobuje autozomálně dominantní syndrom Li-Fraumeni, který je predispozicí k nádorovým onemocněním různého typu. Charakteristický je velmi častý výskyt nádorů v rodině („nádorové rodiny“) s velmi časným nástupem onemocnění. Ve vztahu k PC bylo stanoveno RR 7,3 [19].
Familiární adenomatózní polypóza
Mutace genu APC jsou podkladem familiární adenomatózní polypózy (FAP), autozomálně dominantní choroby, pro kterou je typický výskyt stovek až tisíců polypů tlustého střeva s vysokou tendencí k malignizaci. Jedinci s FAP mají rovněž zvýšené riziko PC s RR 4,46 [19].
Ataxia telangiectasia
Ataxia telangiectasia je komplexní autozomálně recesivní syndrom způsobený zárodečnými mutacemi v genu ATM, který se projevuje zvýšenou citlivostí buněk k potenciálně mutagenním faktorům zevního prostředí (např. sluneční záření) a náchylností k maligní transformaci. Onemocnění je příznačné neurologickými projevy a cévními anomáliemi a nemocní mají rovněž 4násobně zvýšené riziko PC [19].
Hereditární pankreatitida
Typické označení „hereditární“ pankreatitida (HP) bývá používáno pro autozomálně dominantní onemocnění asociované s mutacemi v genu PRSS1. V širším slova smyslu je hereditární pankreatitida zapříčiněna i mutacemi v dalších genech (např. SPINK1), které jsou asociovány s autozomálně recesivní dědičností (běžné označení jako „familiární“ pankreatitida). Onemocnění představuje malou část případů CP, která se u většiny postižených rozvíjí před dosažením 20 let věku a nezřídka před dosažením 5 let. Vlivem chronického zánětu je HP spojena s rizikem PC [24]. Celoživotní riziko se udává 25–44 %, RR 50–82 [25,26].
Familiární karcinom pankreatu
Familiární karcinom pankreatu (FPC) je dědičnou predispozicí k PC, která je charakteristická akumulací onemocnění v rodinách. Ke splnění definice se musí jednat minimálně o dva postižené a navzájem příbuzné prvního stupně (FDR – first-degree relative), tj. rodič–dítě nebo sourozenecký pár, u nichž zároveň nebyl prokázán definovaný syndrom genetické predispozice. Prospektivní analýza dat z velkého registru pacientů s FPC vedla ke stanovení rizika PC u pokrevních příbuzných [12]. Stratifikací na základě počtu postižených se RR u jedinců s jedním postiženým FDR rovnalo 4,6; při dvou 6,4 a při třech bylo 32. Specifické genové alterace zodpovědné za FPC nebyly identifikovány, nicméně v minulosti byla vyslovena dosud nepotvrzená hypotéza o vzácném genu možné dědičné náchylnosti, který se vyskytuje u přibližně 7 lidí z 1 000 [27].
Genetické vyšetření
Riziko hereditární predispozice k rakovině by mělo být hodnoceno u všech osob. Toto hodnocení zahrnuje podrobnou osobní a rodinnou anamnézu včetně typu onkologických onemocnění u pokrevních příbuzných a věku při jejich diagnóze. V případě podezření na přítomnost dědičného nádorového onemocnění či rizika jeho rozvoje na základě anamnestických údajů by měli být vybraní jedinci vyšetřeni klinickým genetikem a dle indikace geneticky testováni (tab. 1).

American Society of Clinical Oncology (ASCO) nedávno publikovala expertní názor doporučující cílenou identifikaci a dispenzarizaci rodinných příslušníků s možnou dědičnou predispozicí k PC [28]. Sdělení obsahovalo i doporučení genetického testování pacientů s diagnostikovaným PC, pokud může výsledek prospět pacientovi nebo jeho rodinným příslušníkům. Tento postup následně doporučila National Comprehensive Cancer Network (NCCN) [29]. Patogenní mutace v rizikových genech jsou detekovány přibližně u 4–20 % pacientů s PC včetně pacientů s klinicky sporadickými tumory bez pozitivní RA [8,30–36]. Identifikace syndromů hereditární predispozice může ovlivnit nejen indikaci k došetření příbuzných, ale výsledky se mohou také uplatnit v léčbě daného pacienta, jelikož jsou některé mutace cílem terapie. Příkladem mohou být PARP inhibitory u BRCA mutací [37].
Screening karcinomu pankreatu u vysoce rizikových osob
Rozhodnutí provádět pankreatický screening jedincům s rizikem PC vyžaduje diskuzi o výhodách, potenciálních rizicích i relativním nedostatku definitivních dat o dlouhodobých přínosech. Screeningový program by měl být přednostně realizován v rámci výzkumného protokolu zkušeným multidisciplinárním týmem a pouze u osob, které jsou kandidáty chirurgického zákroku [6,8].
Jaké screeningové modality by měly být použity?
Současná strategie screeningu PC je založena na zobrazovacích metodách. Je doporučena kombinace endoskopické ultrasonografie (EUS) a magnetické rezonance s magnetickou cholangiopankreatografií (MR/MRCP); výpočetní tomografie (CT) je v pankreatickém protokolu indikována u jedinců, kteří nemohou podstoupit EUS nebo MR/MRCP, zejména kvůli nižší míře detekce menších lézí a snaze vyvarovat se ionizujícímu záření [6,8,38].
Systematickou analýzu jednotlivých screeningových studií provedl tým USPSTF [10]. Screening založený na EUS měl v devíti studiích diagnostický výnos v rozmezí 0 (97,5% CI 0,0–16,9) až 68,2 (95% CI 14,3–186,6) případů na 1 000 osob. Screening založený na MR/MRCP měl v osmi studiích diagnostický výnos od 0 (97,5% CI 0,0–16,9) do 75 (95% CI 15,7–203,9) případů na 1 000 osob. Dvě studie hodnotily CT, kde diagnostický výnos činil 0 (97,5% CI 0,0–16,9) až 12,8 (95% CI 0,3–69,4) případů na 1 000 osob. Metody EUS a MR/MRCP se navíc ukázaly jako komplementární – MR/MRCP je zvláště citlivá pro detekci cystických lézí a EUS pro detekci solidních ložisek, navíc s možností odběru biopsie [39,40]. Ve studii autorů Canto et al pouze EUS detekovala PC ve stadiu I [41] a výhodou EUS je rovněž skutečnost, že některé PC vykazují izodenzní strukturu na CT, ale jsou identifikovatelné na EUS [42]. V případě CT je naopak možnost kvantifikace změn ve viscerálním tuku a svalech lumbální krajiny, které mohou doprovázet časná stadia PC [43,44]. Tento přístup ovšem nebyl ověřen v prospektivních studiích.
Endoskopická retrográdní cholangiopankreatografie (ERCP) se pro screening nedoporučuje vzhledem k riziku post-ERCP pankreatitidy (PEP) [8]. Studie zkoumající přínos ERCP jsou ovšem rozporuplné. V menší prospektivní studii neposkytlo provedení ERCP při abnormálním EUS nálezu žádné další klinicky relevantní informace a bylo spojeno se 7% mírou PEP [45]. Naopak v japonských studiích byl sběr pankreatické šťávy s cytologií při změně kalibru hlavního pankreatického vývodu (MPD) či drobných cystických lézí přínosný v detekci časných stadií PC; senzitivita, specificita a přesnost předoperační cytologie byly 75, 100 a 88 % [46,47]. Pankreatickou šťávu, případně cystickou tekutinu aspirovanou při EUS, lze dále analyzovat genetickým sekvenováním. Mezi potenciální markery patří mutantní GNAS, mutantní KRAS a mutantní TP53 [48–50]. Ve studii zahrnující HRI a kontrolní jedince prokázali Kanda et al přítomnost mutantní TP53 v pankreatické šťávě u 29 ze 43 pacientů s PC, ale v žádných vzorcích od kontrolních jedinců [50].
Jsou k dispozici krevní biomarkery vhodné k detekci PC?
V tuto chvíli neexistují konkluzivní data umožňující doporučení konkrétního biomarkeru jako screeningového nástroje. Nejpoužívanějším nádorovým markerem je CA 19-9. O jeho screeningovém potenciálu u pacientů s vysokým rizikem PC jsou ovšem omezené údaje. Zubarik et al zaznamenali ve screeningové studii s 546 subjekty zvýšení CA 19-9 u 27 osob (4,9 %); neoplastické nálezy byly při následné EUS detekovány u pěti pacientů (0,9 %) a u jednoho byl zjištěn PC (0,2 %) [51]. International Cancer of the Pancreas Screening (CAPS) Consortium doporučuje vyšetření CA 19-9 pouze v případě podezřelého nálezu na zobrazovacích metodách a obav z přítomného PC [8]. Velkým příslibem jsou testy kombinující nádorově specifické proteiny (včetně CA 19-9) a cirkulující nádorovou DNA (tzv. tekutá biopsie). Jeden takový, – CancerSEEK – byl vyvinut týmem z Johns Hopkins University k detekci více typů karcinomů současně. Výsledky studijní populace byly publikovány v časopise Science a v případě PC vykazoval test senzitivitu 72 % a specificitu 99 % [52]. Dalšími potenciálními markery jsou aberantní exprese mikroRNA. Ve studii autorů Liu et al zlepšily panely mikroRNA analyzované v kombinaci s CA 19-9 diagnostickou přesnost u PC [53].
Velkým tématem je pankreatogenní DM typu 3c (T3cDM), který označuje diabetes vzniklý v souvislosti s chorobou exokrinní části pankreatu. Nejčastěji je způsoben v důsledku CP, ale může se rovněž jednat o paraneoplastický projev PC. V retrospektivní studii se Sharma et al zaměřili na pacienty starší 50 let s nově diagnostikovaným DM s předpokladem, že zvýšení hladin glykemie nalačno může předcházet diagnózu PC až o 3 roky [54,55]. Cílem bylo vyvinutí nástroje k určení rizika PC u této populace a výstupem se stal skórovací systém ENDPAC, který zohledňuje změnu hmotnosti, hodnoty glykemie a věk v čase diagnózy DM. Pomocí tohoto systému byli autoři schopni identifikovat jedince s několikanásobně vyšším rizikem rozvoje PC v následujících letech [54]. Studie provedené za účelem validace ENDPAC poskytly nadějné závěry, nicméně nebyly tak úspěšné jako originální studie z Mayo Clinic [56,57]. Změnou metabolických poměrů a měkkotkáňových struktur se zabývali rovněž Sah et al, kteří popsali tři zřetelné fáze předcházející diagnóze PC [44]. Fáze 1 (30–18 měsíců) je charakterizována izolovanou hyperglykemií, fáze 2 (18–6 měsíců) pre-kachexií s hyperglykemií, snížením lipidemie, tělesné hmotnosti a podkožního tuku a fáze 3 (6–0 měsíců) kachexií včetně úbytku viscerálního tuku se sarkopenií. Abnormální hodnoty glykemie či nově vzniklý DM u rizikového jedince by měly vést promptně k dalším diagnostickým vyšetřením [8,58].
Jaké jsou cíle a benefity screeningu PC u vysoce rizikových osob?
Primárním cílem pankreatického screeningu je snížení mortality spojené s PC detekcí časných stadií onemocnění a prevence jeho výskytu identifikací a léčbou prekurzorových lézí [8]. Při současných vyšetřovacích postupech je PC často metastatický v době diagnózy či během krátké doby poté, co je diagnostikován [1,3,59]. Publikované výsledky screeningových programů prokázaly,,downstaging“ zachycených PC (tj. častější zachycení časných stadií) spojený s lepším přežitím [41,60]. Konkrétně ve studii autorů Canto et al s 354 HRI a mediánem doby sledování 5,6 let bylo identifikováno 14 PC, z toho 10 (71 %) asymptomatických a 9 z nich časných a resekovatelných [41]. Čtyři symptomatičtí pacienti, kterým byl diagnostikován inoperabilní PC, nepodstoupili vyšetření ve stanoveném intervalu. Tříletá míra přežití byla významně vyšší u devíti resekovatelných PC ve srovnání se symptomatickými (85 vs. 25 %; p < 0,0001).
Na co je pankreatický screening zaměřen?
Hlavními patologickými cíli jsou PC stadium I (T1–2 N0 M0) a jeho prekurzory s těžkou dysplazií, konkrétně pankreatické intraepiteliální neoplazie (PanIN) nebo mucinózní cystické léze (intraduktální papilární mucinózní neoplazie (IPMN) a mucinózní cystická neoplazie) [8]. Zobrazovací charakteristiky u IPMN mohou být užitečné při identifikaci dysplastických rysů, to ale není případ PanIN, z nichž většina jsou mikroskopické léze, které nelze zobrazit konvenčními metodami. Předpokládá se, že většina duktálních adenokarcinomů pochází právě z PanIN [61]. Nicméně PanIN s těžkou dysplazií (dříve PanIN-3) bývají diagnostikovány typicky pouze histopatologicky, např. po resekcích provedených pro jiné znepokojující nálezy na zobrazovacích vyšetřeních. Studie Bartsche et al ale poukázala na možnost přítomnosti těžce dysplastických PanIN lézí u pacientů s vícečetnými malými IPMN jinde v parenchymu [62] a některé drobné cystické léze vizualizované na EUS jsou ve skutečnosti viditelnými PanIN [38,45,63,64].
Jaká jsou rizika a nevýhody pankreatického screeningu?
Mezi rizika patří komplikace spojené s diagnostickými vyšetřeními, např. s prováděním EUS-navigované tenkojehlové aspirace (FNA), podáním kontrastní látky či analgosedací. Dále může vzniknout poškození,,naddiagnostikováním“, což má za následek léčbu zcela benigních nebo nízce rizikových neoplastických lézí [13,45,64,65]. Falešně pozitivní cytologie může vést k anxietě pacienta a také zbytečné operaci [64,66]. Na druhou stranu účast ve screeningovém programu u některých osob úzkost z rakoviny snižuje [67]. Nevýhodou screeningu závislého na pokročilých zobrazovacích metodách je nákladová stránka a z hlediska samotné podstaty screeningu PC je významným omezením neschopnost spolehlivě detekovat a rozlišovat PanIN léze současnými metodami.
Screeningem identifikované léze
Solidní léze
Méně než 2 % pankreatických lézí detekovaných screeningem je solidních [38]. U těchto lézí je indikováno CT v pankreatickém protokolu [8]. Některá indeterminovaná solidní ložiska identifikovaná pouze na EUS mohou být PanIN s fokálně asociovanou lobulocentrickou atrofií [63]. Rozhodnutí provést EUS-FNA ze solidních ložisek by mělo být individuální. Pokud je léze přístupná a cytologický výsledek ovlivní další směřování, je doporučeno odběr provést [8]. Dopad je potenciálně větší u pravostranných pankreatických lézí vyžadujících Whippleovu operaci oproti lézím v kaudě, které lze odstranit i minimálně invazivními přístupy.
Cystické léze
Přibližně jedna třetina HRI má při vstupním screeningu jednu nebo více cyst [38]. Prevalence se zvyšuje s věkem, přičemž cystické léze byly detekovány u 14 % subjektů mladších 50 let, 34 % ve věku 50–59 let a 53 % ve věku 60–69 let [38]. Většina jsou nízkorizikové IPMN a během dispenzarizace zůstávají neměnné [13,66,68]. Přístup se obecně řídí přidruženými patologickými rysy a u podezřelých cyst je indikována FNA [8].
Změny kalibru MPD bez viditelného ložiska
V případě detekce nejasné stenózy MPD bez nádorové masy se doporučuje CT a případně FNA s kontrolním vyšetřením do 3 měsíců k potenciální identifikaci okultní neoplazie; ERCP se nedoporučuje [8,45]. Nicméně recentní studie poukazují na užitečnost odběru pankreatické šťávy v případě diagnostiky PC [46,47] i predikce přítomnosti dysplastických prekurzorových lézí [69,70].
Pankreatické neuroendokrinní tumory
Sledování HRI příležitostně identifikuje malé (< 1 cm) pankreatické neuroendokrinní tumory (pNET), i když není jasné, zda jsou léze v této populaci běžnější než u osob v průměrném riziku PC [8]. Většina náhodně detekovaných pNET má nízký maligní potenciál [71] a současné pokyny doporučují sledování asymptomatických nefunkčních nízkorizikových pNET velikosti < 2 cm [72].
Chirurgické indikace
Pankreatické léze jsou detekovány až u 42 % HRI [38]. Většina z nich je řešena konzervativně a nevyžadují chirurgický zákrok. Panuje shoda, že indikace k pankreatické resekci by se u HRI neměly významně lišit od zavedených postupů v případě,,běžné“ populace a rozhodování by mělo probíhat v rámci multioborových skupin [8]. Je nutné mít na paměti, že abnormality s nulovým až nízkým maligním potenciálem jsou detekovány daleko častěji než klinicky relevantní léze.
Resekována by měla být všechna ložiska podezřelá z PC [8]. Konsenzus ohledně chirurgického přístupu k HRI podstupujícím resekci pro podezření na PC se ovšem vyvíjí. Většina odborníků nedoporučuje totální pankreatektomii, pokud to není nutné k dosažení zcela negativního (R0) resekčního okraje [8]. Diskutuje se o případných PanIN lézích na chirurgickém okraji. Data naznačují, že PanIN jakéhokoli stupně na okraji resekovaného pankreatu s invazivním PC nemá prognostické důsledky; klinický význam dysplazie na okraji resekovaného pankreatu bez invazivního PC je ovšem třeba určit [73,74]. Část odborníků by v tomto případě další operaci neprováděla [73], ale pokud se jedná o PanIN s těžkou dysplazií, doporučuje se kontrolní zobrazovací vyšetření do 6 měsíců od operace a následně pravidelně „na dobu neurčitou“ vzhledem k riziku nových či metachronních neoplazií u těchto pacientů [8]. Canto et al publikovali výsledky HRI po resekci lézí detekovaných screeningem [75]. Z celkem 354 sledovaných bylo operováno 48 (22 solidních ložisek, 25 cystických lézí, 1 stenóza MPD). U většiny byla provedena parciální pankreatektomie a metachronní PC se vyvinul u dvou pacientů, kdy u obou předcházelo odstranění benigní prekurzorové léze. Medián délky hospitalizace byl 7 dní, míra pooperačních komplikací 35 % a perioperační mortalita 0. Důležité bylo, že devět z deseti zachycených PC bylo resekovatelných, u nichž pětiletá míra přežití činila 60 %.
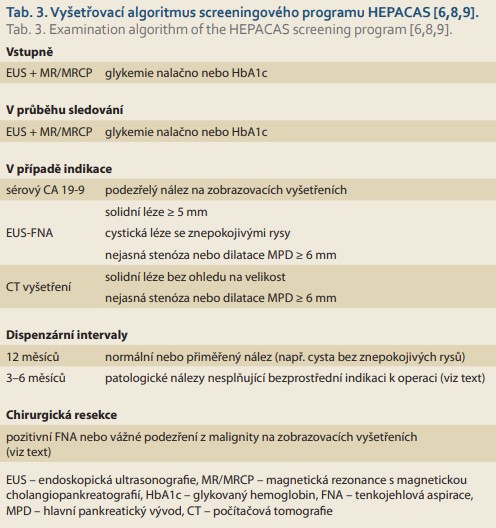
Chirurgická resekce je doporučena v případě [8]:
- solidní ložisko pankreatu ≥ 5 mm indeterminované povahy;
- pozitivní nebo vysoce suspektní výsledek FNA;
- cystické ložisko se znepokojivými rysy (solidní komponenta s,,enhancementem“, nástěnný nodulus nebo výrazné ztluštění stěny, dilatace MPD na ≥ 10 mm, náhlá změna kalibru MPD s distálního atrofií, související příznaky pankreatitidy, ikterus nebo bolest pankreatického typu).
Dispenzarizace pacientů bez chirurgické indikace
Jedinci s přiměřeným nálezem na pankreatu by měli podstoupit kontrolní vyšetření za 12 měsíců a sledování by mělo pokračovat po dobu, kdy jsou chirurgickými kandidáty. Intervaly v případě detekovaných lézí, které nevykazují známky malignity (včetně provedené CT nebo FNA), jsou ovlivněny velikostí, počtem a typem lézí, rychlostí růstu a souvisejícími rysy [6,8,9]. Kontrolní vyšetření s odstupem 3 měsíců by mělo být provedeno v případě přítomnosti:
a) solidního ložiska < 5 mm nejasné významnosti;
b) solidního ložiska s MPD šíře 5–9 mm;
c) stenózy nebo dilatace MPD ≥ 6 mm nejasné etiologie.
Kontrolní vyšetření s odstupem 6 měsíců je doporučeno v případě:
a) cystické léze o velikosti ≥ 3 cm;
b) cystické léze s MPD šíře 5–9 mm;
c) cystické léze s přidruženou lymfadenopatií;
d) růstu cysty ≥ 5 mm za 2 roky;
e) zvýšeného sérového CA 19-9.
Projekt HEPACAS
Hereditary Pancreatic Cancer Screening neboli HEPACAS je pilotním projektem realizovaným ve Fakultní nemocnici Olomouc ve spolupráci II. interní kliniky, I. chirurgické kliniky, Onkologické kliniky, Radiologické kliniky, Ústavu klinické a molekulární patologie a Ústavu lékařské genetiky. Primárním cílem projektu je snížení výskytu a mortality PC záchytem potenciálně kurabilních neoplazií pankreatu u asymptomatických rizikových jedinců. Projekt je koncipován jako kohortová studie v podobě screeningového programu, který byl schválen Etickou komisí FN Olomouc (tab. 2). Jedinec zařazený do projektu absolvuje jednou ročně vyšetření pankreatu pomocí EUS a MR/MRCP, krevních testů a klinického vyšetření. V případě pozitivního nálezu ve smyslu záchytu podezřelého ložiska či jiné pankreatopatie je pacientovi doporučen adekvátní postup v souladu s platnými doporučeními (tab. 3). Hodnocení dlouhodobých výsledků účastníků tohoto projektu považujeme za důležité k zavedení screeningového programu do klinické praxe, což je druhotným cílem projektu.

Závěr
Včasná detekce karcinomu pankreatu je považována za nejúčinnější způsob, jak zlepšit přežití u tohoto onemocnění. Populační screening se nedoporučuje, nicméně identifikace osob s hereditárním rizikem a použití minimálně invazivních screeningových vyšetření je opodstatněné. V tomto ohledu je třeba více dat týkajících se přirozeného vývoje prekurzorových lézí u vysoce rizikových jedinců a dopadů screeningových programů na morbiditu a mortalitu u této specifické skupiny. Z těchto důvodů je doporučeno realizovat screeningový program v rámci výzkumného protokolu v terciárních centrech a na spolupracujících menších pracovištích. Úspěch takového programu vyžaduje compliance na straně pacientů, expertní endosonografisty, zkušené pankreatobiliární chirurgy a multidisciplinární zázemí dedikovaných gastroenterologů, radiologů, histopatologů, onkologů a klinických genetiků.
Věříme, že tato,,olomoucká výzva“ poskytne podnět k mezicentrové spolupráci, která bude nezbytná ke vzniku centrálního registru a vypracování doporučených postupů na národní úrovni. V případě zájmu o další informace nebo spolupráci s pracovní skupinou HEPACAS prosím kontaktujte hlavního řešitele MUDr. Petra Vaňka nebo MUDr. Vincenta Zoundjiekpona.
Doručeno/Submitted: 8. 9. 2021
Přijato/Accepted: 16. 10. 2021
MUDr. Petr Vaněk
II. interní klinika – gastroenterologická a geriatrická
LF UP a FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
petr.vanek3@fnol.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. ÚZIS ČR. Novotvary 2018 ČR. 2021 [online]. Dostupné z: https: //www.uzis.cz/res/f/008352/novotvary2018.pdf.
2. Loveček M, Skalický P, Ryska M et al. Aktuální stav chirurgické léčby karcinomu pankreatu v České republice. Rozhl Chir 2016; 95(4): 151–155.
3. Huang L, Jansen L, Balavarca Y et al. Resection of pancreatic cancer in Europe and USA: an international large-scale study highlighting large variations. Gut 2019; 68(1): 130–139. doi: 10.1136/gutjnl-2017-314828.
4. National Cancer Institute. Cancer stat facts: pancreatic cancer. 2021 [online]. Available from: https: //seer.cancer.gov/statfacts/html/pancreas.html.
5. Ryska M. Karcinom pankreatu – současný efektivní diagnostický a terapeutický postup. Čas Lék Čes 2016; 155(1): 38–43.
6. Aslanian HR, Lee JH, Canto MI. AGA clinical practice update on pancreas cancer screening in high-risk individuals: expert review. Gastroenterology 2020; 159(1): 358–362. doi: 10.1053/j.gastro.2020.03.088.
7. Owens DK, Davidson KW, Krist AH et al. Screening for pancreatic cancer: US preventive services task force reaffirmation recommendation statement. JAMA 2019; 322(5): 438–444. doi: 10.1001/jama.2019.10232.
8. Goggins M, Overbeek KA, Brand R et al. Management of patients with increased risk for familial pancreatic cancer: updated recommendations from the International Cancer of the Pancreas Screening (CAPS) Consortium. Gut 2020; 69(1): 7–17. doi: 10.1136/gutjnl-2019-319352.
9. Syngal S, Brand RE, Church JM et al. ACG clinical guideline: genetic testing and management of hereditary gastrointestinal cancer syndromes. Am J Gastroenterol 2015; 110(2): 223–263. doi: 10.1038/ajg.2014.435.10. Henrikson NB, Aiello Bowles EJ, Blasi PR et al. Screening for pancreatic cancer: updated evidence report and systematic review for the US preventive services task force. JAMA 2019; 322(5): 445–454. doi: 10.1001/jama.2019.6190.
11. Canto MI, Harinck F, Hruban RH et al. International Cancer of the Pancreas Screening (CAPS) Consortium summit on the management of patients with increased risk for familial pancreatic cancer. Gut 2013; 62(3): 339–347. doi: 10.1136/gutjnl-2012-303108.
12. Klein AP, Brune KA, Petersen GM et al. Prospective risk of pancreatic cancer in familial pancreatic cancer kindreds. Cancer Res 2004; 64(7): 2634–2638. doi: 10.1158/0008-5472.can-03-3823.
13. Schneider R, Slater EP, Sina M et al. German national case collection for familial pancreatic cancer (FaPaCa): ten years experience. Fam Cancer 2011; 10(2): 323–330. doi: 10.1007/s10689-010-9414-x.
14. Lowenfels AB, Maisonneuve P, Whitcomb DC. Risk factors for cancer in hereditary pancreatitis. International Hereditary Pancreatitis Study Group. Med Clin North Am 2000; 84(3): 565–573. doi: 10.1016/s0025-7125(05)70240-6.
15. Yeo TP, Hruban RH, Brody J et al. Assessment of „gene-environment“ interaction in cases of familial and sporadic pancreatic cancer. J Gastrointest Surg 2009; 13(8): 1487–1494. doi: 10.1007/s11605-009-0923-6.
16. Giardiello FM, Welsh SB, Hamilton SR et al. Increased risk of cancer in the Peutz-Jeghers syndrome. N Engl J Med 1987; 316(24): 1511–1514. doi: 10.1056/NEJM198706113162404.
17. Giardiello FM, Brensinger JD, Tersmette AC et al. Very high risk of cancer in familial Peutz-Jeghers syndrome. Gastroenterology 2000; 119(6): 1447–1453. doi: 10.1053/gast.2000.20228.
18. van Lier MG, Wagner A, Mathus-Vliegen EM et al. High cancer risk in Peutz-Jeghers syndrome: a systematic review and surveillance recommendations. Am J Gastroenterol 2010; 105(6): 1258–1264. doi: 10.1038/ajg.2009.725.
19. DaVee T, Coronel E, Papafragkakis C et al. Pancreatic cancer screening in high-risk individuals with germline genetic mutations. Gastrointest Endosc 2018; 87(6): 1443–1450. doi: 10.1016/j.gie.2017.12.019.
20. Vasen HF, Gruis NA, Frants RR et al. Risk of developing pancreatic cancer in families with familial atypical multiple mole melanoma associated with a specific 19 deletion of p16 (p16-Leiden). Int J Cancer 2000; 87(6): 809–811.
21. Goldstein AM, Fraser MC, Struewing JP et al. Increased risk of pancreatic cancer in melanoma-prone kindreds with p16INK4 mutations. N Engl J Med 1995; 333(15): 970–974. doi: 10.1056/NEJM199510123331504.
22. Yang X, Leslie G, Doroszuk A et al. Cancer risks associated with germline PALB2 pathogenic variants: an international study of 524 families. J Clin Oncol 2020; 38(7): 674–685. doi: 10.1200/JCO.19.01907.
23. Kastrinos F, Mukherjee B, Tayob N et al. Risk of pancreatic cancer in families with Lynch syndrome. JAMA 2009; 302(16): 1790–1795. doi: 10.1001/jama.2009.1529.
24. Dítě P, Hermanová M, Trna J et al. The role of chronic inflammation: chronic pancreatitis as a risk factor of pancreatic cancer. Dig Dis 2012; 30(3): 277–283. doi: 10.1159/000336991.
25. Lowenfels AB, Maisonneuve P, DiMagno EP et al. Hereditary pancreatitis and the risk of pancreatic cancer. International Hereditary Pancreatitis Study Group. J Natl Cancer Inst 1997; 89(6): 442–446. doi: 10.1093/jnci/89.6.442.
26. Rebours V, Boutron-Ruault MC, Schnee M et al. Risk of pancreatic adenocarcinoma in patients with hereditary pancreatitis: a national exhaustive series. Am J Gastroenterol 2008; 103(1): 111–119. doi: 10.1111/j.1572-0241.2007.01597.x.
27. Klein AP, Beaty TH, Bailey-Wilson JE et al. Evidence for a major gene influencing risk of pancreatic cancer. Genet Epidemiol 2002; 23(2): 133–149. doi: 10.1002/gepi.1102.
28. Stoffel EM, McKernin SE, Brand R et al. Evaluating susceptibility to pancreatic cancer: ASCO provisional clinical opinion. J Clin Oncol 2019; 37(2): 153–164. doi: 10.1200/JCO.18.01489.
29. National Comprehensive Cancer Network. NCCN Guidelines – Pancreatic Adenocarcinoma. 2021 [online]. Available from: https: //www.nccn.org/guidelines/guidelines-detail?category=1&id=1455.
30. Lowery MA, Wong W, Jordan EJ et al. Prospective evaluation of germline alterations in patients with exocrine pancreatic neoplasms. J Natl Cancer Inst 2018; 110(10): 1067–1074. doi: 10.1093/jnci/djy024.
31. Grant RC, Selander I, Connor AA et al. Prevalence of germline mutations in cancer predisposition genes in patients with pancreatic cancer. Gastroenterology 2015; 148(3): 556–564. doi: 10.1053/j.gastro.2014.11.042.
32. Salo-Mullen EE, O’Reilly EM, Kelsen DP et al. Identification of germline genetic mutations in patients with pancreatic cancer. Cancer 2015; 121(24): 4382–4388. doi: 10.1002/cncr.29664.
33. Yurgelun MB, Chittenden AB, Morales-Oyarvide V et al. Germline cancer susceptibility gene variants, somatic second hits, and survival outcomes in patients with resected pancreatic cancer. Genet Med 2019; 21(1): 213–223. doi: 10.1038/s41436-018-0009-5.
34. Brand R, Borazanci E, Speare V et al. Prospective study of germline genetic testing in incident cases of pancreatic adenocarcinoma. Cancer 2018; 124(17): 3520–3527. doi: 10.1002/cncr.31628.
35. Dudley B, Karloski E, Monzon FA et al. Germline mutation prevalence in individuals with pancreatic cancer and a history of previous malignancy. Cancer 2018; 124(8): 1691–1700. doi: 10.1002/cncr.31242.
36. Shindo K, Yu J, Suenaga M et al. Deleterious germline mutations in patients with apparently sporadic pancreatic adenocarcinoma. J Clin Oncol 2017; 35(30): 3382–3390. doi: 10.1200/JCO.2017.72.3502.
37. Zemanek T, Melichar B, Lovecek M et al. Biomarkers and pathways of chemoresistance and chemosensitivity for personalized treatment of pancreatic adenocarcinoma. Pharmacogenomics 2019; 20(2): 113–127. doi: 10.2217/pgs- 2018-0073.
38. Canto MI, Hruban RH, Fishman EK et al. Frequent detection of pancreatic lesions in asymptomatic high-risk individuals. Gastroenterology 2012; 142(4): 796–804. doi: 10.1053/j.gastro.2012.01.005.
39. Overbeek KA, Levink IJ, Koopmann BD et al. Long-term yield of pancreatic cancer surveillance in high-risk individuals. Gut 2021; 70(Suppl). doi: 10.1136/gutjnl-2020-323611.
40. Harinck F, Konings IC, Kluijt I et al. A multicentre comparative prospective blinded analysis of EUS and MRI for screening of pancreatic cancer in high-risk individuals. Gut 2016; 65(9): 1505–1513. doi: 10.1136/gutjnl-2014-308008.
41. Canto MI, Almario JA, Schulick RD et al. Risk of neoplastic progression in individuals at high risk for pancreatic cancer undergoing long-term surveillance. Gastroenterology 2018; 155(3): 740–751. doi: 10.1053/j.gastro.2018.05.035.
42. Psar R, Urban O, Cerna M et al. Improvement of the diagnosis of isoattenuating pancreatic carcinomas by defining their characteristics on contrast enhanced computed tomography and endosonography with Fine-Needle Aspiration (EUS-FNA). Diagnostics 2021; 11(5): 776. doi: 10.3390/diagnostics11050776.
43. Danai LV, Babic A, Rosenthal MH et al. Altered exocrine function can drive adipose wasting in early pancreatic cancer. Nature 2018; 558(7711): 600–604. doi: 10.1038/s41586-018-0235-7.
44. Sah RP, Sharma A, Nagpal S et al. Phases of metabolic and soft tissue changes in months preceding a diagnosis of pancreatic ductal adenocarcinoma. Gastroenterology 2019; 156(6): 1742–1752. doi: 10.1053/j.gastro.2019.01.039.
45. Canto MI, Goggins M, Hruban RH et al. Screening for early pancreatic neoplasia in high-risk individuals: a prospective controlled study. Clin Gastroenterol Hepatol 2006; 4(6): 766–781. doi: 10.1016/j.cgh.2006.02.005.
46. Hanada K, Minami T, Shimizu A et al. Roles of ERCP in the early diagnosis of pancreatic cancer. Diagnostics 2019; 9(1): 30. doi: 10.3390/diagnostics9010030.
47. Kanno Y, Koshita S, Ogawa T et al. Predictive value of localized stenosis of the main pancreatic duct for early detection of pancreatic cancer. Clin Endosc 2019; 52(6): 588–597. doi: 10.5946/ce.2019.018.
48. Wu J, Matthaei H, Maitra A et al. Recurrent GNAS mutations define an unexpected pathway for pancreatic cyst development. Sci Transl Med 2011; 3(92): 92ra66. doi: 10.1126/scitranslmed.3002543.
49. Kanda M, Knight S, Topazian M et al. Mutant GNAS detected in duodenal collections of secretin-stimulated pancreatic juice indicates the presence or emergence of pancreatic cysts. Gut 2013; 62(7): 1024–1033. doi: 10.1136/gutjnl-2012-302823.
50. Kanda M, Sadakari Y, Borges M et al. Mutant TP53 in duodenal samples of pancreatic juice from patients with pancreatic cancer or high-grade dysplasia. Clin Gastroenterol Hepatol 2013; 11(6): 719–730. doi: 10.1016/j.cgh.2012.11.016.
51. Zubarik R, Gordon SR, Lidofsky SD et al. Screening for pancreatic cancer in a high-risk population with serum CA 19-9 and targeted EUS: a feasibility study. Gastrointest Endosc 2011; 74(1): 87–95. doi: 10.1016/j.gie.2011.03.1235.
52. Cohen JD, Li L, Wang Y et al. Detection and localization of surgically resectable cancers with a multi-analyte blood test. Science 2018; 359(6378): 926–930. doi: 10.1126/science.aar3247.
53. Liu J, Gao J, Du Y et al. Combination of plasma microRNAs with serum CA19-9 for early detection of pancreatic cancer. Int J Cancer 2012; 131(3): 683–691. doi: 10.1002/ijc.26422.
54. Sharma A, Kandlakunta H, Nagpal SJ et al. Model to determine risk of pancreatic cancer in patients with new-onset diabetes. Gastroenterology 2018; 155(3): 730–739. doi: 10.1053/j.gastro.2018.05.023.
55. Sharma A, Smyrk TC, Levy MJ et al. Fasting blood glucose levels provide estimate of duration and progression of pancreatic cancer before diagnosis. Gastroenterology 2018; 155(2): 490–500. doi: 10.1053/j.gastro.2018.04.025.
56. Khan S, Safarudin RF, Kupec JT. Validation of the ENDPAC model: identifying new-onset diabetics at risk of pancreatic cancer. Pancreatology 2021; 21(3): 550–555. doi: 10.1016/j.pan.2021.02.001.
57. Chen W, Butler RK, Lustigova E et al. Validation of the enriching new-onset diabetes for pancreatic cancer model in a diverse and integrated healthcare setting. Dig Dis Sci 2021; 66(1): 78–87. doi: 10.1007/s10620-020-06139-z.
58. Frič P, Šedo A, Škrha J et al. Časná detekce sporadického karcinomu pankreatu. Čas Lék Čes 2016; 155(1): 44–47.
59. Trna J, Kala Z, Kunovský L et al (eds). Klinická pankreatologie. 2. přepracované a doplněné vydání. Praha: Maxdorf 2021.
60. Vasen H, Ibrahim I, Ponce CG et al. Benefit of surveillance for pancreatic cancer in high-risk individuals: outcome of long-term prospective follow-up studies from three European expert centers. J Clin Oncol 2016; 34(17): 2010–2019. doi: 10.1200/JCO.2015.64.0730.
61. Roberts NJ, Norris AL, Petersen GM et al. Whole genome sequencing defines the genetic heterogeneity of familial pancreatic cancer. Cancer Discov 2016; 6(2): 166–175. doi: 10.1158/2159-8290.CD-15-0402.
62. Bartsch DK, Dietzel K, Bargello M et al. Multiple small „imaging“ branch-duct type intraductal papillary mucinous neoplasms (IPMNs) in familial pancreatic cancer: indicator for concomitant high grade pancreatic intraepithelial neoplasia? Fam Cancer 2013; 12(1): 89–96. doi: 10.1007/s10689-012-9582-y.
63. Brune K, Abe T, Canto M et al. Multifocal neoplastic precursor lesions associated with lobular atrophy of the pancreas in patients having a strong family history of pancreatic cancer. Am J Surg Pathol 2006; 30(9): 1067–1076.
64. Canto MI, Goggins M, Yeo CJ et al. Screening for pancreatic neoplasia in high-risk individuals: an EUS-based approach. Clin Gastroenterol Hepatol 2004; 2(7): 606–621. doi: 10.1016/s1542-3565 (04) 00244-7.
65. Lang J, Kunovský L, Kala Z et al. Risk factors of pancreatic cancer and their possible uses in diagnostics. Neoplasma 2021; 68(2): 227–239. doi: 10.4149/neo_2020_200706N699.
66. Vasen HF, Wasser M, van Mil A et al. Magnetic resonance imaging surveillance detects early-stage pancreatic cancer in carriers of a p16-Leiden mutation. Gastroenterology 2011; 140(3): 850–856. doi: 10.1053/j.gastro.2010.11.048.
67. Konings IC, Sidharta GN, Harinck F et al. Repeated participation in pancreatic cancer surveillance by high-risk individuals imposes low psychological burden. Psychooncology 2016; 25(8): 971–978. doi: 10.1002/pon.4047.
68. Al-Sukhni W, Borgida A, Rothenmund H et al. Screening for pancreatic cancer in a high-risk cohort: an eight-year experience. J Gastrointest Surg 2012; 16(4): 771–783. doi: 10.1007/s11605-011-1781-6.
69. Yu J, Sadakari Y, Shindo K et al. Digital next-generation sequencing identifies low-abundance mutations in pancreatic juice samples collected from the duodenum of patients with pancreatic cancer and intraductal papillary mucinous neoplasms. Gut 2017; 66(9): 1677–1687. doi: 10.1136/gutjnl-2015-311166.
70. Suenaga M, Yu J, Shindo K et al. Pancreatic juice mutation concentrations can help predict the grade of dysplasia in patients undergoing pancreatic surveillance. Clin Cancer Res 2018; 24(12): 2963–2974. doi: 10.1158/1078-0432.CCR-17-2463.
71. Pea A, Yu J, Marchionni L et al. Genetic analysis of small well-differentiated pancreatic neuroendocrine tumors identifies subgroups with differing risks of liver metastases. Ann Surg 2020; 271(3): 566–573. doi: 10.1097/SLA.0000000000003022.
72. Falconi M, Eriksson B, Kaltsas G et al. ENETS consensus guidelines update for the management of patients with functional pancreatic neuroendocrine tumors and non-functional pancreatic neuroendocrine tumors. Neuroendocrinology 2016; 103(2): 153–171. doi: 10.1159/000443171.
73. Matthaei H, Hong SM, Mayo SC et al. Presence of pancreatic intraepithelial neoplasia in the pancreatic transection margin does not influence outcome in patients with R0 resected pancreatic cancer. Ann Surg Oncol 2011; 18(12): 3493–3499. doi: 10.1245/s10434-011-1745-9.
74. Basturk O, Hong SM, Wood LD et al. A revised classification system and recommendations from the Baltimore consensus meeting for neoplastic precursor lesions in the pancreas. Am J Surg Pathol 2015; 39(12): 1730–1741. doi: 10.1097/PAS.0000000000000533.
75. Canto MI, Kerdsirichairat T, Yeo CJ et al. Surgical outcomes after pancreatic resection of screening-detected lesions in individuals at high risk for developing pancreatic cancer. J Gastrointest Surg 2020; 24(5): 1101–1110. doi: 10.1007/s11605-019-04230-z.