Renální komplikace akutních a chronických onemocnění jater
Miroslav Merta1
+ Pracoviště
Souhrn
K současnému postižení jater a ledvin dochází poměrně často a toto duální postižení může mít různou podobu. Nové poznatky naznačují, že při postižení jater a ledvin se mohou uplatňovat některé společné patogenetické mechanizmy a spíše než o izolovaném postižení obou orgánů lze hovořit o systémovém procesu vedoucímu k významnému zhoršení celkové prognózy. U cirhózy jater je akutní poškození ledvin spojeno s významným vzestupem mortality a je důležitým faktorem pro posouzení transplantability jater. Na případech akutního poškození ledvin (AKI – acute kidney injury) se značným podílem, nikoli však výlučně, uplatňuje hepatorenální syndrom, jehož podstatou jsou hemodynamické změny v ledvinách a průvodní systémové a zánětlivé změny v ledvinách a dalších orgánech; pozornost je však v současnosti věnována také dalším typům AKI, které jsou ve zvýšené míře rozpoznávány. U chronického onemocnění jater je intenzivně studován vztah mezi nealkoholovou tukovou chorobou jater (NAFLD – non-alcoholic fatty liver disease) a chronickým onemocněním ledvin (CKD – chronic kidney disease). NAFLD je v současnosti často řazeno mezi jaterní projevy metabolického syndromu a asociováno s dalšími systémovými onemocněními, jako jsou kardiovaskulární onemocnění, diabetes mellitus a v neposlední řadě s CKD. Pro úspěšné řešení klinických problémů na ose játra-ledviny je nezbytná úzká spolupráce specialistů z obou orgánových oborů.
Klíčová slova
chronické onemocnění jater, chronické onemocnění ledvin, cirhóza, hepatorenální syndrom, nealkoholová tuková choroba jaterÚvod
K současnému postižení jater a ledvin dochází v klinické praxi poměrně často a toto duální postižení může mít různou podobu. Při zaměření na primární onemocnění jater lze uvést, že renální postižení různého typu a závažnosti provází a komplikuje klinický průběh jak u nemocných s akutním onemocněním jater, tak u nemocných s chronickým onemocněním jater (CLD – chronic liver diseases), v řadě případů je odlišení akutního či chronického průběhu u obou orgánových postižení obtížné.
U nemocných s akutním selháním jater nejrůznější etiologie (toxické působení léků, etylu, autoimunitní onemocnění, nádory, virové hepatitidy aj.) dochází k vývoji akutního poškození ledvin (AKI – acute kidney injury) běžně (kolem 70 %). Zvláště perzistující případy AKI (z definice ADQI 16 Workgroup – perzistující AKI = AKI > 48 hod) se zdají být spojeny se závažnějším průběhem AKI, vyšším počtem systémových komplikací a vyšší mortalitou [1].
Mezi CLD, které jsou renálními komplikacemi provázeny, patří nejčastěji především hepatitidy B, C, E a jaterní cirhóza (LC – liver cirrhosis), nově je také studován vztah mezi nealkoholovou tukovou chorobou jater (NAFLD – non-alcoholic fatty liver disease) a chronickým onemocněním ledvin (CKD – chronic kidney disease). Specifickou kapitolou jsou renální komplikace transplantace jater (LT – liver transpantion).
Infekce virem hepatitidy B
Chronická infekce virem hepatitidy B (HBV) zůstává přes zřetelnou tendenci k poklesu v ekonomicky rozvinutých zemích nadále celosvětově významnou příčinou LC a hepatocelulárního karcinomu. Kromě převažujícího hepatálního postižení se HBV může u 10–20 % pacientů projevit příznaky extrahepatálními, zahrnujícími především onemocnění ledvin, polyarteritis nodosa či dermatologické onemocnění [2,3]. Onemocnění ledvin mají obvykle podobu chronické nefropatie s proteinurií či nefrotickým syndromem a lze je nejčastěji zařadit do skupiny imunokomplexových glomerulonefritid (GN) (membranózní GN, membranoproliferativní GN) či vaskulitid (polyarteritis nodosa, kryoglobulinemická vaskulitida). Ačkoli přesný patogenetický mechanizmus jejich vzniku není znám, předpokládá se, že se na něm mohou uplatňovat některé z odhalených patologických procesů u pacientů s HBV infekcí, jako jsou depozice HBV-asociovaných imunitních komplexů, HBV replikace v renálním tubulárním epitelu či HBV-asociovaná inzulinová rezistence. Některé recentní studie především z asijských zemí prokázaly, že u pacientů s chronickou HBV infekcí a pozitivním HBsAg je vyšší incidence a prevalence CKD, projevujících se sníženou hodnotou glomerulární filtrace (GF) a/či proteinurií [4]. Je nepochybné, že pro snížení výskytu HBV infekce s jejími hepatálními i extrahepatálními projevy jsou klíčová především preventivní opatření, vč. vakcinace, a u pacientů postižených HBV poskytnutí dostupné účinné antivirotické léčby [5].
Infekce virem hepatitidy C
Cirhóza na podkladě chronické infekce virem hepatitidy C (HCV) je významnou příčinou mortality a morbidity. Podobně jako u chronické infekce HBV je u HCV infekce zřetelná dvojí vazba mezi HCV infekcí, resp. HCV hepatitidou a CKD – na jedné straně může HCV infekce vyvolat CKD jako jednu z řady dalších extrahepatálních projevů, mechanizmem tvorby a ukládání imunokomplexových depozit (smíšená kryoglobulinemie) v renální matrici či dalšími imunopatologickými mechanizmy spojenými se vznikem GN. Charakteristický typ ledvinného onemocnění představuje membranoproliferativní GN, ačkoli jiné typy GN se rovněž vyskytují (membranózní GN, fokálně segmentální glomeruloskleróza) [6]. Navíc byl u nemocných s HCV pozitivitou prokázán negativní vliv na progresi CKD [7]. Na druhé straně může být CKD pokročilejšího stupně, a chronické selhání ledvin (CHSL) zvláště, rizikovým faktorem pro vznik chronické hepatitidy C. Komplexními hygienickými a léčebnými opatřeními se do současnosti v ČR podařilo téměř úplně dosáhnout „mikroeliminace“ HCV mezi dialyzovanými pacienty a díky rozvoji přímo působících antivirových léčiv (DAA – direct antiviral agent), které vedou k trvalé eliminaci HCV, byl u případně infikovaného příjemce vyřešen přenos HCV od infikovaného dárce ledviny.
První ucelenou iniciativu určenou pro prevenci, diagnostiku a léčbu HCV u CKD představoval dokument Kidney disease: improving global outcomes (KDIGO) guideline, publikovaný v roce 2008. Nejnovější verze, která zahrnuje poznatky o nové terapeutické možnosti – skupině DAA – byla publikována v roce 2018 (tab. 1) [8]. Rozvoj léčby DAA probíhá natolik intenzivně, že i tato recentně publikovaná doporučení jsou v některých ohledech překonána (např. HCV je preferenčně léčena pangenotypovými režimy a bez ovlivnění virovou náloží) [9].
Infekce virem hepatitidy E
Infekce virem hepatitidy E (HEV) byla nově rozpoznána až v 70. letech 20. století. Původně se předpokládalo, že HEV infekce postihuje výhradně rozvojové země, kde HEV způsobuje rozsáhlé epidemie se závažnou morbiditou a mortalitou, ukazuje se však, že HEV se může vyskytovat i v rozvinutých zemích. Cesty přenosu se liší v závislosti na genotypu (GT) a oblasti rozšíření – v endemických oblastech dochází k přenosu výhradně humánních GT (HEV1, HEV2) kontaminovanou vodou, v rozvinutých zemích jsou pozorovány sporadické případy zoonotických GT HEV (HEV3, HEV4) šířené pravděpodobně potravní cestou. Infekce HEV obvykle probíhá pod obrazem akutní hepatitidy různé závažnosti, provázené v některých případech extrahepatálními projevy, především neurologickými, hematologickými a renálními. HEV-asociované renální onemocnění bylo pozorováno především u GT HEV3, zahrnovalo různé typy GN; podobně jako u HCV infekce byla častým nálezem kryoglobulinemická GN. V ojedinělém případu byla popsána izolace HEV RNA z kryoprecipitátu pacienta postiženého HEV-kryoglobulinemickou GN [10]. Klíčovou strategií prevence přenosu HEV infekce v našich podmínkách je dostatečná tepelná úprava masa rizikových zvířat.
Renální komplikace cirhózy jater
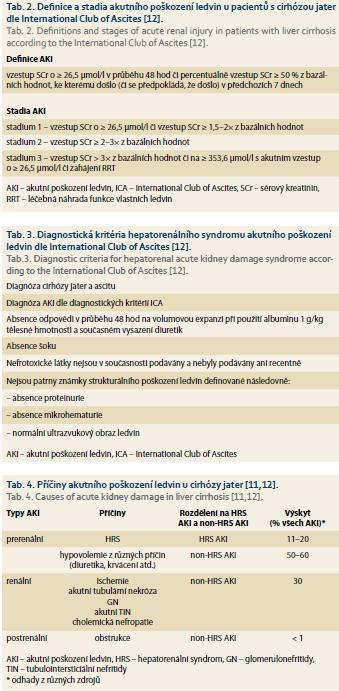
Porucha funkce u pacientů s cirhózou je velmi častá a je spojena s vysokou morbiditou a mortalitou. Příčiny renálního postižení bývají běžně multifaktoriální, mechanizmy jejich vzniku nejsou často plně objasněny a specifická léčba je limitovaná [11]. Historicky se u pacientů vyšetřovaných a léčených pro AKI na pozadí CLD s ascitem považoval za příčinu AKI – pokud byla vyloučena organická onemocnění ledvin – hepatorenální syndrom (HRS). HRS se dále dělil na HRS typu I, u kterého dochází k poklesu renálních funkcí v průběhu dnů až týdnů, a HRS typu II, u kterého probíhá pokles renálních funkcí v řádu měsíců. Recentně byla odbornou organizací International Club of Ascites navržena nová klasifikace akutního renálního postižení v rámci LC (tab. 2) a nová definice HRS (tab. 3) [12], které lépe odrážejí klinický scénář a jsou v souladu se současně uznávanou terminologií a klasifikací AKI a CKD [13,14]. Patofyziologickou podstatou HRS jsou hemodynamické změny, které jsou primárně vyvolané portální hypertenzí v rámci LC a které se komplexními mechanizmy přenášejí na ledviny. Výrazná splanchnická vazodilatace podmíněná portální hypertenzí a produkcí potentních splanchnických vazodilatačních látek způsobuje pokles systémové cévní rezistence a snížení objemu efektivně cirkulující krve; tyto změny jsou pouze přechodně kompenzovány poklesem krevního tlaku a zvýšením srdečního výdeje. Aktivace systému renin-angiotensin-aldosteron a sympatického nervového systému jsou spojeny s retencí vody a sodíku, vývojem ascitu a intenzivní renální vazokonstrikcí vedoucí k hypoperfuzi ledvin [15,16]. V patogenezi HRS se také nově zdůrazňuje možné působení systémové zánětlivé reakce projevující se mimo jiné zvýšenou produkcí řady prozánětlivých faktorů a cytokinů (C-reaktivní proteinu, tumor necrosis factoru α, interleukinu 6). Tato systémová zánětlivá reakce může souviset s bakteriální infekcí či sepsí, avšak lze ji prokázat i u pacientů s pokročilou LC bez přítomnosti bakteriální infekce a lze uvažovat o jejich možném negativním působení na systémovou cirkulaci a perfuzi ledvin [16,17].
AKI se vyskytuje u 25–50 % všech cirhotických pacientů přijímaných k hospitalizaci po epizodě akutní dekompenzace [18]. AKI je spojena s vysokou mortalitou, jelikož část pacientů umírá v průběhu hospitalizace a v delším časovém horizontu dosahuje 12měsíční mortalita až 63 % [19]. Pro úspěšnou léčbu AKI je klíčové včasné rozpoznání AKI a příčiny AKI (tab. 2–4); diagnostika a diferenciální diagnostika AKI v rámci dekompenzované LC však může být z řady důvodů obtížná. Vyšetření funkce ledvin je u cirhotických pacientů zatíženo vyšším počtem nepřesností než u běžné populace. Nejrozšířenějším parametrem pro stanovení renálních funkcí a posouzení GF zůstává sérový kreatinin (SCr) a odvozené rovnice odhadu GF (CKD-EPI, MDRD), avšak u pacientů s cirhózou je kromě běžných limitací (vliv věku, pohlaví, rasy, svalové hmoty) nutno počítat s nadhodnocením GF z důvodu snížené produkce kreatininu játry, relativní kachexie a snížené produkce kreatininu svaly a falešně nižšími výsledky měření v případě hyperbilirubinemie [20]. K variacím hodnot SCr navíc mohou významně přispět změny distribučního objemu (hypervolemie či změny v objemu tekutin po paracentéze či diuretické léčbě apod.), ke kterým u pacientů s LC často dochází [21]. Další běžné metody stanovení GF – kreatininová clearance či stanovení sérové koncentrace cystatinu – mají u pacientů s cirhózou rovněž své limitace, a proto jsou vyvíjeny nové alternativní metody stanovení GF [22,23]. Nové biomarkery AKI (např. neutrofilní gelatináza-asociovaný lipocalicin) dosud nepředstavují pro diagnostiku a diferenciální diagnostiku AKI a potažmo HRS AKI u pacientů s cirhózou významnější přínos [21]. Ačkoli jediným definitivním řešením HRS je LT, mohou být některé terapeutické zákroky úspěšné v prevenci a léčbě epizod HRS. Patří mezi ně především úprava efektivního cirkulujícího objemu (albumin aj.), vazokonstrikční léčba (terlipressin, norepinefrin aj.), vytvoření transjugulárního portosystémového shuntu a léčebná náhrada funkce vlastních ledvin (RRT – renal replacement therapy) [16,21].
Úspěšná léčba ostatních příčin AKI v rámci LC (tzv. non-HRS AKI) vyžaduje včasné určení příčiny AKI a použití adekvátního léčebného postupu v závislosti na konkrétním typu AKI. Přitom je třeba počítat s tím, že jednotlivé typy AKI se mohou významně vyvíjet (např. přechod hypovolemického a hypoperfuzního poškození do akutní tubulární nekrózy) a kombinovat.
Ačkoli se v minulosti u pacientů s LC věnovala pozornost především akutním typům ledvinného postižení a HRS zvláště a výskyt CKD se považoval za vzácný [24], nyní se odhaduje, že CKD je přítomno až u 13 % pacientů hospitalizovaných s LC [25]. Příčiny CKD u pacientů s cirhózou nebyly dosud detailně studovány, avšak lze předpokládat, že se jako u běžné populace projevuje především ledvinné postižení v rámci diabetes mellitus (DM) a arteriální hypertenze (AH). Je velmi pravděpodobné, že řada pacientů původně označovaných jako pacienti s HRS II byli ve skutečnosti pacienti s CKD (dle definice CKD = strukturální či funkční postižení ledvin trvající déle než 3 měsíce, KDIGO), případně pacienti s CKD a nasedající AKI. Některé novější práce prokazují, že výskyt CKD u pacientů s LC je spojen s přítomností refrakterního ascitu a dalšími prognosticky negativními parametry a pacienti s CKD představují vysoce rizikovou skupinu, které by měla být věnována zvýšená pozornost [24].
Chronické onemocnění ledvin u nealkoholové tukové choroby jater
NAFLD je onemocnění vyznačující se abnormálním nahromaděním tuku v játrech při nepřítomnosti jiné vyvolávající příčiny (nadměrná konzumace etylu, léků či jiné onemocnění jater). Steatóza jater je definována přítomností tuku v > 5 % hepatocytů. Za určitých podmínek dojde k zánětlivé reakci jaterního parenchymu (NASH – nealkoholická steatohepatitida) s rizikem fibrotizace a vývojem do cirhózy [26]. Za značné rozšíření NAFLD je nepochybně odpovědný především životní styl v moderní civilizaci a v současnosti se NAFLD považuje za jaterní komponentu metabolického syndromu. Většina pacientů s NAFLD je obézních, častý je výskyt DM, AH a dyslipidemie. NAFLD probíhá obvykle bez klinických příznaků, jedinou biochemickou abnormitou může být mírný vzestup jaterních testů; vhodnou diagnostickou metodu představuje ultrazvukové vyšetření (obraz „světlých jater“). Výskyt NAFLD je mimořádně vysoký – na podkladě vyšetření zobrazovacími metodami je NAFLD diagnostikována asi u čtvrtiny evropské a severoamerické populace [27]. NAFLD je intenzivně studována – jednak proto, že se postupně stává nejčastější příčinou CLD [28], a dále proto, že je spojena s vysokým výskytem kardiovaskulárního onemocnění a CKD [29]. Z metaanalýz desítek klinických studií vyplývá, že výskyt CKD je u pacientů s NAFLD zvýšen přibližně dvojnásobně, přičemž u pacientů s NASH se tato vazba projevuje ještě silněji [26,29]. Jaký konkrétní typ renálního onemocnění ve stadiu CKD je u pacientů s NAFLD zvýšen, však není známo a patofyziologické mechanizmy, které mohou podmiňovat tuto asociaci, zůstávají ve stadiu hypotéz [29]. Z hlediska diagnostického je důležité věnovat zvýšenou pozornost možným příznakům a projevům CKD u nemocných s NAFLD; specifická doporučení pro prevenci či léčbu CKD v kontextu NAFLD nebyla formulována [29].
Onemocnění ledvin po transplantaci ledvin
Transplantace ledvin (LT) je v současnosti standardní léčebnou metodou vyznačující se dlouhodobou úspěšností. AKI a CKD jsou běžnými komplikacemi u pacientů s pokročilým onemocněním jater, kteří jsou v čekací listině na LT, a také u pacientů, kteří LT podstoupili, a to přes skutečnost, že se jejich výskyt udává ve velmi širokém rozmezí [30]. Prevalence AKI u pacientů v čekací listině na LT se odhaduje na 25–50 % a prevalence CKD 30–90 % [31]. Za vysokou variabilitu v těchto údajích alespoň částečně odpovídají současné používané diagnostické metody, které nepřesně vyhodnocují funkci ledvin v kontextu pokročilého onemocnění jater (např. LC), dalším pravděpodobným zdrojem variability je nejednotnost v použité terminologii ledvinného a jaterního postižení. V 90. letech 20. století Nair et al odhadovali přítomnost snížené GF na 33 % příjemců transplantovaných jater a prokázali, že u pacientů s eGF < 40 ml/min/1,73 m2 je krátkodobé i dlouhodobé přežívání významně snížené [32]. Ve snaze snížit mortalitu pacientů nejzávažněji postižených pacientů v čekací listině na LT byl v roce 2002 v USA přijat model orgánové alokace označený jako MELD (Model for End-stage Liver Eisease) upřednostňující pacienty s vysokým předpokládaným stupně mortality v průběhu 3 měsíců. Model MELD predikuje mortalitu na podkladě 4 proměnných: hodnoty SCr, celkového bilirubinu, INR a přítomnosti RRT [33]. Model MELD se stal hlavním mechanizmem alokace orgánů v USA a dalších zemích a jeho přijetí mělo za následek určité zvýhodnění pacientů v čekací listině s poruchou funkce ledvin [34] a vzestupu LT u pacientů se zvýšenou hodnotou SCr, pacientů s CHSL léčených dialyzační léčbou a pacientů, u kterých byla provedena kombinovaná transplantace jater a ledvin. Z retrospektivních analýz vyplynulo, že navzdory přijatým alokačním kritériím MELD lze u pacientů po LT pozorovat vysoký výskyt AKI a CKD, které mohou progredovat do CHSL a zvyšují riziko ztráty LT [35,36]. Významný nezávislý faktor pro predikci vývoje CKD v potransplantačním období představuje především snížená hodnota GF v období před LT [37]. Výsledky řady klinických studií naznačují, že na vývoji CKD v potransplantačním období se komplexním způsobem mohou podílet faktory z pretransplantačního období (narušená hemodynamika ledvin u pacientů s dekompenzovanou LC), perioperační (hypovolemie a hypoperfuze ledvin) a z postoperačního období (imunosupresivní látky – zvl. kalciumneurinové inhibitory, AH, DM, další epizody AKI) [36,38]. Některé nově vyvinuté skórovací systémy komplexně zahrnující větší počet rizikových faktorů nezávisle asociovaných s vývojem CHSL umožňují lépe predikovat riziko CKD po LT [39]. Pro klinickou praxi vyplývá nezbytnost věnovat obecně pozornost projevům renálního poškození v pre-i potransplantačním období a snažit se omezit veškeré rizikové faktory, které mohou vést k jejich vzniku. K lepšímu pochopení patofyziologie renálních komplikací po LT může nepochybně přispět adekvátní volba metody měření renálních funkcí a užití standardní terminologie pro označení typu a závažnosti ledvinného postižení.
Doručeno/Submitted: 13. 5. 2019
Přijato/Accepted: 10. 6. 2019
prof. MUDr. Miroslav Merta, CSc.
Ústav biologie a lékařské genetiky 1. LF UK a VFN Praha
Purkyňův ústav
Albertov 4
128 00 Praha 2
mirek.merta@seznam.cz

Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Coelho S, Fonseca JN, Gameiro J et al. Transient and persistent acute kidney injury in acute liver failure. J Nephrol 2019; 32 (2): 289–296. doi: 10.1007/s40620-018-00568-w.
2. Pyrsopoulos NT, Reddy KR. Extrahepatic manifestations of chronic viral hepatitis. Curr Gastroenterol Rep 2001; 3 (1): 71–78.
3. Cho EJ, Kim SE, Suk KT et al. Current status and strategies for hepatitis B control in Korea. Clin Mol Hepatol 2017; 23 (3): 205–211. doi: 10.3350/cmh.2017.0104.
4. Kim SE, Jang ES, Ki M et al. Chronic hepatitis B infection is significantly associated with chronic kidney disease: a population-based, matched case-control study. J Korean Med Sci 2018; 33 (42): e264. doi: 10.3346/jkms.2018.33. e264.
5. Husa P, Šperl J, Urbánek P et al. Doporučený postup diagnostiky a léčby infekce virové hepatitidy B. Gastroenterol Hepatol 2017; 71 (5): 419–437. doi: 10.14735/amgh2017419.
6. Cottone C, Bhamidimarri KR. Evaluating CKD/ESRD patient with hepatitis C infection: how to interpret diagnostic testing and assess liver injury. Semin Dial 2019; 32 (2): 119–126. doi: 10.1111/sdi.12760.
7. Lee JJ, Lin MY, Chang JS et al. Hepatitis C virus infection increases risk of developing end-stage renal disease using competing risk analysis. PLoS One 2014; 9 (6): e100790. doi: 10.1371/journal.pone.0100790.
8. KDIGO 2018 clinical practice guideline for the prevention, diagnosis, evaluation, and treatment of hepatitis C in chronic kidney disease. [online]. Available from: https: //www.kisupplements.org/article/S2157-1716 (18) 30005-4/fulltext.
9. Urbánek P, Fraňková S, Husa P et al. Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C (HCV). Gastroenterol Hepatol 2019; 73 (2): 101–125. doi: 10.14735/amgh2019101.
10. Guinault D, Ribes D, Delas A et al. Hepatitis E virus-induced cryoglobulinemic glomerulonephritis in a nonimmunocompromised person. Am J Kidney Dis 2016; 67 (4): 660–663. doi: 10.1053/j.ajkd.2015.10.022.
11. Amin AA, Alabsawy EI, Jalan R et al. Epidemiology, pathophysiology, and management of hepatorenal syndrome. Semin Nephrol 2019; 39 (1): 17–30. doi: 10.1016/j.semnephrol.2018.10. 002.
12. Angeli P, Ginès P, Wong F et al. Diagnosis and management of acute kidney injury in patients with cirrhosis: revised consensus recommendations of the International Club of Ascites. J Hepatol 2015; 62 (4): 968–974. doi: 10.1016/j.jhep.2014.12.029.
13. KDIGO clinical practice guideline for acute kidney injury. Kidney Int 2012; 2 (Suppl 1): 1–141.
14. KDIGO clinical practice guideline for the evaluation and management od chronic kidney disease. Kidney Int 2013; 3 (Suppl 1): 1–150.
15. Solé C, Solà E, Huelin P et al. Characterization of inflammatory response in hepatorenal syndrome: relationship with kidney outcome and survival. Liver Int 2019; 00: 1–10. doi: 10.1111/liv.14037.
16. Durand F, Graupera I, Ginès P et al. Pathogenesis of hepatorenal syndrome: implications for therapy. Am J Kidney Dis 2016; 67 (2): 318–328. doi: 10.1053/j.ajkd.2015.09.013.
17. Mehta G, Mookerjee RP, Sharma V et al. Systemic inflammation is associated with increased intrahepatic resistance and mortality in alcohol-related acute-on-chronic liver failure. Liver Int 2015; 35 (3): 724–734. doi: 10.1111/liv.12559.
18. Piano S, Rosi S, Maresio G et al. Evaluation of the acute kidney injury network criteria in hospitalized patients with cirrhosis and ascites. J Hepatol 2013; 59 (3): 482–489. doi: 10.1016/j.jhep.2013.03.039.
19. Fede G, D’Amico G, Arvaniti V et al. Renal failure and cirrhosis: a systematic review of mortality and prognosis. J Hepatol 2012; 56 (4): 810–818. doi: 10.1016/j.jhep.2011.10.016.
20. Francoz C, Nadim MK, Durand F. Kidney biomarkers in cirrhosis. J Hepatol 2016; 65 (4): 809–824. doi: 10.1016/j.jhep.2016.05.025.
21. MacDonald AJ, Nadim MK, Durand F et al. Acute kidney injury in cirrhosis: implications for liver transplantation. Curr Opin Crit Care 2019; 25 (2): 171–178. doi: 10.1097/MCC.0000000000 000590.
22. Mindikoglu AL, Dowling TC, Magder LS et al. Estimation of glomerular filtration rate in patients with cirrhosis by using new and conventional filtration markers and dimethylarginines. Clin Gastroenterol Hepatol 2016; 14 (4): 624–632. doi: 10.1016/j.cgh.2015.06.021.
23. Asrani SK, Jennings LW, Trotter JF et al. A model for glomerular filtration rate assessment in liver disease (GRAIL) in the presence of renal dysfunction. Hepatology 2019; 69 (3): 1219–1230. doi: 10.1002/hep.30321.
24. Wong F, Reddy KR, O’Leary JG et al. Impact of chronic kidney disease on outcomes in cirrhosis. Liver Transpl 2019; 25 (6): 870-880. doi: 10.1002/lt.25454.
25. Warner NS, Cuthbert JA, Bhore R et al. Acute kidney injury and chronic kidney dis-ease in hospitalized patients with cirrhosis. J Investig Med 2011; 59 (8): 1244–1251. doi: 10.2130/JIM.0b013e3182321471.
26. Younossi ZM. Non-alcoholic fatty liver dis-ease – a global public health perspective. J Hepatol 2019; 70 (3): 531–544. doi: 10.1016/j.jhep.2018.10.033.
27. Younossi ZM, Koenig AB, Abdelatif D et al. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology 2016; 64 (1): 73–84. doi: 10.1002/hep.28431.
28. Loomba R, Sanyal AJ. The global NAFLD epidemic. Nat Rev Gastroenterol Hepatol 2013; 10 (11): 686–690. doi: 10.1038/nrgastro.2013.171.
29. Targher G, Byrne CD. Non-alcoholic fatty liver disease: an emerging driving force in chronic kidney disease. Nat Rev Nephrol 2017; 13 (5): 297–310. doi: 10.1038/nrneph.2017.16.
30. Meraz-Muñoz A, García-Juárez I. Chronic kidney disease in liver transplantation: evaluation of kidney function. Rev Gastroenterol Mex 2019; 84 (1): 57–68. doi: 10.1016/j.rgmx.2018.07.002.
31. Charlton MR, Wall WJ, Ojo AO et al. Report of the first international liver transplantation society expert panel consensus conference on renal insufficiency in liver transplantation. Liver Transpl 2009; 15 (11): S1–S34. doi: 10.1002/lt.21877.
32. Nair S, Verma S, Thuluvath PJ. Pretransplant renal function predicts survival in patients undergoing orthotopic liver transplantation. Hepatology 2002; 35 (5): 1179–1185. doi: 10.1053/jhep.2002.33160.
33. Kamath PS, Wiesner RH, Malinchoc M et al. A model to predict survival in patients with end-stage liver disease. Hepatology 2001; 33 (2): 464–470. doi: 10.1053/jhep.2001.22172.
34. Sharma P, Schaubel DE, Guidinger MK. Impact of MELD-based allocation on end-stage renal disease after liver transplantation. Am J Transplant 2011; 11 (11): 2372–2378. doi: 10.1111/j.1600-6143.2011.03703.x.
35. Gonwa TA, McBride MA, Anderson K. Continued influence of preoperative renal function on outcome of orthotopic liver transplant (OLTX) in the US: where will MELD lead us? Am J Transplant 2006; 6 (11): 2651–2659. doi: 10.1111/j.1600-6143.2006.01526.x.
36. Thongprayoon C, Kaewput W, Thamcharoen N et al. Incidence and impact of acute kidney injury after liver transplantation: a meta-analysis. J Clin Med 2019; 8 (3): pii E372. doi: 10.3390/jcm8030372.
37. Sharma P, Welch K, Eikstadt R et al. Renal outcomes after liver transplantation in the model for end-stage liver disease era. Liver Transpl 2009; 15 (9): 1142–1148. doi: 10.1002/lt.21821.
38. Li Y, Li B, Wang W et al. Risk factors for new-onset chronic kidney disease in patients who have received a liver transplant. Exp Ther Med 2018; 15 (4): 3589–3595. doi: 10.3892/etm.2018.5823.
39. Sharma P, Goodrich NP, Schaubel DE et al. Patient-specific prediction of ESRD after liver transplantation. J Am Soc Nephrol 2013; 24 (12): 2045–2052. doi: 10.1681/ASN.2013040436.