Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku a medikamentózní léčbu ulcerózní kolitidy
Martin Bortlík1, Dana Ďuricová2, Aleš Novotný Orcid.org 3, Pavel Drastich4, Václav Mandys5, Petra Mináriková Orcid.org 6, Barbora Pipek7, Ivana Mikoviny-Kajzrlíková8, Lenka Nedbalová9, Jana Koželuhová Orcid.org 10, Naděžda Machková2, Lucie Prokopová Orcid.org 11, Pavel Kohout Orcid.org 12, Zuzana Šerclová Orcid.org 13, Martin Vašátko2, Tomáš Douda Orcid.org 14, Jiří Stehlík Orcid.org 15, Karel Mareš Orcid.org 16, Milan Lukáš2, Vladimír Zbořil Orcid.org 11, Petra Matějková17, Luděk Hrdlička17
+ Pracoviště
Úvod
Ulcerózní kolitida (UC) je chronické zánětlivé onemocnění postihující tlusté střevo v různém rozsahu od konečníku orálním směrem. Jeho příčina není známa, a většina pacientů proto vyžaduje dlouhodobou, mnohdy celoživotní medikamentózní léčbu a trvalé sledování. Cílem léčby je potlačení symp- tomů, eliminace zánětlivé aktivity ve sliznici střeva a normalizace kvality života postiženého jedince [1].
Výskyt UC v České republice stoupá, podobně jako je tomu v případě Crohnovy choroby [2]. Ačkoli statistická data neprokazují zvýšenou úmrtnost pacientů s UC, jde o onemocnění závažné [3]. V závislosti na aktivitě zánětu, efektivitě a toleranci léčby, délce trvání nemoci a výskytu komplikací ovlivňuje UC rodinný, profesní, partnerský i sociální život pacientů. Včasná a správná diagnostika tohoto onemocnění je proto nezbytným základem pro podání účinné léčby a snížení rizika dlouhodobých nepříznivých důsledků nemoci pro život pacientů.
V České republice je diagnostika a léčba UC v rukou specialistů – gastroenterologů. Od roku 1996 působí v rámci České gastroenterologické společnosti Pracovní skupina pro idiopatické střevní záněty (PS IBD), mezi jejíž dlouhodobé aktivity patří příprava doporučených postupů pro různé oblasti IBD. Většina z nich byla dosud věnována buď konkrétní skupině medikamentů používaných v léčbě střevních zánětů, nebo léčbě chirurgické. Ve shodě s aktuálním přístupem většiny odborných společností (ECCO, AGA) se však domníváme, že pro lékaře v běžné klinické praxi je výhodnější celkový pohled na dané onemocnění z hlediska jeho diagnostiky i léčby.
Problematika IBD doznala v posledních 20–30 letech významných změn, které se týkají především léčby těchto onemocnění [4]. Konvenční medikamentózní léčba je stále základem terapie u většiny pacientů s UC, tito nemocní proto obvykle zůstávají v péči ambulantních gastroenterologů. Těžší či komplikovaný průběh UC vede zpravidla k odeslání pacienta do specializovaného centra pro biologickou a inovativní léčbu IBD. Těchto pracovišť je v ČR již více než 30 a jejich počet dále narůstá. Je tedy zřejmé, že péči o pacienty s UC zajišťuje početná skupina lékařů, jejichž zkušenosti a erudice mohou být značně odlišné. Cílem předkládaných doporučení je tuto heterogenitu minimalizovat a nabídnout klinikům návod na diagnostický a léčebný postup u pacientů s UC odpovídající současnému stupni poznání.
Metodika
Při přípravě tohoto materiálu jsme postupovali podobně jako u předchozích doporučení: problematika byla rozdělena do několika okruhů, které byly zpracovány určenými členy Pracovní skupiny IBD. Ti vypracovali návrhy jednotlivých doporučení, které byly posléze diskutovány na jednáních Pracovní skupiny v červnu 2021 formou videokonference a prezenční formou v září 2021. Jednotlivé body doporučení byly přijímány jako konsenzuální stanovisko po schválení více než 70 % účastníků. V případě nedostatečného souhlasu pokračovala diskuze a příslušné stanovisko bylo upraveno tak, aby bylo dosaženo alespoň 70% shody. Pokud takové shody dosaženo nebylo, stanovisko bylo vyřazeno nebo nahrazeno novým. Při zpracování textu byla úroveň důkazů (EL – evidence level) v jednotlivých stanoviscích posouzena podle aktuální verze oxfordského Centra pro evidence-based medicine (OCEBM) z roku 2011 [5].
Vzhledem k tomu, že ve druhé polovině roku 2021 schválila Evropská léková agentura (EMA) dva nové léky pro terapii UC (ozanimod a filgotinib), byly oba zařazeny do těchto doporučení navzdory tomu, že v době vydání pro ně nejsou stanoveny indikační a úhradové podmínky Státním ústavem pro kontrolu léčiv. Ve stejné situaci se v době publikace těchto doporučení nachází ustekinumab. Ve všech případech ovšem platí, že takový lék je možno podat po schválení revizním lékařem příslušné zdravotní pojišťovny (dle § 16 zákona o veřejném zdravotním pojištění).
V důsledku velmi rychlého vývoje v oblasti idiopatických střevních zánětů se mohou některá předkládaná stanoviska v době jejich vydání již mírně odlišovat od aktuálního stavu poznání. Přesto věříme, že tato doporučení tvoří ucelený přehled o současných možnostech diagnostiky a léčby UC, který je v souladu s doporučeními publikovanými a prezentovanými v posledních letech na mezinárodních i domácích odborných fórech.
1. Diagnostika, diferenciální diagnostika a klasifikace
Symptomy
Stanovisko 1
Typickými symptomy aktivní UC jsou krvácení z konečníku, tenesmy, urgentní stolice a průjem. Časté jsou bolesti břicha, noční symptomy a únava. Intenzita obtíží obvykle koreluje s aktivitou a rozsahem zánětu ve střevě. U menší části pacientů se objevují mimostřevní projevy – axiální nebo periferní artropatie, episkleritida, uveitida, nodózní erytém nebo pyoderma gangrenosum. Nejzávažnější koincidující chorobou je primární sklerozující cholangitida (PSC) [EL5].
Ulcerózní kolitida je chronické zánětlivé onemocnění tlustého střeva, které postihuje stejně obě pohlaví a všechny věkové kategorie, nejčastěji je však diagnostikováno ve věku 20–40 let. V období aktivity jsou typickými symptomy krvácení z konečníku, tenesmy a průjem, intenzita průjmu obvykle souvisí s rozsahem zánětlivého postižení střeva. V klidové fázi (remisi) je pacient zpravidla bez obtíží, u části pacientů však mohou přetrvávat střevní symptomy (průjem, břišní diskomfort) i při absenci zánětlivé aktivity ve střevě. U pacientů s proktitidou malého rozsahu se může objevit zácpa. V 15 % případů je prvním projevem akutní těžká ataka UC projevující se bolestmi břicha, frekventní krvavou stolicí, horečkou a tachykardií. U většiny pacientů s UC je korelace mezi intenzitou obtíží a aktivitou zánětu velmi dobrá [6].
U 10–20 % pacientů s UC se objevují mimostřevní projevy zánětu. Nejčastěji jde o artritidu periferních kloubů (typ I – pauciartikulární, asymetrické postižení velkých kloubů akutní synovitidou, souvisí s aktivitou UC; typ II – polyartikulární, symetrické postižení malých kloubů ruky, nesouvisí s aktivitou UC) nebo axiální spondylartritidu. Kožní projevy v podobě nodózního erytému nebo pyoderma gangrenosum a projevy oční – episkleritida nebo závažnější uveitida jsou méně časté. Výskyt mimostřevních projevů je u pacientů s UC méně častý ve srovnání s Crohnovou chorobou, jejich přítomnost je obvykle signálem závažnějšího průběhu střevního zánětu [7]. Z prognostického hlediska je nejzávažnější koincidující chorobou PSC, která je významným rizikovým faktorem pro vznik cholangiokarcinomu a kolorektálního karcinomu [8].
Diagnostika
Stanovisko 2
Ke stanovení diagnózy UC je nezbytné zhodnotit anamnestické údaje a provést endoskopické vyšetření celého tlustého střeva s odběrem bioptických vzorků k histologickému vyšetření. Důležité je vyloučení infekční příčiny, změn vyvolaných léky, ischemií střeva nebo předchozím ozařováním. Vždy je nutno zvážit diagnózu Crohnovy choroby (CN). Iniciální laboratorní vyšetření krve a stolice je zaměřeno na posouzení zánětlivé aktivity, přítomnosti komplikací a důsledků zánětu na celkový stav pacienta [EL5].
Pro diagnózu UC je nezbytné posoudit nejen výše uvedené symptomy střevního zánětu, ale i další anamnestické údaje. Nejvýznamnějším rizikovým faktorem pro vznik UC je rodinná anamnéza IBD, zejména u prvostupňových příbuzných [9]. Je třeba odebrat cestovatelskou anamnézu, zjistit užívání léků v předchorobí (včetně volně prodejných, např. nesteroidních antirevmatik – NSA), zvážit možnost sexuálně přenosné infekce a změn vyvolaných přítomností divertiklů (tzv. segmentární kolitida asociovaná s divertikulózou – SCAD). U pacientů s předchozí aktinoterapií v oblasti malé pánve je častým projevem rektální krvácení. Riziko vzniku UC je mírně zvýšeno po ukončení kouření [10], naopak předchozí appendektomie pro appendicitidu se zdá být protektivní [11].
Laboratorní vyšetření v době diagnózy musí zahrnovat krevní obraz, základní biochemické parametry (minerály, ureu, kreatinin, transaminázy, alkalickou fosfatázu, gamaglutamyltransferázu, hladinu feritinu, C-reaktivní protein – CRP), vyšetření stolice (mikrobiologické kultivační vyšetření, fekální kalprotektin, antigen a toxin Clostridium difficile). Rutinní sérologické vyšetření perinukleárních protilátek proti cytoplazmě neutrofilů (pANCA) nebo protilátek proti Saccharomyces cerevisiae (ASCA) není pro diagnózu UC nezbytné, má okrajový význam v diferenciální diagnostice UC a CN [12].
Endoskopický obraz
Stanovisko 3
Pro diagnózu UC svědčí kontinuální zánětlivé změny na sliznici tlustého střeva od rekta orálním směrem, hranice mezi zánětlivou a normální sliznicí je obvykle ostrá. Charakteristickým nálezem je redukce až ztráta slizniční cévní kresby, erytém, hypersekrece hlenu, zvýšená kontaktní krvácivost přecházející v krvácivost spontánní, rozvoj drobných erozí a postupně i větších povrchových vředů [EL2].
Koloskopie je nejdůležitější vyšetření v diagnostice UC. Přestože diagnózu UC může odhalit i částečná koloskopie, pouze totální koloskopie může ověřit rozsah zánětu a posoudit případné změny v orální části tračníku a v terminálním ileu, které by mohly svědčit pro jiné onemocnění (např. CN). U dospělých pacientů s UC začínají zánětlivé změny již v anorektálním spojení, absence zánětu v rektu je vzácným nálezem, který je častější u dětí [13]. Velmi často se naopak setkáváme s nálezem periapendikulárního zánětlivého infiltrátu u pacientů s levostrannou UC [14], v praxi je tento nález často mylně interpretován jako projev CN. U léčených pacientů dochází k hojení zánětlivých změn, které se mohou stát diskontinuálními a vést rovněž k záměně s CN. V případě endoskopického nálezu stenózy je u pacientů s UC vždy nutno zvážit možnost neoplazie [15].
Histologický obraz
Stanovisko 4
Pro histologický obraz UC je typická bazální plazmocytóza, smíšený zánětlivý infiltrát v lamina propria mucosae (lymfocyty, plazmatické buňky, neutrofily), tzv. kryptitida a kryptové abscesy. Destrukce architektoniky slizničních krypt a deplece pohárkových buněk jsou projevem chronického zánětu a mohou přetrvávat i ve fázi remise [EL2].
Histologické vyšetření je důležitou součástí diagnostiky UC, jeho výsledek je však třeba hodnotit v kontextu ostatních nálezů a informací o pacientovi. Ke vstupnímu vyšetření by měly být odebrány vždy dva vzorky z jednotlivých etáží tlustého střeva a z terminálního ilea separátně do samostatných zkumavek [16]. Patolog by měl být informován o endoskopické aktivitě a lokalizaci každého vzorku, délce trvání nemoci a podávané léčbě. Typickým a časným histologickým nálezem je u pacientů s UC bazální plazmocytóza – přítomnost plazmatických buněk mezi bazemi krypt a slizniční svalovinou. Zánětlivý infiltrát následně postihuje sliznici v celé šíři, má smíšený charakter (lymfocyty, plazmatické buňky, neutrofily), zřídka zasahuje do povrchové vrstvy submukózy. Aktivitu zánětu vyjadřuje přítomnost neutrofilních leukocytů mezi epiteliálními buňkami krypt (tzv. kryptitida), popřípadě v lumen krypt (kryptové abscesy). Změny v architektonice krypt (nepravidelný průběh, větvení) jsou projevem chronického zánětu a jsou obvykle přítomny i ve stadiu klidovém (remise). Deplece pohárkových buněk a úbytek hlenu jsou nespecifickým, nicméně pomocným histologickým nálezem. S ohledem na důkazy o prospěšném vlivu histologického zhojení na další průběh UC považujeme za vhodné vyjadřovat histologický nález pomocí validovaného skóre (např. IBD-DCA nebo Nancy index) [16].
Klasifikace UC podle rozsahu
Stanovisko 5
Rozsah UC je definován jako maximální makroskopický rozsah zánětu verifikovaný koloskopickým vyšetřením. Podle rozsahu klasifikujeme UC jako proktitidu, levostrannou UC a extenzivní UC [EL5].
Pro stanovení rozsahu UC je nezbytné provedení totální koloskopie. Hranicí mezi proktitidou a levostrannou UC je vzdálenost 15 cm od anorektálního přechodu, levostranná kolitida nepřesahuje slezinné ohbí tračníku. Pokud zánětlivé změny dosahují orálně nad lienální flexuru, hovoříme o extenzivní UC. U třetiny až poloviny pacientů dochází v průběhu života k rozšíření zánětu na větší část tlustého střeva, tato extenze je významně častější u pacientů s počátkem nemoci v mladém věku [17].
Zhodnocení rozsahu UC má vliv na volbu léku i strategii léčby. Současně je důležitým faktorem pro rozhodnutí o zahájení dispenzárních koloskopických kontrol, které provádíme pouze u pacientů s levostrannou nebo extenzivní UC. U pacientů s proktitidou není riziko kolorektální neoplazie zvýšeno oproti běžné populaci [18].
Klasifikace UC podle aktivity
Stanovisko 6
Klinická a endoskopická klasifikace ovlivňují léčbu a sledování pacienta s UC [EL1]. V klinické praxi je vhodné používání endoskopického Mayo skóre, z klinických skórovacích systémů pak celkové nebo parciální Mayo skóre. U pacientů s vysokou aktivitou nebo fulminantním průběhem UC je vhodný index Truelova a Wittse nebo jeho modifikace – Montrealská klasifikace [EL5].
Vzhledem k tomu, že klinické projevy UC jsou relativně uniformní, jejich uspořádání do relevantního a klinicky využitelného skóre je podstatně jednodušší, než je tomu v případě CN. Nejen v klinických studiích, ale i v běžné klinické praxi je vhodným nástrojem endoskopické Mayo skóre, které je zároveň součástí celkového Mayo skóre [19]. Předností tohoto endoskopického indexu je jednoduchost a relativně nízká intra- a interindividuální variabilita, jeho nevýhodou je fakt, že nezohledňuje rozsah zánětu ve střevě. V kombinaci s klasifikací UC podle rozsahu je tato nevýhoda minimalizována. Novější alternativou endoskopického skóre je Ulcerative Colitis Endoscopic Index of Severity (UCEIS) [20]. Popisuje tři základní charakteristiky zánětu ve střevě – cévní kresbu, krvácení a přítomnost vředů nebo erozí. Tento index dobře koreluje s klinickými projevy a je validován, nicméně jde o index kompozitní a vyžaduje kalkulaci, byť poměrně triviální. Z tohoto důvodu je jeho implementace do běžné praxe obtížnější a většina pracovišť nadále využívá endoskopické Mayo skóre (tab. 1).
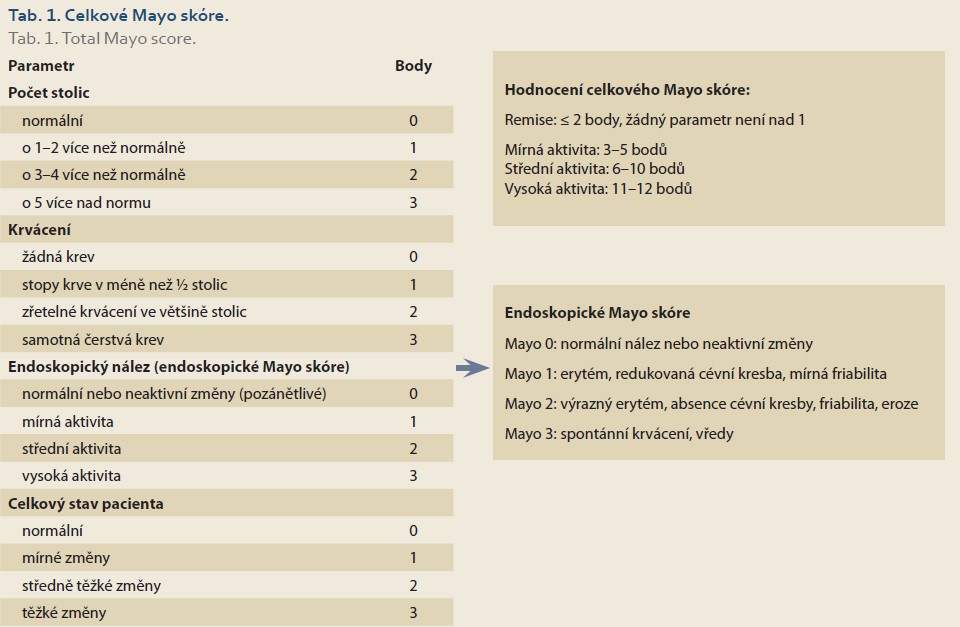
U pacientů s vysokou aktivitou UC je typická symptomatologie (krvavý průjem) doprovázená systémovou zánětlivou reakcí organizmu. Tento fakt dobře zohledňuje index Truelova a Wittse (tab. 2), který je vhodným nástrojem pro diagnostiku akutní těžké ataky UC [21]. Splnění podmínek – šest a více krvavých stolic denně – spolu s nejméně jedním parametrem systémového zánětu odpovídá diagnóze těžké ataky UC s nutností hospitalizace a zahájením tzv. záchranné terapie.

Biomarkery
Stanovisko 7
Klasické biochemické a hematologické markery zánětlivé aktivity (CRP, leukocyty) jsou u mírné a střední aktivity UC málo senzitivní, vhodné jsou v monitoraci akutní těžké ataky UC [EL5]. Koncentrace fekálního kalprotektinu dobře koreluje s endoskopickým nálezem a je také vhodným prediktorem hrozícího relapsu u pacienta v remisi [EL3].
Role biomarkerů v hodnocení zánětlivé aktivity UC je odlišná od CN. Až polovina pacientů s aktivní UC nemá zvýšené hladiny CRP, jehož senzitivita a negativní prediktivní hodnota jsou proto u pacientů s UC nízké [22]. Významnou roli má CRP pouze u pacientů s akutní těžkou atakou UC, obvykle nahrazuje hodnotu sedimentace erytrocytů v indexu Truelova a Wittse.
Fekální kalprotektin je vysoce senzitivním ukazatelem zánětlivé aktivity v tlustém střevu [23]. Je vhodný k iniciálnímu odlišení zánětlivého onemocnění a nezánětlivých chorob, např. dráždivého tračníku. Velmi dobře koreluje s endoskopickým nálezem, může být použit pro neinvazivní monitoring UC. Současně se ukázalo, že může být využíván i jako prediktor relapsu UC u nemocných v remisi. Vzestup hladiny kalprotektinu může předcházet až 2 měsíce klinický relaps zánětu.
2. Medikamentózní léčba
Terapeutické cíle
Stanovisko 8
U pacientů s UC je krátkodobým terapeutickým cílem symptomatická odpověď, střednědobým cílem je klinická remise a normalizace biomarkerů a dlouhodobým cílem je zhojení sliznice, normalizace kvality života a eliminace invalidity. Uvedených cílů by mělo být dosaženo bez dlouhodobé léčby systémovými kortikoidy [EL4].
Medikamentózní léčba je základem terapie UC. Jejím cílem je trvalá a hluboká (kompletní) remise, optimální kvalita života a minimalizace rizika invalidity. Terapeutické cíle ovšem musí reflektovat délku léčby, v tomto ohledu mezinárodní konsorcium STRIDE aktualizovalo své doporučení týkající se cílů léčby IBD z roku 2015 (STRIDE II) [24]. Součástí tohoto doporučení je také předpokládaná doba nezbytná k dosažení konkrétních terapeutických cílů pro jednotlivé lékové skupiny používané u pacientů s UC.
K dosažení terapeutických cílů je u většiny pacientů nezbytná trvalá medikamentózní léčba. Ukončení (přerušení) udržovací léčby lze zvážit v individuálních případech (lehký průběh, hluboká remise > 2 roky, proktitida-levostranná UC) [25]. I poté je vhodné pokračovat v klinických a laboratorních (fekální kalprotektin) kontrolách v intervalu 6–12 měsíců.
Zatímco pro CRP platí, že cílem léčby je normalizace tohoto biomarkeru, v případě fekálního kalprotektinu ukázala řada studií, že k normalizaci na hodnoty odpovídající zdravé populaci často nedochází ani při dosažení kompletního slizničního zhojení. Hranice „normy“ fekálního kalprotektinu se u pacientů s IBD pohybuje v rozmezí od 50 do 250 µg/g stolice [26]. Otevřenou otázkou zůstává také endoskopická remise, za kterou je mnoha autory považována kategorie 1 endoskopického Mayo skóre. Ta nicméně odpovídá minimálním zánětlivým změnám a „skutečnou“ remisi představuje pouze kategorie Mayo 0 [24,27]. Pro fekální kalprotektin i endoskopický nález ovšem platí, že v klinické praxi je často důležitější dynamika nálezu než absolutní hodnota biomarkeru nebo endoskopického nálezu.
a) Indukční léčba
Proktitida
Stanovisko 9
Topická forma mesalazinu ve formě čípku v dávce 1 g denně je první linií léčby proktitidy. Při nedostatečné terapeutické odpovědi je indikována léčba kombinací topického mesalazinu v dávce 1 g denně s perorálním mesalazinem v dávce 4 g denně, event. s topickými nebo systémovými kortikoidy [EL2].
Lokální mesalazin je účinnější než perorálně podávané aminosalicyláty nebo lokální kortikoidy [EL1].
Refrakterní proktitida je definována jako zánět neodpovídající na plnou dávku perorálních systémových kortikoidů. Další léčebnou možností jsou intravenózní kortikoidy, nebo biologika (preferenčně infliximab) [EL4].
Topický mesalazin je první linií léčby proktitidy. Čípky jsou vhodnější než nálevy, protože lépe distribuují léčivo na místo zánětu, léčba je tedy efektivnější a jsou pacienty lépe tolerovány. Topická léčba mesalazinem v dávce nad 1 g denně není spojena s vyšší účinností. Dávka 1× denně je stejně účinná jako rozdělená dávka, zvyšuje však adherenci pacientů k léčbě [28,29]. Topicky podávané aminosalicyláty jsou u proktitidy účinnější než perorálně podávané aminosalicyláty [30].
Kombinace perorální a topické formy mesalazinu je účinnější než samotná topická léčba a je indikována u pacientů s nedostatečnou terapeutickou odpovědí na lokální terapii [31]. Kombinace nebo střídání topického mesalazinu a topických steroidů je možností volby při selhání výše uvedené kombinované terapie.
Lokální mesalazin je účinnější než lokální kortikosteroidy v dosažení klinické, endoskopické a histologické remise [32]. Proto by lokální kortikosteroidy měly být podávány pacientům, kteří mají nedostatečnou odpověď na mesalazin nebo danou topickou léčbu netolerují.
Levostranná a extenzivní UC
Stanovisko 10
Mírná až středně aktivní UC by měla být léčena kombinovanou léčbou aminosalicylátovým klyzmatem v dávce ≥ 1 g/den v kombinaci s perorálním mesalazinem ≥ 4 g/den. Budesonid MMX 9 mg/den lze zvážit u pacientů s mírnou až středně aktivní UC, kteří netolerují terapii aminosalicyláty nebo při ní relabují [EL2].
Kombinovaná léčba je účinnější než samotná perorální nebo lokální léčba aminosalicyláty nebo kortikoidy. Podávání mesalazinu v jedné denní dávce je stejně účinné ve srovnání s rozděleným dávkováním [EL1].
Systémové kortikosteroidy v dávce 1 mg prednisonu/1 kg hmotnosti jsou vhodné u pacientů se středně těžkou až těžkou aktivitou a u pacientů s mírnou aktivitou, kteří nereagují na léčbu mesalazinem nebo budesonidem MMX [EL1].
Kombinovaná perorální a topická léčba mesalazinem je léčbou první linie pro mírně až středně aktivní levostrannou a extenzivní UC. Kombinovanou léčbou je dosaženo časnější remise ve srovnání se samostatně podávaným mesalazinem [33].
Perorálně podávaný mesalazin není účinnější než perorální sulfasalazin, mesalazin je ale pacienty lépe tolerován. Není rozdíl v účinnosti mesalazinu podávaného jednou denně nebo ve více denních dávkách, jedna denní dávka však zlepšuje adherenci pacientů k léčbě [34]. Subanalýza randomizované studie navíc prokazuje vyšší účinnost granulátu mesalazinu podávaného v dávce 3 g jednou denně vs. dávka 3 × 1 g [35]. Dávky > 2 g denně vedou k remisi časněji než dávky nižší, pacienti se středně aktivním onemocněním mohou profitovat z dávky 4–4,8 g/den [36]. Metaanalýza několika studií prokazuje vyšší účinnost mesalazinu ve formě perorálního granulátu ve srovnání s tabletami s pH dependentním obalem [37].
U pacientů, u nichž je léčba mesalazinem neúčinná, je indikován MMX budesonid v dávce 9 mg denně, opět v kombinaci s rektální formou mesalazinu. Pokud nedojde k odpovědi na tuto léčbu během 2–4 týdnů, jsou indikovány systémové kortikosteroidy – prednison 1 mg/kg denně (nebo ekvivalent). Stejná léčba, tedy prednison 1 mg/kg denně, je nutná v terapii vysoce aktivní UC. Postupná redukce systémových kortikosteroidů začíná po 1–2 týdnech od zahájení léčby v závislosti na odpovědi, celková délka podávání by neměla překračovat dobu 3–4 měsíců.
Kortikodependence nebo neúčinnost systémových kortikosteroidů jsou indikací k podání biologické léčby, tofacitinibu, ozanimodu nebo filgotinibu [38–40].
Kortikodependentní UC
Stanovisko 11
Pacienti s kortikodependentním průběhem nemoci by měli být léčeni thiopuriny [EL2], anti-TNFα preparáty (infliximab preferenčně v kombinaci s thiopuriny) [EL1], vedolizumabem, tofacitinibem, ustekinumabem, ozanimodem nebo filgotinibem [EL3]. V případě selhání léčby následuje léčba druhé linie jiným anti-TNFα preparátem, vedolizumabem, tofacitinibem, ustekinumabem, ozanimodem nebo filgotinibem, event. je třeba zvážit kolektomii [EL5].
Za kortikodependentní považujeme takový průběh onemocnění, kdy dávku prednisonu nelze snížit < 10 mg/den během 3 měsíců od zahájení léčby nebo dojde k relapsu UC do 3 měsíců od ukončení léčby systémovými kortikoidy [41]. Azathioprin je v této situaci lékem volby, pokud jej pacient toleruje a není kontraindikován. Léčba systémovým kortikoidem a azathioprinem se musí překrývat do doby nástupu účinku azathioprinu (3–6 měsíců). Remise bez kortikoidů je při léčbě azathioprinem popisována v 55 %, 52 % a 45 % v 12., 24. a 36. týdnu [42].
Všechny dostupné anti-TNFα preparáty jsou efektivní v dosažení a udržení remise bez kortikosteroidů u pacientů, kteří v úvodu kortikosteroidy dostávali [43]. Obdobné výsledky byly potvrzeny i u druhé generace biologik – vedolizumabu a ustekinumabu [44,45], stejně jako v případě malé molekuly – tofacitinibu [46]. Nejnovějšími léky schválenými Evropskou lékovou agenturou pro léčbu UC jsou ozanimod, agonista receptoru pro sfingosin-1-fosfát (S1P), který sekvestruje aktivované lymfocyty v lymfatických uzlinách mimo oblast zánětu [47], a filgotinib [48], selektivní inhibitor Janusovy kinázy 1 (JAK-1). Porovnání účinnosti jednotlivých biologik a malých molekul je možné pouze formou tzv. síťové metaanalýzy, nebo observačních kohortových studií s použitím tzv. „propensity score matching“ studijních populací, přímé srovnávací studie (tzv. head-to-head studie) chybí. Výjimkou je studie Varsity, která porovnávala efektivitu vedolizumabu a adalimumabu u pacientů se středně a vysoce aktivní UC [49]. Vedolizumab byl efektivnější v dosažení klinické remise a endoskopického zlepšení po 1 roce léčby, hodnocení klinické remise bez kortikoidů vyznělo lépe pro adalimumab.
Kortikorefrakterní UC
Stanovisko 12
U pacientů s aktivní UC refrakterní na perorální kortikosteroidy je nutno vyloučit infekční komplikace (cytomegalovirus a Clostridium difficile) [EL5]. V další léčbě jsou vhodné intravenózně podávané kortikosteroidy nebo anti-TNFα preparáty, vedolizumab, tofacitinib, ustekinumab, ozanimod nebo filgotinib [EL3]. Druhá léčebná linie zahrnuje jiný anti-TNFα preparát, vedolizumab, tofacitinib, ustekinumab, ozanimod nebo filgotinib. Měli bychom zvažovat i kolektomii [EL5].
U pacientů s aktivní UC refrakterní na perorální kortikosteroidy bychom měli vyloučit především infekční komplikace – cytomegalovirovou (CMV) infekci a infekci Cl. difficile. K detekci CMV slouží běžný bioptický vzorek fixovaný ve formolu, ideálně odebraný z okraje vředu [50].
U pacientů refrakterních k perorálním kortikosteroidům je možnost podání intravenózních kortikosteroidů. Nevýhodou je nutnost hospitalizace a vznik časné kortikodependence téměř u poloviny pacientů [51].
Všechny anti-TNFα preparáty, vedolizumab, ustekinumab a tofacitinib prokázaly benefit u pacientů užívajících v úvodu kortikosteroidy. Stejně tomu bylo ve studiích s novými perorálními léky – ozanimodem a filgotinibem. Všechny studie zahrnovaly též pacienty refrakterní na kortikosteroidy, ovšem nebylo vždy možné odlišit, kteří pacienti byli kortikodependentní a kteří refrakterní [43–48].
UC refrakterní na imunosupresiva (včetně intolerance)
Stanovisko 13
Pacienti s aktivní UC refrakterní na thiopurinová imunosupresiva nebo ti, kteří thiopuriny netolerují, by měli být léčeni anti-TNFα preparáty ([EL1], vedolizumabem, tofacitinibem, ustekinumabem, ozanimodem nebo filgotinibem [EL3]. Druhá léčebná linie zahrnuje jiný anti-TNFα preparát, vedolizumab, tofacitinib, ustekinumab, ozanimod nebo filgotinib. Měli bychom zvažovat i kolektomii [EL5].
Neúčinnost nebo intolerance thiopurinů je u pacientů s UC jednou z hlavních indikací k podání biologické léčby nebo inovativních malých molekul [38,43]. Infliximab, adalimumab, golimumab, vedolizumab i ustekinumab prokázaly efektivitu u pacientů refrakterních na thiopuriny. Lze použít i tofacitinib, ozanimod nebo filgotinib [43–48].
b) Udržovací léčba
Aminosalicyláty
Stanovisko 14
Aminosalicyláty jsou vhodné k udržovací léčbě u pacientů s mírnou a středně těžkou UC, u nichž byla remise navozena aminosalicyláty, budesonidem a výjimečně i systémovými kortikoidy (první ataka, dlouhý interval mezi relapsy) [EL1]. Rektální formy jsou vhodné u distálních forem UC při dobré toleranci léčby, kombinovaná léčba mesalazinem (orální a rektální) je vhodná při nedostatečném efektu monoterapie [EL1].
Optimální dávka mesalazinu v udržovací léčbě je 2 g denně nebo více v jedné denní dávce. U pacientů s častými relapsy (> 3/rok) a extenzivní UC mohou být efektivnější vyšší dávky. Minimální udržovací dávka rektální formy mesalazinu jsou 3 g týdně [EL1].
Data z Cochranovy databáze ukazují, že udržovací léčba perorálními aminosalicyláty snižuje riziko relapsu přibližně o 30 % oproti placebu [52]. Rovněž rektální forma mesalazinu je účinná v udržovací léčbě proktitidy nebo proktosigmoiditidy. Efektivita udržovací léčby může být významně snížena non-adherencí pacienta, její hodnocení je proto nutnou součástí léčebného režimu. Podávání léku v jedné dávce zlepšuje adherenci ve srovnání s více denními dávkami, současně je bezpečné a účinné. Při udržovací léčbě 5-ASA je doporučena kontrola renálních funkcí 1× ročně [53].
Thiopuriny
Stanovisko 15
Indikací k podávání thiopurinů je intolerance nebo nedostatečný efekt aminosalicylátů [EL5] v udržovací léčbě UC a kortikodependence [EL2]. Výjimečně jsou thiopuriny vhodné k udržení remise navozené cyklosporinem [EL3]. Doporučená dávka je 2–2,5 mg/kg AZA a 1–1,5 mg/kg 6-MP. Thiopuriny nejsou vhodné u pacientů starších 60 let, nemocných s anamnézou malignity a pacientů EBV (virus Epsteina a Barrové) negativních, zejména mladých mužů [EL5].
Azathioprin je efektivní v udržovací léčbě UC u pacientů kortikodependentních i pacientů netolerujících mesalazin; relativní riziko pro udržení remise je 1,59 ve srovnání s placebem [1]. Thiopuriny nemají žádný efekt v indukční fázi léčby, vzhledem k pomalému nástupu jejich účinku je proto nezbytné jejich současné podávání s účinnou indukční léčbou do doby nástupu jejich účinku. Thiopuriny zvyšují riziko lymfoproliferativních onemocnění (zejména non-hodgkinských lymfomů), nejvyšší absolutní riziko je u pacientů starších 65 let [54] Vzhledem k potřebě jejich dlouhodobého podávání nedoporučujeme zahajovat léčbu u pacientů ve věku 60 let a starších. Ukončení léčby thiopuriny u pacientů, kteří dosáhnou věku 60 let, je třeba zvážit individuálně, riziko relapsu v následujících 5 letech se pohybuje kolem 30 % [55]. Thiopuriny zvyšují také riziko nemelanomových nádorů kůže, proto jsou u těchto pacientů doporučeny pravidelné dermatologické kontroly. Podání thiopurinů není vhodné u mladých mužů EBV séronegativních z důvodu zvýšeného rizika tzv. postmononucleosis lymfomu [56].
Probiotika
Stanovisko 16
Probiotická léčba E. coli kmen Nissle 1917 je vhodná jako udržovací terapie u pacientů s lehkou formou UC, kteří netolerují aminosalicyláty. Doporučená dávka je 200 mg denně [EL2].
Randomizované, kontrolované studie prokázaly, že probiotikum E. coli kmen Nissle 1917 není v udržovací léčbě lehké formy UC méně účinný ve srovnání s mesalazinem [57–59]. Tato léčba je proto indikována u pacientů, kteří v této indikaci netolerují perorální formu mesalazinu.
Biologická a inovativní léčba
Stanovisko 17
Udržovací léčba anti-TNF protilátkami, vedolizumabem, ustekinumabem, tofacitinibem, ozanimodem nebo filgotinibem je vhodná u pacientů, u nichž byla odpověď nebo remise navozena příslušným lékem [EL2].
Pro všechna biologika i malé molekuly používané v terapii UC platí, že pacienti, kteří odpoví na indukční fázi léčby, by měli pokračovat v udržovací léčbě stejným lékem. Data vycházejí především z randomizovaných, kontrolovaných studií, ale i z velkého počtu kohortových studií [1,43–48].
Vzhledem k omezenému počtu biologik a inovativních léků pro terapii UC je nezbytné maximálně využít potenciál každého použitého léku dříve, než dojde ke změně léčby. Nejčastějším způsobem optimalizace léčby je její intenzifikace, k níž, v závislosti na konkrétní situaci, přistupujeme u třetiny až poloviny léčených [60].
Protilátky proti TNF
Stanovisko 18
Základní dávkovací schémata pro anti-TNF protilátky jsou vhodná při dosažení remise indukční léčbou. Pokud není dosaženo remise nebo v případě sekundární ztráty odpovědi, je vhodná intenzifikace léčby nebo změna léku. V případě anti-TNF protilátek je vhodné v takové situaci využít farmakokinetických parametrů (hladina léku, přítomnost protilátek) [EL5].
Randomizované kontrolované studie i studie kohortové potvrzují účinnost infliximabu, adalimumabu i golimumabu v udržovací léčbě UC. Metaanalýza deseti kontrolovaných, randomizovaných studií prokázala účinnost anti-TNF protilátek v udržení klinické remise, klinické remise bez kortikosteroidů a zlepšení kvality života pacientů s UC [1]. Při udržovací léčbě infliximabem je možno zvážit změnu z intravenózní formy na subkutánní infliximab.
Množství retrospektivních studií potvrzuje vztah mezi hladinou biologika (anti-TNF protilátky) a klinickým efektem u pacientů s UC [61]. Přestože mezinárodní odborné společnosti nejsou ve svých doporučeních jednotné, převažující odborný názor akceptuje farmakokinetické monitorování jako efektivní nástroj při léčbě UC. Doporučujeme proto, aby všechna pracoviště, kde jsou podávány anti-TNF protilátky pacientům s UC, měla možnost měřit hladiny léčiv, případně koncentrace protilátek proti nim v séru. Na základě aktuálního konsenzu skupiny odborníků [61] doporučujeme stanovit hladiny anti-TNF protilátek, případně protilátek proti lékům v těchto situacích:
- u respondérů na konci indukční fáze;
- alespoň 1× v průběhu udržovací léčby;
- v případě primární neodpovídavosti;
- u pacientů se sekundární ztrátou odpovědi.
V případě infliximabu by minimální koncentrace v týdnu 6 měla dosáhnout 15–20 µg/ml, v týdnu 14 a během udržovací léčby 5–10 µg/ml. U pacientů s aktivní UC bychom neměli léčbu infliximabem ukončit, dokud nedosáhneme intenzifikací hladiny 10–15 µg/ml. Intenzifikace zahrnuje zkrácení intervalu až na 4 týdny a zvýšení dávky až na 10 mg/kg [61].
Minimální koncentrace adalimumabu v týdnu 4 a v průběhu udržovací léčby by měla být 8–12 µg/ml. U pacientů s aktivní UC by léčba neměla být ukončena, dokud nedosáhneme intenzifikací hladiny 10–15 µg/ml. Intenzifikace zahrnuje zkrácení intervalu na 1 týden, případně navýšení dávky na 80 mg v intervalu 2 týdnů [61].
Antiintegriny, antiinterleukiny, malé molekuly
Stanovisko 19
Udržovací léčba vedolizumabem, ustekinumabem, tofacitinibem, ozanimodem a filgotinibem je vhodná při dosažení odpovědi nebo remise indukční léčbou [EL2]. V případě ztráty odpovědi je vhodná intenzifikace léčby vedolizumabem a tofacitinibem. Při léčbě ustekinumabem lze v takové situaci zvážit intenzifikaci nebo opakování indukční dávky [EL5]. V případě ozanimodu a filgotinibu nejsou dosud k dispozici data týkající se případné intenzifikace.
Stejně jako v případě anti-TNF protilátek také pro vedolizumab, ustekinumab, tofacitinib, ozanimod a filgotinib platí, že při dosažení pozitivní odpovědi na indukční léčbu je vhodné pokračovat v udržovací terapii stejným lékem. Potvrzují to randomizované kontrolované studie i studie kohortové [1,43–48]. V udržovací léčbě vedolizumabem je možno zvážit změnu na subkutánní vedolizumab.
Ve srovnání s anti-TNF protilátkami je k dispozici jen omezené množství dat týkajících se farmakokinetického monitorování. Z tohoto důvodu je vhodné u pacientů se sekundární ztrátou odpovědi zvážit možnost intenzifikace léčebného režimu vedolizumabu, ustekinumabu a tofacitinibu bez ohledu na hladiny léčiv v séru [61]. V případě ozanimodu a filgotinibu není k dispozici dostatek dat.
V případě vedolizumabu je možno při ztrátě odpovědi zkrátit aplikační interval až na 4 týdny [62], při léčbě tofacitinibem pak navýšit dávku na 2 × 10 mg p. o. [63]. Při léčbě ustekinumabem omezená data potvrzují příznivý efekt intenzifikace léčby v podobě zkrácení intervalu na 4–6 týdnů, případně v kombinaci s reindukční dávkou i.v. Tento efekt je výraznější u pacientů se sekundární ztrátou odpovědi ve srovnání s pacienty s nedostatečným efektem indukční léčby [64]. Ozanimod a filgotinib jsou nové léky a spolehlivá data opravňující k intenzifikaci léčby zatím nejsou k dispozici.
Telemedicína
Stanovisko 20
Při dlouhodobém sledování a léčbě pacientů s UC je vhodné využít nástrojů telemedicínského monitoringu [EL4].
Všeobecná dostupnost elektronických komunikačních prostředků vedla k intenzivnímu výzkumu možností telemedicíny v populaci pacientů s IBD. Řada studií prokazuje, že tento způsob sledování je bezpečný, efektivní a ekonomicky přínosný [65,66]. Optimální postavení telemedicíny v systému péče o pacienty s UC bude vyžadovat další výzkum a vývoj příslušných aplikací. V případě dostupnosti ověřeného a zdravotnickým systémem akceptovaného nástroje (aplikace) doporučujeme využití telemedicíny zejména u pacientů s mírným a středně těžkým průběhem UC.
Duální terapie
Stanovisko 21
Duální terapie dvěma biologickými léky nebo kombinací JAK inhibitoru s biologikem je v ojedinělých případech variantou medikamentózní léčby UC u pacientů neodpovídajících veškerou dostupnou biologickou či inovativní léčbu v monoterapii [EL5].
Duální terapií rozumíme současné použití dvou biologik nebo biologika a malé molekuly (např. tofacitinibu). V klinické praxi je nejčastějším důvodem ke zvážení takové léčby aktivní střevní zánět nebo závažné mimostřevní projevy nereagující na jinou monoterapii. Vychází z představy vzájemně se doplňujícího mechanizmu účinku, který pokryje širší spektrum patogenetických mechanizmů, než je tomu při použití jednoho léku.
Recentní metaanalýza 30 kohortových studií a kazuistických sérií (pacienti s UC tvořili čtvrtinu pacientů) potvrdila dosažení klinické remise u 59 % a endoskopické remise u 34 % pacientů, většího efektu bylo dosaženo u pacientů léčených pro mimostřevní projevy IBD [67]. Nežádoucí účinky se vyskytly u 31 % a závažné nežádoucí účinky u 6,5 % pacientů. Nejčastější byly kombinace vedolizumabu s anti-TNF protilátkou nebo ustekinumabem. Recentní česká práce zahrnula celkem 25 pacientů s IBD, 8 z nich s UC [68]. Účinnost duální léčby byla zřetelně vyšší právě ve skupině pacientů s UC, ve 30. týdnu odpovědělo 80 % léčených. Cena léčby ovšem dosahovala 5–8násobku terapie samotnou anti-TNF protilátkou. Duální léčbu lze v současnosti považovat za výjimečnou variantu medikamentózní léčby u pacientů neodpovídajících na veškerou dostupnou biologickou či inovativní léčbu v monoterapii.
3. Dispenzarizace pacientů
Indikace k dispenzarizaci
Stanovisko 22
Pacienti s levostrannou a extenzivní UC mají vyšší riziko vzniku kolorektálního karcinomu. Rizikovými faktory jsou délka trvání UC, rozsah postižení, přítomnost chronických zánětlivých a morfologických změn (stenóza, tubulární tračník), koincidující primární sklerozující cholangitida a rodinná anamnéza KRK [EL2]. Dispenzární program je vhodné zahájit 8 let od začátku symptomů onemocnění [EL5].
Zvýšené riziko kolorektální neoplazie je všeobecně známým faktem u pacientů s levostrannou a extenzivní UC, naproti tomu pacienti s proktitidou zvýšené riziko nemají. Hlavní rizikové faktory – délka trvání a rozsah UC, těžké morfologické změny jako projev dlouhodobě perzistující aktivity zánětu, primární sklerozující cholangitida a rodinná anamnéza kolorektálního karcinomu, zejména v prvním stupni příbuzenství a u osoby mladší 50 let, jsou jednoznačným důvodem k zařazení do dispenzárního programu prevence kolorektální neoplazie. Pacient by měl být do tohoto programu zařazen 8 let od vzniku prvních symptomů onemocnění, nikoli od data stanovení diagnózy [6,56].
Způsob provádění dispenzárních kontrol
Stanovisko 23
Základem je koloskopické vyšetření přístrojem s vysokým rozlišením s využitím chromoendoskopie, event. virtuální chromoendoskopie [EL3]. Dysplastické léze dělíme na endoskopicky viditelné (polypoidní a nepolypoidní) a endoskopicky neviditelné (detekce v náhodné biopsii). Pokud je léze endoskopicky kompletně odstranitelná, lze pokračovat v dispenzárních koloskopiích, pokud odstranitelná není, je indikována kolektomie [EL5]. Dispenzární koloskopie by měla být prováděna v době endoskopické remise zánětu a na adekvátně vybavených endoskopických pracovištích se zkušeností s tímto programem [EL5].
Koloskop s vysokým rozlišením spolu s klasickou nebo virtuální chromoendoskopií jsou základní nástroje k provádění dispenzárních kontrol. Možnost využít pro dispenzární program i virtuální chromoendoskopii (Narrow Band Imaging, i-Scan, FICE) ukázala recentní metaanalýza, v níž nebyl zjištěn rozdíl mezi klasickou chromoendoskopií s využitím indigokarmínu nebo metylenové modři a různými nástroji virtuální chromoendoskopie [69]. Přestože někteří autoři doporučují kombinovat cílené biopsie s náhodnými biopsiemi ve čtyřech kvadrantech u vysokorizikových pacientů (např. s koincidující PSC), ve shodě s doporučením ECCO považujeme za dostačující bioptické vyšetření viditelných lézí [6].
Mezinárodní konsenzus SCENIC upravil dříve nepřehlednou klasifikaci dysplastických lézí, které nyní dělíme na dva základní typy: endoskopicky viditelné a neviditelné, u prvního typu dále rozlišujeme léze polypoidní a nepolypoidní [70]. Terapie spočívá v endoskopické resekci léze; je-li kompletní, může pacient pokračovat v endoskopických kontrolách, inkompletní resekce léze s jakýmkoli stupněm dysplazie by měla vést k chirurgické léčbě.
Dispenzární koloskopie by měly být prováděny v době endoskopické remise, kdy je minimalizováno riziko záměny neoplastických a zánětlivých změn, a to v následujících intervalech:
- 1 rok: pacienti s koincidující PSC, slizniční dysplazií v posledních 5 letech, extenzivní UC se strukturálními změnami a rodinnou anamnézou kolorektálního karcinomu (KRK) u prvostupňového příbuzného mladšího 50 let;
- 2–3 roky: pacienti s extenzivní UC s převažující mírnou nebo střední aktivitou, pozánětlivými polypy nebo příbuzenství osoby s KRK ve věku nad 50 let;
- 5 let: ostatní pacienti, kteří nemají žádný z výše uvedených rizikových faktorů [71].
U všech pacientů s levostrannou a extenzivní UC je vhodné využít chemopreventivního efektu mesalazinu. Minimální dávka účinná v chemoprevenci je 1,2 g denně [6].
4. Speciální situace
4.1. Gravidita a laktace
a) Diagnostika a monitoring UC v graviditě a laktaci
Stanovisko 24
Kombinace klinického vyšetření lékařem a stanovení hodnoty FC je vhodná metoda monitorování aktivity UC v graviditě. Abdominální ultrasonografie a magnetická rezonance bez intravenózního gadolinia jsou nejbezpečnější zobrazovací techniky pro diagnostiku u těhotných žen, u nichž je známa nebo suspektní diagnóza IBD, bez ohledu na trimestr [EL5].
Endoskopie prováděná v graviditě je považována za bezpečnou. Vyšetření by mělo být provedeno pouze tehdy, pokud existuje jasná indikace a výsledek vyšetření je nezbytný pro další terapeutický postup. Flexibilní sigmoidoskopie bez přípravy je preferována a je možno ji provádět v jakémkoli trimestru, optimálně v poloze na levém boku a po konzultaci s porodníkem. Periprocedurálně je třeba monitorovat přítomnost srdečních ozev plodu [EL5].
K event. analgosedaci je třeba použít léky, které mají prokázanou bezpečnost v graviditě s použitím minimální dávky, která dosáhne dostatečného účinku [EL5].
S ohledem na průměrný věk pacientek s IBD je gravidita v této skupině častou situací. UC samotná nesnižuje fertilitu pacientek, snížena může být jejich fekundita v důsledku adhezí po předchozích chirurgických výkonech (např. konstrukce ileálního pouche). Fertilita však zůstává obvykle zachována, početí je možné např. formou asistované reprodukce. Pacientky s UC by měly graviditu plánovat, v době koncepce by měla být pacientka ve stadiu remise UC. Pokud je střevní zánět v době početí aktivní, zvyšuje se riziko nepříznivého průběhu a výsledku gravidity. U malé části pacientek se UC manifestuje v graviditě poprvé, často v podobě těžké akutní ataky [72].
Při sledování gravidních pacientek s UC preferujeme neinvazivní metody – klinické vyšetření, stanovení koncentrace fekálního kalprotektinu, případně břišní ultrazvuk. Endoskopické vyšetření by mělo být prováděno pouze v případě, že jeho výsledek může významným způsobem ovlivnit další léčbu pacientky. Optimální metodou je flexibilní sigmoidoskopie tenkým endoskopem (pediatrický koloskop, gastroskop), prováděná u pacientky ležící na levém boku [73–75]. Je-li nutná totální koloskopie, je vhodná konzultace porodníka a přítomnost anesteziologa k zajištění bezpečné sedace pacientky.
b) Medikamentózní léčba UC v graviditě a laktaci
Stanovisko 25
Efektivní udržovací léčba UC před koncepcí by měla pokračovat i v průběhu gravidity, její ukončení nebo redukce může vést k relapsu nemoci. Akutní relaps UC v graviditě představuje vysoké riziko pro vývoj gravidity a plodu a je třeba ho adekvátně a bez odkladu léčit [EL3]. Většina léků užívaných k léčbě UC představuje nízké riziko pro průběh gravidity. V případě akutního relapsu UC jsou doporučovány 5-ASA nebo kortikosteroidy, v indikovaných případech anti-TNF preparáty [EL3].
Pokud pacientka otěhotní v průběhu terapie anti-TNF protilátkou, je doporučeno pokračovat v této léčbě po celou dobu gravidity. V určitých případech (plná remise onemocnění, nízké riziko relapsu) lze zvážit přerušení biologické léčby na konci druhého, nebo počátkem třetího trimestru a terapii obnovit po porodu [EL3].
Přestože medikamentózní léčba UC není spojena se závažným rizikem nežádoucích účinků pro plod nebo pro matku, má diagnóza střevního zánětu negativní vliv na reprodukční chování pacientů [76]. U pacientek s UC není gravidita důvodem k redukci nebo vysazení efektivní a dobře tolerované medikamentózní léčby. Takový postup zvyšuje riziko relapsu UC, a tím i riziko nepříznivého průběhu a výsledku gravidity (předčasný porod, nízká porodní hmotnost novorozence). Pokud dojde během těhotenství k relapsu UC, léčba by měla být stejná jako u negravidních pacientek – u lehké formy podáváme mesalazin, včetně kombinace s rektální formou, pokud ji pacientka toleruje. V ostatních případech obvykle volíme systémové kortikoidy v obvyklém dávkování, event. biologika – preferenčně infliximab. Dostupná data nesvědčí pro nepříznivý vliv anti-TNF protilátek na průběh gravidity nebo zdravotní stav novorozence [72,77].
Pacientky dlouhodobě léčené anti-TNF protilátkami by měly v graviditě v této léčbě pokračovat minimálně do konce druhého trimestru (týden 24–26), kdy je možno zvážit přerušení léčby u pacientek ve stabilizovaném stavu bez zvýšeného rizika relapsu. U pacientek s projevy aktivity UC nebo rizikem relapsu UC (např. při relapsu v předchozí graviditě) je vhodné léčbu anti-TNF protilátkami nepřerušovat [78].
Stanovisko 26
Data o léčbě vedolizumabem, ustekinumabem a tofacitinibem v průběhu těhotenství jsou omezená, v případě ozanimodu a filgotinibu chybí. Léčba vedolizumabem a ustekinumabem se v průběhu gravidity řídí stejnými pravidly jako léčba anti-TNF protilátkami. Léčba tofacitinibem není v graviditě doporučena, před jejím ukončením je však vždy nutno zvážit potenciální přínos a riziko pro matku a plod [EL3].
Léčba UC v průběhu laktace preparáty 5-ASA, kortikosteroidy, thiopuriny, anti-TNF, vedolizumabem či ustekinumabem představuje nízké riziko pro kojené děti [EL3]. Při léčbě tofacitinibem se kojení nedoporučuje [EL5]. Pro ozanimod a filgotinib nejsou potřebná data.
Vakcinace živými vakcínami u dětí exponovaných intrauterinně monoklonálním protilátkám (anti-TNF, vedolizumab, ustekinumab) by měla být odložena do doby vymizení léku z oběhu dítěte nebo do minimálního věku 6 měsíců. Vakcinace neživými vakcínami omezena není [EL5].
Data o léčbě antiintegrinovými a antiinterleukinovými protilátkami v graviditě jsou ve srovnání s informacemi o anti-TNF protilátkách omezená. Dosud publikované studie nicméně svědčí pro dobrou bezpečnost vedolizumabu i ustekinumabu pro matku i plod, bez zvýšeného výskytu komplikací u novorozenců. V případě ustekinumabu se zdá, že jeho farmakokinetika se neliší od anti-TNF protilátek – koncentrace ustekinumabu v krvi novorozence převyšuje koncentraci v krvi matky. Důvodem je aktivní transport léku proti koncentračnímu spádu ve třetím trimestru gravidity. Farmakokinetika vedolizumabu se však pravděpodobně liší a koncentrace léku v krvi novorozence jsou nižší než koncentrace v krvi matky [79]. Pro oba léky proto platí v graviditě stejná pravidla jako pro anti-TNF protilátky.
Ačkoli léčba tofacitinem není v graviditě vhodná vzhledem k nedostatku bezpečnostních dat, před jeho případným vysazením je nutno pečlivě zvážit potenciální benefit a riziko pro matku a plod. Současná data jsou omezena na kazuistické případy [80,81], poškození plodu však zatím popsáno nebylo. Na rozdíl od monoklonálních protilátek není léčba tofacitinem vhodná ani při kojení z důvodu vylučování léku do mateřského mléka.
Vakcinace dětí živými vakcínami je možná po vymizení léku, kterým byly léčeny matky v době těhotenství. V naprosté většině případů se tak stane do 6–9 měsíců od porodu. Alternativou je stanovení hladiny léku v krvi dítěte [72]. Neživé vakcíny lze podat bez omezení.
4.2. Vyšší věk
Stanovisko 27
Charakteristickým rysem UC diagnostikované ve vyšším věku (> 60 let) je mírnější průběh onemocnění a převážně levostranné postižení. Efektivita medikamentózní léčby se podstatně neliší od účinnosti u mladších pacientů, zvýšený důraz je kladen na prevenci nežádoucích účinků [EL5].
Podíl pacientů s IBD ve věku nad 60 let na celkové IBD populaci narůstá a v současnosti tvoří 25–30 %. Pacienti, u nichž byl střevní zánět diagnostikován v pokročilém věku, se vyznačují celkově mírnějším průběhem s převahou levostranné UC. Dalším specifikem této populace pacientů je širší diferenciální diagnostika a zvýšené riziko nežádoucích účinků léčby – zejména infekčních komplikací a malignit. Zvýšenou pozornost je proto třeba věnovat správné vakcinaci a screeningu nádorů [82,83].
Účinnost medikamentózní léčby není u starších pacientů s UC zásadně změněna. V terapii UC by měl dominovat mesalazin v obvyklém dávkování, je však třeba zohlednit často obtížnější aplikaci rektálních forem léků a riziko neúmyslné nonadherence z důvodu prostého zapomínání. Léčba systémovými kortikoidy je spojena s vyššími riziky ve srovnání s mladší populací, nezbytná je prevence osteoporózy a dalších komplikací (hypertenze, diabetes). Nevhodná jsou thiopurinová imunosupresiva z důvodu zvýšeného rizika lymfomů. Vyšší riziko komplikací, zejména infekčních, je spojeno i s aplikací protilátek proti TNF [82,83]. Vhodnou variantou může být vedolizumab nebo ustekinumab. Tofacitinib není vhodný u starších pacientů z důvodu zvýšeného rizika infekčních komplikací (Herpes zoster). V případě ozanimodu a filgotinibu nejsou potřebná data.
4.3. Léčba pacientů s anamnézou malignity
Stanovisko 28
Pacienti s osobní anamnézou malignity mají, bez ohledu na typ léčby, zvýšené riziko další malignity v podobě recidivy původní malignity anebo vzniku malignity de novo [EL2].
Aminosalicyláty, topické kortikosteroidy a krátkodobě podávané systémové kortikosteroidy jsou bezpečné u pacientů s předchozí malignitou [EL3]. Thiopuriny nejsou vhodné pro pacienty s anamnézou hematologické malignity, nemelanomového karcinomu kůže, karcinomu močových cest a případně HPV asociovaného karcinomu děložního čípku, a to s ohledem na jejich zvýšené riziko indukce těchto malignit. Z téhož důvodu by se neměla zahajovat anti-TNF terapie u pacientů s předchozím maligním melanomem, nevyjasněné je zatím riziko lymfomů [EL5].
Za bezpečnou léčbu u pacientů s UC a osobní anamnézou malignity lze považovat aminosalicyláty, topické a pravděpodobně i systémové kortikosteroidy při krátkodobém užívání [56]. V případě nutnosti imunosupresivní nebo biologické terapie je nutno zohlednit aktuální stav onkologického onemocnění, typ předchozí malignity a interval od ukončení onkologické léčby. Vždy je vhodná konzultace s onkologem. Preferována je monoterapie oproti kombinované imunosupresivní léčbě [56].
S ohledem na potenciál některých preparátů indukovat vznik specifického typu malignity je vhodné nezahajovat tuto léčbu u pacientů s určitým typem předchozí malignity. Jedná se o thiopuriny u pacientů s anamnézou hematologické malignity (lymfo- a myeloproliferativní), nemelanomového karcinomu kůže, karcinomu močových cest a HPV asociovaného karcinomu děložního čípku. Anti-TNF terapie není vhodná pro jedince s předchozím maligním melanomem; v případě lymfomu nejsou dosavadní data jednoznačná [56].
Na základě výsledků studií transplantovaných pacientů se z důvodu vysokého rizika recidivy malignity doporučuje oddálit zahájení imunosupresivní anebo systémové biologické terapie minimálně po dobu 2 let od ukončení onkologické léčby. U malignit se středním a vysokým rizikem recidivy je doporučený interval až 5 let. Preferována je monoterapie oproti kombinované imunosupresivně-biologické léčbě [84,85].
Vedolizumab se, s ohledem na jeho selektivní působení v trávicí trubici, zdá být z hlediska bezpečnosti optimálním biologickým preparátem u pacientů s maligním onemocněním mimo střevní trakt. V tomto případě není pravděpodobně nutná ani doporučovaná latentní doba od ukončení onkologické léčby.
Stanovisko 29
V případě potřeby pokračovat po diagnóze malignity v systémové imunosupresivní anebo biologické léčbě z důvodu IBD je vždy doporučena konzultace onkologa. U vedolizumabu lze vzhledem k absenci systémového efektu předpokládat dobrou bezpečnost i po diagnóze onkologického onemocnění lokalizovaného mimo gastrointestinální trakt [EL5].
Pokud dojde k relapsu IBD v průběhu onkologické léčby, jsou preferovaným lékem kortikosteroidy nebo vedolizumab, podle klinické situace. Nasazení systémové imunosupresivní anebo biologické léčby je nutno konzultovat s onkologem [EL5].
Onkologická léčba může vést jak k navození a udržení remise IBD u pacientů s aktivním střevní zánětem, tak i k relapsu nebo zhoršení IBD [EL5].
Po diagnóze malignity je doporučeno vysadit systémovou imunosupresivní anebo biologickou terapii. Pokračování v této léčbě lze zvážit u solidních nádorů, u kterých bylo možné kurativní chirurgické řešení bez nutnosti chemoterapie anebo radioterapie. Jinak je nutná konzultace onkologa [56,86].
Pokud dojde k relapsu IBD v průběhu onkologické léčby nebo je onemocnění aktivní již v době diagnózy malignity a je nutno zahájit imunosupresivní terapii, jsou preferovanou léčbou kortikosteroidy. U malignit lokalizovaných mimo gastrointestinální trakt je z hlediska bezpečnosti optimálním preparátem vedolizumab, a to z důvodu selektivního účinku v trávicím traktu. U střevních malignit je bezpečnost vedolizumabu s ohledem na jeho mechanizmus účinku nejasná. V případě neefektivity nebo intolerance předchozí terapie a potřeby systémově působící biologické léčby je nutná konzultace onkologa. Léčba thiopuriny není obecně vhodná u pacientů léčených chemoterapií, a to z důvodu možné myelosuprese vyvolané těmito preparáty [87].
4.4. Ileální pouch, komplikace a jejich léčba
Stanovisko 30
Pacienti s ileopouch-anální anastomózou (IPAA) by měli být sledováni na specializovaném pracovišti s adekvátními zkušenostmi [EL4].
Zánětlivé komplikace ileálního pouche zahrnují pouchitidu a cuffitidu, mezi nezánětlivé komplikace patří septické projevy (leak, absces, sinus), mechanické poruchy pouche, poruchy funkční a neoplazie [EL3]. Nejčastější příčinou selhání pouche jsou komplikace septické [EL3]. Pro zachování pouche je důležitá jejich včasná identifikace a diagnostika a adekvátní léčba.
Komplikace u pacientů po proktokolektomii s konstrukcí ileálního pouche zahrnují změny zánětlivé, chirurgické (septické), mechanické a funkční. Jejich výskyt je závislý na řadě faktorů, zejména na správné indikaci a technickém provedení výkonu, je významně nižší na pracovištích s vyšší frekvencí výkonů [6]. Nejčastější příčinou selhání pouche jsou septické komplikace – anastomotický leak, absces, sinus. Tyto komplikace se vyskytují přibližně u 10 % pacientů [88]. V případě časné septické komplikace je vhodné provedení ileostomie, drenáže, případně resutury defektu transanálním přístupem. Léčba pozdních komplikací zahrnuje drenáže abscesů a píštělí, dilatace případné stenózy, plastiku píštěle, event. ileostomii. Krajním řešením je reoperace s vytvořením nového pouche nebo exstirpace pouche s ponecháním ileostomie.
Stanovisko 31
Diagnóza pouchitidy je založena na přítomnosti symptomů a endoskopickém a histologickém nálezu [EL3]. Základem léčby akutní pouchitidy jsou antibiotika (ciprofloxacin a/nebo metronidazol), chronická pouchitida vyžaduje dlouhodobou léčbu antibiotiky, budesonidem nebo biologiky. Lékem první volby je v takovém případě infliximab, event. adalimumab [EL3].
Pouchitida se projevuje zvýšenou frekvencí řídkých stolic, tenesmy, inkontinencí, křečovitými bolestmi, teplotou a někdy i artralgiemi. Diagnostikujeme ji endoskopicky a histologicky. Lékem první volby je perorální ciprofloxacin v dávce 500 mg 2× denně minimálně po dobu 2 týdnů. Při nedostatečném účinku je vhodné přidat metronidazol 2 × 500 mg, při jeho intoleranci lze připravit magistraliter čípek s metronidazolem. Variantou metronidazolu může být rifaximin. V dalším kroku lze podat perorální budesonid, případně budesonid ve formě rektální pěny. Pouchitidu refrakterní na konvenční terapii léčíme biologiky, lékem první volby je infliximab. U pacientů se zvýšeným rizikem pouchitidy (těžký průběh UC, PSC) nebo po prodělané akutní atace lze doporučit probiotický koktejl VSL#3 k prevenci pouchitidy. Jen výjimečně je pouchitida příčinou selhání pouche s nutností reoperace nebo exstirpace pouche [89].
5. Akutní těžká ataka, fulminantní UC, toxické megakolon
Diagnostika akutní těžké ataky UC (ASUC)
Stanovisko 32
Těžká ataka je definována podle kritérií Truelova a Wittse a zahrnuje přítomnost těchto symptomů: šest a více krvavých stolic denně a alespoň jeden projev systémové zánětlivé reakce (tachykardie > 90/min, teplota > 37,8 °C, Hgb < 105 g/l, CRP > 30 mg/l) [EL3].
Známky těžké zánětlivé reakce (systémové toxicity) zahrnují přítomnost tachykardie (> 90/min), anemii (hemoglobin < 105 g/l), zvýšenou tělesnou teplotu (T > 37,8 °C), zvýšenou hodnotu sedimentace červených krvinek (> 30 mm/1 hod) nebo nověji zvýšenou hodnotou CRP (> 30 mg/l). S narůstajícím počtem znaků systémové zánětlivé reakce progresivně narůstá riziko kolektomie. V případě jednoho systémového znaku dosahuje riziko kolektomie 11 %, jsou-li přítomna všechna čtyři kritéria, přesahuje riziko akutního chirurgického zákroku v následujících šesti týdnech 40 % [90,91].
Průběh ASUC je spojen s vysokým rizikem závažných a život ohrožujících komplikací, jako je toxické megakolon (paralytický ileus na tlustém střevě), perforace tlustého střeva se sterkorální peritonitidou, masivní krvácení nebo sepse s multiorgánovým selháním. Dalším významným rizikem jsou tromboembolické komplikace. Urgentně nebo akutně provedené chirurgické výkony spočívající v provedení kolektomie nebo proktokolektomie jsou rovněž spojeny s významnou pooperační morbiditou a nezanedbatelnou mortalitou v porovnání s elektivními nebo odloženými chirurgickými výkony. Metaanalýza zahrnujících celkem 17 studií publikovaných od roku 1990 do roku 2014 na více než 65 000 nemocných s UC z 15 zemí světa ukázala, že časná pooperační mortalita je u urgentně provedených operací mnohonásobně vyšší v porovnání s výkony elektivními nebo odloženými (5,3 vs. 0,7 %) [92]. U nemocných s UC nebylo patrno snížení mortality v průběhu sledovaného období (24 let), a to i přes významné pokroky v medikamentózní terapii a při nových možnostech intenzivní péče. Na rozdíl od pacientů s UC se pooperační mortalita u nemocných s CN v posledních letech významně snížila.
Léčba akutní těžké ataky UC
Stanovisko 33
Základem léčby je hospitalizace a podání intravenózních kortikoidů (metylprednisolon 1 mg/kg). Součástí léčby je úprava vnitřního prostředí, anemie, profylaxe tromboembolických komplikací a výživa, zpravidla enterální formou. Je nutno vyloučit a monitorovat potenciální komplikace onemocnění (infekce, toxické megakolon) [EL2].
V randomizované, placebem kontrolované studii u nemocných s ASUC bylo potvrzeno, že podávání kortikoidů intravenózně významně snižuje mortalitu a je spojeno se zvýšením počtu dosažených remisí [93].
Pokud nedojde k odpovědi na léčbu mezi 3. a 5. dnem od zahájení, je indikována druhá linie medikamentózní léčby, lékem volby je infliximab nebo cyklosporin A v dávce 2 mg/kg. V případě infliximabu je nutno zvážit podání intenzifikovaného režimu od počátku léčby (10 mg/kg). Není-li odpověď ani na druhou linii léčby, je nutno zvážit chirurgické řešení. Podání cyklosporinu je vhodné pouze na pracovištích s adekvátní zkušeností a možností monitorace hladiny léku, v případě příznivé odpovědi může pokračovat léčba thiopuriny, vedolizumabem, nebo ustekinumabem. Léčba musí být od počátku konzultována se zkušeným kolorektálním chirurgem [94].
6. Vakcinace a prevence infekčních komplikací
Riziko infekčních komplikací
Stanovisko 34
Pacienti s UC léčení imunosupresivně působícími léky, ve vyšším věku (> 50 let), s malnutricí a předchozí anamnézou infekčních komplikací jsou ve zvýšeném riziku infekčních komplikací [EL2]. U všech pacientů s UC je nutno odebrat podrobnou anamnézu týkající se prodělaných infekčních onemocnění a předchozí vakcinace. U všech pacientů s UC by mělo být při stanovení diagnózy provedeno laboratorní vyšetření zaměřené na hepatitidu A, B a C a na infekce Varicella zoster, HIV, EBV, CMV a virus spalniček [EL5].
Rizikové faktory pro vznik závažných infekcí zahrnují faktory pacienta dané jeho věkem, malnutricí a přidruženými nemocemi a faktory zevní, mezi něž patří použité imunosupresivní léky nebo jejich kombinace (thiopuriny, anti-TNF protilátky a kortikoidy) a rizikové kontakty. Největší riziko pro vznik infekcí představuje současné podávání kortikoidů, thiopurinů a anti-TNF protilátek. Podávání jednoho z nich zvyšuje riziko infekce trojnásobně, kombinace všech uvedených skupin léčiv téměř 15násobně [95].
Vakcinace pacientů s UC
Stanovisko 35
Pacienti by měli být pravidelně očkováni proti chřipce, doporučena je vakcinace proti Str. pneumoniae, SARS-CoV-2 a lidskému papilomaviru [EL5]. V případě potřeby (séronegativita) je vhodná vakcinace proti hepatitidě B a varicella zoster viru. Podání živých vakcín není vhodné při probíhající imunosupresivní léčbě, v období 3 týdnů před jejím zahájením a 1–3 měsíců po jejím ukončení, dle typu preparátu. Podání neživých vakcín není limitováno. V případě dostupné metody je vhodné sérologicky ověřit účinnost vakcinace [EL5].
Reaktivace viru hepatitidy B je možná u nemocných s UC na imunosupresivní terapii. Všichni pacienti s UC by proto měli být očkováni proti infekci virem hepatitidy B a sérologická postvakcinační odpověď by měla být monitorována stanovením titru protilátek.
U všech pacientů s UC by měla být zjištěna přítomnost protilátek proti dalším virovým infekcím, jako je EBV a Herpes zoster. V případě nízkých titrů protilátek proti infekci varicella zoster je doporučeno podání rekombinantní vakcíny nebo aplikace živé vakcíny, která však může být aplikována nejpozději 3 týdny před zahájením a nejdříve 3 měsíce po ukončení imunosupresivní terapie [95].
Pravidelná každoroční vakcinace proti chřipce je důležitým preventivním opatřením. První volbou je aplikace trivalentní nebo kvadruvalentní inaktivované vakcíny proti chřipce, kterou je možno využít také u pacientů na již probíhající imunosupresivní terapii. Očkování proti SARS-CoV-2 je jednoznačně doporučováno u všech IBD nemocných bez ohledu na probíhající medikamentózní terapii. Je třeba mít na paměti, že tvorba protilátek je u nemocných na imunosupresivní terapii v porovnání se zdravou populací snížena a rychleji také dochází k vymizení vytvořených protilátek. Tzv. mRNA vakcíny jsou s ohledem na tvorbu anti-SARS-Cov-2 protilátek efektivnější než rekombinantní adenovektorové vakcíny [96].
Očkování proti pneumokoku (Streptococcus pneumonie) patří do základního vakcinačního schématu všech nemocných s UC. Doporučeno je podat první dávku 13valentní vakcínou a přeočkovat po 8 týdnech 23valentní vakcínou [96].
U všech mladých mužů a žen ve věku 11–14 let je doporučeno provést vakcinaci proti lidskému papilomaviru [96].
Doručeno/ Submitted: 23. 2. 2022
Přijato/ Accepted: 24. 2. 2022
doc. MUDr. Martin Bortlík, Ph.D.
Gastroenterologické oddělení
Nemocnice České Budějovice, a.s.
B. Němcové 585/ 54
370 01 České Budějovice
MBortlik@seznam.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Raine T, Bonovas S, Burisch J et al. ECCO guidelines on therapeutics in ulcerative colitis: medical treatment. J Crohns Colitis 2022; 16(1): 2–17. doi: 10.1093/ecco-jcc/jjab178.
2. Lukáš M, Dušek L. Idiopatické střevní záněty ve statistických ukazatelích a analýzách. In: Lukáš M et al (eds). Idiopatické střevní záněty – nové trendy a mezioborové souvislosti. Praha: Grada Publishing, a. s. 2020.
3. Jess T, Gamborg M, Munkholm P et al. Overall and cause-specific mortality in ulcerative colitis: meta-analysis of population-based inception cohort studies. Am J Gastroenterol 2007; 102(3): 609–617. doi: 10.1111/j.1572-0241.010 00.x.
4. Bortlík M. Vývoj léčby idiopatických střevních zánětů v posledních 20 letech. Gastroent Hepatol 2015; 69(4): 341–350.
5. OCEMB levels of evidence working group. The Oxford 2011 levels of evidence: Oxford centre for evidence-based medicine. 2014 [online]. Available from: https: //www.cebm.net/wp-content/uploads/2014/06/CEBM-Levels-of-Evidence-2.1.pdf.
6. Magro F, Gionchetti P, Eliakim R et al. Third European evidence-based consensus on diagnosis and management of ulcerative colitis. Part 1: definitions, diagnosis, extra-intestinal manifestations, pregnancy, cancer surveillance, surgery, and ileo-anal pouch disorders. J Crohns Colitis 2017; 11(6): 649–670. doi: 10.1093/ecco-jcc/jjx008.
7. Vavricka SR, Brun L, Ballabeni P et al. Frequency and risk factors for extraintestinal manifestations in the Swiss inflammatory bowel disease cohort. Am J Gastroenterol 2011; 106: 110–119. doi: 10.1038/ajg.2010.343.
8. Bajer L, Kamenář D, Sticová E et al. Idiopatický střevní zánět u pacientů s primární sklerozující cholangitidou – samostatný fenotyp IBD. Gastroent Hepatol 2014; 68(1): 24–35.
9. Moller FT, Andersen V, Wohlfahrt J et al. Familial risk of inflammatory bowel disease: a population-based cohort study 1977–2011. Am J Gastroenterol 2015; 110(4): 564–571. doi: 10.1038/ajg.2015.50.
10. To N, Ford AC, Gracie DJ. Systematic review with meta-analysis: the effect of tobacco smoking on the natural history of ulcerative colitis. Aliment Pharmacol Ther 2016; 44(2): 117–126. doi: 10.1111/apt.13663.
11. Radford-Smith GL, Edwards JE, Purdie DM et al. Protective role of appendicectomy on onset and severity of ulcerative colitis and Crohn’s disease. Gut 2002; 51(6): 808–813. doi: 10.1136/gut.51.6.808.
12. Sandborn WJ. Serologic markers in inflammatory bowel disease: state of the art. Rev Gastroenterol Disord 2004; 4(4): 167–174.
13. Rajwal SR, Puntis JW, McClean P et al. Endoscopic rectal sparing in children with untreated ulcerative colitis. J Pediatr Gastroenterol Nutr 2004; 38(1): 66–69. doi: 10.1097/00005176-20 0401000-00015.
14. Park SH, Loftus EV Jr, Yang SK. Appendiceal skip inflammation and ulcerative colitis. Dig Dis Sci 2014; 59(9): 2050–2057. doi: 10.1007/s10620-014-3129-z.
15. Rutter MD, Saunders BP, Wilkinson KH et al. Cancer surveillance in longstanding ulcerative colitis: endoscopic appearances help predict cancer risk. Gut 2004; 53(12): 1813–1816. doi: 10.1136/gut.2003.038505.
16. Lang-Schwarz C, Angeloni M, Agaimy A et al. Validation of the ‚Inflammatory Bowel Disease-Distribution, Chronicity, Activity [IBD-DCA] score‘ for ulcerative colitis and Crohn’s Disease. J Crohns Colitis 2021; 15(10): 1621–1630. doi: 10.1093/ecco-jcc/jjab055.
17. Gower-Rousseau C, Dauchet L, Vernier-Massouille G et al. The natural history of pediatric ulcerative colitis: a population-based cohort study. Am J Gastroenterol 2009; 104(8): 2080–2088. doi: 10.1038/ajg.2009.177.
18. Katsanos KH, Vermeire S, Christodoulou DK et al. EC-IBD Study Group. Dysplasia and cancer in inflammatory bowel disease 10 years after diagnosis: results of a population-based European collaborative follow-up study. Digestion 2007; 75(2–3): 113–121. doi: 10.1159/000104731.
19. D’Haens G, Sandborn WJ, Feagan BG et al. A review of activity indices and efficacy end points for clinical trials of medical therapy in adults with ulcerative colitis. Gastroenterology 2007; 132(2): 763–786. doi: 10.1053/j.gastro.2006.12.038.
20. Travis SP, Schnell D, Krzeski P et al. Developing an instrument to assess the endoscopic severity of ulcerative colitis: the Ulcerative Colitis Endoscopic Index of Severity (UCEIS). Gut 2012; 61(4): 535–542. doi: 10.1136/gutjnl-2011-300486.
21. Truelove SC, Jewell DP. Intensive intravenous regimen for severe attacks of ulcerative colitis. Lancet 1974; 1(7866): 1067–1070. doi: 10.1016/s0140-6736(74)90552-2.
22. Vermeire S, Van Assche G, Rutgeerts P. Laboratory markers in IBD: useful, magic, or unnecessary toys? Gut 2006; 55(3): 426–431. doi: 10.1136/gut.2005.069476.
23. Lin JF, Chen JM, Zuo JH et al. Meta-analysis: fecal calprotectin for assessment of inflammatory bowel disease activity. Inflamm Bowel Dis 2014; 20(8): 1407–1415. doi: 10.1097/MIB.0000000000000057.
24. Turner D, Ricciuto A, Lewis A et al. STRIDE-II: an update on the Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE) Initiative of the International Organization for the Study of IBD (IOIBD): Determining Therapeutic Goals for Treat-to-Target strategies in IBD. Gastroenterology 2021; 160(5): 1570–1583. doi: 10.1053/j.gastro.2020.12.031.
25. Doherty G, Katsanos KH, Burisch J et al. European Crohn‘s and colitis organisation topical review on treatment withdrawal (‚exit strategies‘) in inflammatory bowel disease. J Crohns Colitis 2018; 12(1): 17–31. doi: 10.1093/ecco-jcc/ jjx101.
26. Dulai PS, Battat R, Barsky M et al. Incorporating fecal calprotectin into clinical practice for patients with moderate-to-severely active ulcerative colitis treated with biologics or small-molecule inhibitors. Am J Gastroenterol 2020; 115(6): 885–894. doi: 10.14309/ajg.0000000000000596.
27. Wetwittayakhlang P, Lontai L, Gonczi L et al. Treatment targets in ulcerative colitis: is it time for all in, including histology? J Clin Med 2021; 10(23): 5551. doi: 10.3390/jcm10235551.
28. Andus T, Kocjan A, Müser M et al. Clinical trial: a novel high-dose 1 g mesalamine suppository (Salofalk) once daily is as efficacious as a 500- mg suppository thrice daily in active ulcerative proctitis. Inflamm Bowel Dis 2010; 16(11): 1947–1956. doi: 10.1002/ibd.21258.
29. Lamet M. A multicenter, randomized study to evaluate the efficacy and safety of mesalamine suppositories 1 g at bedtime and 500 mg Twice daily in patients with active mild-to-moderate ulcerative proctitis. Dig Dis Sci 2011; 56(2): 513–522. doi: 10.1007/s10620-010-1334-y.
30. Gionchetti P, Rizzello F, Venturi A et al. Comparison of oral with rectal mesalazine in the treatment of ulcerative proctitis. Dis Colon Rectum 1998; 41(1): 93–97. doi: 10.1007/ BF02236902.
31. Ng SC. Management of ulcerative colitis. In: Hart AL, Ng SC (eds). Inflammatory bowel disease: an evidence-based practical guide. Malta: Gutenberg Press Ltd 2012: 5–12.
32. Marshall JK, Irvine EJ. Rectal corticosteroids versus alternative treatments in ulcerative colitis: a meta-analysis. Gut 1997; 40(6): 775–781. doi: 10.1136/gut.40.6.775.
33. Ford AC, Khan KJ, Achkar JP et al. Efficacy of oral vs. topical, or combined oral and topical 5-aminosalicylates, in Ulcerative Colitis: systematic review and meta-analysis. Am J Gastroenterol 2012; 107(2): 167–176. doi: 10.1038/ajg.2011.410.
34. Feagan BG, MacDonald JK. Once daily oral mesalamine compared to conventional dosing for induction and maintenance of remission in ulcerative colitis: a systematic review and meta-analysis. Inflamm Bowel Dis 2012; 18(9): 1785–1794. doi: 10.1002/ibd.23024.
35. Kruis W, Kiudelis G, Rácz I et al. Once daily versus three times daily mesalazine granules in active ulcerative colitis: a double-blind, double-dummy, randomised, non-inferiority trial. Gut 2009; 58(2): 233–240. doi: 10.1136/gut.2008.154302.
36. Ford AC, Achkar JP, Khan KJ et al. Efficacy of 5-aminosalicylates in ulcerative colitis: systematic review and meta-analysis. Am J Gastroenterol 2011; 106(4): 601–616. doi: 10.1038/ajg. 2011.67.
37. Leifeld L, Pfützer R, Morgenstern J et al. Mesalazine granules are superior to Eudragit-L-coated mesalazine tablets for induction of remission in distal ulcerative colitis – a pooled analysis. Aliment Pharmacol Ther 2011; 34(9): 1115–1122. doi: 10.1111/j.1365-2036.2011.04840.x.
38. Bortlík M, Ďuricová D, Douda T et al. Doporučení pro podávání biologické léčby pacientům s idiopatickými střevními záněty: čtvrté, aktualizované vydání. Gastroent Hepatol 2019; 73(1): 11–24. doi: 10.14735/amgh201911.
39. European Medicines Agency. Zeposia. 2022 [online]. Available from: https: //www.ema.europa.eu/en/documents/product-information/zeposia-epar-product-information_en.pdf.
40. European Medicines Agency. Jyseleca. 2022 [online]. Available from: https: //www.ema.europa.eu/en/documents/product-information/jyseleca-epar-product-information_ en.pdf.
41. Stange EF, Travis SP, Vermeire S et al. European evidence-based consensus on the diagnosis and management of ulcerative colitis: definitions and diagnosis. J Crohns Colitis 2008; 2(1): 1–23. doi: 10.1016/j.crohns.2007.11.001.
42. Chebli LA, Chaves LD, Pimentel FF et al. Azathioprine maintains long-term steroid-free remission through 3 years in patients with steroid-dependent ulcerative colitis. Inflamm Bowel Dis 2010; 16(4): 613–619. doi: 10.1002/ibd.21083.
43. Harbord M, Eliakim R, Bettenworth D et al. Third European evidence-based consensus on diagnosis and management of ulcerative colitis. Part 2: current management. J Crohns Colitis 2017; 11(7): 769–784. doi: 10.1093/ecco-jcc/jjx009.
44. Feagan BG, Rutgeerts P, Sands BE et al. Vedolizumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2013; 369(8): 699–710. doi: 10.1056/NEJMoa1215734.
45. Sands BE, Sandborn WJ, Panaccione R et al. Ustekinumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2019; 381(13): 1201–1214. doi: 10.1056/ NEJMoa 1900750.
46. Sandborn WJ, Su C, Panes J. Tofacitinib as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2017; 377(5): 496–497. doi: 10.1056/NEJMc1707500.
47. Sanborn WJ, Feagan B, D’Haens G et al. Ozanimod as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2021; 385(14): 1280–1291. doi: 10.1056/NEJMoa2033617.
48. Feagan BG, Danese S, Loftus EV Jr et al. Filgotinib as induction and maintenance therapy for ulcerative colitis (SELECTION): a phase 2b/3 double-blind, randomised, placebo-controlled trial. Lancet 2021; 397(10292): 2372–2384. doi: 10.1016/S0140-6736(21)00666-8.
49. Sands B, Peyrin-Biroulet L, Loftus EV Jr et al. Vedolizumab versus Adalimumab for moderate-to-severe ulcerative colitis. N Engl J Med 2019; 381(13): 1215–1226. doi: 10.1056/ NEJMoa1905725.
50. Jena A, Mishra S, Singh AK et al. Cytomegalovirus in ulcerative colitis: an evidence-based approach to diagnosis and treatment. Expert Rev Gastroenterol Hepatol 2022; 16(2): 109–120. doi: 10.1080/17474124.2022.2032662.
51. Llaó J, Naves JE, Ruiz-Cerulla A et al. Intravenous corticosteroids in moderately active ulcerative colitis refractory to oral corticosteroids. J Crohns Colitis 2014; 8(11): 1523–1528. doi: 10.1016/j.crohns.2014.06.010.
52. Murray A, Nguyen TM, Parker CE et al. Oral 5-aminosalicylic acid for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev 2020; 8(8): CD000544. doi: 10.1002/14651858.CD000544.pub5.
53. Prokopová L, Ďuricová D, Bortlík et al. Doporučené postupy pro podávání aminosalicylátů u nemocných s idiopatickými střevními záněty. Gastroent Hepatol 2012; 66(5): 391–400.
54. Beaugerie L, Brousse N, Bouvier AM et al. Lymphoproliferative disorders in patients receiving thiopurines for inflammatory bowel disease: a prospective observational cohort study. Lancet 2009; 374(9701): 1617–1625. doi: 10.1016/S0140-6736 (09) 61302-7.
55. Jorissen C, Verstockt B, Schils N et al. Long-term clinical outcome after thiopurine discontinuation in elderly IBD patients. Scand J Gastroenterol 2021; 56(11): 1323–1327. doi: 10.1080/00365521.2021.1965207.
56. Annese V, Beaugerie L, Egan L et al. European evidence-based consensus: inflammatory bowel disease and malignancies. J Crohns Colitis 2015; 9(11): 945–965. doi: 10.1093/ecco-jcc/jjv141.
57. Kruis W, Schütz E, Fric P et al. Double-blind comparison of an oral Escherichia coli preparation and mesalazine in maintaining remission of ulcerative colitis. Aliment Pharmacol Ther 1997; 11(5): 8535–8538. doi: 10.1046/ j.1365-2036.1997.00225.x.
58. Rembacken BJ, Snelling AM, Hawkey PM et al. Non-pathogenic Escherichia coli versus mesalazine for the treatment of ulcerative colitis: a randomised trial. Lancet 1999; 354(9179): 635–639. doi: 10.1016/s0140-6736(98)06343-0.
59. Kruis W, Fric P, Pokrotnieks J et al. Maintaining remission of ulcerative colitis with the probiotic Escherichia coli Nissle 1917 is as effective as with standard mesalazine. Gut 2004; 53(11): 1617–1623. doi: 10.1136/gut.2003.037747.
60. Institut biostatistiky a analýz. CREDIT. 2021 [online]. Available from: https: //credit.registry.cz/res/file/credit/iba1062_vyrocni_zprava_5.0_15mar2021.pdf.
61. Papamichael K, Cheifetz AS, Melmed GY et al. Appropriate therapeutic drug monitoring of biologic agents for patients with inflammatory bowel diseases. Clin Gastroenterol Hepatol 2019; 17(9): 1655–1668. doi: 10.1016/ j.cgh.2019.03.037.
62. Ungar B, Malickova K, Hanžel J et al. Dose optimisation for Loss of Response to Vedolizumab-Pharmacokinetics and Immune Mechanisms. J Crohns Colitis 2021; 15(10): 1707–1719. doi: 10.1093/ecco-jcc/jjab067.
63. European Medicines Agency. Xeljanz. 2022 [online]. Available from: https: //www.ema.europa.eu/en/ documents/product-information/xeljanz-epar-product-information_en.pdf.
64. Dalal RS, Esckilsen S, Barnes EL et al. Predictors and outcomes of Ustekinumab dose intensification in ulcerative colitis: a multicenter cohort study. Clin Gastroenterol Hepatol 2021; S1542-3565(21)00338-4. doi: 10.1016/ j.cgh.2021.03.028.
65. Malíčková K, Pešinová V, Bortlík M et al. Telemedicína a idiopatické střevní záněty – výsledky pilotního projektu IBD Asistent. Gastroent Hepatol 2020; 74(1): 18–27. doi: 10.14735/ amgh202018.
66. de Jong MJ, Boonen A, van der Meulen-de Jong AE et al. Cost-effectiveness of telemedicine-directed specialized vs standard care for patients with inflammatory bowel diseases in a randomized trial. Clin Gastroenterol Hepatol 2020; 18(8): 1744–1752. doi: 10.1016/j.cgh.2020.04.038.
67. Ahmed W, Galati J, Kumar A et al. Dual biologic or small molecule therapy for treatment of inflammatory bowel disease: a systematic review and meta-analysis. Clin Gastroenterol Hepatol 2022; 20(3): e361–e379. doi: 10.1016/j.cgh.2021.03.034.
68. Lukáš M, Kolář M, Vašátko M et al. Dual biological or small molecule treatment in inflammatory bowel diseases: data from clinical practice. Crohn’s Colitis Congress (virtual), January 20–22, 2022, Las Vegas, USA.
69. El-Dallal M, Chen Y, Lin Q et al. Meta-analysis of virtual-based chromoendoscopy compared with dye-spraying chromoendoscopy standard and high-definition white light endoscopy in patients with inflammatory bowel disease at increased risk of colon cancer. Inflamm Bowel Dis 2020; 26(9): 1319–1329. doi: 10.1093/ibd/izaa011.
70. Laine L, Kaltenbach T, Barkun A et al. SCENIC international consensus statement on surveillance and management of dysplasia in inflammatory bowel disease. Gastroenterology 2015; 148(3): 639–651. doi: 10.1053/j.gastro.2015.01.031.
71. Annese V, Daperno M, Rutter MD et al. European Crohn’s and Colitis Organisation. European evidence-based consensus for endoscopy in inflammatory bowel disease. J Crohns Colitis 2013; 7(12): 982–1018. doi: 10.1016/j.crohns.2013.09.016.
72. van der Woude CJ, Ardizzone S, Bengtson MB et al. The second European evidenced-based consensus on reproduction and pregnancy in inflammatory bowel disease. J Crohns Colitis 2015; 9(2): 107–124. doi: 10.1093/ecco-jcc/jju 006.
73. Cappell MS. Risks versus benefits of gastrointestinal endoscopy during pregnancy. Nat Rev Gastroenterol Hepatol 2011; 8(11): 610–634. doi: 10.1038/nrgastro.2011.162.
74. Ko MS, Rudrapatna VA, Avila P et al. Safety of flexible sigmoidoscopy in pregnant patients with known or suspected inflammatory bowel disease. Dig Dis Sci 2020; 65(10): 2979–2985. doi: 10.1007/s10620-020-06122-8.
75. de Lima A, Zelinkova Z, van der Woude CJ. A prospective study of the safety of lower gastrointestinal endoscopy during pregnancy in patients with inflammatory bowel disease. J Crohns Colitis 2015; 9(7): 519–524. doi: 10.1093/ecco-jcc/jjv079.
76. Ďuricová D, Krátká Z, Bortlík M et al. Idiopatické střevní záněty mají negativní dopad na reprodukční chování pacientů: první multicentrický průzkum v České republice. Gastroent Hepatol 2021; 75(1): 12–19. doi: 10.48 095/ccgh202112.
77. Duricova D, Dvorakova E, Hradsky O et al. Safety of anti-TNF-alpha therapy during pregnancy on long-term outcome of exposed children: a controlled, multicenter observation. Inflamm Bowel Dis 2019; 25(4): 789–796. doi: 10.1093/ibd/izy294.
78. Mahadevan U, Long MD, Kane SV et al. Pregnancy and neonatal outcomes after fetal exposure to biologics and thiopurines among women with inflammatory bowel disease. Gastroenterology 2021; 160(4): 1131–1139. doi: 10.1053/j.gastro.2020.11.038.
79. Mitrova K, Pipek B, Bortlik M et al. Differences in the placental pharmacokinetics of vedolizumab and ustekinumab during pregnancy in women with inflammatory bowel disease: a prospective multicentre study. Therap Adv Gastroenterol 2021; 14: 17562848211032790. doi: 10.1177/17562848211032790.
80. Mahadevan U, Dubinsky MC, Su C et al. Outcomes of pregnancies with maternal/Paternal exposure in the tofacitinib safety databases for ulcerative colitis. Inflamm Bowel Dis 2018; 24(12): 2494–2500. doi: 10.1093/ibd/izy160.
81. Fernández-Sánchez M, Ribes-Artero H, Fernández-Sánchez M et al. Fetal exposure to tofacitinib during the first trimester: a healthy newborn case report. Birth Defects Res 2021; 113(17): 1275–1279. doi: 10.1002/bdr2.1942.
82. LeBlanc JF, Wiseman D, Lakatos PL et al. Elderly patients with inflammatory bowel disease: updated review of the therapeutic landscape. World J Gastroenterol 2019; 25(30): 4158–4171. doi: 10.3748/wjg.v25.i30.4158.
83. Sturm A, Maaser C, Mendall M et al. European Crohn’s and colitis organisation topical review on IBD in the elderly. J Crohns Colitis 2017; 11(3): 263–273. doi: 10.1093/ecco-jcc/jjw188.
84. Beaugerie L, Carrat F, Colombel JF et al. Risk of new or recurrent cancer under immunosuppressive therapy in patients with IBD and previous cancer. Gut 2014; 63(9): 1416–1423. doi: 10.1136/gutjnl-2013-305763.
85. Beaugerie L, Kirchgesner J. Balancing benefit vs risk of immunosuppressive therapy for individual patients with inflammatory bowel diseases. Clin Gastroenterol Hepatol 2019; 17(3): 370–379. doi: 10.1016/j.cgh.2018.07.013.
86. Khoury W, Lavery IC, Kiran RP. Effects of chronic immunosuppression on long-term oncologic outcomes for colorectal cancer patients undergoing surgery. Ann Surg 2011; 253(2): 323–327. doi: 10.1097/SLA.0b013e3181fc9d36.
87. Ďuricová D, Lukáš M. Který typ biologické léčby zvolit u pacientů s idiopatickými střevními záněty? Remedia 2019; 29: 67–71.
88. Alsafi Z, Snell A, Segal JP. Prevalence of ‚pouch failure‘ of the ileoanal pouch in ulcerative colitis: a systematic review and meta-analysis. Int J Colorectal Dis 2022; 37(2): 357–364. doi: 10.1007/s00384-021-04067-6.
89. Shen B, Kochhar GS, Rubin DT et al. Treatment of pouchitis, Crohn‘s disease, cuffitis, and other inflammatory disorders of the pouch: consensus guidelines from the International Ileal Pouch Consortium. Lancet Gastroenterol Hepatol 2022; 7(1): 69–95. doi: 10.1016/S2468-1253(21)00214-4.
90. Truelove SC, Witts LJ. Cortisone in ulcerative colitis: final report on a therapeutic trial. Br Med J 1955; 2(4947): 1041–1048. doi: 10.1136/bmj.2.4947.1041.
91. Dinesen LC, Walsh AJ, Nedeljkovic Protic M et al. The pattern of severe ulcerative colitis. J Crohns Colitis 2017; 4: 431–434.
92. Singh S, Al-Darmaki A, Frolkis AD et al. Postoperative mortality among patients with inflammatory bowel diseases: a systematic review and meta-analysis of populations based studies. Gastroenterology 2015; 149(4): 928–937. doi: 10.1053/j.gastro.2015.06.001.
93. Turner D, Walsh CM, Steinhart AH et al. Response to corticosteroids in severe ulcerative colitis: a systematic review of the literature and a meta-regression. Clin Gastroent Hepatol 2007; 5(1): 103–110. doi: 10.1016/j.cgh.2006.09.033.
94. Spinelli A, Bonovas S, Burisch J et al. ECCO guidelines on therapeutics in ulcerative colitis: surgical treatment. J Crohns Colitis 2022; 16(2): 179–189. doi: 10.1093/ecco-jcc/jjab177.
95. Kucharzik T, Ellul P, Greuter T el al. ECCO guidelines for prevention, diagnoses and management of infections in inflammatory bowel disease. J Crohns Colitis 2021; 15(6): 879–913. doi: 10.1093/ecco-jcc/jjab052.
96. Lukáš M, Malíčková K. Epidemická infekční onemocnění a idiopatické střevní záněty. In: Lukáš M et al (eds). Idiopatické střevní záněty – nové trendy a mezioborové souvislosti. Praha: Grada Publishing, a. s. 2020.