Prométheus v léčbě akutního selhání jater v experimentu na velkém laboratorním zvířeti
Miroslav Ryska1, Eva Lásziková Orcid.org 2, Tomáš Pantoflíček Orcid.org , Ondřej Ryska Orcid.org 3, Josef Pražák, Eva Koblihová Orcid.org 4, Jelena Skibová Orcid.org
+ Pracoviště
Souhrn
Cíl studie: Zhodnotit účinek nové nebiologické eliminační metody - frakcionované plazmatické separaci a adsorpci (FPSA) přístrojem Prométheus u akutního selhání jater v experimentu na praseti.
Metodika: Čtrnáct prasat váhy 35-40 kg, u kterých jsme navodili ASJ chirurgickou devaskularizací jater s vytvořením portokavální anastomózy jsme napojili na FPSA. Měřili jsme hodnotu indikátorů ASJ včetně intrakraniálního tlaku. Výsledky jsme porovnali s kontrolní skupinou 7 prasat s ASJ bez léčby. Získané údaje jsme statisticky zpracovali pomocí Mannova-Whitneyova testu. Byly vypočteny též plochy pod křivkou (AUC).
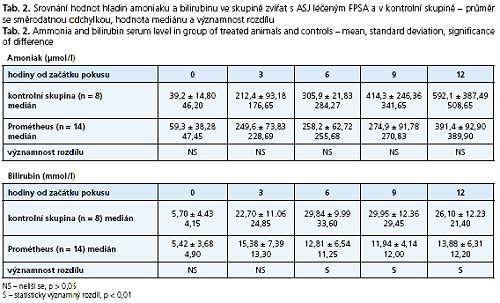
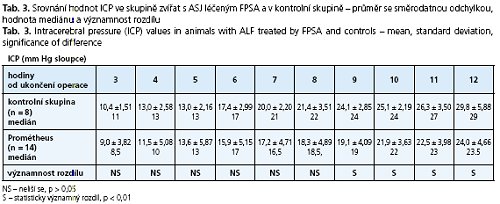
Výsledky: Hladina bilirubinu se v experimentální skupině oproti kontrolní signifikantně lišila ve prospěch skupiny s léčbou FPSA (p < 0,01): v 6. hodině 12,81 ± 6,54 vs. 29,84 ± 9,99, v 9. hodině 11,94 ± 4,14vs. 29,95 ± 12,36 ave 12. hodině 13,88 ± 6,31 vs. 26,10 ± 12,23 mmol/1. Signifikantní rozdíl u hodnot amoniaku jsme nenašli. Hodnoty ICP se statisticky významně lišily od 9. hodiny po 12 hodinu ve prospěch skupiny léčené FPSA (p < 0,01): 9. hodina 19,1 ± 4,09 vs. 24,1 ± 2,85, 10. hodina 21,9 ± 3,63 vs. 25,1 ± 2,19, 11. hodina 22,5 ± 3,98 vs. 26,3 ± 3,50, 12. hodina 24,0 ± 4,66 vs. 29,8 ± 5,88 mm Hg sloupce. U hladiny bilirubinu byla hodnota plochy pod křivkou (AUC) u kontrolní versus experimentální skupiny 293,2 ± 107,8 vs. 144,1 ± 59,6 (p < 0,01), u amoniaku byl rozdíl hodnot AUC v celém průběhu experimentu nesignifikantní: 3744,8 ± 1814,4 vs. 3043,7 ± 800,1 (ns.). Pro AUC u ICP obou skupin zvířat byl signifikantní rozdíl na hladině p < 0,05: 157,7 ± 10,25 vs. 138,4 ± 30,3.
Závěr: Autoři prokázali na experimentálním chirurgickém modelu akutního jaterního selhání u prasete signifikantní snížení sérové hladiny bilirubinu a snížení intrakraniálního tlaku při léčbě frakcionovanou plazmatickou separací a adsorpcí (přístroj Prométheus) ve srovnání s kontrolní skupinou bez léčby
Klíčová slova: akutní jaterní selhání - FPSA -intrakraniální tlak.
Autoři toto sdělení věnují kolektivu prof. MUDr. J. Horáka CSc, který před 30 lety prokázal v experimentu na psech s akutním jaterním selháním detoxikační účinek hemoperfuze kapslí s aktivním uhlím.
ÚVOD
Akutní selhání jater (ASJ) je klinickým syndromem vzniklým na podkladě masivní nekrózy jaterních buněk, jehož výsledkem je selhání jaterních funkcí. Přežití nemocných dosahuje v závislosti na progresi encefalopatie a výskytu fatálních infekčních komplikací při konzervativní terapii pouhých 10-40 %(1). Ortotopická transplantace jater (TJ) je v současné době nejefektivnější metodou, která signifikantně zlepšuje šance nemocného na přežití(2). V době, po kterou pacient čeká na vhodného dárce jaterního štěpu, či po kterou může dojít nebo dochází ke spontánní regeneraci jaterního parenchymu, je pacient akutně ohrožen na životě, a to především rozvojem ireverzibilního poškození mozku edémem na základě zvyšujícího se intrakraniálního tlaku (ICP) a možnou herniací mozkové tkáně v oblasti mozkového kmene(3). Současné možnosti jak pacienta přes toto období převést (tzv. „bridging") jsou limitovány.
V posledních 20 letech dochází k rozvoji biologických i nebiologických eliminačních metod, které by umožňovaly efektivní bridging, a tím zlepšily šanci nemocného s ASJ přežít. Z biologických metod se jedná především o tzv. bioartificiální játra (BAL), která využívají k perfuzi zvířecí či lidské hepatocyty. Sami jsme BAL v léčbě ASJ v experimentu vyzkoušeli(4,5). Z nebiologických metod klinické uplatnění nalezl v 90. letech minulého století systém MARS(6). Nověji se začíná uplatňovat systém FPSA (Fractionated Plasma Separation and Absorption)(7).
Cílem předkládané studie je prokázat efektivitu této nebiologické eliminační metody u ASJ v experimentu na velkém laboratorním zvířeti.
MATERIÁL A METODIKA
K experimentu jsme použili chirurgický model ASJ u prasete váhy 35-40 kg. Metodiku vyvolání ASJ s provedením chirurgické devaskularizace jater s portokavální anastomózou (PCA) a monitorace hemodynamiky i laboratorních parametrů jsme popsali v našich předchozích publikacích(8-11).
Zapojení eliminačního přístroje a monitorace
Po chirurgické devaskularizaci jater jsme prase uložili na levý bok, zahřívali a ventilovali směsí kyslíku se vzduchem s FiO2 0,4. Intravenózně jsme podávali analgosedaci s využitím farmak s převážně mimojaterní cestou eliminace: kombinaci propofolu v úvodní dávce 2 mg/kg/hod (Diprivan, AstraZeneca, UK), fentanylu v úvodní dávce 5 μg/kg/min (Fentanyl Torrex, Torrex Chiesi Pharmy GmbH, Rakousko) a medetomidinu v úvodní dávce 1 μg/ kg/hod (Domitor, Phizer, USA). Podle potřeby podávali krystaloidní, koloidní roztoky a noradrenalin (Noradrenalin, Léčiva, ČR), k forsírování diurézy eventuálně bolusově furosemid (Furosemid, Hoechst-Biotika, SR). Monitorovali jsme parametry hemodynamiky, SpO2, ETCO2, tělesnou teplotu a hodinovou diurézu. V pravidelných intervalech jsme odebírali krevní vzorky na stanovení vnitřního prostředí, hodnot iontů, glykémie, krevního obrazu, parametrů hemokoagulace, jaterních testů a sérového kreatininu(12). Monitoraci intrakraniálního tlaku (ICP) jsme zahájili 3. hodinu po nástupu ASJ zavedením čidla (fy Codman, Johnson and Johnson, USA) (obr. 1).
Nástup ASJ jsme zaznamenali v čase poklesu glykémie pod hodnoty 3,5 mmol/1. Tento moment byl počátkem otevření tzv. terapeutického okna a zahájením eliminační terapie. K provedení eliminační metody FPSA jsme použili přístroj Prométheus firmy Fresenius, Německo (obr. 2). Normoglykémii v průběhu terapie jsme udržovali adekvátní infuzí roztoku 40% glukózy.
Monitoraci hodnot jednotlivých laboratorních ukazatelů ASJ jsme prováděli po celou dobu operace, rozvoje ASJ a léčby FPSA až do doby plánovaného exitu zvířete. Hodnoty ICP jsme měřili po zavedení čidla od 3. hodiny po nástupu ASJ.
Získané hodnoty laboratorních vyšetření v průběhu léčby ASJ připojením na Prométheus jsme porovnali s parametry kontrolní skupiny 8 zvířat stejné váhové kategorie, u kterých bylo vyvoláno ASJ identickým operačním výkonem a která nebyla na Prométheus napojena.
STATISTICKÉ ZPRACOVÁNÍ VÝSLEDKŮ
Získané údaje jsme statisticky zpracovali pomocí Mannova-Whitneyova testu. Dále jsme provedli výpočet plochy pod křivkou (AUC).
Prohlášení
Předoperační přípravu, operaci a pooperační péči jsme prováděli v souladu se zákonem ČR § 12 vyhlášky č. 311/97 Sb., o chovu a využití pokusných zvířat.
VÝSLEDKY

Kontrolní skupina
Kontrolní skupinu s vyvolaným ASJ devaskularizační metodou jsme vytvořili z 8 prasat váhy 35-40 kg. V této skupině jsme ASJ neléčili, udržovali jsme pouze vnitřní prostředí podáním minerálů a infuzí krystaloidů. Farmaka ovlivňující ICP (kortikoidy, hyperosmolární látky apod.) jsme nepodávali. Získané laboratorní hodnoty sérových hladin bilirubinu a amoniaku a hodnoty ICP jsou uvedeny ve společných tabulkách níže.
Experimentální skupina
Prométheus jsme použili k léčbě 20 prasat váhy 35-40 kg, u kterých jsme vyvolali ASJ chirurgickou devaskularizací. Z tohoto celkového množství jsme 6 zvířat do sestavy nezařadili - použili jsme je k provedení nácviku metodiky. Při eliminační terapii byl pro snížení srážlivosti krve použit u poloviny prasat Heparin, u druhé poloviny citrát sodný.
U skupiny 14 zařazených zvířat jsme v průměru 3 hod. 17 minut (rozmezí: 2 hod. 15 min - 4 hod. 20 min) po provedení devaskularizace zahájili léčbu FPSA, která trvala průměrně 5 hod. 54 min (rozmezí: 5 hod. 45 min - 6 hod.). Délka operace činila v průměru 1 hod. 40 min časový interval na svorce při vytvoření PCA v průměru 18 min, celkový interval mezi časem naložení svorky a napojením přístroje Prométheus 3 hod. 17 min (tab. 1).

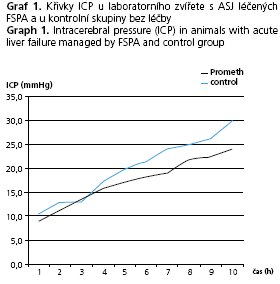
V tabulce 2 je uvedeno srovnání laboratorních hladin amoniaku a bilirubinu v séru zvířat s ASJ léčených pomocí FPSA s průměrnými hodnotami laboratorních ukazatelů kontrolní skupiny s ASJ bez léčby eliminační metodou včetně mediánu hodnot a zhodnocením významnosti rozdílu. ICP u obou skupin je vyčísleno v tabulce 3, opět s vyjádřením mediánu hodnot a významnosti rozdílu mezi kontrolní a experimentální skupinou zvířat. Průběh křivky hodnot intrakraniálního tlaku je znázorněn v grafu 1. Hladina bilirubinu se v experimentální skupině oproti kontrolní signifikantně lišila od 6. do 12. hodiny ve prospěch skupiny s léčbou FSPA (p < 0,01): v 6. hodině 12,81 ± 6,54 vs. 29,84 ± 9,99, v 9. hodině 11,94 ± 4,14 vs. 29,95 ± 12,36 a ve 12. hodině 13,88 ± 6,31 vs. 26,10 ± 12,23 mmol/1.
Statisticky signifikantní rozdíl ve srovnání laboratorních hodnot hladin amoniaku mezi kontrolní a experimentální skupinou nebyl nalezen.
Hodnoty ICP ve skupině léčené pomocí FPSA a ve skupině kontrolní se v průběhu experimentu statisticky významně lišily od 9. hodiny po 12 hodinu ve prospěch skupiny léčené FPSA(p < 0,01): 9. hodina 19,1 ± 4,09 vs. 24,1 ± 2,85, 10. hodina 21,9 ± 3,63 vs. 25,1 ± 2,19, 11. hodina 22,5 ± 3,98 vs. 26,3 ± 3,50, 12. hodina 24,0 ± 4,66 vs. 29,8 ± 5,88 mm Hg sloupce. V doplnění statistického zpracování jsme vyčíslili velikosti ploch pod křivkou (AUC). U hladiny bilirubinu byla hodnota AUC u kontrolní versus experimentální skupiny 293,2 ± 107,8 vs. 144,1 ± 59,6 (p < 0,01), u amoniaku byl rozdíl hodnot AUC v celém průběhu experimentu nesignifikantní: 3744,8 ± 1814,4 vs. 3043,7 ± 800,1 (ns.). Pro AUC u ICP obou skupin zvířat byl nalezen signifikantní rozdíl na hladině p < 0,05: 157,7 ± 10,25 vs. 138,4 ± 30,3.
Hodnoty dalších laboratorních hodnot - AST, ALT, kreatininu, albuminu a Quick - se v obou skupinách zvířat signifikantně nelišily a v tabulce výsledků je proto neuvádíme.
DISKUZE
Akutní selhání jater, často nazývané vzhledem k rychlému nepříznivému vývoji pro pacienta fulminantním, je poměrně řídce se vyskytující syndrom s vysokou mortalitou. Ta závisí na věku pacienta: u mladších je 65-70 %, u starších až 90 %(12). Zatímco u menší části nemocných dojde k regeneraci jaterního parenchymu, a tím ke spontánnímu přežití, u větší části nemocných rozvoj onemocnění nepříznivě pokračuje. Za příznaků hrozící sepse při multiorgánovém selhání pacient většinou zmírá na ireverzibilní poškození mozku při zhoršující se perfuzi mozkové tkáně a narůstajícím intrakraniálním tlaku(3). U těchto nemocných je jedinou účinnou léčbou urgentní transplantace jater (TJ)(2). Té se však vzhledem k nedostatku vhodného dárce jater v daném momentu urgentní příjemce nemusí dočkat. Významné procento nemocných tak zemře na čekací listině, aniž by bylo možné TJ provést. K překlenutí kritického období, kdy vlastní játra nejsou schopna zajistit bazální metabolické potřeby organizmu nemocného, tzv. „bridging", a to jak při postupné spontánní regeneraci jaterní tkáně, tak i při čekání na TJ, byla navržena od 50. let minulého století celá řada postupů a zkonstruována řada eliminačních přístrojů. Od prosté hemodialýzy a výměnné krevní transfuze, přes perfuzi krve přes živá prasečí či lidská kadaverózní játra, plazmaferézu, hemoperfuzi pomocí aktivního uhlí až k současným sofistikovaným biologickým či nebiologickým eliminačním přístrojům(13).
Poslední v řadě nebiologických postupů používá přístroj nazvaný podle řeckého Boha Prométheus(14). Provádí detoxikaci organizmu nemocného s ASJ frakcionovanou plazmatickou separací a adsorpcí - FPSA (Fractionated Plasma Separation and Absorption). Podpora vlastních selhávajících jater umožňuje eliminovat jak toxické substance rozpuštěné ve vodě, tak i toxiny vázané na albumin. Přístroj se skládá z dialyzačního přístroje FMC 4008H rozšířeného o modul pro frakcionovanou plazmatickou separaci albuminovým filtrem a dvěma adsorbery Albumin s vázanými toxiny je přímo transportován na místo, kde jsou toxiny odstraněny. Proto není potřeba lidského albuminu a proces není limitován disociací z albuminu a difúzí tak, jak je tomu u předchozího nebiologického podpůrného přístroje MARS (molecular adsorbent recirculating systém) vyvinutého Stangem a Mitznerem na začátku 90. let minulého století(6).
Přístroj Prométheus má tzv. „Albu flow filtr" s polysulfonovou membránou neutrálního pryskyřičného adsorbéru - Prométh 01. Ten propouští molekuly do velikosti 250 kD. Tak pronikají filtrem i molekuly albuminu, zatímco fibrinogen nikoliv. Tím dochází k adsorpci žlučových kyselin, aromatických aminokyselin, fenolických substancí a toxinů. Druhý adsorber - Prométh 02 - se styren-divinylbenzen kopolymerem s prostorovou sítí 100 um vychytává negativně nabité ligandy (nekonjugovaný bilirubin). Ve vodě rozpustné substance jsou odstraňovány hemodialýzou(14). Celý přístroj, založený na dialyzační jednotce 4008H, je „all-in-one" extrakorporální podpůrný systém s FPSA a hemodialýzou integrován do jednoho celku. V případě, že není zapojen jako eliminační systém k „bridging" terapii ASJ, lze ho využívat rutinně ke konvenční hemodialýze u renálně selhávajících nemocných.
Klinické zkušenosti s přístrojem Prométheus potvrzují bezpečnost léčby u nemocných s ASJ a efektivitu při odstranění na albumin vázaných toxinů a ve vodě rozpustných substancí. Rifai K. se spoluautory(7) jako první na 11 nemocných s ASJ prokázal signifikantní snížení sérové hladiny konjugovaného bilirubinu, žlučových kyselin, amoniaku, cholinesterázy, kreatininu a urey. Také v prospektivní studii na 10 nemocných nezaznamenal komplikace metody při dvou po sobě následujících minimálně 4 hodiny trvajících eliminacích(15). V randomizované studii s malým počtem nemocných s ASJ Aleman se spoluautory(16) porovnali vliv albuminové dialýzy (MARS) a FPSA (Prométheus) na hemodynamiku a vazoaktivní látky u nemocných s ASJ u chronického alkoholického poškození jater. Oba postupy prokázaly srovnatelný vliv na hemodynamiku a hladinu vázo aktivních látek, ve snížení hladiny bilirubinu byl úspěšnější Prométheus. Pouze MARS však signifikantně zlepšil střední arteriální tlak a systémovou vaskulární rezistenci. Srdeční index nebyl ani jedním z přístrojů ovlivněn. Stadlbauer se spoluautory(17) u pacientů s totožnou diagnózou prokázali, že cytokiny jsou eliminovány oběma přístroji srovnatelně, nicméně jejich hladina v séru ovlivněna není. In vivo provedená kvantifikace srovnání obou eliminačních metod prokázala na 8 nemocných signifikantně vyšší clearence jak albuminových ligandů, tak i ve vodě rozpustných substancí. Nekonjugovaný bilirubin byl eliminován pouze FPSA(18). Z 31 nemocného zařazeného v klasifikaci UNOS-1 (extra-urgentní indikace k TJ) použili Prométheus s dobrými výsledky v rámci „bridging therapy" u 8 nemocných Nyckowski se spoluautory(19). I z dalších publikovaných studií(20,21) vyplývá zlepšení biochemických markerů ASJ, nicméně exaktní přínos eliminační léčby ve zlepšení přežívání nemocných je obtížně hodnotitelný na základě víceméně kazuistických zkušeností. Proto je opakovaně voláno po provedení randomizovaných studiích(15-17).
Co lze obtížně provést v klinice, lze provést v experimentu na zvířatech(22). Z těchto důvodů jsme přistoupili k naší studii. K provedení experimentální práce jsme použili osvědčený chirurgický model ASJ u prasete(8). Jak v experimentální, tak i kontrolní skupině bez léčby pomocí FPSA jsme monitorovali nástup ASJ po devaskularizaci jater a vytvoření portokaválního shuntu. Léčbu FPSA jsme zahájili v průměru 3 hod. 17 min po provedení devaskularizace. U všech zvířat jsme zavedli čidlo k měření ICR Měřili jsme biochemické hodnoty transamináz, Quick, amoniaku, bilirubinu, kreatininu a albuminu. Dále Astrup a ICR V souladu s literaturou jsme nepovažovali změny v hodnotě transamináz za směrodatné(23). Ani hodnoty Quick, kreatininu a albuminu nebyly v obou skupinách signifikantně rozdílné. Za zásadní považujeme signifikantní rozdíly v hladinách bilirubinu, které jsme dosáhli od 6. hodiny po zahájení léčby FPSA. Hodnoty amoniaku byly také u experimentální skupiny výrazně nižší, nicméně významnost rozdílu obou skupin jsme statisticky neprokázali. Jako důvod vidíme příliš velké hodnoty SD u kontrolní skupiny. To je pravděpodobně i důvodem, proč i ostatní statistické metody, zejména plocha pod křivkou, neprokázala významnost rozdílu.
Za nejcennější považujeme prokázání signifikantního vlivu FPSA na snížení intrakraniálního tlaku, který na rozdíl od kontrolní skupiny nepřekročil hodnotu 25 mm Hg sloupce a nedostal se na úroveň, při které již hrozí poškození mozkové tkáně(3). V současné dostupné literatuře jsme tato měření provedená v experimentu nenašli.
ZÁVĚR
Autoři prokázali na experimentálním chirurgickém modelu akutního jaterního selhání u prasete signifikantní snížení hladiny bilirubinu při léčbě frakcionovanou plazmatickou separací a adsorpcí (přístroj Prométheus) ve srovnání s kontrolní skupinou bez léčby. Také hodnoty intrakraniálního tlaku byly signifikantně nižší než u kontrolní skupiny.
LITERATURA
- 1. Lee WM. Acute liver failure. NEJM 329, 1993: 1862-1872.
- 2. Bismuth , Samuel D, Castaing D, et al. Orthotopic liver transplantation in fuminant and subfulminant hepatitis. Ann Surg 1995; 222: 109-119.
- 3. Detry , De Roover A, Honoré P, et al. Brain edema and intracranial hypertension in fulminant hepatic failure: pathophysiology and management. World J Gastroenterol 2006; 12: 7405-7412.
- 4. Ryska M, Kieslichová E, Pantoflíček T, et al. Bioeliminace v léčbě akutního selhání jater v experimentu na velkém laboratorním zvířeti. Čes Slov Gastroent Hepatol 2006; 60: 157-162.
- 5. Ryska M, Kieslichová E, Pantoflicek T, et al. Bioartificial liver in the treatment of experimental acute liver failure does not decrease intracranial pressure. World J Gastroenterol (v tisku).
- 6. Stange J, Ramlow W, Mitzner S, et al. Dialysis against a recycled albumin solution enables the removal of albumin-bound toxins. Artur Organs 1993; 17: 809-813.
- 7. Rifai K, Ernist T, Kretschmer U, et al. Prometheus - a new extracorporeal system for the treatment of liver failure. J Hepatol 2003; 39: 984-990.
- 8. Ryska M, Kieslichová E, Pantoflíček T, et al. Devascularization Surgical Model of Acute Liver Failure in Minipigs. Eur Surg Res 2004; 36: 179-184.
- 9. Ryska M, Kieslichová E, Pantoflíček T, et al. Chirurgický model akutního selhání jater u laboratorního miniprasete. Čes Slov Gastroent Hepatol 2004; 58: 83-88.
- 10. Ryska M, Kieslichová E, Pantoflíček T, et al. Model akutního selhání jater u miniprasete z hlediska chirurga a anesteziologa. Rozhl Chir 2004; 83: 436-442.
- 11. Kieslichová E, Ryska M, T. Pantoflíček T, et al. Hemodynamic Parameters in a Surgical Devascularization Model of Fulminant Hepatic Failure in the Mini-pig. Phys Res 2005; 54: 485-490.
- 12. Hoofnagle JH, Carithers RL, Shapiro C, et al. Fulminant hepatic failure: summary of a workshop. Hematology 1995; 21: 240-252.
- 13. Williams R. The elusive goal of liver suport-quest for the Holy Gril. Clin Med 2006; 6: 482-487.
- 14. Falkenhage D, Strobl W, Vogt G, et al. Fractionated plasma separation and absorption systém: a novel systém for blood purification to remove albumin bound substance. Artur Organs 1999; 23: 81-86.
- 15. Rifai K, Ernst T, Kretschmer U, et al. The Prométheus device for extracorporeal support of combined liver and renal failure. Blood Purif 2005; 23: 298-302.
- 16. Aleman W, A, Evenepoel P, et al. Effect of the molecular adsorbent recirculating systém and Prométheus device on systemic haemodynamics and vasoactive agents in patiens with acute-on-chronic alcoholic liver failure. Crit care 2006; 10: R108 (do:10.1186/cc4985).
- 17. Stadlbauer V, Krisper P, signet B, et al. Effect of extracorporeal liver support by MARS and Prométheus on serum cytokines in acute-on-chronic liver failure. Crit care 2006; 10: R169(do:10.1186/ cc5119).
- 18. Krisper P, Haditých B, Stauber R, et al. In vivo quantification of liver dialysis: comparison of albumin dialysis and fractionated plasma separation. J Hematology 2005; 43: 451-457.
- 19. Nyckowski P, Skwarek A, Zieniewicz K, et al. Orthotopic liver transplantation for fulminant hepatic failure. Transplant Proc 2006; 38: 219-220.
- 20. Evenepoel P, Aleman W, A, et al. Detoxifying capacity and kinetics of Prométheus - a new extracorporeal systém for the treatment of liver failure. Blood Purif 2005; 23: 349-358.
- 21. Santoro A, Faenza S, Mancini E, et al. Prométheus systém: a technological support in liver failure. Transplant Proc 2006; 38: 1078-1082.
- 22. Sheil AGR, Sun J, Wang L, et al. A biodialysis system for liver support tested in a porcine hepatic failure model. Aust N Z J Surg 2000; 70: 127-131.
- 23. Carraro P, Burighel D, De Silvestro G, et al. Early prognostic biochemical indicators of fulminant hepatic failure. Int J Clin Lab Res 1998; 28: 196-199.
- 24. Horák J, Horky J, Rabi M. Haemoperfusion through activeted charcoal in dogs with fulminant liver failure. Digestion 1980; 20: 22-30.
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené