Překvapivá etiologie stenózy terminálního choledochu
Jan Vašíček1, Ivo Horný1
+ Pracoviště
Souhrn
Autoři prezentují případ pacientky s nejasnou stenózou terminálního choledochu projevující se ikterem a opakovanými ataky akutní cholangoitidy. Popisují diagnostický postup ke zjištění etiologie stenózy, přičemž vylučují jak maligní etiologii stenózy, tak se zabývají též diferenciální diagnózou benigní etiologie stenóz. Přesto bylo k definitivnímu zjištění zapotřebí až klinické pitvy (pro rychle progredující klinický stav pacientky), která odhalila adenokarcinom žlučníku s generalizací do duodena, pankreatu, peripankreatických lymfatických uzlin, do plic a žlučových cest, kde vytvářel stenózu choledochu. Na závěr byly podány základní informace o karcinomu žlučníku, jeho incidenci, rizikových faktorech, diagnostice a léčbě.
Klíčová slova
hlavní žlučový vývod, malignita, stenóza, žlučníkÚvod
V článku je prezentován překvapivý nález etiologie stenózy terminálního choledochu formou kazuistiky. Etiologie stenózy choledochu je celá řada, základní dělení stenóz je na maligní a benigní. Nejčastější příčinou maligní stenózy je karcinom pankreatu či cholangiocelulární karcinom, velmi malou část tvoří metastázy jiných malignit (nejčastěji kolorektálního karcinomu). Benigní stenózy choledochu indukuje až ve 30 % chronická pankreatitida (ChP) následovaná iatrogenními příčinami stenóz (po operaci žlučníku či po operaci jater), primární sklerozující cholangoitidou, IgG4 (imunoglobulin G4) sklerozující cholangoitidou, eozinofilní cholangoitidou, folikulární cholangoitidou či Mirizziho syndromem [1]. Žlučové cesty mohou být utlačeny též extramurálně, např. při lymfadenopatii [1]. Prvním a nejčastějším příznakem stenózy bývá nebolestivý obstrukční ikterus. Základním a vstupním vyšetřením jsou laboratorní testy. Ve většině případů dochází k elevaci obstrukčních enzymů gama-glutamyltransferázy (GGT), alkalické fosfatázy (ALP) a konjugovaného bilirubinu. Vyšetření ultrasonografií (USG) je základní a v rukou zkušeného sonografisty nesmírně cennou metodou. Sonografickou charakteristikou extrahepatální cholestázy je dilatace žlučových cest (ať již intra-či extrahepatálních). Často je možné již při abdominální sonografii zjistit příčinu obstrukce (choledocholitiáza, tumor pankreatu, žlučových cest, jater či žlučníku). V případě sonografistou vysloveného podezření na tumorózní příčinu obstrukčního ikteru (ať již maligní nebo benigní) je standardně indikováno CT jater a podjaterní krajiny vč. pankreatu. Po sonografickém a CT vyšetření musí být pečlivě zvážena možnost kurativní operace (při podezření na maligní tumor pankreatu). V případě, že operace není indikována, je další vhodnou metodou ve vyšetřovacím protokolu nebolestivého ikteru endoskopická retrográdní cholangiopankreatografie (ERCP). Vyšetření detekuje místo stenotického úseku, rozsah postižení a lze odebrat vzorky na histologii (brush cytologie). Na závěr výkonu lze implantovat do žlučových cest různé typy duodenobiliárních endoprotéz, a tím provést desobstrukci žlučových cest. K preciznímu určení etiologie stenózy volíme doplňující vyšetření, většinou dle lokalizace stenózy. Nejcennější metodou je endoskopická ultrasonografie (EUS), která nám v rukou zkušeného endosonografisty potvrdí či vyloučí patologický proces v pankreatu či žlučových cestách. V případě patologického nálezu můžeme získat přímo vzorek na histologické vyšetření pomocí aspirační biopsie tenkou jehlou (FNAB – fine needle aspiration biopsy). Novější a rychle se rozvíjející metodou je cholangioskopie, při které lze přímo vizualizovat stenotický úsek a odebrat pod zrakovou kontrolou tkáň přímo z postiženého úseku žlučových cest. Jako doplňující vyšetření k ozřejmění etiologie stenóz mohou výrazně pomoci radiodiagnostické metody jako magnetická rezonance (MR) či pozitronová emisní tomografie v kombinaci s RTG počítačovou tomografií (PET-CT). Nesmíme zapomenout na vyšetření onkomarkerů CEA (carcinoma embryonic antigen) a CA (carcinoma antigen) 19-9 v krvi, které mohou pomoci při rozhodování o etiologii stenózy žlučových cest.
Kazuistika
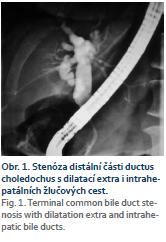
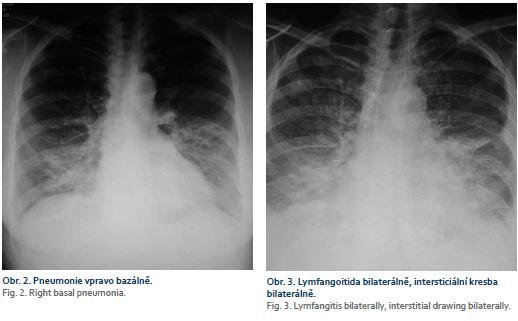
Naše kazuistika pojednává o 64leté pacientce, která do té doby byla sledována pouze pro revmatoidní artritidu, nekouřila, alkohol pila pouze příležitostně, chronickou medikaci neužívala, též rodinná anamnéza byla bez pozoruhodností. Týden před příjmem na naše oddělení byla vyšetřena u ambulantního gastroenterologa pro bolesti v pravém podžebří po dietní chybě. Sonograficky byla zjištěna cholecystolitiáza, bylo vysloveno podezření na drobný výpotek v okolí nezvětšené hlavy pankreatu, laboratorně byla patrna hraniční hodnota amylázy a lipázy. Opakovaně byla vyšetřována na chirurgické ambulanci, léčena konzervativně spazmolytiky. V krátké době se objevily známky obstrukčního ikteru (ikterus, světlá stolice, tmavá moč, pruritus kůže celého těla), na kontrolní USG břicha provedené u ambulantního gastroenterologa byla patrná dilatace extra-i intrahepatálních žlučových cest. K nám přichází ke konci 2/2016 k provedení ERCP pro suspektní choledocholitiázu. Při příjmu se cítila až na pruritus dobře, abdominalgie neměla, 1× byla subfebrilní. Tvrdila, že cíleně zhubla od 1/2016 cca 7 kg. Vstupní laboratorní vyšetření byla zcela v normě kromě jaterních testů, kde byly patrny známky obstrukce žlučových cest – aspartátaminotransferáza 2,41 µkat/l, alaninaminotransferáza 2,53 µkat/l, GMT 7,96 µkat/l, ALP 11,92 µkat/l, celkový bilirubin 75 µmol/l). Vzhledem k dobrému celkovému zdravotnímu stavu bylo indikováno ERCP, během kterého byla překvapivě zjištěna stenóza distálního choledochu (obr. 1). Byla provedena drenáž žlučových cest implantací 7 cm dlouhého duodenobiliárního (DB) stentu šíře 10 Fr typu Amsterdam, výkon i postprocedurální průběh byl bez komplikací, následující den bylo patrné zlepšení laboratorních výsledků. Pro celkem překvapivou stenózu byla provedena další vyšetření. Onkomarkery CEA i CA 19-9 byly negativní, na CT bylo popsáno pouze hypodenzní ložisko dorzálně u hlavy pankreatu velikosti 14 mm, v. s. tumorózní a známky chronické cholecystitidy (zesílená stěna žlučníku). Jako další vyšetření byla provedena EUS pankreatu s nálezem homogenní struktury hlavy pankreatu, lehkého edému v okolí, bez jasné expanze, ductus choledochus byl špatně přehledný, vyplněn duodenobiliární endoprotézou, byl popsán lehce dilatovaný ductus Wirsungi na 4 mm. Nález svědčil spíše pro zánětlivou expanzi v hlavě pankreatu. Vzhledem k nálezu na ERCP byla provedena FNAB z hlavy pankreatu – bez nálezu atypických maligních buněk či známek ChP. Stav ke konci této hospitalizace byl uzavřen jako stenóza terminálního choledochu, pravděpodobně při zánětlivém tumoru hlavy pankreatu (ke konci 2/2016). Přesto byla doplněna další vyšetření (IgG4 v krvi, objednáno PET-CT, naplánována cholangioskopie). Pacientka byla po propuštění zcela bez obtíží. Na kontrolní USG břicha týden po propuštění byla popsána mírně zvětšená homogenní hlava pankreatu, bez známek edému v okolí pankreatu. V polovině 3/2016 byla pacientka přijata k přeléčení akutní cholangitidy na interní oddělení. Po týdenní léčbě antibiotiky (ATB) a provedení výměny DB stentu byla propuštěna do domácí péče. Na konci 3/2016 podstoupila pacientka PET-CT s nálezem metabolicky aktivní infiltrace dorzální části hlavy pankreatu s výraznou cholecystitidou a metabolicky aktivními uzlinami v dolním jugulu, v oblasti krku, v nadklíčkové oblasti oboustranně, v mediastinu, v plicních hilech, v podbráničních uzlinách, v okolí hlavy pankreatu a retroperitoneu. Byla popsána oboustranná zánětlivá infiltrace plic. Po obdržení výsledků byla pacientka kontaktována. Již v té době užívala od praktického lékaře pro zánětlivou infiltraci na RTG plic ATB terapii (Amoksiklav + Klacid). Přesto se celkový stav pacientky zhoršoval. Pro progresi dyspnoe, febrilie a přetrvávající nález pravostranné bazální pneumonie na kontrolním RTG (obr. 2) byla přijata na plicní oddělení naší nemocnice k intravenózní ATB terapii (Cefotaxim, Azitromycin), sérologicky byly pozitivní protilátky proti Mycoplasma pneumoniae ve třídě imunoglobulinu A (Ig) i IgG. Na kontrolním RTG srdce a plic nebyla patrna regrese nálezu. Laboratorně a subjektivně došlo ke zlepšení stavu. Ke konci hospitalizace bylo provedeno znovu EUS vyšetření pankreatu a žlučových cest s nálezem expanze hlavy pankreatu spíše již maligního vzhledu s pozitivními uzlinami. Byla provedena re-FNAB, ovšem opětovně s onkologicky negativním výsledkem. V krátké době byla pacientka rehospitalizována pro dušnost na plicním oddělení. Po RTG plic (obr. 3) a na základě laboratorních výsledků proběhlo CT hrudníku s nálezem kombinace intersticiální pneumonie a intersticiálního plicního edému. Vzhledem k celkovému stavu byla přeložena na JIP interního oddělení k intenzivní léčbě. Provedená vyšetření nesignalizovala infekční etiologii, byl zvažován i autoimunitní proces (IgG4 asociovaná nemoc – IgG4-related disease). Stav se však nelepšil ani po vysokých dávkách kortikoidů. Pro progresi fluidothoraxu byla provedena punkce. V punktátu byly zachyceny atypické nádorové elementy, v. s. karcinomového původu. Stav byl uzavřen jako karcinomatózní postižení plic. Kontrolní hladina onkomarkeru CA 19-9 byla mírně elevována na 50,5 IU/ml, hodnota CEA byla v normě. Klinický stav pacientky postupně progredoval, až na začátku 6/2018 vyústil v exitus letalis. Teprve výsledek klinické pitvy nám dal definitivní diagnózu, která byla pro nás překvapivá – adenokarcinom žlučníku s generalizací do duodena, pankreatu, peripankreatických lymfatických uzlin, do plic a žlučových cest, kde vytvářel stenózu choledochu. Jako vedlejší nález byly popsány známky lehké ChP a perforace stěny žlučníku se vznikem pericholecystického abscesu.
Diskuze
Karcinom žlučníku patří v ČR k celkem vzácným nádorům, incidence se pohybuje kolem 1,7/100 000 obyvatel, přičemž má dle dostupných informací klesající tendenci [2]. Onemocnění má vysoce nepříznivou prognózu, kdy pouze cca 5–15 % pacientů přežije 5 let [3].
Histologicky se jedná především o adenokarcinom. Vzácnější formy jsou mucinózní, papilární, skvamózní či adenoskvamózní [4]. Byly popsány též raritní případy jiných typů nádorů, jako např. neuroendokrinní tumor, který nelze rozlišit zobrazovacími metodami od jiných histologických typů. Diagnostika se získá až po histologickém vyšetření resekátu a imunohistochemickém vyšetření [5]. Přibližně 60 % karcinomů vyrůstá ve fundu žlučníku, 30 % v těle žlučníku a 10 % v krčku žlučníku [4].
Častější výskyt se popisuje u pacientů ženského pohlaví, a to v poměru 2: 1. Rizikových faktorů pro vznik karcinomu je popsána celá řada. Byla prokázána asociace s familiární adenomatózní polypózou, Gardnerovým syndromem, Peutz-Jeghersovým syndromem. Velmi riziková se zdá přítomnost porcelánového žlučníku [4]. Byla popsána progrese z adenomového polypu žlučníku do karcinomu, proto by se polypy žlučníku měly pomocí USG sledovat a při rychlé progresi či dosažení velikosti 10 mm by měla být indikována cholecystektomie [6]. Chronická infekce salmonelou může být též důležitý faktor v patogenezi vývoje karcinomu. Byla popsána vyšší prevalence u pracovníků v papírnickém, olejovém, chemickém a textilním průmyslu [4]. Karcinom žlučníku je geograficky vázaný, přičemž vysoká incidence se nachází u Chilanů, Bolivijců, severoamerických indiánů, Mexičanů a u obyvatel střední Evropy, tudíž v místech, kde je vysoká prevalence cholecystolitiázy [7]. Cholecystolitiáza je přítomna u 74–92 % pacientů s karcinomem žlučníku. Rizikovými faktory jsou velikost konkrementu, délka trvání cholecystolitiázy a recidivující cholecystitidy. Všechny tyto faktory mohou vyvolat dysplastické a následně maligní změny v mukóze, i když dle dostupných studií je vývoj do karcinomu multifaktoriální a přítomnost lithiázy je pouze jeden z faktorů [8].
Symptomatologie onemocnění je závislá na stadiu detekce karcinomu. V iniciálním stadiu je karcinom asymptomatický. Postupně se manifestuje nespecifickými příznaky jako nechutenství, bolesti v pravém hypochondriu, nauzea, vomitus. Při další progresi se objevuje ikterus, známky obstrukce duodena či ascites, což jsou známky již pokročilého karcinomu.
Iniciálním vyšetřením k detekci tumoru je USG břicha, kdy nacházíme nepravidelně zesílenou stěnu či přímo masu tumorózní tkáně. Limitací USG jsou časná stadia, kdy tumor plošně infiltruje stěnu žlučníku, a stavy, kdy je tumorózní tkáň překryta lithiázou. Sonografie nám může pomoci ve stagingu onemocnění, k posouzení biliárního stromu či invaze do cévních struktur nebo přítomnost lymfatických uzlin. Základními metodami stagingu jsou CT, EUS či MR, které blíže posoudí pokročilost onemocnění. Využít lze PET-CT se značením fluorodeoxyglukózou k ozřejmění vzdálených metastáz či potvrzení karcinomatózy peritonea [4]. Nesmíme opomenout roli laboratorních metod, kde vyšetření onkomarkeru CA 19-9 v krvi má důležitou výpovědní hodnotu.
Léčba karcinomu žlučníku je závislá na TNM klasifikaci nádoru. Při T1N0M0 (stadium I) postačí radikální chirurgická léčba, adjuvantní léčba není indikována. Radikální chirurgická léčba s následnou adjuvantní chemoterapií (s podáním 5-fluorouracilu) je indikována při T2N0M0 (stadium II). Ve stadiu III a IV (T3 nebo přítomnost metastáz do uzlin či vzdálených metastáz) je indikována paliativní chemoterapie na bázi 5-fluorouracilu, kapecitabinu či gemtacibinu. Zvláště kombinace gemcitabinu s cisplatinou prokázala vyšší efektivitu. Jedinou možnou potenciálně kurativní léčbou je léčba chirurgická. Nelze opomenout podpůrnou paliativní léčbu, která spočívá v potlačení symptomů při pokročilém tumoru žlučníku. Ikterus vzniklý obstrukcí žlučových cest lze vyřešit zavedením drenáže. Drenáž můžeme zajistit endoskopicky (stentáž při ERCP, EUS navigovaná drenáž), radiologicky (perkutánní transhepatická drenáž) nebo chirurgicky (bilioenterická anastomóza). Obstrukci žaludku či duodena lze vyřešit endoskopicky zavedením samoexpandibilního metalického stentu nebo chirurgicky provedením gastrojejunoanastomózy [7].
Ke zjištění přesné diagnózy u naší pacientky jsme byli limitováni negativními výsledky vyšetření onkomarkerů v krvi i zobrazovacích metod, kde především PET-CT má vysokou senzitivitu i specificitu v záchytu adenokarcinomu žlučníku [9]. Můžeme litovat, že se nám nepodařilo (vzhledem k rychle se zhoršujícímu zdravotnímu stavu pacientky) provést cholangioskopii pomocí Spyglass (SOC – single-operator mother-baby peroral cholangiopancreatoscopy), který byl na našem pracovišti již k dispozici. Z důvodu technologického pokroku a lepší dostupnosti se SOC stává postupně standardní diagnostickou metodou k posouzení indeterminovaných stenóz žlučového stromu. Především Spyglass DS (s digitální technologií, vyšší kvalitou obrazu a jednodušším ovládáním) umožňuje rychlou a kvalitní vizualizaci stenózy s možností odebrání vzorků z tumorózní tkáně pod zrakovou kontrolou [10].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Doručeno/Submitted: 1. 10. 2018
Přijato/Accepted: 1. 1. 2019
MUDr. Jan Vašíček
Interní oddělení, gastroenterologie
Nemocnice Strakonice, a. s.
Radomyšlská 336
386 01 Strakonice
jan.vasicek.87@seznam.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Nguyen Canh H, Harada K. Adult bile duct strictures: differentiating benign biliary stenosis from cholangiocarcinoma. Med Mol Morphol 2016; 49 (4): 189–202. doi: 10.1007/-s00795-016-0143-016.
2. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice. Masarykova univerzita (2005). [online]. Dostupný z: http: //www.svod.cz.
3. Vyzula R (ed). Modrá kniha České onkologické společnosti. [online]. Dostupný z: https: //www.linkos.cz/files/modra-kniha/17.pdf.
4. Ioannidis O, Paraskevas G, Varnalidis I et al. Primary gallbladder cancer discovered postoperatively after elective and emergency cholecystectomy. Klin Onkol 2013, 26 (1): 31–34. doi: 10.14735/amko201331
5. Fujii M, Saito H, Shiode J et al. Rare case of gallblader neuroendocrine carcinoma. [online]. Clin J Gastroenterol 2019; 12 (1): 38–45. Available from: https: //link.springer.com/article/10.1007/s12328-018-0883-z. doi: 10.1007/ s12328-018-0883-z.
6. Mareček Z, Procházka V, Vaňásek T et al. Choroby žlučníku a žlučových cest. In: Ehrmann J, Hůlek P (eds). Hepatologie. Praha: Grada Publishing 2010: 563.
7. Kanthan R, Senger JL, Ahmed S et al. Gallbladder cancer in the 21st century. J Oncol 2015; 2015: 967472. doi: 10.1155/2015/967 472.
8. Ejaz A, Sachs T, Ihab R Kamel et al. Gallbladder Cancer – Current Management Options. Oncology & Hematology Review (US), 2013; 9 (2): 102–108. doi: http: //doi.org/10.17925/OHR.2013.09.2.102.
9. Ramos-Font C, Gómez-Rio M, Rodríguez-Fernández A et al. Ability of FDG-PET-CT in the detection of gallbladder cancer. J Surg Oncol 2014; 109 (3): 218–224. doi: 10.1002/jso.23476.
10. Urban O, Fojtík P, Mikolajek O et al. Renesance cholangiopankreatoskopie a nové možnosti intraduktální endoskopické terapie. Gastroent Hepatol 2016; 70 (3): 203–207. doi: 10.14735/amgh2016203.