Posterior reversible encephalopathy syndrom u dítěte s ulcerózní kolitidou
Eva Karásková1, Maria Velgáňová-Véghová1, Miloš Geryk1, Vratislav Smolka1, Kamila Michálková2, Dagmar Pospíšilová2
+ Pracoviště
Souhrn
Posterior reversible encephalopathy syndrom (PRES) je akutně vzniklá, klinicko-neuroradiologická jednotka definovaná jako vazogenní edém mozku v souvislosti s neurotoxickým postižením. Prezentována je kazuistika osmiletého chlapce s těžkou formou ulcerózní kolitidy a celiakií, který byl léčen kombinovanou terapií infliximabem a azatioprinem. Desátý den po aplikaci infliximabu se rozvinul 45 minut trvající stav bezvědomí s generalizovanými křečemi a miózou zornic, provázený arteriální hypertenzí. Chlapec byl léčen antikonvulzivy a antihypertenzivy. Stav vědomí se upravil ad integrum. Magnetická rezonance (MR) mozku nalezla ložiskové hypersignální změny kortikálně a subkortikálně, uložené symetricky v okcipitálních a frontoparietálních oblastech. Lumbální punkce byla negativní. Při kontrolní MR v odstupu týdne se nález zcela znormalizoval. Stav byl zhodnocen jako PRES, který se vyvinul jako komplikace léčby (infliximab, azatioprin) u pacienta s chronicky aktivní ulcerózní kolitidou. Případ ukazuje na možné riziko rozvoje neurologických potíží typu PRES u pacientů s nespecifickým střevním zánětem, jejichž klinický stav není kompenzován, dostávají imunosupresivní nebo biologickou léčbu a/nebo se u nich rozvine arteriální hypertenze.
Klíčová slova
ulcerózní kolitida, infliximab, posterior reversible encephalopathy syndrom, azatioprin, děti
Kazuistika
Pacient s negativní rodinnou anamnézou, neměl do 4 let věku žádné zásadní zdravotní potíže. Ve 4 letech bylo zjištěno neprospívání (hmotnost 13 kg, výška 101 cm (–2,9 SD)) a sideropenická anemie (hemoglobin 100 g/l, norma 135–175),gastrointestinální potíže neměl. Na základě sérologických parametrů: protilátky proti tkáňové transglutamináze ve třídě IgA > 300 U/ml (norma < 10) a pozitivní protilátky proti endomysiu, byla indikována gastroskopie s enterobiopsií. Nalezen malabsorpční syndrom s atrofií sliznice tenkého střeva klasifikovanou podle Marshe IIIB. Byla stanovena diagnóza celiakie a doporučena bezlepková dieta. Dietní doporučení pacient dodržoval (verifikováno poklesem protilátek: protilátky proti tkáňové transglutamináze ve třídě IgA 24 U/ml, negativní protilátky proti endomysiu za 6 měsíců po zahájení diety), ale k očekávanému zlepšení růstových parametrů nedošlo. Růstová retardace přetrvávala.
V 7 letech se objevily průjmy s krví. Byla diagnostikována ulcerózní pankolitida (UC) (Mayo skóre 2, Pediatric Ulcerative Colitis Activity Index (PUCAI 45)) s významnou retardací růstu (–2 SD).
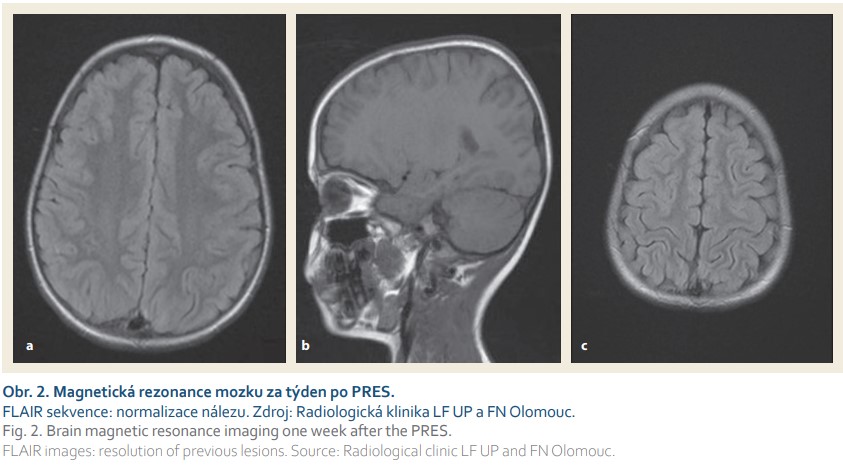
Terapeuticky byly úvodně bez většího efektu podány aminosalicyláty. Vzhledem k těžké růstové retardaci nebyly k indukci remise onemocnění indikovány kortikoidy a byl zvolen infliximab v dávce 5 mg/kg, bezprostředně s dobrou klinickou odpovědí (PUCAI 25). Po indukční fázi se ale vždy ke konci intervalu podání (à 8 týdnů) klinické potíže zhoršovaly. Proto jsme aplikační interval infliximabu zkrátili na 6 týdnů a byl přidán azatioprin (2,5 mg/kg/den). Po páté dávce biologika se po přechodné stabilizaci stavu objevily opět průjmy s příměsí krve (PUCAI 55) a pacient byl přijat do nemocnice. Po aplikaci šesté dávky infliximabu (5 mg/kg) se klinický stav mírně zlepšil (PUCAI 35). Avšak 10. den po aplikaci infliximabu se objevilo bezvědomí s miózou zornic, následované generalizovanými tonicko-klonickými křečemi v trvání 45 minut. Byla zjištěna arteriální hypertenze (120/90–125/100 mmHg, norma < 120/83). Chlapec byl léčen antikonvulzivy (diazepam) a antihypertenzivy (atenolol). Pacient byl monitorován na jednotce intenzivní péče. Neurologický nález se postupně upravil ad integrum. Akutní magnetická rezonance mozku (MR) ukázala hypersignální ložiskové změny kortikálně a subkortikálně, lokalizované symetricky v okcipitálních a frontoparietálních oblastech mozku (obr. 1). Bylo vysloveno podezření na PRES. Diferenciálně diagnosticky radiologové zvažovali zánětlivé změny nebo vaskulitidu. Lumbální punkce byla negativní. Na kontrolní MR mozku za týden po inzultu došlo k úplné regresi původních patologických změn (obr. 2). Stav jsme vyhodnotili jako PRES u pacienta s nekompenzovanou ulcerózní kolitidou a náhle vzniklou arteriální hypertenzí. Jako možný spouštěč byl označen infliximab a/nebo azatioprin.
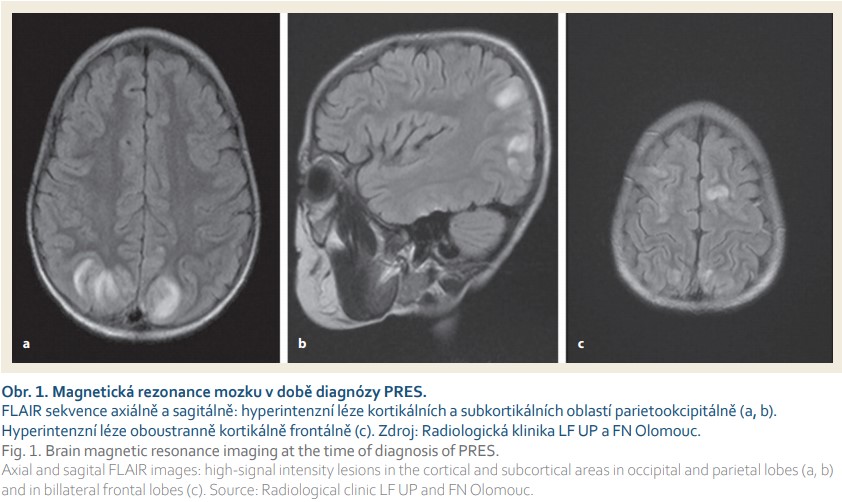
Po dobu následujících pěti měsíců byl pacient léčen antihypertenzivy (enalapril). Neurologické potíže od té doby neměl. Změnili jsme léčbu základního onemocnění na adalimumab. Klinická a endoskopická remise UC ale nastala až po přidání metotrexátu k biologické léčbě.
Diskuze
Posterior reversible encephalopathy syndrom (PRES) je klinicko-neuroradiologická jednotka definovaná jako náhle vzniklý, vazogenní edém mozku v souvislosti s neurotoxickým poškozením. Přesná incidence syndromu není známa [1]. Riziko rozvoje PRES vzniká jako následek závažného základního onemocnění a/nebo jeho léčby. Mezi nejčastěji uváděná riziková onemocnění patří arteriální hypertenze, eklampsie, renální selhání, hemolyticko-uremický syndrom, polyarteriitis nodosa, systémový lupus erythematodes, revmatoidní artritida, malignity, sepse, šok, hypomagnezemie nebo hyperkalcemie. Za rizikové léky jsou považovány především imunosupresiva (cyklosporin, takrolimus, metotrexát, kortikoidy), chemoterapeutika (cytarabin, cisplatina, vinkristin, L-asparagináza), dále antivirotika (acyklovir, indinavir), monoklonální protilátky a kontrastní látky [1–3].
Patogeneze onemocnění není kompletně objasněna a je zřejmě multifaktoriální. Popisováno je několik mechanizmů. Nejčastěji je uváděn vznik hyperperfuze při arteriální hypertenzi s poruchou hematoencefalické bariéry a se vznikem sekundárního vazogenního edému. Nicméně až 30 % pacientů s PRES má arteriální tlak v normě nebo jen mírně zvýšený. Navíc syndrom může vzniknout i u pacientů v šoku, kteří vyžadují léčbu hypotenze pomocí vazopresorů. Druhým zvažovaným mechanizmem je tedy přímé cytotoxické působení některých léčiv na cévní endotel, capillary leak syndrom, endotelová dysfunkce a zánětlivé změny mozkových cév [1]. Podstatou endotelové dysfunkce je zánětlivými cytokiny (tumor necrosis factor alpha, interleukin-1) indukovaná exprese adhezivních molekul (intercellular adhesion molecule-1 – ICAM-1; vascular cell adhesion molecule-1 – VCAM-1) s adhezí cirkulujících leukocytů produkujících reaktivní molekuly kyslíku (ROS) a proteázy, s následným poškozením endotelu a úniku tekutiny mimo cévy. Zánětlivé cytokiny rovněž aktivují astrocyty k produkci VEGF (vascular endothelial growth factor), který oslabuje těsná spojení (tight junctions) mezi buňkami v mozkových cévách, a tím zvyšuje cévní permeabilitu. Celá tato kaskáda vede ke vzniku vazogenního edému určitých okrsků mozku [2]. Patologicko-anatomicky jsou predilekčně postiženy zadní části mozku. Jako pravděpodobné vysvětlení se uvádí slabší sympatická inervace cév vertebrobazilárního systému (oproti cévnímu systému arteria carotis interna) s následnou nižší schopností autoregulace cévního průtoku [2,4].
Klinický obraz zahrnuje akutně vzniklou bolest hlavy a poruchy vizu. Přibližně u dvou třetin postižených se rozvinou fokální nebo generalizované křeče a porucha vědomí různého stupně. Může se vyskytnout vertigo, tinitus a porucha sluchu. Arteriální hypertenzi má 50–70 % pacientů [2]. Jedním z charakteristických znaků PRES je reverzibilita symptomů (a i radiologických abnormalit) po zahájení adekvátní terapie nebo odstranění precipitujících faktorů.
Pro diagnostiku má klíčovou roli MR mozku. Na T2-vážených a FLAIR (fluid-attenuated inversion recovery) sekvencích jsou patrny hypersignální, symetrické okrsky v bílé hmotě kortikálně a subkortikálně, predilekčně v okcipitální a parietální oblasti. Na T1-vážených sekvencích jsou ložiska hypointenzní. Ve vzácnějších případech jsou postiženy temporální a frontální laloky, mozeček, mozkový kmen nebo bazální gan-glia. Zobrazení pomocí DWI (diffusion--weighted images) umožní lépe odlišit vazogenní edém u PRES od edému cytotoxického. Pro diagnózu je nutná rychlá regrese MR nálezu. CT vyšetření lze využít při nedostupnosti MR, nicméně toto vyšetření nezobrazí 22–50 % lézí [5,6].
Diferenciální diagnostika je široká a zahrnuje hypoxicko-ischemickou encefalopatii, infekční meningoencefalitidu, včetně herpetické, akutní diseminovanou encefalomyelitidu (ADEM), vaskulitidu mozkových cév, trombózu venózního sinu, akutní toxickou leukoencefalopatii, progresivní multifokální leukoencefalopatii, encefalopatii u dědičných poruch metabolizmu nebo pontinní myelinolýzu [1,6,7].
Základem léčby jsou antikonvulziva (benzodiazepiny, fenytoin, fenobarbital). Adekvátní antihypertenzní léčba je preventivním opatřením proti progresi vazogenního edému do edému cytotoxického, vzniku infarktů a trvalým neurologickým následkům. Doporučeno je vysazení nebo snížení dávek léčiva jako možného spouštěče vzniku PRES. Toto opatření je ale v praxi velmi obtížně realizovatelné (chemoterapie, biologická léčba) a je přísně individuální [1].
Prognóza onemocnění je většinou dobrá. Velká část pacientů (90 %) se zhojí ad integrum, ustoupí klinické potíže a znormalizuje se MR nález. Asi u 10 % pacientů může onemocnění recidivovat (křeče, poruchy vizu, mydriáza, halucinace) [8]. S nárůstem poznatků o tomto onemocnění jsou popsány i případy tzv. maligního nebo těžkého průběhu u kriticky nemocných pacientů a případy s neurologickými následky nebo úmrtím. Riziko rozvoje epilepsie jako následku PRES se uvádí mezi 2,7 a 3,9 % [1]. Včasné rozpoznání onemocnění s rychlou antihypertenzní a antikonvulzní léčbou a pokud možno odstraněním léčiva jako spouštěče výrazně prognózu zlepšují. Byly studovány sérové (C-reaktivní protein, albumin, laktátdehydrogenáza) a likvorové (albumin) markery, ale prozatím žádný z ukazatelů nebylo možno využít ke stratifikaci rizika a prognózy [1].
Syndrom byl v literatuře poprvé popsán v roce 1996 [9]. Od té doby byla publikována řada prací popisujících rozvoj PRES jak u dospělých, tak i dětí. V dospělé populaci šlo často o gravidní pacientky s eklampsií, pacienty s onemocněním ledvin, onkologickým onemocněním, onemocněním pojiva nebo například hemolyticko-uremickým syndromem či trombotickou trombocytopenickou purpurou [2].
Bylo popsáno také 17 pacientů s Henoch-Schönleinovou purpurou a PRES. Jako možný patogenetický mechanizmus zde byla zvažována endotelová dysfunkce a porucha hematoencefalické bariéry [10].
PRES u dětí
V dětském věku byl PRES publikován u renálních onemocnění, především v případech s léčbou cyklosporinem [7]. Velkou skupinu tvoří hematoonkologičtí pacienti, např. s aplastickou anemií, akutní leukemií, nehodgkinským lymfomem, po aplikaci systémové nebo intratékální chemoterapie nebo po transplantaci kmenových buněk [11,12]. PRES byl popsán také u tří dětí po transplantaci plic léčených cyklosporinem nebo takrolimem [13]. V českém písemnictví byla publikována kazuistika devítiletého chlapce s PRES během poststreptokokové glomerulonefritidy s arteriální hypertenzí [6] a dále u dětí s hematoonkologickými onemocněními [14].
PRES a idiopatické střevní záněty
U pacientů s idiopatickými střevními záněty (IBD – inflammatory bowel disease) je rozvoj PRES dáván do spojitosti s protizánětlivou léčbou. Raritně se jednalo o možnou souvislost s léčbou mesalazinem nebo kortikoidy: u 32leté ženy s anamnézou léčené tuberkulózy, která medikovala mesalazin (2 × 400 mg) pro Crohnovu chorobu (CD), nastal relaps CD. Dávka mesalazinu byla proto zvýšena na 2 × 800 mg s následným rozvojem PRES [15]. PRES proběhl také u 25leté pacientky během akutní ataky UC léčené prednisolonem a metronidazolem [16]. V ostatních případech šlo o pacienty léčené buď imunomodulancii, nebo biologiky. V případě 15leté dívky s UC byl popsán PRES v souvislosti s léčbou azatioprinem [17]. U dalšího pacienta (26 let) s CD se PRES rozvinul během udržovací léčby azatioprinem [18]. Byla publikována kazuistika 14letého chlapce s CD, kde se PRES rozvinul 5. den po první infuzi infliximabu. V daném období byl arteriální tlak pacienta v mezích normy [3]. Haddock et al referovali případ 8leté dívky s CD, která byla na počátku onemocnění léčena exkluzivní enterální výživou, stav se ale zhoršoval, proto byly po týdnu podány kortikoidy a za týden poté jedna dávka infliximabu (5 mg/kg). Za další týden si stav vynutil kolektomii s ileostomií. Za 5 dní po operaci byl diagnostikován PRES. Před vypuknutím neurologických potíží byl arteriální tlak v mezích normy. Hypertenze a bradykardie se objevily až během křečí. Autoři dávají vznik PRES do souvislosti s podaným infliximabem, nicméně pacientka byla v celkově těžkém pooperačním stavu, léčena také kortikoidy a antibiotiky, laboratorně byla přítomna hypokalemie a hypomagnezemie [19]. Další kazuistika 18leté pacientky s CD uvádí možnou souvislost s podáním ustekinumabu. Tato dívka dostávala dlouhodobě infliximab a metotrexát. Pro zhoršení gastrointestinálních potíží byla přijata do nemocnice a podán byl ustekinumab. Klinický stav se přesto zhoršoval a bylo indikováno chirurgické řešení (strikturoplastika a ileostomie). Za 12 dní po aplikaci ustekinumabu a proběhlé operaci se rozvinul PRES (arteriální tlak nebyl v kazuistice hodnocen) [20]. Druhým popisovaným případem je muž (54 let) s perianální, fistulující CD, léčený postupně kortikoidy, infliximabem a adalimumabem. Pro selhání léčby dostal ustekinumab a za 6 dní po aplikaci se rozvinul PRES [20]. Po ustekinumabu byl PRES popsán také u 65leté ženy s diagnózou psoriázy [21].
Uvedené kazuistiky ukazují na heterogenitu jednotlivých případů. Spojujícím faktorem je často dekompenzace klinického stavu, který si vynutí intenzifikaci léčby s následným rozvojem PRES. Arteriální hypertenze může, ale také nemusí být přítomna.
Závěr
PRES je klinicko-radiologický syndrom projevující se neurologickými symptomy (bolestmi hlavy, poruchami vizu či sluchu, křečemi, popř. poruchou vědomí různého stupně nebo dalšími ložiskovými projevy). Charakteristickým nálezem na MR mozku na T2-vážených a FLAIR sekvencích jsou patrné hypersignální, symetrické okrsky v bílé hmotě kortikálně a subkortikálně, predilekčně v okcipitální a parietální oblasti, na T1-vážených sekvencích jsou pak v odpovídajících lokalitách hyposignální ložiska. Často je přítomna arteriální hypertenze. Patogeneze onemocnění není zatím plně objasněna. Předpokládaným podkladem neurologického postižení je endotelová dysfunkce a zánětlivé změny mozkových cév vedoucí k vazogennímu edému mozku. Základem léčby jsou antikonvulziva a adekvátní kontrola krevního tlaku. Doporučeno je také vysazení nebo snížení dávek možného spouštěče tohoto syndromu, což může být v praxi obtížně realizovatelné. V literatuře popisované případy i prezentovaná kazuistika poukazují na možnost rozvoje PRES u pacientů s IBD. Spouštěčem se jeví biologická a/nebo imunomodulační léčba. Riziková může být dekompenzace klinického stavu, která si vynutí intenzifikaci léčby s následným rozvojem PRES. Při adekvátní léčbě bývá prognóza onemocnění dobrá. Stav je většinou reverzibilní, u nemocných ustoupí klinické potíže a dojde k normalizaci změn na MR.
Doručeno/Submitted: 2. 12. 2020
Přijato/Accepted: 19. 1. 2021
MUDr. Eva Karásková, Ph.D.
Dětská klinika LF UP a FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
eva.karaskova@fnol.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Gao B, Lyu C, Lerner A et al. Controversy of posterior reversible encephalopathy syndrome: what have we learnt in the last 20 years? J Neurol Neurosurg Psychiatry 2018; 89 (1): 14–20. doi: 10.1136/jnnp-2017-316225.
2. Tetsuka S, Ogawa T. Posterior reversible encephalopathy syndrome: A review with emphasis on neuroimaging characteristics. J Neurol Sci 2019; 404: 72–79. doi: 10.1016/j.jns.2019.07.018.
3. Zamvar V, Sugarman ID, Tawfik RF et al. Posterior reversible encephalopathy syndrome following infliximab infusion. J Pediatr Gastroenterol Nutr 2009; 48 (1): 102–105. doi: 10.1097/MPG.0b013e31818aedb4.
4. Striano P, Striano S, Tortora F et al. Clinical spectrum and critical care management of Posterior Reversible Encephalopathy Syndrome (PRES). Med Sci Monit 2005; 11 (11): CR549–CR553.
5. Shankar J, Banfield J. Posterior reversible encephalopathy syndrome: a review. Can Assoc Radiol J 2017; 68 (2): 147–153. doi: 10.1016/j.carj.2016.08.005.
6. Dvořáková L. PRES syndrom u pacienta s poststreptokokovou Glomerulonefritidou. Pediatr praxi 2013; 14 (3): 183–186.
7. Gavrilovici C, Miron I, Voroneanu L et al. Posterior reversible encephalopathy syndrome in children with kidney disease. Int Urol Nephrol 2017; 49 (10): 1793–1800. doi: 10.1007/s11255-017-1684-x.
8. Ghali MGZ, Davanzo J, Leo M et al. Posterior reversible encephalopathy syndrome in pediatric patients: pathophysiology, diagnosis, and management. Leuk Lymphoma 2019; 60 (10): 2365–2372. doi: 10.1080/10428194.2019.1594210.
9. Hinchey J, Chaves C, Appignani B et al. A reversible posterior leukoencephalopathy syndrome. N Engl J Med 1996; 334 (8): 494–500. doi: 10.1056/NEJM199602223340803.
10. Lava SAG, Peeters GGAM, Bianchetti MG et al. Posterior reversible encephalopathy syndrome in Henoch-Schönlein purpura. Rheumatol Int 2017; 37 (3): 461–463. doi: 10.1007/ s00296-016-3577-1.
11. Khan SJ, Arshad AA, Fayyaz MB et al. Posterior reversible encephalopathy syndrome in pediatric cancer: clinical and radiologic findings. J Glob Oncol 2018; 4: 1–8. doi: 10.1200/JGO.17.00089.
12. Tambasco N, Mastrodicasa E, Salvatori C et al. Prognostic factors in children with PRES and hematologic diseases. Acta Neurol Scand 2016; 134 (6): 474–483. doi: 10.1111/ane.12570.
13. Yamagishi H, Chen-Yoshikawa TF, Date H. Basiliximab for posterior reversible encephalopathy syndrome after lung transplantation. Eur J Cardiothorac Surg 2017; 52 (4): 823–824. doi: 10.1093/ejcts/ezx151.
14. Cahová P, Bernátková H, Muchová M et al.Posterior Reversible Encephalopathy Syndrom/PRES/u onkologických dětských pacientů –kazuistiky. Cesk Slov Neurol N 2011; 74 (107): S21–S22.
15. Cherian A, Soumya CV, Iype T et al. Posterior reversible encephalopathy syndrome with PLEDs-plus due to mesalamine. J Neurosci Rural Pract 2014; 5 (1): 72–75. doi: 10.4103/ 0976- 147.127882.
16. Kikuchi S, Orii F, Maemoto A et al. Reversible posterior leukoencephalopathy syndrome associated with treatment for acute exacerbation of ulcerative colitis. Intern Med 2016; 55 (5): 473–477.doi: 10.2169/internalmedicine.55.5250.
17. Ogawa R, Oikawa T, Shijo T et al. Case of posterior reversible encephalopathy syndrome due to azathioprine. Rinsho Shinkeigaku 2015; 55 (12): 936–939. doi: 10.5692/clinicalneurol.cn-000733.
18. Nemati R, Mehdizadeh S, Salimipour H et al. Neurological manifestations related to Crohn‘s disease: a boon for the workforce. Gastroenterol Rep (Oxf) 2019; 7 (4): 291–297. doi: 10.1093/gastro/gox034.
19. Haddock R, Garrick V, Horrocks I et al. A case of posterior reversible encephalopathy syndrome in a child with Crohn‘s disease treated with Infliximab. J Crohns Colitis 2011; 5 (6): 623–627. doi: 10.1016/j.crohns.2011.06.011.
20. Mishra A, Seril DN. Posterior reversible encephalopathy syndrome following ustekinumab induction for Crohn‘s disease. Case Rep Gastroenterol 2018; 12 (2): 521–527. doi: 10.1159/000492462.
21. Gratton D, Szapary P, Goyal K et al. Reversible posterior leukoencephalopathy syndrome in a patient treated with ustekinumab: case report and review of the literature. Arch Dermatol 2011; 147 (10): 1197–1202. doi: 10.1001// archdermatol.2011.161.