Poresekčná pečeňová nedostatočnosť – skórovacie systémy v klinickej praxi
Viktor Rekeň1, Martin Sabol1, Štefan Nemergut1, Luis Miguel Arciniegas Rodriguez1, Daniel Šintál1, Štefan Durdík1
+ Pracoviště
Souhrn
Úvod: Poresekčná pečeňová nedostatočnosť (PHLF – posthepatectomy liver failure) je napriek medicínskym pokrokom stále obávanou chorobnou jednotkou. Primárnym cieľom práce bolo na základe sumarizácie aktuálnych poznatkov retrospektívne aplikovať vybrané skórovacie systémy používané na vyhodnotenie rizika PHLF na súbor pacientov po veľkých resekciách pečene operovaných na pracovisku autorov. Predpokladáme, že najnovšie skórovacie systémy budú podávať presnejší obraz o riziku PHLF. Metódy: V období rokov 2007 až 2016 bolo identifikovaných 82 pacientov spĺňajúcich inklúzne kritériá (elektívne odstránenie troch alebo viacerých segmentov pečene pre neoplazmu). Na nich bolo aplikovaných 5 skórovacích systémov, a to „50-50 kritérium“, ISGLS klasifikácia, Hyderovo skóre, ALBI skóre a Liu skóre. Výsledky: Pri použití kritéria „50-50“ nedosiahol ani jeden z pacientov diagnózu PHLF. Aplikáciou skórovacieho systému ISGLS bol u 68 pacientov (86 %) zistený stupeň „A“ a u 11 stupeň „B“ PHLF na 5. pooperačný deň (POD5). Hyderovo skóre nad 11 dosiahli dvaja pacienti, ktorí exitovali na 14., resp. 34. pooperačný deň. V ALBI skóre dosiahol jediný pacient hodnotu viac ako –1,39 (–0,4), pričom exitoval na druhý pooperačný deň. V rámci Liu skóre malo 55 pacientov predikované veľmi závažné riziko rozvoja PHLF, z nich 46 pacientov exitovalo pri priemernej dĺžke prežívania po resekcii 27 mesiacov. Z piatich aplikovaných skórovacích systémov bol iba v prípade ALBI a Liu skóre dosiahnutý štatisticky významný rozdiel medzi podskupinami pacientov s rôznym stupňom prítomnosti či predikcie PHLF. V rámci celého súboru bol tiež zaznamenaný hranične signifikantný rozdiel v proporcii pohlaví, pričom vyššia šanca úmrtia bola u mužov (OR 2,63; 95% CI 0,83–8,32). Diskusia: Skórovací systém ALBI preukázal veľmi dobrú predikciu vo viacerých metaanalýzach kohort pacientov po veľkej resekcii pečene. Významne pozitívnym klinickým faktorom použitia daného systému je, že vychádza z predoperačných hodnôt laboratórneho vyšetrenia krvi a možno ho navrhnúť ako stabilný predikčný model pre krátkodobé výsledky po resekcii pečene. Záver: Prezentované skórovacie systémy predstavujú stále pomerne heterogénny pohľad na PHLF. Aj vzhľadom na to sú kľúčovými piliermi prevencie PHLF dôsledná stratifikácia pacientov štandardizovaným skórovacím systémom a liečba vo vysokoobjemových centrách.
Klíčová slova
hepatektómia, zlyhanie pečene, neoplazma pečene, poresekčná pečeňová nedostatočnosť, veľká resekcia pečene, skórovacie systémy
Úvod
Chirurgická resekcia je základnou liečebnou modalitou mnohých benígnych či malígnych nádorov pečene. Zobrazovacie metódy, systémová liečba, ako aj pokroky v samotnej chirurgickej technike rozšírili indikácie k resekcii pečene umožňujúc aj resekciu tumorov, ktoré by boli tradične pred niekoľkými dekádami hodnotené ako neresekabilné. Zlepšenie procesu selekcie pacientov, pozornosť pre zvýšenie objemu budúceho pečeňového zvyšku a perioperačná starostlivosť umožnili bezpečnejšiu aplikáciu pečeňovej chirurgie najmä u onkologických pacientov. Obávanou komplikáciou po pečeňovej resekcii zostáva poresekčná pečeňová nedostatočnosť (PHLF – post- hepatectomy liver failure). Incidencia PHLF napriek mnohým novým vedeckým poznatkom varíruje od 0,70 % do 33,83 % [1], pričom závisí od definície konkrétneho autora, rozsahu resekcie pečene a charakteristík študovanej populácie. Progresia v pochopení rizikových faktorov PHLF, ako aj zlepšenie v prevencii jej vzniku vedú k poklesu jej incidencie počas poslednej dekády [2]. PHLF je v silnej asociácii s mortalitou a má úzke spektrum efektívnych terapeutických možností od podpornej nešpecifickej medikamentóznej liečby cez rôzne eliminačné techniky až po transplantáciu pečene [3]. Primárnym cieľom práce je na základe sumarizácie aktuálnych poznatkov retrospektívne aplikovať vybrané skórovacie systémy používané pre vyhodnotenie PHLF na súbor pacientov po veľkých resekciách pečene operovaných na Klinike onkologickej chirurgie LFUK a OÚSA v Bratislave. Vedľajším cieľom práce je stanovenie morbidity a mortality vo vzťahu k základným charakteristikám súboru. Základnou hypotézou bolo, že novšie publikované skórovacie systémy budú poskytovať lepšiu prediktívnu schopnosť PHLF.
Súbor pacientov
Manuálnou a elektronickou rešeršnou činnosťou (vykonali: V. R., D. Š., Š. N.) v archíve operačných protokolov Kliniky onkologickej chirurgie LFUK a OÚSA v Onkologickom ústave sv. Alžbety, s. r. o., Bratislava v období od 1. 1. 2007 do 31. 12. 2016 bolo identifikovaných 82 pacientov spĺňajúcich inklúzne kritérium, ktorým bolo elektívne odstránenie troch a viacerých pečeňových segmentov pre neopláziu. Pre ukončenie pooperačného sledovania bol stanovený dátum 1. 1. 2022.
Metodika
Bolo vybratých 5 skórovacích systémov, a to:
- „50-50“ kritérium (pokles protrombínového času (PT) pod 50 % a zároveň zvýšená sérová hladina bilirubínu nad 50 µmol/l) na piaty pooperačný deň (POD5) [4,5],
- ISGLS klasifikácia (stupeň PHLF podľa hodnoty celkovej diurézy [ml], bilirubínu [mg/dl], priemernej saturácie krvi kyslíkom [%] a INR) na POD5 podľa [6,7],
- Hyderovo skóre (stupeň komplikácie podľa Clavien-Dindo klasifikácie, hodnoty INR, bilirubínu [ mg/dl] a kreatinínu [mg/dl] dosadené do vzťahu: Hyder = (INR × 2,5) + (stupeň komplikácie Clavien-Dindo × 1,5) + (bilirubín × 0,15) + (kreatinín × 0,5)) na POD3 [8],
- ALBI skóre (predoperačné hodnoty hladiny bilirubínu [mg/dl] a albumínu [g/l] dosadené do vzťahu: (log10bilirubín × 0,66) + (albumín × [–0,085]) [9],
- Liu skóre (súčet premenných podľa [10]: vek, ASA skóre, prítomnosť ascitu, predoperačná hodnota bilirubínu [mg/dl] a AST [µkat/l], histologický nález, využitie neoadjuvantnej terapie, rozsah resekcie (počet odstránených seg- mentov), chirurgický prístup (laparoskopický alebo otvorený), charakter pečeňového parenchýmu a biliárna rekonštrukcia).
Pri zisťovaní úmrtia pacientov bol využitý register ÚDZS SR. Kohorta pacientov bola podrobená deskriptívnej štatistike, analýzam výsledkov aplikovaných skórovacích systémov týkajúcich sa PHLF, veku, pohlavia pacientov, počtu odstránených segmentov pečene vo vzťahu k úmrtiu. Pomocou neparametrických testov bola vyhodnocovaná štatistická významnosť vzťahov, ktorá bola vyjadrená veličinou p a za štatisticky významnú bola stanovená hodnota p < 0,05. Na štatistické spracovanie bol použitý softvér MS Excel 365.
Výsledky
V analyzovanom súbore prevládali ženy, ktorých bolo 43 (52,4 %). Vekový interval bol od 23 do 76 rokov. Rozsah resekcií: pravostranná hepatektómia (odstránenie 4 segmentov pečene) v 53 (64,6 %) prípadoch; v 16 (19,5 %) prípadoch ľavostranná hepatektómia (odstránenie 3 segmentov pečene); resekcia 5 segmentov (rozšírená pravostranná hepatektómia) 11-krát (13,4 %); 2-krát (2,4 %) resekcia 6 segmentov (rozšírená pravostranná hepatektómia a caudatus lobektómia). Všetci pacienti boli operovaní otvoreným prístupom. Najčastejším histologickým nálezom bolo metachrónne metastatické postihnutie pečene kolorektálnym karcinómom, a to v 61 prípadoch (74,4 %), 13 pacientov malo cholangiocelulárny karcinóm a šiesti pacienti benígny nádor. Celkovo v dohliadanom období 180 mesiacov (od 13. 1. 2007 do 1. 1. 2022) zomrelo 65 pacientov, medián prežívania bol 64 mesiacov. Tridsaťdňová mortalita bola 4,8 %. Deväťdesiatdňová mortalita bola 6 %.
Pomocou kritéria „50-50“ nebola diagnóza PHLF stanovená u žiadneho pacienta.
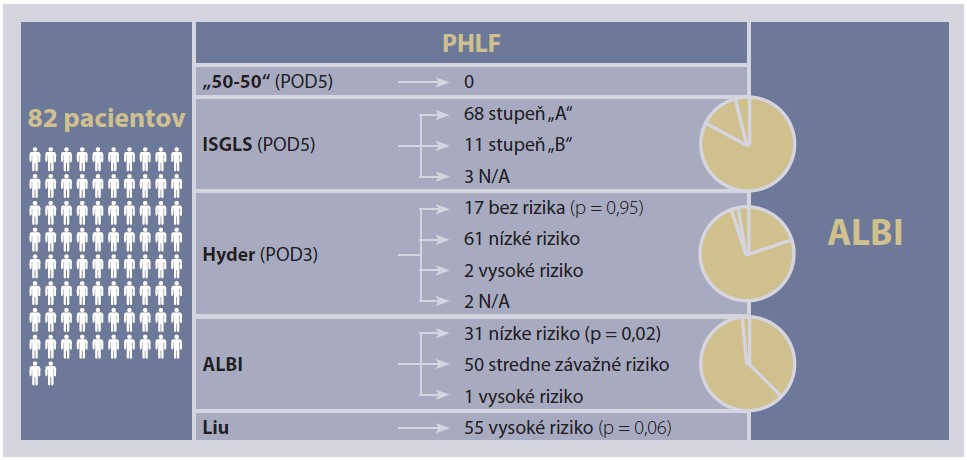
Aplikáciou skórovacieho systému ISGLS na POD5 bol u 68 pacientov (86 %) zistený stupeň „A“ PHLF. Dvaja pacienti exitovali pred POD5, 11 (14 %) mali zistený stupeň „B“ PHLF (graf 1). V jednom prípade nebola dostupná hodnota INR na POD5, a teda uvedený skórovací systém nebolo možné použiť. Z podskupiny pacientov s PHLF stupňa „B“ bola 90-dňová mortalita 9 % (1 úmrtie). Celkové prežívanie (OS) v danej podskupine bolo 29 mesiacov. V skupine s PHLF stupňa „A“ bola 90-dňová mortalita 2 % a celkové prežívanie 57,6 mesiaca.
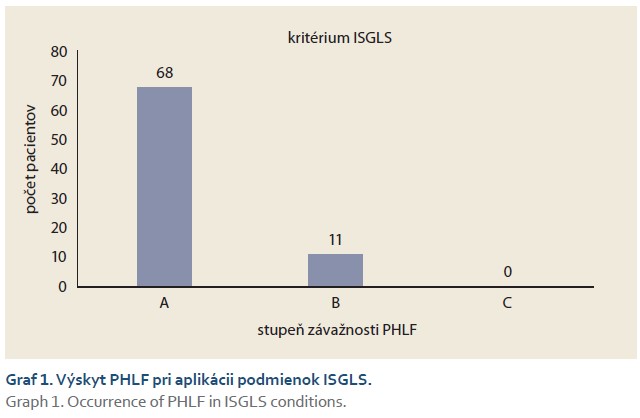
Podľa Hyderovho skóre bolo 17 pacientov bez rizika PHLF. Šesťdesiatjeden pacientov malo nízke riziko PHLF. Dvaja pacienti dosiahli vysoké riziko PHLF (skóre nad 11: 11,58 a 12,09). Obaja exitovali do 30 dní po operácii. Pomocou Mann-Whitneyho neparametrického testu bolo zistené, že rozdiel medzi podskupinami pacientov vo vzťahu k prežívaniu nebol štatisticky významný (graf 2).
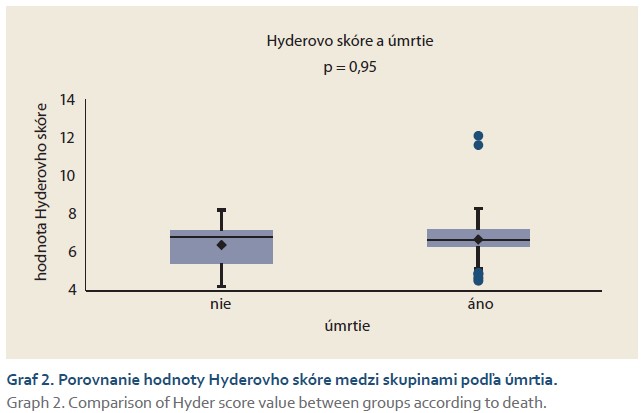
Skóre ALBI preukázalo u jediného pacienta hodnotu ako –1,39 (–0,4) s predikciou najvyššieho rizika výskytu PHLF. Išlo o pacienta, ktorý exitoval na POD2. Pri 50 pacientoch bolo skóre v intervale medzi –1,39 a –2,6. Zvyšných 31 pacientov dosiahlo skóre < –2,6. Pomocou Mann-Whitneyho neparametrického testu bolo zistené, že rozdiel medzi podskupinami pacientov vo vzťahu k prežívaniu je signifikantný (graf 3), čo bolo preukázané aj alternatívnymi neparametrickými testami (Fligner-Policello a Brunner-Munzel).
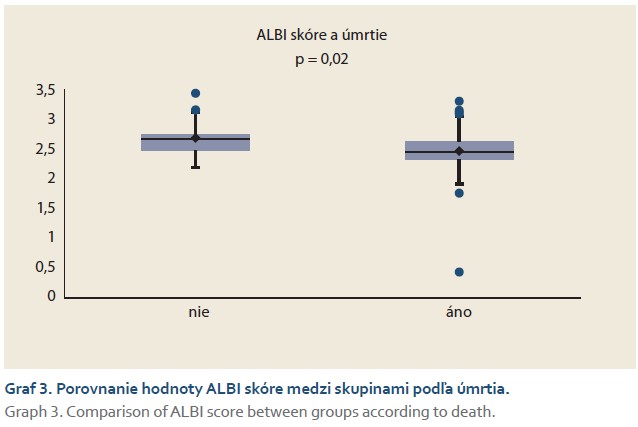
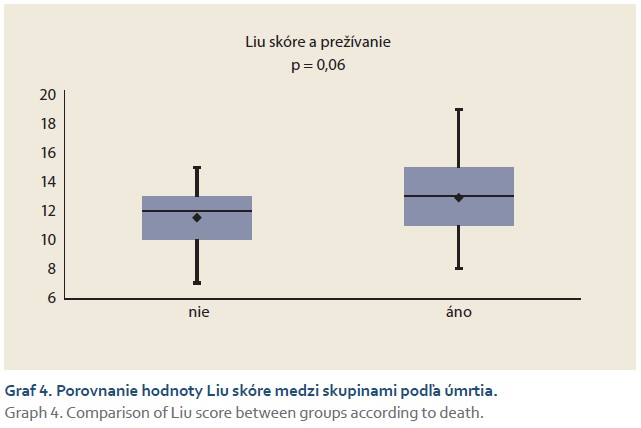
Skórovací systém podľa Liuovej (tab. 1) predikoval veľmi závažné riziko rozvoja PHLF u 55 pacientov (67 %). Pomocou Mann-Whitneyho neparametrického testu bol zistený hranične signifikantný rozdiel (p = 0,06) medzi podskupinami pacientov vo vzťahu k prežívaniu (graf 4). Alternatívne neparametrické testy preukázali signifikantný rozdiel: Fligner-Policello (p = 0,03), Brunner-Munzel (p = 0,04).

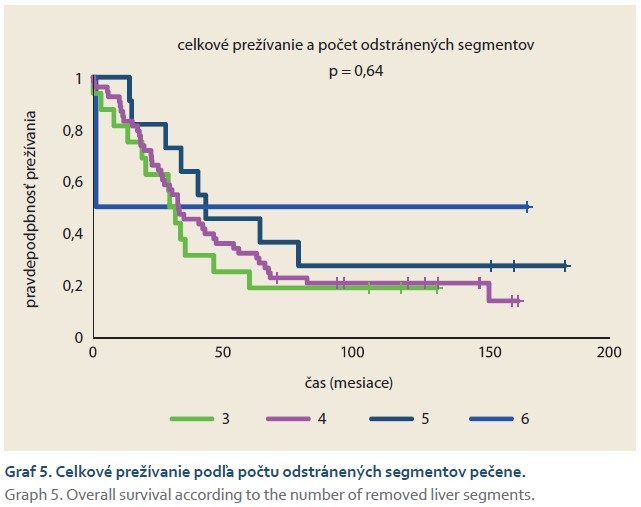
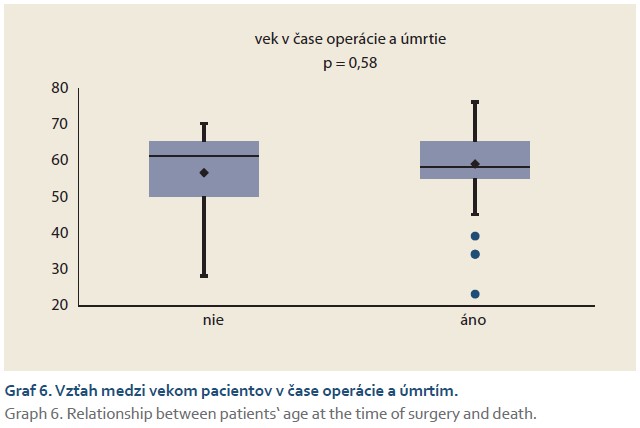
Porovnanie dĺžky prežívania medzi skupinami definovanými počtom odstránených segmentov pečene nepreukázalo štatistický význam (graf 5). Rovnako štatisticky nevýznamným bol vzťah medzi vekom pacientov v čase operácie a úmrtím (graf 6). Finálne bol zaznamenaný hranične signifikantný rozdiel (p = 0,09) v proporcii pohlaví týkajúci sa vyššej šance úmrtia u mužov (OR 2,63; 95% CI 0,83–8,32).
Diskusia
Incidencia PHLF závisí od nedostatočného objemu ponechaného zvyšného parenchýmu pečene a jeho funkčnej kapacity [1]. Kritérium „50-50“ v nami analyzovanej kohorte pacientov na POD5 pre stanovenie PHLF nespĺňal nikto. Uvedený čiastkový výsledok by mohol viesť k úvahe o falošnej neprítomnosti PHLF a neadekvátnym opatreniam pre pooperačné sledovanie a liečbu pacientov. Toto kritérium nie je vhodným pre účely použitia v klinickej praxi, hoci môže na prvý pohľad ísť o jednoduchý a ľahko memorovateľný vzorec. Tento poznatok je v súlade s inými literárnymi údajmi [5,6].
Kritériá ISGLS pre PHLF sú v súčasnosti najčastejšie používanými v literatúre. Nikto z našej kohorty nerozvinul PHLF stupňa „C“. Diskutovalo sa o niekoľkých aspektoch kritérií ISGLS, ako je napr. potenciálne chýbajúca klinická relevantnosť stupňa „A“ a že kritériá nezahŕňajú rozdiel medzi primárnym a sekundárnym zlyhaním pečene. Hlavným problémom uvedených definícií je časový bod ich použiteľnosti. Piaty pooperačný deň alebo obdobie po ňom sú obmedzené čo do možnosti podstatne ovplyvniť a potenciálne liečiť PHLF vzhľadom na okamžitý nástup regenerácie pečene po resekcii. Nové štúdie by sa mali zamerať na naliehavú potrebu vývoja prediktívnych modelov a definícií, ktoré by bolo možné použiť v prvých 48 hodinách po operácii na usmernenie možných rozhodnutí o liečbe týchto pacientov [11]. Existuje veľké množstvo pokusov definovať PHLF. V článku, kde boli kritériá ISGLS pre PHLF prezentované po prvýkrát, Rahbariet al uvádzali takmer 50 rôznych publikácií s vlastnou zodpovedajúcou definíciou PHLF medzi rokmi 2003 a 2009 [7]. Odvtedy bolo publikovaných množstvo ďalších článkov prezentujúcich nové definície PHLF, z ktorých mnohé pochádzajú z jednotlivých centier bez validácie [9,10]. PHLF je obávanou komplikáciou v skorom pooperačnom období najmä preto, že kauzálna liečba nie je dostupná. Zlyhanie pečene vzniká, keď je zvyšková funkcia hepatocytov nedostatočná, väčšinou v dôsledku malého budúceho pečeňového zvyšku (FLR), alebo ak regenerácia pečene nemôže kompenzovať stratu pečeňového tkaniva [12,13]. V štúdii [14] malo 27 % všetkých pacientov diagnostikovanú PHLF akéhokoľvek stupňa ISGLS a 13 % malo klinicky relevantnú PHLF, čo je v súlade s predchádzajúcimi správami o veľkých hepatektómiách [15,16]. Daný údaj o klinicky relevantnom stupni (stupeň „B“) ISGLS bol zaznamenaný aj v našich výsledkoch.
Práca uverejnená Hyderom et al v roku 2013 [8] nebola podľa dostupnej literatúry predmetom inej porovnávacej štúdie. Naše výsledky však preukazujú, že hoci nebola zaznamenaná štatisticky významná odchýlka medzi podskupinami, môže byť uvedený skórovací systém vhodný pre prax najmä u pacientov s vysokým skóre pravdepodobnosti PHLF. Títo pacienti veľmi pravdepodobne nebudú profitovať zo štandardnej pooperačnej intenzívnej starostlivosti, ale bude nutné u nich zvážiť nadstavbovú starostlivosť napr. plánovaním eliminačnej liečby.
Skórovací systém ALBI sa ukázal ako najvhodnejší pre predikciu výskytu PHLF a mortality. Jediný pacient, ktorý dosiahol aj najvyššie skóre (–0,4), exitoval na POD2. Išlo o štatisticky významný výsledok pri porovnaní jednotlivých podskupín a ich prežívania. Tieto poznatky sú v súlade s výsledkami viacerých metaanalýz a pôvodných prác porovnávajúcich rôzne skórovacie systémy [14–20].
Dostupné literárne zdroje neposkytujú validačnú štúdiu pre Liu skóre, ktoré bolo v našom projekte použité na celú kohortu pacientov. Najväčšie zastúpenie mala podskupina pacientov s predikciou veľmi závažného rizika rozvoja PHLF, pričom tento výsledok bol hranične štatisticky významný.
V československom priestore sú zriedkavé pôvodné práce skúmajúce PHLF. Práca z roku 2009 [21] prezentovala 30-dňovú mortalitu na úrovni 1,1 %. V našom súbore bol daný parameter porovnateľný (4,8 %), čo môže svedčať pre podobnú kvalitu vykonávania pečeňovej chirurgie medzi pracoviskami.
Vo všeobecnosti je klinické použitie stratifikačného systému založeného na pooperačných hodnotách (napr. kritérium ISGLS, Hyderovo skóre a Liu skóre) rizikové. Obdobie stratifikácie PHLF na POD3, resp. POD5 nie je pre pacienta výhodné a naopak je rizikové z omeškania. Dôraz sa kladie na etablovanie aktívnej predoperačnej stratifikácie.
Záver
Ako najvhodnejšie sa v našom kontexte javí použitie ALBI skóre. Dôsledný výber pacientov za použitia štandardizovaného skórovacieho systému, napr. ALBI je základom klinického manažmentu.
Zoznam skratiek
ALBI – albumín-bilirubín skóre
ASA – American Society od Anesthesiologists (Americká anestéziologická spoločnosť)
AST – aspartátaminotransferáza
FLR – future liver remnant (budúci pečeňový zvyšok)
INR – international normalised ratio
ISGLS – International Study Group of Liver Surgery (Medzinárodná spoločnosť pre pečeňovú chirurgiu)
LFUK – Lekárska fakulta Univerzity Komenského
OS – overall survival (celkové prežívanie)
OÚSA – Onkologický ústav sv. Alžbety
PHLF – posthepatectomy liver failure (poresekčná pečeňová nedostatočnosť)
POD2 – druhý pooperačný deň
POD3 – tretí pooperačný deň
POD5 – piaty pooperačný deň
PT – protrombínový čas
ÚDZS – Úrad pre dohľad nad zdravotnou starostlivosťou
ORCID autorov
V. Rekeň ORCID 0000-0002-8887-0814,
M. Sabol ORCID 0000-0002-5063-1463,
L. M. S. Rodriguez ORCID 0000-0002-0002-9431,
Š. Durdík ORCID 0000-0001-7290-5122.
Doručené/Submitted: 31. 3. 2023
Prijaté/Accepted: 30. 5. 2023
MUDr. Viktor Rekeň
Klinika onkologickej chirurgie
LF UK a Onkologický ústav sv. Alžbety, s. r. o.
Heydukova 10
812 50 Bratislava
viktor.reken@gmail.com
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Hammond JS, Guha IN, Beckingham IJ et al. Prediction, prevention and management of postresection liver failure. Br J Surg 2011; 98(9): 1188–1200. doi: 10.1002/bjs.7630.
2. Zou H, Yang X, Li QL et al. A Comparative Study of Albumin-Bilirubin Score with Child-Pugh Score, Model for End-Stage Liver Disease Score and Indocyanine Green R15 in Predicting Posthepatectomy Liver Failure for Hepatocellular Carcinoma Patients. Dig Dis 2018; 36(3): 236–243. doi: 10.1159/000486590.
3. Chan S, Sharr W, Chan A et al. Rescue Livingdonor Liver Transplantation for Liver Failure Following Hepatectomy for Hepatocellular Carcinoma. Liver Cancer 2013; 2(3–4): 332–337. doi: 10.1159/000343848.
4. Balzan S, Belghiti J, Farges O et al. The “50-50 criteria” on postoperative day 5: an accurate predictor of liver failure and death after hepatectomy. Ann Surg 2005; 242(6): 824–828, discussion 828–829. doi: 10.1097/01.sla.0000189131.90876.9e.
5. Mullen JT, Ribero D, Reddy SK et al. Hepatic insufficiency and mortality in 1,059 noncirrhotic patients undergoing major hepatectomy. J Am Coll Surg 2007; 204(5): 854–864. doi: 10.1016/j.jamcollsurg.2006.12.032.
6. Rahbari NN, Reissfelder C, Koch M et al. The predictive value of postoperative clinical risk scores for outcome after hepatic resection: a validation analysis in 807 patients. Ann Surg Oncol 2011; 18(13): 3640–3649. doi: 10.1245/ s10434-011-1829-6.
7. Rahbari NN, Garden OJ, Padbury R et al. Posthepatectomy liver failure: a definition and grading by the International Study Group of Liver Surgery (ISGLS). Surgery 2011; 149(5): 713–724. doi: 10.1016/j.surg.2010.10.001.
8. Hyder O, Pulitano C, Firoozmand A et al. A risk model to predict 90-day mortality among patients undergoing hepatic resection. J Am Coll Surg 2013; 216(6): 1049–1056. doi: 10.1016/ j.jamcollsurg.2013.01.004.
9. Fagenson AM, Gleeson EM, Pitt HA et al. Albumin-Bilirubin Score vs Model for End-Stage Liver Disease in Predicting Post-Hepatectomy Outcomes. J Am Coll Surg 2020; 230(4): 637–645. doi: 10.1016/j.jamcollsurg.2019.12.007.
10. Liu JY, Ellis RJ, Hu QL et al. Post Hepatectomy Liver Failure Risk Calculator for Preoperative and Early Postoperative Period Following Major Hepatectomy. Ann Surg Oncol 2020; 27(8): 2868–2876. doi: 10.1245/s10434-020-08239-6.
11. Sparrelid E, Olthof PB, Dasari BVM et al. Current evidence on posthepatectomy liver failure: comprehensive review. BJS Open 2022; 6(6): zrac142. doi: 10.1093/bjsopen/zrac142.
12. Golse N, Bucur PO, Adam R et al. New paradigms in post-hepatectomy liver failure. J Gastrointest Surg 2013; 17(3): 593–605. doi: 10.1007/s11605-012-2048-6.
13. Kauffmann R, Fong Y. Post-hepatectomy liver failure. Hepatobiliary Surg Nutr 2014; 3(5): 238–246. doi: 10.3978/j.issn.2304-3881.2014.09.01.
14. Baumgartner R, Gilg S, Björnsson B et al. Impact of post-hepatectomy liver failure on morbidity and short- and long-term survival after major hepatectomy. BJS Open 2022; 6(4): zrac097. doi: 10.1093/bjsopen/zrac097.
15. Marasco G, Alemanni LV, Colecchia A et al. Prognostic Value of the Albumin-Bilirubin Grade for the Prediction of Post-Hepatectomy Liver Failure: A Systematic Review and Meta-Analysis. J Clin Med 2021; 10(9): 2011. doi: 10.3390/jcm10092011.
16. Guo G, Lei Z, Tang X et al. External Validation of Six Liver Functional Reserve Models to predict Posthepatectomy Liver Failure after Major Resection for Hepatocellular Carcinoma. J Cancer 2021; 12(17): 5260–5267. doi: 10.7150/jca.58726.
17. Pang Q, Zhou S, Liu S et al. Prognostic role of preoperative albumin-bilirubin score in posthepatectomy liver failure and mortality: a systematic review and meta-analysis. Updates Surg 2022; 74(3): 821–831. doi: 10.1007/s13304-021-01080-w.
18. Zou H, Wen Y, Yuan K et al. Combining albumin-bilirubin score with future liver remnant predicts post-hepatectomy liver failure in HBV-associated HCC patients. Liver Int 2018; 38(3): 494–502. doi: 10.1111/liv.13514.
19. Park HJ, Seo KI, Kim SJ et al. Effectiveness of Albumin-bilirubin Score as a Predictor of Post-hepatectomy Liver Failure in Patients with Hepatocellular Carcinoma. Korean J Gastroenterol 2021; 77(3): 115–122. doi: 10.4166/kjg.2020.148.
20. Takahashi K, Gosho M, Kim J et al. Prediction of Posthepatectomy Liver Failure with a Combination of Albumin-Bilirubin Score and Liver Resection Percentage. J Am Coll Surg 2022; 234(2): 155–165. doi: 10.1097/XCS.0000000000000027.
21. Laca L, Urdzik J, Dobrota FM et al. Limitácie resekcií pecene. Rozhl Chir 2009; 88(3): 127–132.