Ovplyvňuje liečba inhibítormi protónovej pumpy riziko gastrointestinálneho krvácania u pacientov na liečbe novými orálnymi antitrombotikami?
Ingrid Škorňová1, Tomáš Bolek2, Matej Samoš2, Jakub Marko1, Ľubica Vádelová2, Janka Žolková2, Mária Boleková Lányiová3, Ján Staško1, Marián Mokáň Orcid.org 2
+ Pracoviště
Souhrn
Orálna antitrombotická liečba u pacientov s akútnym koronárnym syndrómom a u pacientov s fibriláciou predsiení signifikantne zvyšuje riziko gastrointestinálneho (GI) krvácania. Inhibítory protónovej pumpy (PPI – proton pump inhibitors) podávané s protidoštičkovou a antikoagulačnou liečbou môžu znižovať riziko GI krvácania. V súčasnosti bolo do klinickej praxe uvedených niekoľko relatívne nových antitrombotík u pacientov s akútnym koronárnym syndrómom (klopidogrel, prasugrel, tikagrelor) alebo u pacientov s fibriláciou predsiení vyžadujúcich dlhodobú antikoaguláciu (dabigatran, rivaroxaban, apixaban, edoxaban). Tieto nové antitrombotika poskytujú silnejšiu inhibíciu doštičiek alebo antikoaguláciu v porovnaní so staršími preparátmi (tiklopidín, anopyrín, warfarín), a preto sa zdá, že potreba gastroprotekcie môže byť silnejšia, keď sú tieto nové preparáty podávané dlhodobo. Práve pre uvedené je táto konkomitantná terapia podávaná relatívne často. V tejto práci sumarizujeme dostupné dáta o vplyve PPI na riziko GI krvácania asociovaného s liečbou novými orálnymi antitrombotikami.
Klíčová slova
gastrointestinální krvácení, inhibitory protonové pumpy, léčba blokátory ADP receptorů, nová orální antikoagulanciaÚvod
Medzi časté nežiaduce účinky antitrombotickej liečby patrí vo všeobecnosti zvýšené riziko krvácavých komplikácií. Medzi najčastejšie krvácavé komplikácie u pacientov liečených antitrombotickou terapiou patrí krvácanie z horného gastrointestinálneho (GI) traktu. Liečba adenozíndifosfát (ADP – adenosine diphosphate) blokátormi receptorov (ADPRB) u pacientov s akútnym koronárnym syndrómom (AKS) (klopidogrel, prasugrel, tikagrelor) a nové orálne antikoagulanciá (NOAK) u pacientov s fibriláciou predsiení (AF – atrial fibrillation) (dabigatran, rivaroxaban, apixaban, edoxaban) signifikantne zvyšujú riziko GI krvácania [1,2]. Liečba inhbítormi protónovej pumpy (PPI – proton pump inhibitor) podávaná spolu s uvedenou antitrombotickou terapiou môže signifikantne toto riziko znižovať [3]. Tento prehľadový článok sumarizuje súčasne dostupné informácie o vplyve jednotlivých nových antitrombotík (ADPRB a NOAK) na riziko GI krvácania a o možnostiach ovplyvnenia rizika GI krvácania asociovaného s antitrombotickou liečbou súčasným podaním PPI a o riziku interakcie medzi PPI a P2Y12 ADPRB.
Liečba ADPRB, PPI riziko GI krvácania a riziko ich interakcie
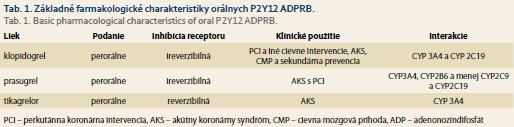
V súčasnosti máme v klinickej praxi dostupné tri P2Y12 ADPRB, konkrétne klopidogrel, prasugrel a tikagrelor. Ich základné farmakologické charakteristiky sú zosumarizované v tab. 1.
Klopidogrel, PPI riziko GI krvácania a riziko ich interakcie
Tienopyridín klopidogrel, blokátor P2Y12 ADP receptorov, signifikantne zvyšuje riziko krvácavých komplikácii, avšak riziko závažného GI krvácania u pacientov liečených klopidogrelom je v porovnaní s anopyrínom signifikantne nižšie (0,52 vs. 0,72%) [4]. Pacienti s anamnézou vredovej choroby gastroduodena však majú vysoké riziko krvácavých komplikácii na liečbe klopidogrelom [5]. V rámci prevencie závažných krvácavých komplikácií u pacientov s anamnézou vredovej choroby gastroduodena liečených klopidogrelom je indikovaná liečba PPI. V randomizovanej, multicentrickej štúdii COGENT u pacientov liečených duálnou antiagregačnou liečbou (klopidogrel a anopyrín) spolu s omeprazolom v porovnaní s ramenom bez omeprazolu bol zistený signifikantne vyšší výskyt krvácavých komplikácii u pacientov bez súčasnej liečby PPI [6]. Wang et al hodnotili švédsky register, kde na selektovanej skupine pacientov s vysokým rizikom GI krvácaní zistili, že pacienti liečení konkomitantnou liečbou PPI a klopidogrelom majú signifikantne nižšiu mortalitu ako pacienti bez liečby PPI [7].
Na podklade dostupných dát sa zdá, že klopidogrel signifikantne zvyšuje riziko GI krvácania, najmä u pacientov s anamnézou vredu gastroduodena a konkomitantná liečba PPI toto riziko signifikantne znižuje.
V súčasnosti viaceré publikované práce diskutujú o možnej interakcii medzi klopidogrelom a PPI. Gilard et al realizovali štúdiu u pacientov liečených duálnou antiagregačnou liečbou (anopyrín + klopidogrel), kde demonštrovali, že pacienti liečení spolu s PPI mali signifikantne vyššiu reaktivitu trombocytov (verifikované testom fosforylácie VASP proteínu) ako pacienti bez liečby PPI (61,4 ± 23,2 vs. 49,5 ± 16,3; p = 0,007) [8]. V randomizovanej, dvojito zaslepenej štúdii OCLA (Omeprazole Klopidogrel Aspirin) u pacientov podstupujúcich perkutánnú koronárnú intervenciu (PCI – percutaneous coronary intervention) liečených anopyrinom a klopidogrelom autori preukázali vyššiu reziduálnu aktivitu trombocytov u pacientov liečených omeprazolom v porovnaní so skupinou bez PPI (51,4 vs. 39,8 %; p = 0,0001), čím preukázali menej efektívnu inhibíciu trombocytov [9]. Boli publikované aj ďalšie práce, ktoré preukázali vplyv PPI na klinický efekt liečby u pacientov liečených klopidogrelom. Metaanalýzy veľkých štúdií opakovane poukázali na vyšší výskyt kardiovaskulárnych príhod MACE (major adverse cardiac events) u pacientov liečených klopidogrelom a PPI [10–12]. Na druhej strane recentne publikované metanalýzy nepreukázali asociáciu medzi konkomitantnou liečbou PPI a klopidogrel a rizikom ischemických kardiovaskulárnych príhod [13–16]. Tiež boli realizované štúdie, ktoré porovnávali interakciu medzi jednotlivými PPI (omeprazol, pantoprazol, ezomeprazol, lanzoprazol, rabeprazol) a preukázali najvyššiu mieru interakcie u jedincov liečených omeprazolom, pričom vyššiu mieru interakcie s klopidogrelom dosahovali tzv. silné inhibítory CYP 2C19, ako je omeprazol a ezomeprazol [17,18]. V nami realizovanej prospektívnej štúdii sme nepreukázali ovplyvnenie účinnosti liečby ADP receptor blokátormi (klopidogrel, prasugrel a tikagrelor) konkomitantnou liečbou pantoprazolom u pacientov s akútnym infarktom myokardu s elevací ST segmentu (STEMI) [19].
Interakcia medzi PPI a klopidogrelom je stále diskutovanou témou. Na základe dostupných dát by sme však mali preferenčne voliť, najmä u pacientov s vysokým rizikom liekových interakcií, slabší inhibítor CYP 2C19, napr. pantoprazol.
Prasugrel, PPI riziko GI krvácania a riziko ich interakcie
Podávanie blokátora P2Y12 ADP receptora prasugrelu v multicentrickej medzinárodnej, randomizovanej, dvojito zaslepenej štúdii s paralelnými skupinami TRITON-TIMI 35 bolo asociované s nižším výskytom primárneho endpointu (zloženého z kardiovaskulárneho úmrtia, nefatálneho infarktu myokardu alebo nefatálnej mozgovej príhody) v porovnaní s klopidogrelom, ale bolo tiež asociované s vyšším výskytom krvácavých komplikácií z GI traktu a rizikom vzniku GI malignít v porovnaní s klopidogrelom [20]. Uvedené výsledky preukázali, že vyššia miera inhibície agregability trombocytov vplyvom liečby prasugrelom znižuje riziko ischemických príhod v porovnaní s pacientmi liečenými klopidogrelom. Na druhej strane zvyšuje riziko krvácavých komplikácií. Nedávno bola publikovaná metaanalýza klinických štúdii, kde autori preukázali, že prasugrel nesignifikatne zvyšuje riziko krvácania z GI traktu v porovnaní s klopidogrelom [21]. V dostupnej literatúre je však málo post-marketingových údajov o nežiaducom efekte prasugrelu na GI trakt. Liečba PPI znižuje riziko vzniku žalúdočných krvácaní, a preto PPI sú často indikované ako konkomitantná liečba k prasugrelu. V subanalýze randomizovanej štúdie TRANSLATE-ACS u pacientov s AKS po PCI autori porovnávali pacientov liečených prasugrelom s PPI vs. bez PPI a hodnotili riziko výskytu ischemických a krvácavých príhod. Pacienti liečení PPI mali porovnateľné riziko ischemických kardiovaskulárnych príhod (hazard ratio (HR) 1,38; 95% CI 1,21–1,58) a tiež porovnateľné riziko krvácavých GI príhod (HR 1,55; 95% CI 1,15–2,09) ako pacienti bez liečby PPI [22].
V dostupnej literatúre je teda relatívne malé množstvo údajov študujúcich súčasnú liečbu PPI a prasugrelom a jej vplyv na výskyt krvácavých komplikácií. Preto bude potreba realizácie ďalšich randomizovaných kontrolovaných štúdii na jej objasnenie.
O potenciálnom riziku interakcie medzi PPI a prasugrelom je dostupných malé množstvo dôkazov. Táto potenciálna interakcia bola popísaná v prospektívnej, observačnej štúdii, v ktorej omeprazol, ezomeprazol a rabeprazol signifikantne znižovali antiagregačný efekt liečby prasugrelom [23]. Na druhej strane post hoc analýza štúdie TRILOGY ACS preukázala konzistentne nižšiu reziduálnu aktivitu trombocytov u pacientov liečených prasugrelom a PPI a u pacientov liečených klopidogrelom a PPI [24].
Interakcia medzi prasugrelom a PPI je relatívne málo študovanou problematikou. Preto by dáta z klinických štúdií mohli priniesť zaujímavé výsledky.
Tikagrelor, PPI riziko GI krvácania a riziko ich interakcie
Reverzibilný blokátor P2Y12 ADP receptorov tikagrelor bol v randomizovanej multicentrickej štúdii PLATO asociovaný s nižším výskytom ischemických príhod v porovnaní s klopidogrelom [25]. Tikagrelor, podobne ako prasugrel, dosahuje vyššiu miernu inhibície agregácie trombocytov v porovnaní s klopidogrelom, a preto môže zvyšovať riziko krvácavých komplikácií. Subanalýza štúdie PLATO preukázala, že pacienti liečení tikagrelorom mali porovnateľný celkový výskyt procedurálnych krvácavých komplikácií (11,6 vs. 11,2 %; p = 0,43), ale vyšší výskyt postprocedurálnych krvácavých komplikácií (4,5 vs. 3,8 %; p = 0,02) v porovnaní s pacientmi liečenými klopidogrelom [26]. Práve pre vyššie riziko krvácavých komplikácií na liečbe tikagrelorom u pacientov s AKS je často podávaná konkomitantná liečba PPI. Vplyv interakcie medzi PPI a tikagrelorom na klinický efekt liečby bol retrospektívne analyzovaný v registrovej multicentrickej štúdii u 15 401 pacientov, kde pacienti liečení PPI a tikagrelorom mali porovnateľný výskyt krvácavých komplikácii s pacientmi liečenými PPI a klopidogrelom. Hoedemaker et al v observačnej prospektívnej štúdii sledovali u pacientov s AKS liečených novými antagonistami ADP receptorov vplyv konkomitantnej liečby PPI na výskyt kardiovaskulárnych a krvácavých príhod a zistili, že pacienti liečení PPI mali nižší výskyt ischemických príhod a mali porovnateľní výskyt GI krvácavých príhod ako pacienti bez liečby PPI [27].
Z uvedených skutočností vyplýva, že aktuálne je relatívne malé množstvo dát o konkomitantnej liečbe PPI s tikagrelorom a o jej vplyve na riziko GI krvácania. V budúcnosti bude potrebné realizovať ďalšie klinické randomizované štúdie, ktoré dajú jednoznačnú odpoveď na otázku, či existuje benefit liečby PPI u pacientov liečených tikagrelorom.
Tikagrelor na rozdiel od klopidogrelu nemá žiadné známe farmakokinetické a farmakodynamické interakcie s PPI. Preto potenciálna interakcia tikagreloru a PPI je málo pravdepodobná [28].
Subanalýza multicentrickej, randomizovanej, dvojito zaslepenej štúdie PLATO ale preukázala nezávislú asociáciu medzi užívaním PPI a vyšším rizikom nežiaducich kardiovaskulárnych príhod u pacientov s AKS liečených klopidogrelom a tiež liečených tikagrelorom. Výsledky tejto práce preukázali potenciálnu interakciu; alebo pravdepodobnejšie poukázali na fakt, že asociácia medzi liečbou PPI a nežiaducimi kardiovaskulárnymi príhodami bola spôsobená hlavne rozdielmi v základných charakteristikách skupín s PPI a bez PPI, teda užívanie PPI bola viac markerom ako príčinou vysokého výskytu nežiaducich kardiovaskulárnych príhod u pacientov liečených tikagrelorom [25].
Liečba NOAK, PPI a riziko GI krvácania
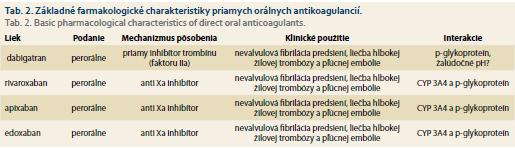
Zavedenie priamych orálnych antikoagulancií do klinickej praxe významne rozšírilo možnosti farmakologickej prevencie systémovej embolizácie a cievnej mozgovej príhody u pacientov s nevalvulárnou fibriláciou predsiení, tiež v liečbe hlbokej žilovej trombózy a pľúcnej embólie. V súčasnosti máme dostupné štyri NOAK, konkrétne dabigatran, rivaroxaban, apixaban a edoxaban. Ich základné farmakologické charakteristiky sú zhrnuté v tab. 2.
Dabigatran, PPI a riziko GI krvácania
Priamy reverzibilný inhibítor trombínu (faktora IIa) dabigatran, v randomizovanej štúdii RE-LY podávaný 2× denne v dávke 150 mg, v porovnaní s warfarínom, bol spojený so signifikantne nižším rizikom vzniku cievnej mozgovej príhody a systémovej embolizácie a porovnateľným rizikom závažného krvácania, ale nížším výskytom intrakraniálneho krvácania [29]. Subanalýza štúdie RE-LY, ktorá hodnotila výskyt nežiaducich krvácavých príhod horného GI traktu u pacientov liečených dabigatranom v porovnaní s warfarínom, preukázala, že u dabigatranom liečených pacientov bol 16,9% výskyt GI krvácavých príhod v porovnaní s 9,4 % u pacientov liečených warfarínom (relative risk 1,81; 95% CI 1,66–1,97 %; p < 0,001). Výskyt krvácavých príhod v skupine liečenej dabigatranom nebol asociovaný s dávkovacím režimom dabigatranu. Celkový výskyt krvácavých príhod síce bol v štúdii RE-LY porovnateľný s warfarínom, krvácanie z horného GI traktu bolo však signifikantne vyššie. Preto sa u pacientov liečených dabigatranom ukazuje ako vhodná súčasná liečba PPI na zníženie rizika krvácania z horného GI traktu [30]. Chan et al preukázali v retrospektívnej analýze zahrňujúcej 5 041 pacientov liečených konkomitantne liečbou dabigatranom a gastroprotektívnou liečbou (PPI alebo H2 blokátory) signifikante nižší výskyt krvácavých komplikácii z horného GI traktu v porovnaní s pacientmi bez gastroprotektívnej liečby [31]. Recentne bola publikovaná kohortná štúdia, ktorá retrospektívne analyzovala súbor 1 643 123 pacientov liečených NOAK z hľadiska výskytu GI krvácavých príhod pri liečbe novými antikoagulanciami. Pacienti liečení PPI a dabigatranom mali v tejto kohortnej štúdii signifikantne nižší výskyt krvácavých komplikácií ako pacienti bez liečby PPI. V skupine liečenej dabigatranom bol najväčší rozdiel vo výskyte GI krvácaní v porovnaní s ostatnými NOAK (apixaban, rivaroxaban) a warfarínom v podskupinách s PPI vs. bez PPI (relative deviation = –61,1) [32].
V dostupnej literatúre však stále chýba randomizovaná štúdia, ktorá by jednoznačne potvrdila benefit liečby PPI v prevencii GI krvácaní u pacientov liečených dabigatranom, napriek tomu je táto konkomitantná liečba v reálnej klinickej praxi relatívne často používaná.
Rivaroxaban, PPI a riziko GI krvácania
V randomizovanej klinickej štúdii ROCKET AF bola preukázaná noninferiorita rivaroxabanu vo výskyte ischemických príhod oproti liečbe warfarínom a porovnateľný výskyt krvácania. Zaznamenaný bol však signifikantne nižší výskyt intrakraniálneho krvácania (0,5 vs. 0,7 %; p < 0,05) a signifikantne nižší výskyt úmrtí v dôsledku krvácania (0,2 vs. 0,5 %; p < 0,01) [33]. V subanalýze štúdie ROCKET AF autori hodnotili výskyt GI krvácaní a zistili, že pacienti liečení rivaroxabanom mali signifikantne vyšší výskyt veľkých, ako aj malých GI krvácaní, ako pacienti liečení warfarínom (3,61 prípadov/100 pacientov/rok vs. 2,6 prípadov/100 pacientov/rok; HR 1,42; 95% CI 1,22–1,66). Výskyt klinicky závažných GI krvácaní bol porovnateľný v oboch sledovaných skupinách (0,47 prípadov/100 pacientov/rok vs. 0,41 prípadov/100 pacientov/rok; p = 0,39). V štúdii ROCKET AF bol teda vyšší výskyt GI krvácaní v ramene liečenom rivaroxabanom, výskyt klinicky závažných krvácaní bol ale porovnateľný s warfarínom [34]. Výskyt krvácaní z horného GI traktu v štúdii ROCKET AF bol identifikovaný u 48 % prípadov celkového krvácania z GI traktu. Práve z dôvodu uvedeného sa zdá byť vhodná u rizikových skupín konkomitantná liečba PPI, ktorá môže znížiť výskyt krvácaní z horného GI traktu. V už spomenutej kohortnej retrospektívnej analýze Ray et al hodnotili vplyv PPI na výskyt krvácavých komplikácii pri liečbe NOAK a zistili, že pacienti liečení rivaroxabanom mali v porovnaní s dabigatranom, apixabanom a warfarínom najvyšší výskyt horného GI krvácania a že konkomitatná liečba PPI toto riziko signifikantne znižovala [32].
Na podklade uvedeného sa zdá byť konkomitantná liečba PPI vhodnou u pacientov s vysokým rizikom krvácania z horného GI traktu liečených rivaroxabanom, stále však chýbajú dáta z randomizovanej klinickej štúdie.
Apixaban, PPI a riziko GI krvácania
V randomizovanej klinickej štúdii ARISTOTLE bol apixaban, čo je vysoko selektívny, priamy inhibítor faktora Xa, superiorný z hľadiska prevencie nežiaducich ischemických príhod definovaných ako cievna mozgová príhoda alebo systémová embolizácia (1,27 vs. 1,6 % za rok; p < 0,01). Tiež v tejto skupine pacientov liečených apixabanom bolo zaznamenaných menej významných krvácaní (2,13 vs. 3,09 % za rok; p < 0,001) v porovnaní s warfarínom [35]. Subanalýza štúdie ARISTOTLE preukázala, že pacienti liečení apixabanom mali nižší výskyt klinicky nevýznamných GI krvácaní ako pacienti liečení warfarínom. V metaanalýze 43 klinických randomizovaných štúdií pacienti liečení apixabanom mali porovnateľné riziko GI krvácavých komplikácií s warfarínom aj s ostatnými NOAK [36]. V už spomínanej recentne publikovanej retrospektívnej kohortnej štúdii mali pacienti liečení apixabanom signifikantne nižší výskyt krvácavých komplikácií z horného GI traktu (73/10 000 pacientovrok; 95% CI 1,73–2,25) ako pacienti liečení rivaroxabanom (144/10 000 pacientov/ rok; 95% CI 136–152). Apixabanom liečení pacienti s konkomitantnou liečbou PPI mali v tejto štúdii signifikantne nižší výskyt krvácavých komplikácií ako apixabanom liečení pacienti bez liečby PPI [32].
Na podklade dostupných dát sa zdá, že pacienti liečení apixabanom majú nižší výskyt krvácavých komplikácií z GI traktu ako pacienti liečení rivaroxabanom a porovnateľné riziko týchto komplikácií s pacientmi liečenými warfarínom. Tiež sa zdá, že liečba PPI toto riziko krvácania z horného GI traktu znižuje; na definitívne potvrdenie tejto skutočnosti však bude nevyhnutná realizácia ďalších štúdií.
Edoxaban, PPI a riziko GI krvácania
Edoxaban, priamy reverzibilný inhibítor faktora Xa, bol v randomizovanej štúdii ENGAGE AF-TIMI 48 noninferiorný voči warfarínu z hľadiska prevencie ischemických príhod (cievnej mozgovej príhody, systémovej embolizácie), pričom liečba edoxabanom bola v tejto štúdii spojená so signifikantne nižším výskytom krvácavých komplikácií [37]. V subanalýze štúdie ENGAGE-TIMI 48, ktorá sledovala výskyt GI krvácania u pacientov liečených edoxabanom v dvoch dávkovacích režimoch (60 mg/denne vs. 30 mg/denne) a u pacientov liečených warfarínom, autori zistili, že pacienti na vyššom dávkovaní edoxabanu (60 mg/denne) majú vyšší výskyt klinicky významného GI krvácania ako pacienti liečení warfarínom, a tiež preukázali, že pacienti s nižším dávkovaním edoxabanu (30 mg/denne) a s nižšími bazálnymi koncentráciami edoxabanu majú signifikantne nižší výskyt GI krvácavých komplikácií ako pacienti liečení warfarínom [38].
V dostupnej literatúre aktuálne nie je k dispozícii žiadna štúdia, ktorá by špecificky hodnotila vplyv PPI na riziko GI krvácania u pacientov liečených edoxabanom. Pre relatívne vysoké riziko GI krvácania práve u pacientov liečených vyššími dávkami edoxabanu (60 mg/denne) by boli výsledky štúdie, ktorá by špecificky túto problematiku hodnotila, veľmi zaujímavé.
Riziko antitrombotickej liečby u endoskopických výkonov
U pacientov liečených antitrombotickou terapiou, ktorí podstupujú endoskopické výkony, sú problémom krvácavé komplikácie pri liečbe aj trombotické komplikácie pri jej vysadení. Práve pre vyše uvedené je dôležité individuálne zhodnotiť krvácavé/trombotické riziko u pacientov na antitrombotickej liečbe, ktorí podstúpujú endoskopické výkony.
U pacientov s nízkorizikovou endoskopickou procedúrou je odporúčané pokračovať v liečbe ADPRB (v monoterapii aj duálnej protidoštičkovej liečbe). U endoskopických výkonov s vysokým procedurálnym krvácavým rizikom a nízkym trombotickým rizikom sa odporúča prerušiť liečbu ADPRB 5 dní pred výkonom. U pacientov s vysokým krvácavým procedurálnym rizikom a vysokým trombotickým rizikom sa odporúča pokračovať v liečbe anopyrínom a konzultovať kardiológa ohľadom benefitu/rizika z prerušenia liečby ADPRB.
U pacientov na liečbe NOAK, u ktorých sa plánuje výkon s nízkym procedurálnym rizikom, sa odporúča vynechať rannú dávku NOAK v deň výkonu. U výkonov s vysokým rizikom sa odporúča vysadiť NOAK min. 48 hod pred výkonom. U pacientov na liečbe dabigatranom s CrCl 30–50 ml/min sa odporúča vynechať dabigatran 72 hod pred výkonom. U pacientov s akútnym zhoršením obličkových funkcií by mal byť konzultovaný hematológ ohľadom manažmentu liečby NOAK [39].
Záver
Účinná liečba novými orálnymi antitrombotikami je asociovaná s vyšším rizikom GI krvácavých komplikácii. V súčasnej klinickej praxi je liečba novými orálnymi antitrombotikami spolu s liečbou PPI relatívne často používaná, avšak na základe aktuálne dostupných údajov nemožno jednoznačne potvrdiť benefit tejto konkomitantnej terapie. Zdá sa, že konkomitantná liečba PPI s klopidogrelom u pacientov s AKS a s anamnézou vredu gastroduodena znižuje riziko krvácavých komplikácií. Tiež sa zdá, že konkomitantná liečba PPI s dabigatranom môže signifikantne znižovať riziko GI krvácania; tieto údaje však pochádzajú z relatívne malého množstva klinických štúdií. Na jednoznačné zhodnotenie benefitu PPI na riziko GI krvácania u pacientov liečených novými orálnymi antitrombotikami bude teda nutná realizácia randomizovaných klinických štúdií.
Doručené/Submitted: 26. 6. 2019
Prijaté/Accepted: 13. 8. 2019
MUDr. Tomáš Bolek
I. interná klinika JLF UK a UN Martin
Kollárova 2
036 59 Martin
ato.bolek@gmail.com
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Nagata N, Niikura R, Yamada A et al. Acute middle gastrointestinal bleeding risk associated with NSAIDs, antithrombotic drugs, and PPIs: a multicenter case-control study. PLoS One 2016; 11 (3): e0151332. doi: 10.1371/journal.pone.0151332.
2. Khan R, Lopes RD, Neely ML et al. Characterising and predicting bleeding in high-risk patients with an acute coronary syndrome. Heart 2015; 101 (18): 1475–1484. doi: 10.1136/heartjnl-2014-307346.
3. Ďuriček M, Bánovčin P, Hyrdel R. Inhibítory protónovej pumpy vo svetle klinických študií a bezpečnostný profil ich dlhodobého užívania. Gastroent Hepatol 2018; 72 (5): 432–440. doi: 10.14735/amgh2018432.
4. CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet 1996; 348 (9038): 1329–1339. doi: 10.1016/ s0140-6736 (96) 09457-3.
5. Tan VP, Yan BP, Kiernan TJ et al. Risk and management of upper gastrointestinal bleeding associated with prolonged dual-antiplatelet therapy after percutaneous coronary intervention. Cardiovasc Revasc Med 2009; 10 (1): 36–44. doi: 10.1016/j.carrev.2008.11.001.
6. Bhatt DL, Cryer BL, Contant CF et al. Clopidogrel with or without omeprazole in coronary artery disease. N Engl J Med 2010; 363 (20): 1909–1917. doi: 10.1056/NEJMoa1007964.
7. Wang Q, Ljung R, Lagergren J et al. Prognosis of concomitant users of clopidogrel and proton-pump inhibitors in a high-risk population for upper gastrointestinal bleeding. BMC Pharmacol Toxicol 2014; 15: 22. doi: 10.1186/2050-6511-15-22.
8. Gilard M, Arnaud B, Cornily JC et al. Influence of omeprazole on the antiplatelet action of clopidogrel associated with aspirin: the randomized, double-blind OCLA (Omeprazole CLopidogrel Aspirin) study. J Am Coll Cardiol 2008; 51 (3): 256–260. doi: 10.1016/j.jacc.2007.06.064.
9. Gilard M, Arnaud B, Le Gal G et al. Influence of omeprazol on the antiplatelet action of clopidogrel associated to aspirin. J Thromb Haemost 2006; 4 (11): 2508–2509. doi: 10.1111/ j.1538-7836.2006.02162.x.
10. Serbin MA, Guzauskas GF, Veenstra DL. Clopidogrel-proton pump inhibitor drug-drug interaction and risk of adverse clinical outcomes among PCI-treated ACS patients: a meta-analysis. J Manag Care Spec Pharm 2016; 22 (8): 939–947. doi: 10.18553/jmcp.2016.22.8. 939.
11. Siller-Matula JM, Jilma B, Schrör K et al. Effect of proton pump inhibitors on clinical outcome in patients treated with clopidogrel: a systematic review and meta-analysis. J Thromb Haemost 2010; 8 (12): 2624–2641. doi: 10.1111/j.1538-7836.2010.04049.x.
12. Niu Q, Wang Z, Zhang Y et al. Combination use of clopidogrel and proton pump inhibitors increases major adverse cardiovascular events in patients with coronary artery disease: a meta-analysis. J Cardiovasc Pharmacol Ther 2017; 22 (2): 142–152. doi: 10.1177/1074248416663647.
13. Demcsák A, Lantos T. Bálint ER et al. PPIs are not responsible for elevating cardiovascular risk in patients on clopidogrel-a systematic review and meta-analysis. Front Physiol 2018; 9: 1550. doi: 10.3389/fphys.2018.01550.
14. Yi X, Zhou Q, Wang C et al. Concomitant use of proton pump inhibitors and clopidogrel is not associated with adverse outcomes after ischemic stroke in chinese population. J Stroke Cerebrovasc Dis 2016; 25 (12): 2859–2867. doi: 10.1016/j.jstrokecerebrovasdis.2016.08.001.
15. Batchelor R, Kumar R, Gilmartin-Thomas JF et al. Systematic review with meta-analysis: risk of adverse cardiovascular events with proton pump inhibitors independent of clopidogrel. Aliment Pharmacol Ther 2018; 48 (8): 780–796. doi: 10.1111/apt.14955.
16. Bhatt DL, Cryer BL, Contant CF et al. Clopidogrel with or without omeprazole in coronary artery disease. N Engl J Med 2010; 363 (20): 1909–1917. doi: 10.1056/NEJMoa1007964.
17. Ogilvie BW, Yerino P, Kazmi F et al. The proton pump inhibitor, omeprazole, but not lansoprazole or pantoprazole, is a metabolism-dependent inhibitor of CYP2C19: implications for coadministration with clopidogrel. Drug Metab Dispos 2011; 39 (11): 2020–2033. doi: 10.1124/dmd.111.041293.
18. Angiolillo DJ, Gibson CM, Cheng S et al. Differential effects of omeprazole and pantoprazole on the pharmacodynamics and pharmacokinetics of clopidogrel in healthy subjects: randomized, placebo-controlled, crossover comparison studies. Clin Pharmacol Ther 2011; 89 (1): 65–74. doi: 10.1038/clpt.2010.219.
19. Bolek T, Samoš M, Šimonová R et al. Does pantoprazole affect the on-treatment platelet reactivity in patients with acute STEMI treated with ADP receptor blockers? A pilot prospective study. Am J Ther 2017; 24 (2): e162–e166. doi: 10.1097/MJT.0000000000000454.
20. Wiviott SD, Braunwald E, McCabe CH. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007; 357 (20): 2001–2015. 10.1056/NEJMoa0706482.
21. Chen HB, Zhang XL, Liang HB et al. Meta-analysis of randomized controlled trials comparing risk of major adverse cardiac events and bleeding in patients with prasugrel versus clopidogrel. Am J Cardiol 2015; 116 (3): 384–392. doi: 10.1016/j.amjcard.2015.04.054.
22. Jackson LR 2nd, Peterson ED, McCoy LA et al. Impact of proton pump inhibitor use on the comparative effectiveness and safety of prasugrel versus clopidogrel: insights from the treatment with adenosine diphosphate receptor inhibitors: longitudinal assessment of treatment patterns and events after acute coronary syndrome (TRANSLATE-ACS) study. J Am Heart Assoc 2016; 5 (10). doi: 10.1161/JAHA.116.003 824.
23. Chen CH, Yang JC, Uang YS et al. Differential inhibitory effects of proton pump inhibitors on the metabolism and antiplatelet activities of clopidogrel and prasugrel. Biopharm Drug Dispos 2012; 33 (5): 278–283. doi: 10.1002/bdd.1795.
24. Nicolau JC, Bhatt DL, Roe MT et al. Concomitant proton-pump inhibitor use, platelet activity, and clinical outcomes in patients with acute coronary syndromes treated with prasugrel versus clopidogrel and managed without revascularization: insights from the targeted platelet inhibition to clarify the optimal strategy to medically manage acute coronary syndromes trial. Am Heart J 2015; 170 (4): 683–694. doi: 10.1016/j.ahj.2015.05.017.
25. Goodman SG, Blare R, Pieper KS et al. Association of proton pump inhibitor use on cardiovascular outcomes with clopidogrel and ticagrelor: insights from the platelet inhibition and patient outcomes trial. Circulation 2012; 125 (8): 978–986. doi: 10.1161/ CIRCULATIONAHA.111.032912.
26. Becker RC, Bassand JP, Budaj A et al. Bleeding complications with the P2Y12 receptor antagonists clopidogrel and ticagrelor in the PLATelet inhibition and patient Outcomes (PLATO) trial. Eur Heart J 2011; 32 (23): 2933–2944. doi: 10.1093/eurheartj/ehr422.
27. Hoedemaker NP, Damman P, Ottervanger JP et al. Trends in cardiovascular and bleeding outcomesin acute coronary syndrome patients treated with or without proton pump inhibitors during the introduction of novel P2Y12 inhibitors: a five-year experience from a single-centre observational registry. Eur Heart J Cardiovasc Pharmacother 2019; 5 (3): 127–138. doi: 10.1093/ehjcvp/pvy030.
28. Teng R. Ticagrelor: pharmacokinetic, pharmacodynamic and pharmacogenetic profile: an update. Clin Pharmacokinet 2015; 54 (11): 1125–1138. doi: 10.1007/s40262-015-0290-2.
29. Connolly SJ, Ezekowitz MD, Yusuf S et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361 (12): 1139–1151. doi: 10.1056/NEJMoa0905561.
30. Flack KF, Desai J, Kolb JM et al. Major gastrointestinal bleeding often is caused by occult malignancy in patients receiving warfarin or dabigatran to prevent stroke and systemic embolism from atrial fibrillation. Clin Gastroenterol Hepatol 2017; 15 (5): 682–690. doi: 10.1016/j.cgh.2016.10.011.
31. Chan EW, Lau WC, Leung WK et al. Prevention of dabigatran-related gastrointestinal bleeding with gastroprotective agents: a population-based study. Gastroenterology 2015; 149 (3): 586–595. doi: 10.1053/j.gastro.2015.05.002.
32. Ray WA, Chung CP, Murray KT et al. Association of oral anticoagulants and proton pump inhibitor cotherapy with hospitalization for upper gastrointestinal tract bleeding. JAMA 2018; 320 (21): 2221–2230. doi: 10.1001/jama.2018.17242.
33. Patel MR, Mahaffey KW, Garg J et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011; 365 (10): 883–891. doi: 10.1056/NEJMoa1009638.
34. Sherwood MW, Nessel CC, Hellkamp AS et al. Gastrointestinal bleeding in patients with atrial fibrillation treated with rivaroxaban or warfarin: ROCKET AF trial. J Am Coll Cardiol 2015; 66 (21): 2271–2281. doi: 10.1016/j.jacc.2015. 09.024.
35. Granger CB, Alexander JH, McMurray JJ et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011; 365 (11): 981–992. doi: 10.1056/NEJMoa1107039.
36. Miller CS, Dorreen A, Martel M et al. Risk of gastrointestinal bleeding in patients taking non-vitamin K antagonist oral anticoagulants: a systematic review and meta-analysis. Clin Gastroenterol Hepatol 2017; 15 (11): 1674–1683. doi: 10.1016/j.cgh.2017.04.031.
37. Giugliano RP, Ruff CT, Braunwald E et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013; 369 (22): 2093–2104. doi: 10.1056/NEJMoa1310907.
38. Aisenberg J, Chatterjee-Murphy P, Friedman Flack K et al. Gastrointestinal bleeding with edoxaban versus warfarin: results from the ENGAGE AF-TIMI 48 trial (Effective anticoagulation with factor Xa next generation in atrial fibrillation-thrombolysis in myocardial infarction). Circ Cardiovasc Qual Outcomes 2018; 11 (5): e003998. doi: 10.1161/CIRCOUTCOMES.117.003998.
39. Veitch AM, Vanbiervliet G, Gershlick AH et al. Endoscopy in patients on antiplatelet or anticoagulant therapy, including direct oral anticoagulants: British Society of Gastroenterology (BSG) and European Society of Gastrointestinal Endoscopy (ESGE) guidelines. Endoscopy 2016; 48 (4): 385–402. doi: 10.1055/s-0042-102652.