Metody neinvazivního stanovení pokročilosti jaterní fibrózy
Michal Koula1, Martina Hrůzová1, Dušan Harmáček1, Petr Hříbek1, Alena Černá2, Dominika Dvořáková1, Petr Urbánek Orcid.org 3
+ Pracoviště
Souhrn
Prognóza, péče a terapie chronických jaterních onemocnění značně závisí na stupni a rychlosti progrese jaterní fibrózy. Dlouhá léta bylo zlatým standardem pro vyšetření pokročilosti jaterní fibrózy histologické hodnocení. Jaterní biopsie je metoda invazivní, její sériové opakování u jednoho nemocného za účelem posouzení progrese onemocnění naráží na celou řadu problémů, vč. etických. Mnoho úsilí proto bylo věnováno nalezení neinvazivního postupu, který by většinu těchto problémů odstranil. Jako velice nadějné se v posledních letech ukazují metody hodnotící jaterní elasticitu. Tyto tzv. elastografické metody využívají střižných vln šířících se jaterní tkání. Samotný princip elastografie je znám již řadu desítek let, ale až zhruba v posledním 10letí dochází k rozvoji přístrojů schopných tento princip přenést do diagnostiky v hepatologii.
Klíčová slova
Fibroscan®, cirhóza, elastografie, jaterní fibróza, střižné vlnyÚvod
Prognóza, péče a terapie chronických jaterních onemocnění značně závisí na stupni a rychlosti progrese jaterní fibrózy v každém individuálním případě jaterního onemocnění. V posledních 10letích byla metodou volby k určení pokročilosti jaterní fibrózy (stagingu) jaterní biopsie a histologické hodnocení získaného vzorku jaterní tkáně [1]. Nevýhodou biopsie je přirozeně riziko komplikací (i když relativně nízké), cena, větší počet hodnoticích systémů, časová náročnost pro pacienta a především skutečnost, že její opakované, sériové, provádění v průběhu času u jednoho nemocného je prakticky neproveditelné [2]. Přitom právě sériová indikace biopsie poskytuje informaci o skutečné rychlosti progrese jaterní fibrózy. Tyto problémy vedly ke snaze vyvinout metody nové, pokud možno neinvazivní, které by bylo možné bez větších limitací v čase opakovat a které by poskytovaly stejnou informaci ve smyslu určení stagingu jaterního postižení jako jaterní biopsie.
Metody neinvazivního hodnocení stadia jaterní fibrózy
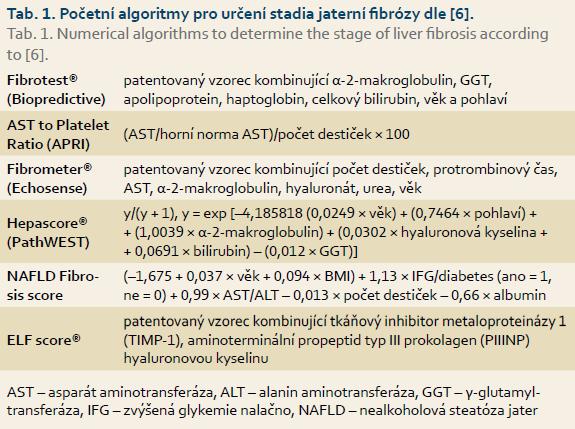
Dostupné metody neinvazivního hodnocení stadia jaterní fibrózy lze rozdělit na dvě skupiny: 1. biochemické a 2. fyzikální.
Biochemické metody
Biochemické metody jsou založeny na principu určení a sledování markerů jaterní fibrózy v séru nemocných. Do dnešní doby bylo zkoumáno velké množství biomarkerů, jejichž sérové hladiny do určité míry korelují se stupněm jaterní fibrózy. Většina těchto jednotlivých biomarkerů jsou metabolity různých typů kolagenu, jiné zase souvisí s aktivitou zánětu. Některá skóre zahrnují i klinické parametry (věk, pohlaví). Bylo vyvinuto několik algoritmů, které hodnoty těchto parametrů různým způsobem matematicky hodnotí. Výsledkem je určité číslo, koeficient, který je pak na základě velkých klinických studií korelován s určitým stadiem jaterní fibrózy v histologickém hodnocení. K tomu je např. používán systém hodnocení METAVIR pro virovou hepatitidu C, či systém NAS pro nealkoholové ztukovatění jater (NAFLD – non-alcoholic fatty liver disease) [3]. Jednotlivé algoritmy se liší mírou specificity a senzitivity pro různé stupně jaterní fibrózy (v systému METAVIR označovaných F0–F4, kdy F4 odpovídá jaterní cirhóze). Některé z těchto matematických postupů jsou patentově chráněny (např. FibroTest, ELF skóre), jiné jsou volně dostupné a využívají rutinně dostupné laboratorní testy (např. APRI, NAFLD skóre) [4,5]. Parametry, které jsou v nejčastěji používaných systémech hodnoceny, ukazuje tab. 1 [6].
Praktický přínos analýzy sérových biomarkerů spočívá v jejich možnosti použití téměř u všech pacientů (> 95 %) a snadné reprodukovatelnosti a dostupnosti [7]. Záporem tohoto přístupu je to, že veškeré doposud známé biomarkery jsou pro játra nespecifické, a proto mohou být ovlivněny dalšími komorbiditami pacienta. Sérologické metody nejsou v ČR příliš používány, jejich použití se zatím nedostalo do žádného českého ani evropského standardu, proto nejsou hlavní náplní tohoto přehledu.
Fyzikální metody
Fyzikální metody jsou založeny na měření jaterní tuhosti – elasticity. Tyto tzv. elastografické metody využívají měření charakteristik střižných vln (shear waves) šířících se jaterní tkání. Střižné vlny jsou poměrně složitým fyzikálním jevem, který je popisován v prostředí různého složení s obsahem vody. Vznikají v důsledku šíření určité energie tímto konkrétním prostředím. Jejich fyzikální charakteristiky se pak liší podle přesného složení prostředí, kterým se šíří. A této vlastnosti se právě využívá při elastografii. Parametrem, který nejvýrazněji ovlivňuje charakteristiky střižných vln v jaterní tkáni, je obsah vaziva, které se svými vlastnostmi nejvýznamněji liší od normální jaterní tkáně.
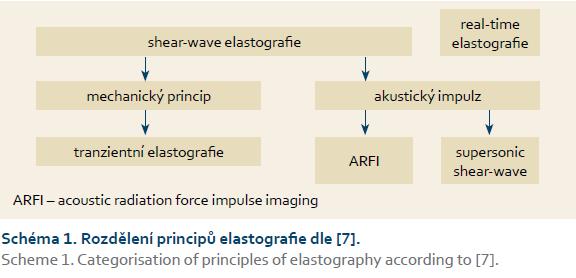
Vlastní fyzikální metody můžeme dále dělit podle mechanizmu vzniku energetického impulzu, který střižné vlny v tkáni generují. Rozlišujeme proto metody s mechanickým původem impulzu a metody ultrazvukové (schéma 1) [8].
Tranzientní elastografie
Tranzientní elastografie je nejdéle dostupnou elastografickou metodou (přístroj Fibroscan®, výrobce Echosens, Francie). Princip metody je znám řadu let, avšak v posledních letech postupně dochází k zavedení do rutinní praxe zejména díky výzkumu provedeném u rozsáhlých souborů pacientů s chronickou virovou hepatitidou C [9]. Samotné vyšetření je velice intuitivní, po patřičném zaškolení může být prováděno sestrou. Základem přístroje je sonda s mechanickým vibrátorem, který po přiložení na kůži do oblasti 9.–11. mezižebří vydá mechanickou vlnu, která se šiří jaterní tkání. Ve stejné době je sondou vyslán ultrazvukový signál, který snímá výše zmíněné střižné vlny vytvořené průchodem mechanické vlny jaterní tkání. Hloubka proniknutí signálu do jaterní tkáně je mezi 25 a 45 mm. Signál je počítačově zpracován a výsledná hodnota je udána v kPa v rozmezí hodnot 2,5–75 kPa (obr. 1) [8]. Výsledek měření je pak možné převést na stupeň jaterní fibrózy pomocí cut-off hodnot daných korelací jaterních biopsií s hodnotami měření jaterní tuhosti během studií na velkých pacientských sestavách. I když je samotné měření velice jednoduché, je třeba dodržovat určitá pravidla, aby mohl být výsledek označen za validní. Především musí být provedeno nejméně 10 úspěšných měření, celkový počet úspěšných měření musí být > 60 % ze všech provedených a interkvartilový rozptyl všech měření musí být < 30 % [6].
Interpretace výsledků a převod do klinického výstupu musí zůstat v rukou zkušeného hepatologa znajícího celou anamnézu pacienta v kontextu ostatních onemocnění. Přestože má tranzientní elastografie vynikající intra- i interobservační shodu, její aplikovatelnost oproti sérovým biomarkerům je nižší (cca 80 %) [10]. Nejčastější příčinou selhání měření je významná obezita pacienta. Ve snaze minimalizovat počet nevyšetřitelných pacientů byla vyvinuta tzv. XL sonda, která vyvolává střižné vlny v hloubce 35–75 mm, a tím umožňuje měření jaterní tuhosti i u obézních pacientů. Nicméně ani s touto sondou není možné vyšetřit 100 % obézních pacientů. Míra selhání měření se pohybuje kolem 25 z 50 % nevyšetřitelných M sondou [11]. Kromě obézních pacientů může být vyšetření jaterní elasticity obtížné či zkreslené u pacientů s úzkými interkostálními prostory, ascitem, srdečním selháváním, akutní zánětem jater, extrahepatální cholestázou, pokračujícím abúzem alkoholu, abnormalitami tkáně v okolí jater a jiné. Dále není vyšetření optimální u pacientů, kteří nejsou nalačno [12,13].
Ultrazvuková elastografie
Kromě výše zmíněného způsobu měření jaterní tuhosti byly a jsou vyvíjeny i další metody založené na využití měření jaterní tuhosti technikami na principu existence střižných vln. Sem patří technika ARFI (acoustic radiaiton force impulse imaging) a SWE (shear-wave elastography) (schéma 1) [8]. Technický podklad ARFI spočívá v excitaci jaterní tkáně krátkým akustickým pulzem, který vyvolá propagaci střižných vln a generuje lokalizované mikroposuny ve tkáni. Charakteristika střižné vlny je udávána v m/s. Objem vyšetřené tkáně je výrazně menší než u tranzientní elastografie (cca 10 × 6 mm), avšak oblast vyšetření může být definována vyšetřujícím (area of interest).
SWE je založena na kombinaci vyvolání vlny indukované ve tkáni akustickým pulzem a ultrazvukovou vykreslovací sekvencí s vysokým rozlišením schopnou zachytit propagaci střižných vln v reálném čase. Hlavní výhoda ARFI a SWE spočívá v tom, že mohou být snadno implementovány na upravené komerčně dostupné ultrasonografické přístroje. Jistou nevýhodou ARFI je, že výsledné hodnoty jsou na rozdíl od tranzientní elastografie a SWE vyjádřeny v m/s s velice úzkým rozmezím (0,5–4,4 m/s), což znesnadňuje rozhodování o cut-off hodnotách u jednotlivých pacientů [14].
Využití a interpretace neinvazivních vyšetřovacích metod
V terapii jaterních chorob, zejména u virových hepatitid B a C, lze stanovit dva kritické body v rozhodování o další terapii. Prvním z nich je přítomnost významné fibrózy (F2) jako jasného indikátoru k zahájení protivirové terapie [7]. Druhým rozhodujícím bodem je přítomnost jaterní cirhózy jako indikátoru zahájení monitorace komplikací jaterní cirhózy (rozvoj portální hypertenze či hepatocelulárního karcinomu) [15]. Většina klinických studií zaměřených na zhodnocení významu a použitelnosti všech neinvazivních metod hodnocení fibrózy se proto soustředí na diskriminaci těchto dvou stupňů, tj. a) významné jaterní fibrózy F ≥ 2 a b) jaterní cirhózy.
Biochemické metody
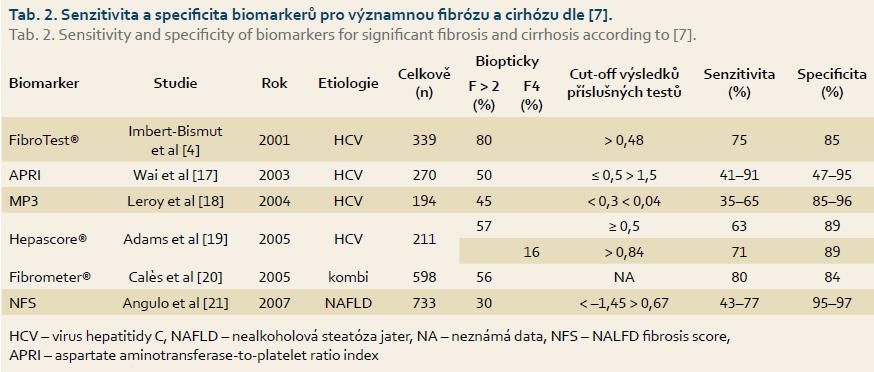
Využitelnost sérových biomarkerů k hodnocení stadia jaterní fibrózy byla zkoumána v řadě studií. Nejčastěji využívaná skóre byla FibroTest a APRI. V roce 2007 byla publikována metaanalýza celkem 6 378 pacientů, u kterých byl proveden FibroTest i jaterní biopsie [16] (tab. 2). Celkem bylo hodnoceno 3 501 pacientů s virem hepatitidy C (HCV), 1 457 pacientů s virem hepatitidy B (HBV), 267 pacientů s nealkoholovou steatózou jater (NAFLD), 429 pacientů s alkoholovou jaterní chorobou a 724 pacientů se smíšeným jaterním onemocněním. Hodnoty senzitivity a specificity pro diagnózu významné jaterní fibrózy (F ≥ 2) byly 75–91 %, resp. 84–97 % bez rozdílu základního jaterního onemocnění. Castera et al provedli metaanalýzu různých patentovaných skóre (FibroTest, Fibrometr, Hepascore) a volně dostupných skóre (APRI, NAFLD skóre) dle které vychází jejich přínos pro diagnózu významné jaterní fibrózy prakticky totožný [7], s dosaženými hodnotami senzitivity 75–91 % a specificity 85–97 % a stejně tak u jaterní cirhózy se senzitivitou 77–76 % a specificitou 84–89 %. Volně dostupná skóre k určení stupně jaterní fibrózy jsou výhodná a dostupná prakticky kdekoli [7].
Fyzikální metody
Tranzientní elastografie
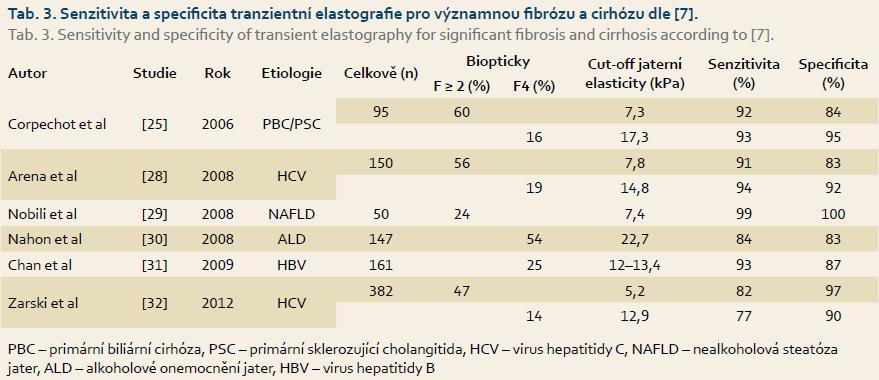
Přínos tranzientní elastografie pro určení pokročilosti jaterní fibrózy byl nesporně prokázán u pacientů s chronickou HCV infekcí [22,23]. Následně byly tyto výsledky potvrzeny i u jiných chronických jaterních chorob [24–26]. S hodnotami senzitivity 91–99 % a specificity 84–100 % při cut-off 7,0–7,3 kPa pro významnou jaterní fibrózu (F ≥ 2) a senzitivity 93–99 % a specificity 95–97 % při cut-off 13 kPa pro jaterní cirhózu by se mohlo zdát, že se jedná o zcela vyhovující metodu. Nicméně je třeba zdůraznit, že i přes vysoké hodnoty senzitivity a specificity, zejména u pacientů s nižším stupněm jaterní fibrózy, může dojít k významnému nadhodnocení hodnoty jaterní tuhosti. Několik metaanalýz dokázalo větší přesnost tranzientní elastografie pro jaterní cirhózu a těžkou jaterní fibrózu než pro fibrózu nižšího stupně (tab. 3). Z tabulky je vidět, že např. Corpechot et al do své studie zařadili celkem 95 pacientů s různým stupněm jaterní fibrózy při primární biliární cholangitidě nebo primární sklerozující cholangitidě. U 60 % z celkového počtu pacientů s biopticky verifikovanou jaterní fibrózou stadia > F2 bylo dosaženo hodnot senzitivity 92 % a specificity 84 % při cut-off 7,3 kPa a u 16 % pacientů s biopticky verifikovanou jaterní fibrózou stadia F4 bylo dosaženo hodnot senzitivity 93 % a specificity 95 % při cut-off 17,3 kPa [25].
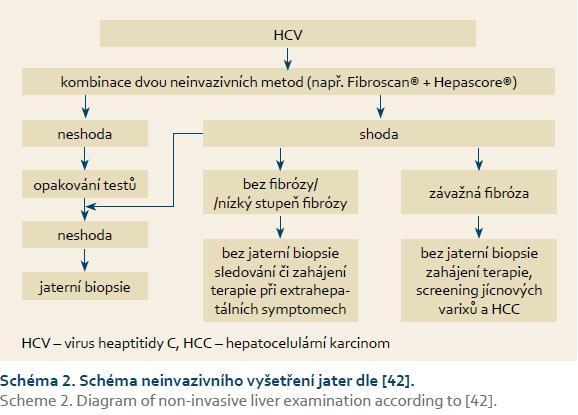
Neinvazivní metody se postupně začínají stávat součástí standardních postupů diagnostiky a terapie jaterních nemocí [27]. Příkladem standardního použití tranzientní elastografie může být její zařazení do vyšetřovacího programu u pacientů s nově diagnostikovanou HCV infekcí. Kombinace s některou ze sérologických metod umožňuje rychlé určení stadia jaterního onemocnění a rychlé zvážení nutnosti a vhodnosti provedení jaterní biopsie (schéma 2).
Dosavadní zkušenosti ukazují, že tranzientní elastografie může být velmi úspěšná při odhalování pacientů s vysokým rizikem rozvoje komplikací spojených s rozvojem portální hypertenze. Několik studií ukázalo, že hodnoty jaterní tuhosti u pacientů s pokročilým jaterními chorobami korelují s portosystémovým gradientem (HVPG – hepatic venous pressure gradient) [33–35]. Podle recentně provedených metaanalýz je tranzientní elastografie dostatečná pro predikci významné portální hypertenze (HVPG ≥ 10 mm Hg) u pacientů s jaterní cirhózou se senzitivitou 90 % a cut-off pro portální hypertenzi 13,6 kPa a specificitou 90 % s cut-off 21 kPa [36]. Zmíněné hodnoty cut-off tedy umožňují spolehlivě a správně určit přítomnost či nepřítomnost klinicky významné portální hypertenze u pacientů s kompenzovanou cirhózou. V důsledku této skutečnosti významně klesá potřeba invazivního měření HVPG – katetrizace jaterních žil [37]. Uvedené specificity a senzitivity je však dosaženo pouze pro hodnoty HVPG mezi 5 a 12 mm Hg. Nad hodnotou 12 mm Hg přesnost vyšetření již významné klesá. Na vině je zejména to, že s progresí cirhózy se mechanizmy vzniku a progrese portální hypertenze stávají stále méně závislé na intrahepatální fibróze [38].
Korelace mezi jaterní tuhostí a rizikem vzniku jícnových varixů byla popisována v několika studiích s hraničními hodnotami jaterní tuhosti 13,9–21,5 kPa [39,40]. Senzitivita pro přítomnost jícnových varixů byla relativně vysoká (76–95 %), nicméně specificita byla zcela nedostatečná (43–78 %). Z toho vyplývá, že tranzientní elastografie není prozatím vhodná ke sledování a odhalování rizika rozvoje jícnových varixů a ke sledování reakce na terapii β-blokátory. Opakované měření jaterní tuhosti se na druhou stranu jeví jako perspektivní u pacientů po transplantaci jater v průběhu prvního roku po transplantaci, kdy hodnoty jaterní tuhosti > 8,7 kPa jsou spojeny s horší prognózou [41].
Ultrazvuková elastografie
Pro ARFI a SWE ukazují dosavadní studie podobnou přesnost jako pro tranzientní elastografii [43]. Největší zkušenosti jsou u pacientů s virovými hepatitidami B a C.
Závěr
Podle dosavadních výsledků klinických studií se zdá, že v případech významné jaterní fibrózy je senzitivita a specificita elastografických metod srovnatelná se senzitivitou a specificitou metod sérologických. Využití jednotlivých metod tedy spíše závisí na lokální dostupnosti. Jako ideální pro detekci jaterní fibrózy se zdá kombinace některé metody sérologické (např. Hepascore®) a některé z elastografických metod (v současné době nejčastěji Fibroscan®). Příkladem může být využití neinvazivních metod u pacientů s nově diagnostikovanou HCV infekcí, kdy kombinace tranzientní elastografie s některou ze sérologických metod umožňuje rychlé určení stadia jaterního onemocnění bez nutnosti jaterní biopsie. Každý pacient s chronickou HCV infekcí, což platí i pro ostatní chronická jaterní onemocnění, by proto měl mít alespoň jednou provedené neinvazivní vyšetření jater. Obdobný algoritmus je aplikovatelný taktéž pro NAFLD či alkoholové onemocnění jater. Jakmile je stanovena diagnóza jaterní cirhózy, zdají se být elastografické metody vhodnější ke screeningu a sledování progrese jaterní cirhózy a rizika rozvoje portální hypertenze. V této indikaci kombinace se sérovými biomarkery nezvýšila přesnost diagnózy. Jako prozatím nevhodné se zdá být využití metod tranzientní elastografie k odhalování rizika vzniku jícnových varixů a ke sledování reakce na terapii β-blokátory. Použitelnost elastografických metod je lehce nižší než u metod sérologických (80 vs. 95 %).
Neinvazivní metody vyšetření jaterní tkáně mohou být využity nejen k identifikaci pacientů s jaterní cirhózou či významnou fibrózou, ale také ke sledování vývoje (progrese, regrese) jaterní fibrózy v čase u každého nemocného s jaterním onemocněním. V této indikaci poskytují také velmi důležitou informaci o efektivitě zvoleného léčebného postupu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Doručeno/Submitted: 15. 3. 2016
Přijato/Accepted: 2. 4. 2016
MUDr. Michal Koula
Interní klinika 1. LF UK a ÚVN Praha
U Vojenské nemocnice 1 200
160 00 Praha 6
michal.koula@uvn.cz

Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Castera L, Pinzani M. Non-invasive assessment of liver fibrosis: are we ready? Lancet 2010; 375 (9724): 1419–1420. doi: 10.1016/S0140-6736 (09) 62195-4.
2. Rockey C, Caldwell SH, Goodman ZD et al. Liver Biopsy. Hepatology 2009; 49 (3): 1017–1044. doi: 10.1002/hep.22742.
3. Bedossa P, Poynard T. An algorithm for the grading of activity in chronic hepatitis C. The METAVIR Cooperative Study Group. Hepatology 1996; 24 (2): 289–293.
4. Imbert-Bismut F, Ratziu V, Pieroni L et al. Biochemical markers of liver fibrosis in patients with hepatitis C virus infection: a prospective study. Lancet 2001; 357 (9262): 1069–1075.
5. Castera L, Vilgrain V, Angulo P. Non-invasive evaluation of NAFLD. Nat Rev Gastroenterol Hepatol 2013; 10 (11): 666–675. doi: 10.1038/nrgastro.2013.175.
6. European Association for the Study of the Liver. EASL-ALEH Clinical Practice Guidelines: non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatology 2015; 63 (1): 237–264. doi: 10.1016/j.jhep.2015.04.006.
7. Castera L. Noninvasive assessment of liver fibrosis. Dig Dis 2015; 33 (4): 498–503. doi: 10.1159/000374097.
8. Jeong WK, Lim HK, Lee HK et al. Principles and clinical application of ultrasound elastography for diffuse liver disease. Ultrasonography 2014; 33 (3): 149–160. doi: 10.14366/usg.14003.
9. Castéra L, Vergniol J, Foucher J et al. Prospective comparison of transient elastography, Fibrotest, APRI, and liver biopsy for the assessment of fibrosis in chronic hepatitis C. Gastroenterology 2005; 128 (2): 343–350.
10. Castéra L, Foucher J, Bernard PH et al. Pitfalls of liver stiffness measurement: a 5-year prospective study of 13,369 examinations. Hepatology 2010; 51 (3): 828–835. doi: 10.1002/hep.23425.
11. Myers RP, Pomier-Layrargues G, Kirsch R et al. Feasibility and diagnostic performance of the FibroScan XL probe for liver stiffness measurement in overweight and obese patients. Hepatology 2012; 55 (1): 199–208. doi: 10.1002/hep.24624.
12. Mederacke I, Wursthorn K, Kirschner J et al. Food intake increases liver stiffness in patients with chronic or resolved hepatitis C virus infection. Liver Int 2009; 29 (10): 1500–1506. doi: 10.1111/j.1478- 3231.2009.02100.x.
13. Sandrin L, Fourquet B, Hasquenoph JM et al. Transient elastography: a new noninvasive method for assessment of hepatic fibrosis. Ultrasound Med Biol 2003; 29 (12): 1705–1713.
14. Berzigotti A, Castera L. Update on ultrasound imaging of liver fibrosis. J Hepatol 2013; 59 (1): 180–182. doi: 10.1016/j.jhep.2012.12.028.
15. Castéra L Noninvasive methods to assess liver disease in patients with hepatitis B or C. Gastroenterology 2012; 142 (6): 1293–1302. doi: 10.1053/j.gastro. 2012.02.017.
16. Poynard T, Morra R, Halfon P et al. Meta- analyses of FibroTest diagnostic value in chronic liver disease. BMC Gastroenterol 2007; 7: 40.
17. Wai CT, Greenson JK, Fontana RJ et al. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C. Hepatology 2003; 38 (2): 518–526.
18. Leroy V, Monier F, Bottari S et al. Circulating matrix metalloproteinases 1, 2, 9 and their inhibitors TIMP-1 and TIMP-2 as serum markers of liver fibrosis in patients with chronic hepatitis C: comparison with PIIINP and hyaluronic acid. Am J Gastroenterol 2004; 99 (2): 271–279.
19. Adams LA, Bulsara M, Rossi E et al. Hepascore: an accurate validated predictor of liver fibrosis in chronic hepatitis C infection. Clin Chem 2005; 51 (10): 1867–1873.
20. Calès P, Oberti F, Michalak S et al. A novel panel of blood markers to assess the degree of liver fibrosis. Hepatology 2005; 42 (6): 1373–1381.
21. Angulo P, Hui JM, Marchesini G et al. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology 2007; 45 (4): 846–854.
22. Castéra L, Vergniol J, Foucher J et al. Prospective comparison of transient elastography, Fibrotest, APRI, and liver biopsy for the assessment of fibrosis in chronic hepatitis C. Gastroenterology 2005; 128 (2): 343–350.
23. Ziol M, Handra-Luca A, Kettaneh A et al. Noninvasive assessment of liver fibrosis by measurement of stiffness in patients with chronic hepatitis C. Hepatology 2005; 41 (1): 48– 54.
24. Fraquelli M, Rigamonti C, Casazza G et al. Reproducibility of transient elastography in the evaluation of liver fibrosis in patients with chronic liver disease. Gut 2007; 56 (7): 968–973.
25. Corpechot C, El Naggar A, Poujol-Robert A et al. Assessment of biliary fibrosis by transient elastography in patients with PBC and PSC. Hepatology 2006; 43 (5): 1118–1124.
26. Foucher J, Chanteloup E, Vergniol J et al. Diagnosis of cirrhosis by transient elastography (FibroScan): a prospective study. Gut 2006; 55 (3): 403–408.
27. European Association for the Study of the Liver, Asociacion Latinoamericana para el Estudio del Higado. EASL-ALEH Clinical Practice Guidelines: non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol 2015; 63 (1): 237–264. doi: 10.1016/j.jhep.2015.04.006.
28. Arena U, Vizzutti F, Abraldes JG et al. Reliability of transient elastography for the diagnosis of advanced fibrosis in chronic hepatitis C. Gut 2008; 57 (9): 1288–1293. doi: 10.1136/gut.2008.149 708.
29. Nobili V, Vizzutti F, Arena U et al. Accuracy and reproducibility of transient elastography for the diagnosis of fibrosis in pediatric nonalcoholic steatohepatitis. Hepatology 2008; 48 (2): 442–448. doi: 10.1002/hep.22376.
30. Nahon P, Kettaneh A, Tengher-Barna I et al. Assessment of liver fibrosis using transient elastography in patients with alcoholic liver disease. J Hepatol 2008; 49 (6): 1062–1068. doi: 10.1016/j.jhep.2008.08.011.
31. Chan HL, Wong GL, Choi PC et al. Alanine aminotransferase-based algorithms of liver stiffness measurement by transient elastography (Fibroscan) for liver fibrosis in chronic hepatitis B. J Viral Hepat 2009; 16 (1): 36–44. doi: 10.1111/j.1365- 2893.2008.01037.x.
32. Zarski JP, Sturm N, Guechot J et al. Comparison of nine blood tests and transient elastography for liver fibrosis in chronic hepatitis C: the ANRS HCEP-23 study. J Hepatol 2012; 56 (1): 55–62. doi: 10.1016/j.jhep.2011.05.024.
33. Carrión JA, Navasa M, Bosch J et al. Transient elastography for diagnosis of advanced fibrosis and portal hypertension in patients with hepatitis C recurrence after liver transplantation. Liver Transpl 2006; 12 (12): 1791–1798.
34. Vizzutti F, Arena U, Romanelli RG et al. Liver stiffness measurement predicts severe portal hypertension in patients with HCV-related cirrhosis. Hepatology 2007; 45 (5): 1290–1297.
35. Bureau C, Metivier S, Peron JM et al. Transient elastography accurately predicts presence of significant portal hypertension in patients with chronic liver disease. Aliment Pharmacol Ther 2008; 27 (12): 1261–1268. doi: 10.1111/j.1365-2036.2008. 03701.x.
36. Shi KQ, Fan YC, Pan ZZ et al. Transient elastography: a meta-analysis of diagnostic accuracy in evaluation of portal hypertension in chronic liver disease. Liver Int 2013; 33 (1): 62–71. doi: 10.1111/liv.12 003.
37. Llop E, Berzigotti A, Reig M et al. Assess- ment of portal hypertension by transient elastography in patients with compensated cirrhosis and potentially resectable liver tumors. J Hepatol 2012; 56 (1): 103–108. doi: 10.1016/j.jhep.2011.06.027.
38. Reiberger T, Ferlitsch A, Payer BA et al. Non-selective beta-blockers improve the correlation of liver stiffness and portal pressure in advanced cirrhosis. J Gastroenterol 2012; 47 (5): 561–568. doi: 10.1007/s00535-011-0517-4.
39. Vizzutti F, Arena U, Romanelli F et al. Liver stiffness measurement predicts severe portal hypertension in patients with HCV-related cirrhosis. Hepatology 2007; 45 (5): 1290–1297.
40. Kazemi F, Kettaneh A, N’Kontchou G et al. Liver stiffness measurement selects patients with cirrhosis at risk of bearing large oesophageal varices. J Hepatol 2006; 45 (2): 230–235.
41. Crespo G, Lens S, Gambato M et al. Liver stiffness 1 year after transplantation predicts clinical outcomes in patients with recurrent hepatitis C. Am J Transplant 2014; 14 (2): 375–383. doi: 10.1111/ajt.12594.
42. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of hepatitis C virus infection. J Hepatol 2014; 60 (2): 392–420. doi: 10.1016/j.jhep.2013.11.003.
43. Friedrich-Rust M, Nierhoff J, Lupsor M et al. Performance of acoustic radiation force impulse imaging for the staging of liver fibrosis: a pooled meta-analysis. J Viral Hepat 2012; 19 (2): 212–219. doi: 10.1111/j.1365-2893.2011.01537.x.