Mění se chirurgická léčba stenotického karcinomu rekta?
Anton Pelikán Orcid.org 1,2, Lubomír Tulinský1, Matúš Peteja1, Milan Lerch1
+ Pracoviště
Souhrn
Úvod: I přes výrazné pokroky v léčbě karcinomu rekta v průběhu posledních desetiletí jsou možnosti chirurgické léčby pacientů se stenotickým karcinomem značně omezeny; prognóza pacientů je nepříznivá. Metody: Retrospektivní klinická studie zaměřená na zhodnocení způsobů a výsledků léčby pacientů s tímto typem nádorů konečníku ve FN Ostrava. Byla provedena analýza léčby pacientů ve dvou sledovaných dvouletých obdobích s odstupem 10 let (2003–2004 a 2013–2014). Výsledky: V prvním sledovaném období (2003–2004) byl stenotický karcinom rekta diagnostikován u 63 pacientů (z toho 24 pacientů mělo klinické známky poruchy pasáže). Operační výkon u pacientů s rozvinutou poruchou pasáže byl proveden obvykle do 72 hod od přijetí (17 pacientů – 70,8 %). V této skupině nemocných převažovaly paliativní výkony – stomie byla vyšita u 14 pacientů (58,3 %). V rámci skupiny 39 pacientů, bez známek poruchy pasáže, byl primárně radikální resekční výkon proveden u 30 pacientů (76,9 %); pouze dva pacienti (5,1 %) byli indikováni k neoadjuvantní terapii. Ve druhém sledovaném období (2013–2014) bylo léčeno 44 pacientů se stenotickým nádorem (z toho 18 pacientů mělo rozvinutý ileózní stav). Do 72 hod od přijetí byla opět operována většina pacientů (13 pacientů – 72,2 %). Zastoupení paliativních výkonů (10 pacientů – 55,6 %) bylo velmi obdobné jako v předchozím období. Z 26 pacientů bez klinických známek poruchy pasáže byl primární radikální resekční výkon proveden u 10 pacientů (38,2 %); primárně neoadjuvantní léčba byla indikována u 13 pacientů (50,0 %). Diskuze: Léčba pacientů se stenotickým nádorem konečníku, bez klinických známek poruchy pasáže, by měla být založena na kvalitním stagingu, multioborovém přístupu a léčbě. U pacientů s rozvinutou poruchou pasáže je pak nevyhnutelné postupovat individuálně s přihlédnutím na zkušenosti daného chirurgického pracoviště. Závěr: V průběhu 10 let nedošlo na našem pracovišti k výraznějším změnám v péči o pacienty s ileózním stavem na podkladě stenotického karcinomu rekta – počty pacientů, spektrum výkonů, pooperační morbidita a mortalita se prakticky nemění.
Klíčová slova
chirurgická léčba, karcinom rekta, multidisciplinární přístup, porucha pasážeÚvod
Kolorektální karcinom (CRC – colorectal carcinoma) je ve vyspělých zemích druhou nejčastější malignitou. Incidence CRC v ČR za posledních 50 let neustále roste, avšak naštěstí díky prevenci a komplexní multidisciplinární léčbě mortalita postupně mírně klesá. Ročně je nově diagnostikováno asi 8 000 pacientů s tímto karcinomem a zhruba 4 000 pacientů na něj zemře. V současnosti patří ČR v mortalitě karci-nomu rekta 3. místo u mužů a 10. místo u žen [1,2].
V léčbě pacientů s karcinomem rekta došlo v průběhu posledních desetiletí k významným změnám, které vedly jak ke snížení počtů lokálních recidiv, tak i ke zlepšenému přežívání nemocných. Multimodální přístup na základě mezioborových indikačních seminářů je základem současné úspěšné léčby karcinomu rekta [2–4]. Z chirurgického hlediska je kladen velký důraz na kvalitní provedení totální mezorektální excize (TME) se snahou o dosažení negativního orálního, aborálního a zejména cirkumferentního resekčního okraje [5–7].
I přes významné pokroky v léčbě pa-cientů s karcinomem rekta není prognóza nemocných se stenotickým karcinomem rekta uspokojivá. Nález stenotického karcinomu rekta je obvykle známkou lokální pokročilosti onemocnění, která je nevyhnutelně asociována s vyšším rizikem recidivy onemocnění a zkráceným přežíváním těchto pacientů [2,8–10]. Navíc v případě, že je stenotický karcinom rekta příčinou již rozvinutého ileózního stavu, jsou možnosti chirurgické léčby značně omezeny v důsledku rozvratu vnitřního prostředí a celkově špatného zdravotního stavu nemocných [3,11–13].
Termín „stenotický“ karcinom rekta představuje specifikum české a slovenské odborné terminologie. Pod pojmem „stenotický“ chápeme cirkulárně rostoucí tumor neprostupný pro endoskop (kolonoskop). Pacient se stenotickým karcinomem se pak může prezentovat klinicky manifestní poruchou pasáže (ileózním stavem) anebo být zatím bez známek poruchy pasáže. V anglosaské literatuře se setkáváme spíše s pojmem „obstructing rectal cancer“, pod kterým rozumíme stenotický karcinom s klinicky manifestní poruchou pasáže [12,14,15].
Cílem této práce je rozbor problematiky chirurgické léčby stenotického karcinomu rekta. Jaké jsou možnosti léčby těchto pacientů v současné době? Jaké terapeutické postupy jsou v praxi reálně vykonávané? Došlo v průběhu posledního desetiletí k nějakým změnám v léčbě pacientů se stenotickým karcinomem rekta?
Materiál a metodika
Retrospektivní klinická studie byla zaměřena na zhodnocení výsledků léčby pacientů se stenotickým karcinomem rekta ve Fakultní nemocnici Ostrava (FNO). Byla provedena analýza pacientů ve dvou sledovaných dvouletých obdobích s odstupem 10 let (od 1. 1. 2003 do 31. 12. 2004 a od 1. 1. 2013 do 31. 12. 2014). Do studie byli zahrnuti všichni pacienti ve věku ≥ 18 let, kteří na Chirurgické klinice FNO v některém ze sledovaných období podstoupili chirurgickou intervenci pro stenotický karcinom rekta.
Vzhledem k retrospektivnímu designu studie a přísné anonymizaci dat nebyla Etická komise FNO žádána o souhlas se studií. Demografická, klinická, operační a perioperační data byla extrahována z nemocničního informačního systému a následně analyzována. Získaná data byla testována s použitím metod popisné statisticky. Rozdíly byly testovány pomocí dvouvýběrového t-testu, Pearsonova χ-kvadrát testu a Fischerova exaktního testu, na hladině významnosti < 0,05.
V éře multimodálního přístupu k nemocným s karcinomem rekta bylo primárním cílem studie zmapování současného stavu léčby pacientů se stenotickým karcinomem rekta a vyhodnocení, jestli došlo za posledních 10 let ke změnám v léčebném managementu těchto nemocných.
Výsledky
V prvním sledovaném dvouletém období (od 1. 1. 2003 do 31. 12. 2004) podstoupilo na Chirurgické klinice FNO operační výkon pro karcinom rekta celkem 132 pacientů. Z tohoto souboru bylo 22 pacientů předoperačně klasifikováno jako cT1 N0 M0 nebo cT2 N0 M0 a byla provedena radikální excize karcinomu pomocí transanální endoskopické mikrochirurgie (TEM). Trans-abdominální elektivní chirurgický výkon (nízká přední resekce rekta nebo abdominoperineální amputace rekta) pro nestenotický karcinom rekta byl proveden u 47 (35,6 %) pacientů. Stenotický karcinom rekta byl diagnostikován celkem u 63 pacientů (47,7 % ze 132 pacientů s karcinomem rekta).
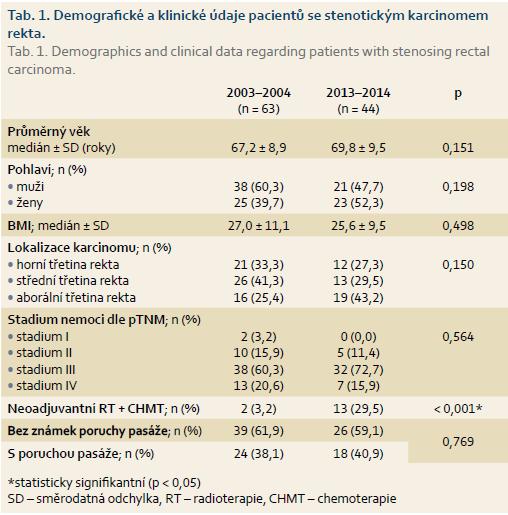
V rámci 63 nemocných se stenotickým karcinomem rekta byl průměrný věk 67,2 let; průměrný body mass index (BMI) 27,0; ve skupině bylo 38 mužů (60,3 %). Základní klinické údaje (lokalizace karcinomu, stadium nemoci dle pTNM, aplikace neoadjuvantní terapie, počet pacientů s poruchou pasáže, nebo bez ní) jsou přehledně uvedeny v tab. 1.
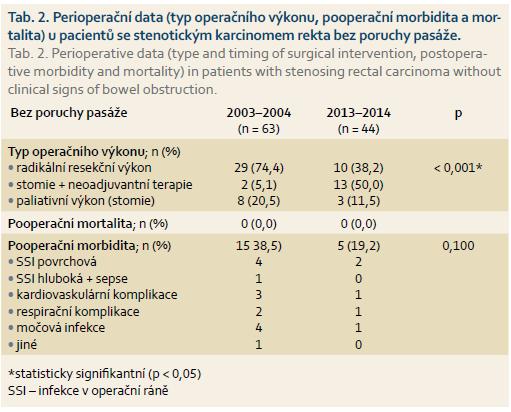
Stenotický karcinom bez klinických známek poruchy pasáže byl léčen u 39 pacientů. Typ provedeného operačního výkonu, pooperační morbidita a mortalita jsou prezentovány v tab. 2. Pouze u dvou pacientů byla založena sigmoideostomie s cílem následně aplikovat neoadjuvantní radio-a chemoterapii. Primárně radikální resekční výkon (přední resekci rekta nebo abdominoperineální amputaci rekta) podstoupilo 30 pacientů. U osmi pacientů byla pro lokální pokročilost a generalizaci onemocnění založena pouze paliativní sigmoideostomie. Pooperační mortalita v této skupině nemocných byla 0,0 %; pooperační 30denní morbidita 38,5 %. Většina zaznamenaných pooperačních komplikací byla málo závažná (povrchní infekce v operační ráně (SSI – surgical site infection), močové infekce, lehké kardiovaskulární komplikace).
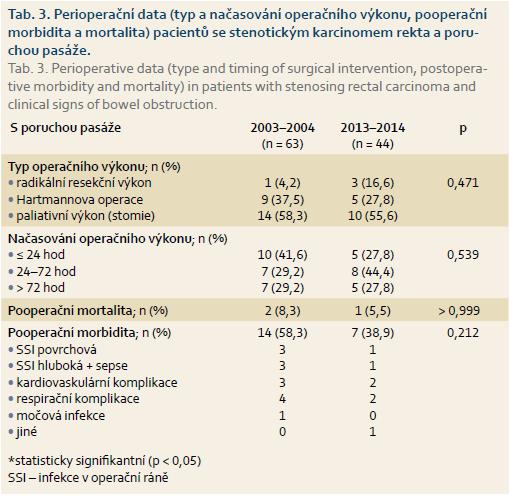
Stenotický karcinom rekta s rozvinutou poruchou pasáže byl v letech 2003–2004 diagnostikován u 24 pa-cientů. Typ provedeného výkonu a jeho načasování jsou uvedeny v tab. 3. Nejčastěji (10 pacientů) byli tito nemocní operováni akutně (do 24 hod od přijetí). U pacientů operovaných pro poruchu pasáže dominovaly paliativní výkony (stomie) s ponecháním tumoru in situ (provedeno u 14 pacientů). Resekce rekta s primární anastomózou byla provedena pouze u jednoho pacienta, který byl operován s odstupem více než 72 hod od přijetí (po obnovení pasáže konzervativními terapeutickými postupy). Resekce rekta bez obnovení kontinuity gastrointestinálního traktu (Hartmannova operace) byla provedena u devíti nemocných. Pooperační 30denní morbidita u pacientů s poruchou pasáže byla 58,3 %. V rámci spektra pooperačních komplikací jsme pozorovali závažné komplikace u několika pacientů – hluboká SSI se sepsí, respirační a závažné kardiovaskulární komplikace. U dvou pacientů (8,3 %) vedly závažné pooperační komplikace ke smrti.
Ve druhém sledovaném dvouletém období (od 1. 1. 2013 do 31. 12. 2014) podstoupilo operační výkon pro karcinom rekta celkem 115 pacientů. Předoperačně bylo 14 pacientů klasifikováno jako cT1 N0 M0 a byla provedena resekce karcinomu pomocí TEM. Elektivní chirurgický výkon pro nestenotický karcinom rekta byl vykonán u 57 pacientů (49,5 %). Stenotický karcinom rekta byl diagnostikován u 44 pacientů (38,2 % ze 115 osob s karcinomem rekta).
V rámci 44 pacientů se stenotickým karcinomem rekta byl průměrný věk 69,8 let; průměrné BMI 25,6; ve skupině bylo 21 mužů (47,7 %). Základní klinická data (lokalizace karcinomu, stadium nemoci dle pTNM, aplikace neoadjuvantní terapie, počet pacientů s poruchou pasáže, nebo bez ní) jsou uvedena v tab. 1. Statistické testování demografických a klinických parametrů uvedených v tab. 1 prokázalo, že obě skupiny nemocných jsou srovnatelné; statisticky signifikantní rozdíl byl pouze v četnosti aplikace neoadjuvantní radiochemoterapie (p < 0,001).
Stenotický karcinom bez poruchy pasáže byl diagnostikován celkem u 26 pacientů. Z toho 13 pacientů podstoupilo laparoskopické založení stomie s následnou neoadjuvantní radio-a chemoterapií. U 10 pacientů byla pro stenotický tumor provedena přední resekce rekta nebo abdominoperineální amputace rekta bez neoadjuvantní terapie. Pouze paliativní stomie byla provedena u tří pacientů pro generalizaci onemocnění. Ve srovnání s prvním obdobím (2003–2004) bylo v letech 2013–2014 provedeno statisticky signifikantně více stomií s cílem aplikovat neoadjuvantní léčbu (a méně primárních radikálních resekcí). Pooperační mortalita byla 0,0 %; pooperační 30denní morbidita 19,2 %. V naprosté většině případů se jednalo o málo závažné pooperační komplikace. Nižší pooperační morbidita ve srovnání s prvním obdobím (38,5 %) byla zřejmě v důsledku rozdílného zastoupení provedených operačních výkonů (nižší morbidita jako důsledek nižšího procentuálního zastoupení primárních resekcí).
V letech 2013–2014 bylo s rozvinutou poruchou pasáže na podkladě stenotického karcinomu rekta přijato celkem 18 pacientů. Nejčastěji (osm pacientů) byl operační výkon proveden v rozmezí 24–72 hod od přijetí. V této skupině nemocných opět převažovaly paliativní chirurgické výkony (stomie), které byly založeny u 10 pacientů. U dvou pacientů bylo možné provedení radikální resekce s primární anastomózou a u jednoho pacienta amputace rekta (tito pacienti však byli operováni po rozběhnutí pasáže s odstupem více než 72 hod). Pooperační komplikace byly zachyceny u 38,9 % pacientů; v pooperačním období zemřel jeden pacient (5,5 %) na multiorgánové selhání na podkladě sepse. I když byla ve srovnání s prvním obdobím (58,3 %) pooperační morbidita o něco nižší, rozdíl nebyl statisticky signifikantní. Obdobně, malý rozdíl v pooperační mortalitě nebyl statisticky signifikantní (tab. 3).
Analýza histolopatologických zpráv popisujících preparáty resekovaného stenotického karcinomu rekta poukázala na významné rozdíly mezi oběma sledovanými obdobími. V prvním období (2003–2004) byl u všech preparátů vyšetřován pouze orální a aborální resekční okraj a jen ojediněle byly specifikovány známky mikroskopické agresivity tumoru (angioinvaze, lymfangioinvaze a perinerální šíření). Ve druhém období (2013–2014) byl u všech preparátů vyšetřován také cirkumferenční resekční okraj a byly rutinně specifikovány mikroskopické známky agresivity tumoru. Průměrný počet lymfatických uzlin (LU) nalezených v preparátu byl v prvním období 10,5 a ve druhém období 13,9. Nižší počet LU v preparátech v prvním období znamená výrazné zvýšení rizika tzv. downstagingu (podhodnocení stadia nemoci).
Diskuze
Chirurgická léčba karcinomu rekta v situacích rozvíjejícího se ileózního stavu vyžaduje správné načasování operačního výkonu a jeho excelentní provedení. Operační výkon by měl být podřízen zásadám onkologické chirurgie se snahou operovat s co nejmenšími krevními ztrátami v co nejkratším možném čase. To vše závisí nejen od celkového stavu nemocného a lokálního nálezu, ale i od zkušeností chirurga, složení operačního týmu, zvyklostí pracoviště atd. [2,3,11].
Taktika a technika operačního výkonu by měla být v jakékoli situaci podřízena hlavní zásadě léčby nádorů – snaze o provedení radikální blokové resekce spočívající v kompletním odstranění nádoru až do zdravé tkáně, spolu s odstraněním příslušné lymfatické drenáže [2–4,16]. Základním požadavkem v chirurgii rekta je tedy provést radikální resekci rekta podle zásad TME se snahou o dosažení negativního orálního, aborálního a cirkumferentního resekčního okraje [5–7,17]. V rámci multidisciplinárního přístupu je potom nevyhnutné, aby patolog pečlivě posoudil kvalitu provedené TME, resekční okraje, dostatečný počet LU jako i základní známky mikroskopické agresivity tumoru (grade, angioinvaze, lymfangioinvaze, perineurální šíření, tumor budding). V tomto směru bylo na našem pracovišti poukázáno na pozitivní vliv zavedení standardizovaného patologického protokolu na kvalitu histopatologického hodnocení preparátů CRC [18,19].
Stenotický karcinom rekta je obvykle projevem lokální pokročilosti onemocnění. Pacienti jsou proto zatíženi vyšším rizikem lokální recidivy a horší prognózou. Léčebný management pacientů se stenotickým karcinomem rekta bez klinických známek poruchy pasáže by měl probíhat v souladu s doporučenými postupy (guidelines). Po adekvátně provedeném iniciálním stagingu (klinické vyšetření, rektoskopie + biopsie, kolonoskopie, MR vyšetření, resp. CT vyšetření + endosonografické vyšetření) by mělo být na multidisciplinárním indikačním semináři rozhodnuto o léčebné modalitě první volby [20]. Pokud předoperační staging prokáže lokálně pokročilý karcinom (tedy T3–T4, nebo N+), měla by být indikována neoadjuvatní konkomitantní radioterapie a chemoterapie [2–4,12]. Vzhledem k tomu, že se jedná o stenotický karcinom rekta, je žádoucí ještě před započetím neoadjuvantní léčby zajistit průchodnost gastrointestinálního traktu vyšitím ileostomie nebo kolostomie.
Pacienti se stenotickým karcinomem rekta představovali v našem souboru poměrně velkou část z celkového souboru pacientů léčených pro karcinom rekta (47,7 % v letech 2003–2004 a 38,2 % v letech 2013–2014). Pokles procentuálního zastoupení stenotického karcinomu po 10 letech by mohl být přičítán zavedenému celostátnímu programu screeningu CRC, který vede k odhalování CRC v dřívějších stadiích nemoci (a tudíž k poklesu počtů pacientů s lokálně pokročilým karcinomem) [2,11,21].
V prvním sledovaném období (2003–2004) byla neoadjuvantní léčba aplikována pouze u dvou (5,1 %) z 39 pacientů se stenotickým karcinomem rekta bez známek poruchy pasáže. V těchto letech totiž ještě nebyla neoadjuvantní radioterapie plně etablována do klinické praxe. Ve druhém sledovaném období (2013–2014) byl již zřejmý výrazný nárůst pacientů indikovaných k neoadjuvantní léčbě – 13 pacientů (50,0 %) z 26 se stenotickým karcinomem bez známek poruchy pasáže. Vzhledem k tomu, že se jedná o pacienty se stenotickým (a tedy i lokálně pokročilým) karcinomem, není ani tento stav zatím plně uspokojivý.
Zastoupení pacientů s poruchou pasáže na podkladě stenotického karcinomu rekta bylo v obou sledovaných obdobích srovnatelné – 24 ze 132 pacientů (18,2 %) v letech 2003–2004 a 18 ze 115 pacientů (15,6 %) v letech 2013–2014. Spektrum operačních výkonů, které je možné provést u pacienta s ileózním stavem na podkladě stenotického karcinomu rekta, je poměrně široké – od paliativních výkonů přes Hartmannovu resekci až po radikální resekci s primární anastomózou. I u akutních výkonů by měla být patrná snaha o upřednostnění radikálních operací zachovávajících střevní pasáž před výkony končící stomiemi. Důraz klademe na správnou operační techniku šití anastomózy, jemnou manipulaci s tkáněmi a adekvátní mechanické očištění břišní dutiny a operační rány [2,3,16,22,23].
Výsledky chirurgické léčby jsou obvykle hodnoceny prostřednictvím po-operační morbidity, mortality a přežívání. V posledních dekádách však celosvětově narůstá důležitost hodnocení kvality života nemocných s nádorovým onemocněním. Operační taktika a případná adjuvantní léčba u pacientů se stenotickým karcinomem rekta by tak měla nabídnout co nejpříznivější pooperační průběh nejen s ohledem na morbiditu, mortalitu a přežívání, ale také s ohledem na kvalitu života [3,24–26]. Mezi nejdůležitější faktory ovlivňující kvalitu života pacientů léčených pro karcinom rekta zajisté patří délka a agresivita léčebného managementu, aplikace radioterapie a systémové léčby, skutečnost, zda byla zachována kontinence stolice, a vytvoření trvalé či dočasné stomie.
Optimální načasování operačního výkonu u pacienta s rozvinutou poruchou pasáže je problematickou otázkou – velmi často se jedná o kompromis mezi dvěma protichůdnými tendencemi. Na jedné straně by měl být ileózní stav operačně řešen bez většího prodlení, na straně druhé je velmi žádoucí pacienta před výkonem stabilizovat a snažit se o adekvátní úpravu iontové dysbalance a vnitřního prostředí. Zdrženlivý přístup k provedení akutní laparotomie pro ileózní stav v průběhu nočních hodin, resp. víkendů (na základě aplikace konzervativních postupů ve formě infuzní léčby, spazmolytik, nazogastrické sondy, klyzmat) umožňuje provedení operační revize s odstupem několika dnů za „normálního“ provozu chirurgického oddělení.
V našem souboru pacientů s poruchou pasáže byla operační revize prováděna nejčastěji do 72 hod od přijetí do nemocnice (17 z 24 pacientů v letech 2003–2004 a 13 z 18 pacientů v letech 2013–2014). Pokud však byli pacienti operováni po více než 72 hod (obvykle se jednalo již o konzervativně zvládnutou poruchu pasáže), byla u těchto pacientů výrazně vyšší pravděpodobnost provedení radikálního resekčního výkonu, event. i s primární anastomózou.
V předoperační klasické přípravě nádorů s částečnou stenózou se můžeme pokusit vyhnout akutní operaci pacienta opakovanými nálevy střeva nebo desuflační kolonoskopií, případně stentováním střeva, a tak připravit nemocného k elektivnímu operačnímu výkonu. Provedení desuflační kolonoskopie u pacientů v ileózním stavu je možné jen velmi ojediněle – je potřebné mít k dispozici dostatečně zkušeného erudovaného endoskopistu, který zavede desuflační set nad stenotický tumor. Pokud se však jedná o akutní pokročilou obstrukci, je celková příprava pacienta krátkodobá, lokálně omezená většinou pouze na výplach střeva pod nádorem [11,14].
S rozvojem použití endoprotéz v cévní chirurgii se začaly postupně aplikovat flexibilní samoroztažitelné stenty i v gastroenterologii. V zásadě je možné použít dva druhy stentů. Streckerův stent spočívá v zavedení stentu na požadované místo a potom je balonkem insuflována jeho stěna na předem určený rozměr. Nevýhodou je častý kolaps stěn nebo migrace stentu. Další druh je např. Wallstent typ, který se dilatuje na základě jeho geometrické struktury, ale obtížně se přesně umísťuje. Novější typy jsou vyrobeny z nitinolu, což je slitina niklu a titanu, např. anglický Ultraflex původně určený pro jícnové stenózy. Tento druh stentů umožňuje dilatovat zúžení horní části rekta i rektosigmoidea až na šířku 12 cm. Úspěšnost dilatace se popisuje až 90%, v trvání až několika měsíců [15,27,28].
Při peroperačním nálezu generalizovaného karcinomu rekta (stadium IV) je prognóza pacientů nedobrá. V současnosti je při synchronním nálezu jaterních metastáz CRC možné zvolit různé operační strategie (tzv. „primary-first“ resekci, synchronní resekci a „liver-first“ resekci). Alternativní strategie („liver-first“) je zatím obvykle aplikovatelná pouze při elektivně prováděných výkonech; v rozvinutém ileózním stavu je možnost jejího provedení značně omezená [29–31]. Nález jaterních metastáz při stenotickém karcinomu rekta je obvykle základním důvodem, který vede operatéra pouze k provedení paliativní sigmoideostomie. Pokud byly v našem souboru diagnostikovány synchronní metastázy jater u pacientů s poruchou pasáže (celkem u šesti pacientů), byl vždy proveden pouze paliativní výkon (stomie). U devíti pacientů se stenotickým karcinomem rekta bez rozvinuté poruchy pasáže byly identifikovány synchronní jaterní metastázy. Z toho byl u osmi pacientů proveden paliativní výkon (5× stomie, 3× paliativní přední resekce rekta) a u jednoho pacienta byla úspěšně provedena synchronní resekce.
Závěr
Předoperační příprava, načasování operačního výkonu i výběr optimální operační techniky u pacientů se stenotickým karcinomem rekta představují specifickou oblast kolorektální chirurgie, ve které jen poměrně těžko najdeme jednoznačné odpovědi, resp. doporučení. Pokud je stenotický karcinom diagnostikován bez klinických známek poruchy pasáže, měl by být management pacientů založen na kvalitním stagingu a multioborovém přístupu a léčbě. Analýza souboru našich pacientů poukázala na skutečnost, že v průběhu 10 let došlo ke změně v terapeutickém přístupu ve smyslu výrazného zvýšení počtu pacientů indikovaných k neoadjuvantní léčbě.
U pacientů s rozvinutou poruchou pasáže na podkladě stenotického karcinomu rekta je nevyhnutelné postupovat individuálně s přihlédnutím na zkušenosti daného chirurgického pracoviště. I když s odstupem 10 let v našem souboru nedošlo k výraznějším změnám v počtech pacientů a spektru provedených výkonů, zaznamenali jsme ve druhém sledovaném dvouletém období nižší pooperační morbiditu a mortalitu (rozdíly však nebyly statisticky signifikantní). I přes neustálý rozvoj terapeutických možností ani dnes nejsme plně spokojeni s výsledky naší léčby (zejména pro častý výskyt paliativních výkonů).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Doručeno/Submitted: 20. 12. 2015
Přijato/Accepted: 17. 5. 2016
prof. MUDr. Anton Pelikán, DrSc.
Chirurgická klinika
LF OU a FN Ostrava
17. listopadu 1790
708 52 Ostrava
anton.pelikan@fno.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Ferlay J, Steliarova-Fourcher E, Lortet-Tieulent J et al. Cancer incidence and mortality patterns in Europe: estimates for 40 countries in 2012. Eur J Cancer 2013; 49(6):1374–1403. doi: 10.1016/ j.ejca.2012.12.027.
2. Hoch J, Dytrych P, Prausová J. Nádory konečníku. In: Krška Z, Hoskoved D, Petruželka L et al. Chirurgická onkologie. Praha: Grada 2014: 553–564.
3. Becker HD, Jehle E, Kratt T et al. Karcinom rekta. In Becker HD, Hohenberger W, Junginger T et al. Chirurgická onkologie. Praha: Grada 2005: 515–539.
4. Berardi R, Maccaroni E, Onofri A et al. Locally advanced rectal cancer: the importance of a mutlidisciplinary approach. World J Gastroenterol 2014; 20(46): 17279–17287. doi: 10.3748/ wjg.v20.i46.17279.
5. Herzog T, Belyaev O, Chromik AM et al. TME quality in rectal cancer surgery. Eur J Med Res 2010; 15(7): 292–296.
6. Ihnát P, Martínek L, Ihnát Rudinská L et al. Cirkumferenčný resekčný okraj v modernej liečbe karcinómu rekta. Rozhl Chir 2013; 92(6): 297–303.
7. Nagtegaal ID, Quirke P. What is the role for the circumferential margin in the modern treatment of rectal cancer? J Clin Oncol 2008; 26(2): 303–312. doi: 10.1200/ JCO.2007.12.7027.
8. Peng J, Ding Y, Tu S et al. Prognostic nomograms for predicting survival and distant metastases in locally advancer rectal cancers. PLoS One 2014; 9(8): e106344. doi: 10.1371/ journal.pone.0106344. 9. Trakamsanga A, Ithimakin S, Weiser MR. Treatment of locally advanced rectal cancer: controversies and questions. World J Gastroenterol 2012; 18(39): 5521–5532. doi: 10.3748/ wjg.v18.i39.5521.
10. Martínek L, Zonča P, Ihnát P. Je celkové přežití objektivním kritériem kvality chirurgické léčby kolorektálního karcinomu? Rozhl Chir 2013; 92(12): 690–693.
11. Hoch J. Chirurgická léčba kolorektálního karcinomu. Rozhl Chir 2012; 91(1): 48–52.
12. Fung-Kee-Fung SD. Therapeutic approaches in the management of locally advanced rectal cancer. J Gastrointest Oncol 2014; 5(5): 353–361. doi: 10.3978/ j.issn. 2078-6891.2014.067.
13. Martínek L, Jahoda P, Guňka I et al. Predikce komplikací a volba operační techniky. Miniinvaziv Chir 2010; 14(1): 13–15.
14. Ghaza AH, El-Shazly WG, Bess SS et al. Colonic endolumental stenting devices and elective surgery versus emergency subtotal/total colectomy in the management of malignant obstructed left colon carcinoma. J Gastrointest Surg 2013; 17(6): 1123–1129. doi: 10.1007/ s11605-013-2152-2. 15. van Hooft JE, van Halsema EE, Vanbiervliet G et al. Self-expandable metal stents for obstructing colonic and extracolonic cancer: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Gastrointest Endosc 2014; 80(5): 747–761. doi: 10.1016/ j.gie.2014.09.018.
16. Bertelsen CA, Bols B, Ingeholm P et al. Cant he quality of colonic surgery be improved by standardization of surgical technique with complete mesocolic excision? Colorectal Dis 2011; 13(10): 1123–1129. doi: 10.1111/ j.1463-1318.2010.02474.x.
17. West NP, Hohengerger W, Weber K. Complete mesocolic exciton with central vascular ligation produces an oncologically superior specimen compared with standard surgery for carcinoma of the colon. J Clin Oncol 2010; 28(2): 272–278. doi: 10.1200/ JCO.2009.24.1448.
18. Ihnát P, Delongová P, Dvořáčková J et al. Zvýšení kvality histopatologického hodnocení preparátů kolorektálního karcinomu prostřednictvím zavedení standardního protokolu. Rozhl Chir 2013; 92(12): 703–707.
19. Ihnát P, Delongová P, Horáček J et al. Impact of standard protocol implementation on the quality of colorectal cancer pathology reporting. World J Surg 2015; 39(1): 259–265. doi: 10.1007/ s00268-014-2796-4.
20. Smith N, Brown G. Preoperative staging of rectal cancer. Acta oncologica 2008; 47(1): 20–31. 21. Lindebjerg J, Osler M, Bisgaard C. Colorectal cancers detected through screening are associated with lower stages and improved survival. Dan Med J 2014; 61(1): A4758.
22. Guňková P, Guňka I, Martínek L et al. Vliv dehiscence anastomózy na onkologické výsledky u resekčních výkonů pro karcinom rekta. Rozhl Chir 2013; 92(5):244–249.
23. Ihnát P, Ihnát Rudinská L, Zonča P. Radiofrequency energy in surgery: state of the art. Surg Today 2014; 44(6): 985–991.doi: 10.1007/ s00595-013-0630-5.
24. How P, Stelzner S, Branagan G et al. Comparative quality of life in patients following abdominoperineal excision and low anterior resection for low rectal cancer. Dis Colon Rectum 2012; 5(4): 400– 406. doi: 10.1097/ DCR.0b013e3182444fd1.
25. Ihnát P, Martínek L, Mitták M et al. Quality of life after laparoscopic and open resection of colorectal cancer. Dig Surg 2014; 31(3): 161–168. doi: 10.1159/ 000363415.
26. Dimitriou N, Michail O. Moris D et al. Low rectal cancer: sphinter preserving techniques-selection of patients, techniques and outcomes. World J Gastrointest Oncol 2015; 7(7): 55–70. doi: 10.4251/ wjgo. v7.i7.55.
27. Mabardy A, Miller P, Goldstein R et al. Stenting for obstructing colon cancer: fewer complications and colostomies. JSLS 2015; 19(1): e2014.00254. doi: 10.4293/JSLS.2014.00254.
28. Cirocchi R, Farinella E, Trastulli S et al. Safety and efficacy of endoscopic colonic stenting as a bridge to surgery in the management of intestinal obstruction due to left colon and rectal cancer: a systematic review and mate-analysis. Surg Oncology 2013; 22(1): 14–21. doi: 10.1016/ j.suronc.2012.10.003.
29. Tsoulfas G, Pramateftakis MG. Management of rectal cancer and liver metastatic disease: which comes first? Ing J Surg Oncol 2012; 2012:196908. doi: 10.1155/ 2012/ 196908.
30. Ihnát P, Vávra P, Zonča P. Treatment strategies for colorectal carcinoma with synchronous liver metastases: which way to go? World J Gastroenterol 2015; 21(22): 7014–7021. doi: 10.3748/ wjg.v21.i22.7014.
31. Verhoef C, van der Pool AE, Nuyttens JJ et al. The „liver-first“ approach for patients with locally advanced rectal cancer and synchronous liver metastases. Dis Colon Rectum 2009; 52(1): 23–30. doi:10.1007/ DCR.0b013e318197939a.