Medzinárodná autotransplantácia Langerhansových ostrovčekov do portálneho riečiska po totálnej pankreatektómii u pacienta s chronickou hereditárnou pankreatitídou – kazuistika a prehľad súčasnej literatúry
Daniel Bolek1, Lenka Nosáková2, Miroslav Pindura1, Patrik Horan1, Peter Bánovčin2, Blažej Palkóci1, Peter Girman3, Jan Kříž3, Lenka Németová3, Ivan Leontovyč4, Kateřina Bittenglová4, Denisa Osinová5, Juraj Miklušica1
+ Pracoviště
Souhrn
Chronická pankreatitída je závažný, multifaktoriálny, fibroinflamačný syndróm charakterizovaný opakovanými bolestivými exacerbáciami. Toto ochorenie má výrazný vplyv na kvalitu života pacientov, najmä z hľadiska bolesti, rozvoja diabetes mellitus a opakovaných záchvatov akútnej pankreatitídy. Autológna transplantácia Langerhansových ostrovčekov po totálnej pankreatektómii je potenciálnou možnosťou na zachovanie endogénnej sekrécie inzulínu u pacientov so závažnými, opakujúcimi sa bolestivými atakmi chronickej pankreatitídy. V našom prípade prezentujeme pacienta s chronickou pankreatitídou trpiaceho opakovanými bolestivými exacerbáciami. Pacient potreboval opakované hospitalizácie s opakovanými ERCP zákrokmi a stentážou pankreatického vývodu. Po genetickom potvrdení hereditárnej pankreatitídy a multidisciplinárnom zhodnotení bolo rozhodnuté o totálnej pankreatektómii s autotransplantáciou ostrovčekov. V tomto prípade prezentujeme prvú medzinárodnú autotransplantáciu Langerhansových ostrovčekov v Slovenskej republike.
Klíčová slova
hereditárna pankreatitída, totálna pankreatektómia, autotransplantácia Langerhansových ostrovčekov
Úvod
Prvá autotransplantácia Langerhansových ostrovčekov bola úspešne vykonaná u pacienta s chronickou pankreatitídou v Minnessote v roku 1977 [1,2]. Odvtedy sa zdokonaľovala technika výkonu aj technika izolácie Langerhansových ostrovčekov [3]. Hlavným cieľom tohto výkonu je zlepšiť metabolickú kompenzáciu diabetu vzniknutého po totálnom odstránení pankreasu [4]. Tento diabetes je špecifický, keďže okrem chýbania produkcie endogénneho inzulínu chýba aj sekrécia kontraregulačných hormónov [5]. Ďalšou komplikáciou výkonu je porucha trávenia živín vrátane sacharidov a z nej vyplývajúcej nepravidelnosti v absorpcii glukózy. Tým pádom dochádza k prudkým výkyvom glykémie, od hypoglykémií až po hyperglykémie, často bez sprievodných symptómov.
Totálna pankreatektómia je radikálne, celoživotné riešenie, preto sa dôkladne zvažuje stav pacienta a posudzuje pomer rizika a benefitu operácie. Pokiaľ je to možné, uprednostňujú sa konzervatívne terapeutické prístupy. Autológna transplantácia Langerhansových ostrovčekov v prípade optimálneho výsledku umožňuje pacientom lepšie kontrolovať diabetes, niekedy bez potreby exogénneho inzulínu, a teda zlepšuje pomer benefitov a negatív operácie. Prakticky je potenciálnou možnosťou pre skorú indikáciu výkonu u vybraných pacientov s ťažkými, opakujúcimi sa bolestivými atakmi chronickej pankreatitídy sprevádzanými častou hospitalizáciou a výrazne zníženou kvalitou života.Významným problémom bežnej praxe je dostupnosť tejto metódy len v niekoľkých centrách a potreba odborných znalostí v oblasti izolácie a prípravy ostrovčekov. V tomto prípade prezentujeme medzinárodnú autológnu transplantáciu Langerhansových ostrovčekov po totálnej pankreatektómii pri ťažkej chronickej dedičnej pankreatitíde spojenej s mutáciou SPINK1.
Kazuistika
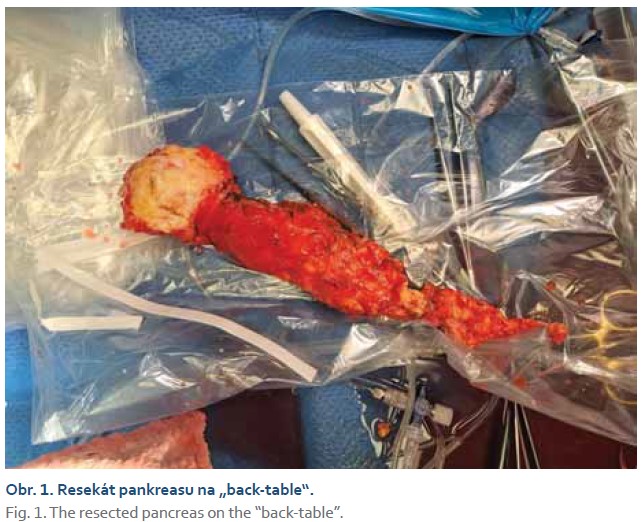
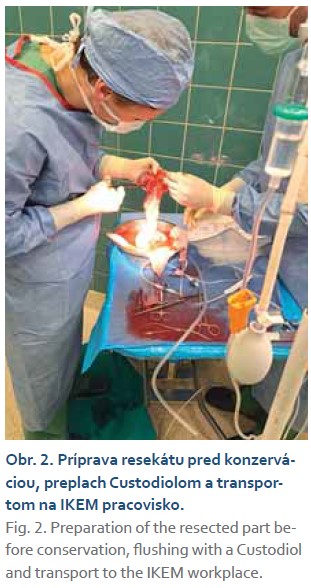
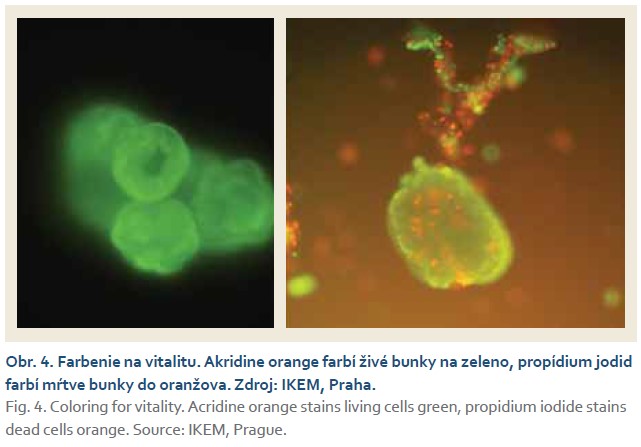
Pacient (29 rokov) s intoleranciou laktózy, hereditárnou chronickou pankreatitídou potvrdenou genetickým vyšetrením (heterozygot pre intrónovú variantu c.194+2T>C v géne SPINK1), bol prvotne vyšetrený na ambulancii hepatopankreatobiliárnej chirurgie UN Martin 12/2021 pre recidivujúce ataky akútnej pankreatitídy, trvajúce od zhruba 17. roku života. Od augusta 2021 bol opakovane hospitalizovaný pre exacerbácie chronickej pankreatitídy s nálezom pankreatikolitiázy a nutnosti opakovaných ERCP s drenážou pankreatických ciest a extrakciou pankreatikolitov. Napriek tomu sa stav pacienta nelepšil a ataky závažných epizód exacerbácie s tvorbou kolekcií a abscesu perisplenicky pokračovali. Endoskopické a konzervatívne možnosti liečby boli vyčerpané. Pacient bol indikovaný k totálnej pankreatektómii. Pre mladý vek sme sa rozhodli kontaktovať pražskú Kliniku diabetologie IKEM o možnosti spolupráce a realizácie autotransplantácie Langerhansových ostrovčekov. V prvom kroku pacient podstúpil sériu predtransplantačných vyšetrení, ako CT portografia, záťažový orálny glukózovo tolerančný test za účelom potvrdenia dostatočnej produkcie endogénneho inzulínu. Po náročnej logistickej príprave, ktorá zahrňovala odborné mítingy, organizáciu dopravy, prípravu a podpis zmluvy o spolupráci, súhlas poisťovne a pacienta, bol určený termín operačného výkonu. V prvej operačnej dobe bola vykonaná totálna duodenopankreatektómia so zachovaním pylorua splenektómioulaparotomicky. Pankreas bol vypreparovaný v celku a vybratý spolu so slezinou a duodenom (obr. 1). Následne bol resekát prepláchnutý Custodiolom na „back-table“ (obr. 2), zakonzervovaný a letecky odoslaný do IKEM Praha k izolácii Langerhansových ostrovčekov. Pacient bol v celkovej anestézii uložený na lôžko Kliniky anesteziológie a intenzívnej medicíny za účelom kontinuálnej analgosedácie, riadenej ventilácie a pooperačnej starostlivosti. U pacienta bola prechodne prítomná hemodynamická instabilita, hypotenzia, s potrebou podpory obehu noradrenalínom, výstupom telesnej teploty nad 38 °C, oligúria, rozvoj ikteru a hepatopatie. Medzičasom na pracovisku diabetológie v IKEM bola realizovaná príprava Langerhansových ostrovčekov. Izolácia ostrovčekov prebiehala za sterilných podmienok na klinickom pracovisku Laboratoře Langerhansových ostrůvků v IKEM. Pankreas bol v prvej fáze distendovaný roztokom kolagenázy, po rozdelení na približne 12 častí sa umiestnil do trepacej komory, v ktorej po dobu 30 min prebiehala digescia väzivovej frakcie pankreasu. Proces bol ukončený potom, čo sa z podžalúdkovej žľazy uvoľnili neporušené ostrovčeky. Získaný sediment mal objem cca 10 ml a obsahoval celkom 134 000 ostrovčekov (obr. 3). Farbenie na vitalitu vylúčilo prítomnosť mŕtvych buniek (obr. 4).

Suspenzia ostrovčekov a exokrinného tkaniva sa umiestnila do transportného vaku a transportovala pri teplote 4 °C do UN v Martine.
Po stabilizácii stavu bol pacient následne transportovaný na operačný sál k realizácii autotransplantácie Langerhansových ostrovčekov.
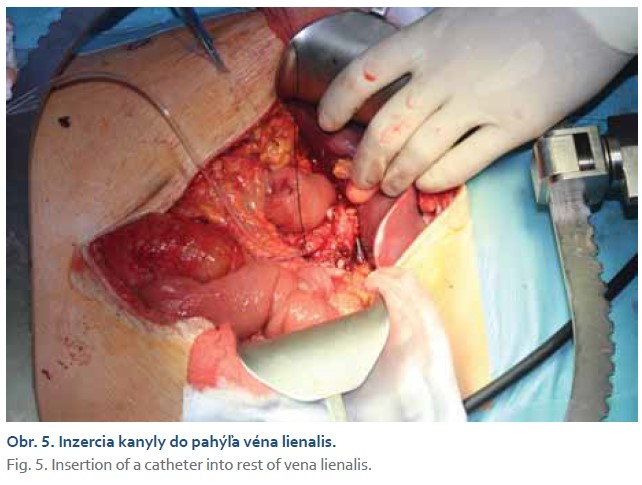
Počas druhého výkonu sme identifikovali pahýľ venalienalis (obr. 5), do ktorého sme zaviedli kanylu. Podali sme cca 100 ml suspenzie autologného štepu Langerhansových ostrovčekov v priebehu približne 10 min do portálneho riečiska (obr. 6). Počas podávania suspenzie bol pacient obehovo nestabilný s nutnosťou podpory vyšších dávok vazoaktívnej podpory noradrenalínom. Po výkone bol transportovaný na kliniku anesteziológie a intenzívnej medicíny, kde bolo pokračované v komplexnej orgánovej podpore, umelej pľúcnej ventilácii, analgosedácii, obehovej podpore noradrenalínom. Postupne došlo k stabilizácii obehu, detrakcii noradrenalínu, poklesu hyperbilirubinémie, cez podporné ventilačné režimy prevedeniu na spontánnu ventiláciu a následne pri dobrých ventilačno-oxygenačných parametroch k extubácii. Obeh bol stabilizovaný bez nutnosti podpory vazoaktívnymi látkami, glykémie korigované inzulínom. Prvý a 7. pooperačný deň bolo realizované USG vyšetrenie pečene a portálnej žily, bez nálezu trombózy. Pacient postupne mohol byť realimentovaný s nastavením adekvátnej inzulinoterapie za účelom kontroly glykémií. Na 11. pooperačný deň bol pacient prepustený domov.
Šiesty mesiac po výkone je pacient vo výbornom klinickom stave. Je liečený inzulínovou pumpou v kombinácii s kontinuálnou monitoráciou glykémií. Jeho diabetes je vyrovnaný, hodnota HbA1c je 37 mmol/mol, podľa stiahnutých dát zo senzoru sa „time in range“ dlhodobo pohybuje nad 90 %. Nevyžaduje analgetickú liečbu, kvalita života je neporovnateľne lepšia s možnosťou zaradiť sa do pracovného života. Od výkonu pacient nemusel byť hospitalizovaný, trávenie na adekvátnej substitúcii pankreatických enzýmov je bezproblémové.
Diskusia
Chronická pankreatitída je charakterizovaná nezvratnými morfologickými zmenami v tkanive pankreasu. Etiologicky rozlišujeme niekoľko typov [6]. Najčastejšou príčinou je nadmerné požívanie alkoholu [7,8], ale existujú aj iné príčiny, ako genetické mutácie (hlavne špecifické mutácie v génoch PRSS1, CFTR, SPINK1 alebo CTRC) alebo autoimunitné ochorenia postihujúce pankreas. Zriedkavo je chronická pankreatitída spôsobená liekmi a v niektorých prípadoch sa príčina nedá určiť (idiopatická forma) [3]. Pretože každý typ má inú prognózu a prístup k liečbe, je kľúčové správne diagnostikovať konkrétny typ chronickej pankreatitídy. Zatiaľ čo u väčšiny typov algickej formy chronickej pankreatitídy je metódou voľby endoskopická liečba alebo chirurgická drenáž, pri hereditárnej pankreatitíde je značné riziko vzniku rakoviny pankreasu [9]. To je dôvod, prečo je pri chirurgickom zákroku indikovaná totálna pankreatektómia [2,7]. Chirurgická liečba sa stáva indikovanou po zlyhaní medikamentóznej alebo endoskopickej liečby. Konkrétne v tomto prípade bolo rozhodnuté o totálnej pankreatektómii z dôvodu genetickej záťaže – mutácií v géne SPINK1. Jones et al odobrali vzorky pankreasu 28 pacientom s mutáciou SPINK1 a zistili histopatologické zmeny, ako je multifokálna, cytoplazmatická vakuolizácia acinárneho parenchýmu a prítomnosť miernej intralobulárnej fibrózy pankreasu. Mutácia SPINK1 je však bežným polymorfizmom v populácii s frekvenciou približne 2 %, čo naznačuje, že môže hrať úlohu skôr ako modifikujúci faktor než ako príčinný [10]. Hoci vzťah medzi chronickou pankreatitídou a mutáciou SPINK1 (homozygotnou alebo heterozygotnou) nie je jasný, mutácie v géne SPINK1 môžu viesť k zníženej inhibícii aktivity trypsínu [11].
Pankreatogénny diabetes, ktorý vznikne po odstránení celej podžalúdkovej žľazy, je najlabilnejšou formou diabetu. Hodnoty cukru v periférnej krvi majú v typickom prípade kolísavý priebeh a ani opakovaná edukácia pacienta a používanie moderných technológií negarantuje dosiahnutie uspokojivej kompenzácie. Nepredvídateľnosť glykémií je spôsobená nielen chýbajúcou endogénnou produkciou inzulínu, ale tiež chýbajúcou sekréciou glukagónu, spomalenou kinetikou žalúdku a nedostatočnou produkciou tráviacich enzýmov. Viac ako polovica pacientov trpí na opakované ťažké hypoglykémie a vyžaduje hospitalizačnú starostlivosť [12]. Zmysluplným postupom u týchto pacientov je autotransplantácia ostrovčekov. Totálna pankreatektómia s autotransplantáciou ostrovčekových buniek (TPIAT) bola prvýkrát vykonaná v roku 1977 v Minnesote (USA) za účelom zlepšenia kvality života u pacienta s ťažkou bolestivou chronickou pankreatitídou [13]. V súčasnej dobe sa tento postup rutinne používa na niekoľkých pracoviskách vo svete. Podľa záznamov z medzinárodného registru je vo svete dokumentovaných viac ako 1 100 autológnych implantácií ostrovčekov (www.citregistry.org). Hlavné indikačné kritéria zahŕňajú bolestivú formu chronickej pankreatitídy, benígne tumory, akútnu pankreatitídu, cystickú fibrózu a traumatické poškodenie pankreasu [14,15].
Keďže odstránenie celého pankreasu je výkon spojený s rizikom mnohých rôznych akútnych aj dlhodobých komplikácií, panuje v prístupe k týmto pacientom určitá zdržanlivosť. Preinvazívne operačné riešenie je kľúčová správna indikácia a výber pacienta [16]. Po operácii je potrebná celoživotná substitučná liečba pankreatickými enzýmami, tomu sa nedá vyhnúť. Pokiaľ je pankreatektómia doplnená autotransplantáciou, pri správnej indikácii nezvyšuje operačné riziko a približne 30 % pacientov nebude vyžadovať po výkone liečbu inzulínom a ostatní pacienti budú mať dobre vyrovnaný diabetes (www.citregistry.org). V porovnaní s dospelými pacientmi môže byť úspešnosť zachovania adekvátnej endogénnej sekrécie inzulínu u detí ešte väčšia [17].
Údaje o zlepšení kvality života u pacientov s chronickou pankreatitídou zahŕňajú hlavne dáta týkajúce sa zníženia bolesti a spotreby opiátových analgetík [18]. V našom prípade je zlepšenie kvality života výrazné, pacient nepotrebuje žiadnu hospitalizáciu, je prakticky bez bolesti, potrebuje aplikovať exogénny inzulín, ale kompenzácia diabetes mellitus je výborná.
Záver
Totálna pankreatektómia s autotransplantáciou Langerhansových ostrovčekov je potenciálnou možnosťou liečby u vybraných pacientov s chronickou pankreatitídou rôznej etiológie. SPINK1 – asociovaná chronická pankreatitída je charakterizovaná progresívnou fibrózou parenchýmu [10], takže načasovanie a výber chirurgickej liečby je kľúčom k úspechu. Pri hereditárnej pankreatitíde s častými bolestivými záchvatmi a zlyhaním endoskopickej liečby je realizácia totálnej pankreatektómie jediným racionálnym riešením. Možnosť kombinácie totálnej pankreatektómie s transplantáciou autologných ostrovčekov, ktorá v optimálnom prípade prechádza vzniku diabetu, môže ošetrujúcim lekárom uľahčiť včasnú indikáciu výkonu a pacientovi výrazne zlepšiť kvalitu života. V prípade optimálneho výsledku sa podstatne znižujú náklady na zdravotnú starostlivosť o pacienta v krátkodobom (nie je nutná intenzifikovaná liečba inzulínom) aj dlhodobom horizonte (minimálne riziko rozvoja chronických komplikácií diabetu).
Transplantácia ostrovčekov medzi pracoviskami dvoch rôznych štátov si vyžaduje detailnú prípravu, entuziazmus, spoluprácu a skúsenosti na oboch stranách. Týmto výkonom sa približujeme k moderným svetovým centrám, ktoré vytvárajú konzorcia pre izolácie a transplantácie ostrovčekov, a tým účinne znižujú náklady a zvyšujú úspešnosť liečby [19].
ORCID autorů
L. Nosáková ORCID 0000-0003-0432-8575,
P. Bánovčin ORCID 0000-0001-6694-9364,
P. Girman ORCID 0000-0003-0944-8189,
J. Kříž ORCID 0000-0001-7695-3885,
I. Lenotovyč ORCID 0000-0003-1610-7796.
Doručené/Submitted: 12. 5. 2023
Prijaté/Accepted: 22. 5. 2023
MUDr. Lenka Nosáková, PhD.
Interná klinika gastroenterologická
JLF UK v Martine
Kollárova 2
036 01 Martin
lenka.bubernakova@gmail.com
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Najarian JS, Sutherland DE, Baumgartner D et al. Total or near total pancreatectomy and islet autotransplantation for treatment of chronic pancreatitis. Ann Surg 1980; 192(4): 526–542. doi: 10.1097/00000658-198010000-00011.
2. Kuroki T, Adachi T, Ono S et al. Pancreatic islet autotransplantation with total pancreatectomy for chronic pancreatitis. Surg Today 2012; 43(7), 715–719. doi: 10.1007/s00595-012-0382-7.
3. Schrope, B. Total Pancreatectomy with Autologous Islet Cell Transplantation. Gastrointest Endosc Clin N Am 2018; 28(4): 605–618. doi: 10.1016/j.giec.2018.05.003.
4. Chaouch MA, Leon P, Cassese G et al. Total pancreatectomy with intraportal islet autotransplantation for pancreatic malignancies: a literature overview. Expert Opin Biol Ther 2022; 22(4): 491–497. doi: 10.1080/14712598.2022.1990261.
5. Aleotti F, Nano R, Piemonti L et al. Total pancreatectomy sequelae and quality of life: results of islet autotransplantation as a possible mitigation strategy. Updates Surg 2021; 73(4): 1237–1246. doi: 10.1007/s13304-021-01129-w.
6. Beyer G, Habtezion A, Werner J et al. Chronic pancreatitis. Lancet 2020; 396(10249): 499–512. doi: 10.1016/S0140-6736(20)31318-0.
7. Conwell DL, Banks PA, Sandhu BS et al. Validation of demographics, etiology, and risk factors for chronic pancreatitis in the USA: a report of the North American Pancreas Study (NAPS) Group. Dig Dis Sci 2017; 62: 2133–2140. doi: 10.1007/s10620-017-4621-z.
8. Beyer G, Mahajan UM, Budde C et al. Development and validation of a chronic pancreatitis prognosis score in 2 independent cohorts. Gastroenterology 2017; 153(6): 1544–1554. doi: 10.1053/j.gastro.2017.08.073.
9. Whitcomb DC, Shelton CA, Brand RE. Genetics and Genetic Testing in Pancreatic Cancer. Gastroenterology 2015; 149(5): 1252–1264. doi: 10.1053/j.gastro.2015.07.057.
10. Jones TE, Bellin MD, Yadav D et al. The histopathology of SPINK1-associated chronic pancreatitis. Pancreatology 2020; 20(8): 1648–1655. doi: 10.1016/j.pan.2020.10.030.
11. Kume K, Masamune A, Ariga H et al. Do genetic variants in the SPINK1 gene affect the level of serum PSTI? J Gastroenterol 2012; 47(11): 1267–1274. doi: 10.1007/s00535-012-0590-3.
12. Parsaik AK, Murad MH, Sathananthan A et al. Metabolic and target organ outcomes after total pancreatectomy: Mayo Clinic experience and meta-analysis of the literature. Clin Endocrinol 2010; 73(6): 723–731. doi: 10.1111/j.1365-22 65.2010.03860.x.
13. Sutherland DE, Matas AJ, Najarian JS. Pancreatic islet cell transplantation. Surg Clin North Am 1978; 58(2): 365–382. doi: 10.1016/s00 39-6109(16)41489-1.
14. Buhler L, Andereggen E, Fournier B et al. Indications for human islet transplantation: chronic pancreatitis and cystic fibrosis. Transplant Proc 1995; 27(6): 3148e9.
14. Garcea G, Weaver J, Phillips J et al. Total pancreatectomy with and without islet cell transplantation for chronic pancreatitis: a series of 85 consecutive patients. Pancreas 2009; 38(1): 1–7. doi: 10.1097/MPA.0b013e3181825c00.
15. Bellin MD, Freeman ML, Gelrud A et al. Total pancreatectomy and islet autotransplantation in chronic pancreatitis: recommendations from PancreasFest. Pancreatology 2014; 14(1): 27–35. doi: 10.1016/j.pan.2013.10.009.
16. Abu-El-Haija M, Anazawa T, Beilman GJ et al. The role of total pancreatectomy with islet autotransplantation in the treatment of chronic pancreatitis: A report from the International Consensus Guidelines in chronic pancreatitis. Pancreatology 2020; 20(4): 762–771. doi: 10.1016/j.pan.2020.04.005.
17. Chinnakotla S, Bellin MD, Schwarzenberg SJ et al. Total pancreatectomy and islet autotransplantation in children for chronic pancreatitis: indication, surgical techniques, postoperative management, and long-term outcomes. Ann Surg 2014; 260(1): 56–64. doi: 10.1097/SLA. 0000000000000569.
18. Bellin MD, Freeman ML, Gelrud A et al. Total pancreatectomy and islet autotransplantation in chronic pancreatitis: recommendations from PancreasFest. Pancreatology 2014; 14(1): 27–35. doi: 10.1016/j.pan.2013.10.009.
19. Lablanche S, Borot S, Wojtusciszyn A et al. Five-Year Metabolic, Functional, and Safety Results of Patients With Type 1 Diabetes Transplanted With Allogenic Islets Within the Swiss-French GRAGIL Network. Diabetes Care 2015; 38(9): 1714–1722. doi: 10.2337/dc15-0094.