Lze předpovědět, nebo dokonce předejít IBD?
Ondřej Hradský1
+ Pracoviště
Souhrn
Klíčová slova
ulcerózní kolitida, prevalence, Crohnova choroba, prevence, predikce, prvostupňový příbuzný
Úvod
Zánětlivá střevní onemocnění (IBD) jsou zásadní zdravotní problém, který spotřebovává velké množství materiálních i personálních zdrojů, a i přes velké pokroky v léčebných strategiích jsou stále nevyléčitelná. Dle recentní studie představují v EU přímé náklady na léčbu jednoho pacienta s IBD 2 609 eur za rok [1]. Bylo odhadnuto, že v roce 2017 trpělo IBD 7 milionů lidí [2]. Jistě se budou náklady na pacienty lišit mezi jednotlivými oblastmi, přesto lze předpokládat, že by se náklady na správně léčené pacienty mohly pohybovat kolem 18 mld. eur ročně. V EU, kde je aktuálně 1,3 milionu pacientů s IBD, by pak tento jistě přesnější odhad činil 3,4 mld. eur ročně [3]. Prevalence IBD roste [4]. Vysvětlením je jednak rostoucí incidence ve většině oblastí [5], dále incidence v nižší věkové skupině a přirozeně nízká mortalita a zvýšené přežívání IBD pacientů díky lepší péči [2]. Pomocí autoregresních integrovaných modelů klouzavých průměrů bylo odhadnuto (pro Kanadu), že v roce 2030 se bude prevalence pohybovat kolo 1 % [4]. Z těchto údajů vyplývá, jak důležité je již nyní zaměřit se na prevenci vzniku zánětlivých střevních onemocnění.
Prevence u jiných onemocnění
Cílená efektivní prevence je reálná jen tehdy, pokud jsme schopni identifikovat dostatečně rizikové jedince. Čím přesněji lze predikci provést, tím ambicióznější intervenci je etické provádět. U několika onemocnění již některé snahy o prevenci úspěšné byly. Příkladem imunitně podmíněného onemocněním, kde již delší dobu preventivní programy fungují, je diabetes mellitus 1. typu (T1DM). Prediktivní modely odhadující rozvoj T1DM dosahují AUC (area under curve) více než 0,90 již 5 let před vznikem, a to už v batolecím věku [6]. Při takto přesné predikci je možné použít k prevenci i intenzivní farmakoterapii. Příkladem projektu s nadějným výsledkem je kontrolovaná randomizovaná studie druhé fáze, v níž dostávalo 76 dětí monoklonální protilátku anti-CD3, teplizumab, či placebo po dobu 14 dní. V průběhu 6 měsíců se pak T1DM manifestoval u menšího počtu léčených pacientů s poměrem rizika (HR – hazard ratio) 0,41 [7].
Fáze rozvoje IBD
V rámci snahy Evropské organizace Crohnovy choroby (CD) a ulcerózní kolitidy (ECCO) o zahájení preventivních programů byla vypracována koncepce čtyř stadií vzniku IBD (obr. 1) [8]. Je však třeba poznamenat, že se jedná pouze o teoretickou koncepci, ve které je zatím spousta nejasností a je jen minimálně založena na důkazech.
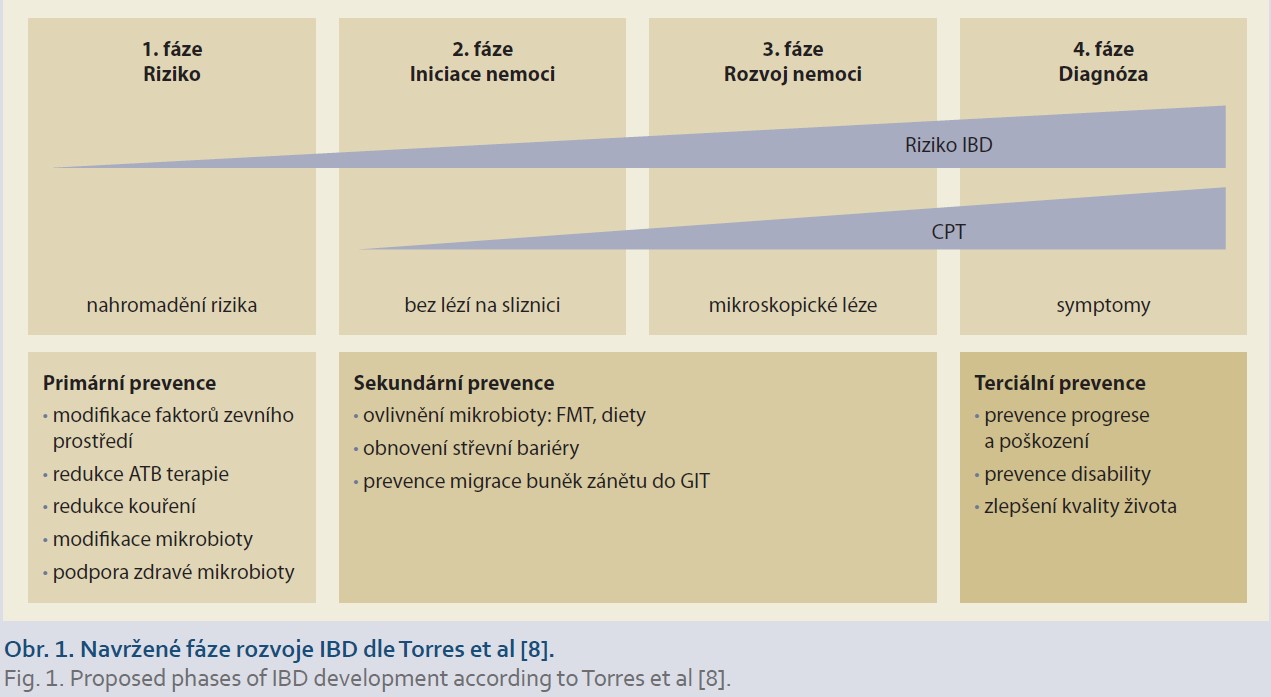
Rizikové faktory a odhad rizika
IBD jsou v naprosté většině multifaktoriální polygenní onemocnění. Ke vzniku je tedy třeba jak genetické riziko, tak ostatní faktory, souhrnně označované jako faktory zevního prostředí. Postupné získávání poznatků z asociačních studií odhalilo více než 240 variant asociovaných s IBD [9,10]. Tyto varianty však vysvětlují pouze 14 % variability rizika u CD a jen 8 % u UC [9]. Mezi rizikové faktory, které lze dle provedených studií považovat za pravděpodobné, především patří: strava [11,12], absence výlučného kojení [13], antibiotická léčba [14] a kouření [15]. Nicméně zkoumáno s rozporuplnými nebo i nadějnými výsledky bylo mnoho dalších faktorů zevního prostředí.
Vzhledem k velké heterogenitě epidemiologických studií zkoumajících faktory zevního prostředí lze relevantní odhad rizika zatím počítat spíše z genetických faktorů a dle rodinné zátěže. Integrací současných poznatků se podařilo vytvořit a validovat skóre (genome-wide polygenic score), které je schopno identifikovat 3,2 % populace s trojnásobným poměrem rizika (OR) k rozvoji IBD (0,8 % populace s OR ≥ 4; 0,2 % populace s OR ≥ 5) [16]. Stále nejlépe odhadnutelná riziková skupina jsou příbuzní pacientů s IBD. U prvostupňových příbuzných s CD je riziko zvýšeno osmkrát, pro příbuzné s UC čtyřikrát [17].
Potenciální prediktory iniciální preklinické fáze onemocnění
Předpokládáme, že během iniciální preklinické fáze rozvoje IBD se mění také složení mikrobioty. Ta je u pacientů s IBD extenzivně studována. Přestože máme k dispozici intervenční studie podávající důkaz, že při modifikaci střevní mikrobioty dojde, alespoň u části pacientů s UC, k současné změně mikrobioty a k úzdravě sliznice [18], není zatím možno definitivně vyloučit, že změny mikrobioty mohou být sekundární při změnách na sliznici. Zajímavé zjištění přináší recentní studie, která ukazuje, že děti matek s IBD mají odlišné složení mikrobioty oproti dětem matek bez IBD [19]. To by mohlo zvyšovat riziko u potomků (prvostupňových příbuzných) i bez genetické komponenty.
Dalším jevem, který předpokládáme, že se objevuje v iniciální preklinické fázi IBD, je porucha permeability. Nedávná studie prokázala, že právě porucha permeability je, pomocí exkreční frakce laktulózo-manitolového poměru, detekovatelná již roky před diagnózou CD, a může ji pomoci předpovědět [20]. Předpokládáme, že v dalších fázích rozvoje IBD se začínají zmnožovat buňky imunitního systému [8]. Již v roce 2005 byla publikována práce ukazující zvýšené hodnoty protilátek proti sacharomycetě (ASCA) a anticytoplazmatických protilátek (ANCA) již tři roky před diagnózou IBD [21]. Tyto nálezy byly dále ověřeny na velké skupině pacientů a doplněny o další sérologické prediktory [22]. Kromě sérologických markerů byla nalezena řada dalších změn sledujících imunitní zánětlivou odpověď, např. zvýšená sedimentace [23] a zvýšené hodnoty C-reaktivního proteinu (CRP) [24]. V recentní studii testovali prediktivní schopnost přes 1 000 proteinů. Při vhodné kombinaci se podařilo vytvořit model s plochou pod ROC křivkou (AUC) 0,85 rok před diagnózou a 0,76 pět let před diagnózou. Lehce lepších výsledků tohoto modelu bylo dosaženo po přidání sérologických parametrů [22].
Při dalším rozvoji onemocnění jsou pravděpodobně již přítomny známky zánětu jdoucí od mikroskopických změn k makroskopickým. Zdá se, že zánětlivé změny, asi nejlépe charakterizované mírným zvýšením fekálního kalprotektinu a vyšší propustností střevní sliznice, jsou nezávislé na sérologii, která se tak jeví jako dobrý časný prediktor [25]. Dalším zajímavým zjištěním je také vyšší fekální kalprotektin u dětí matek s CD oproti zdravým, který tak může být prediktorem již v nejranějších fázích života dítěte [26].
Aktuální prediktivní modely
Je vysoce pravděpodobné, že odhad rozvoje klinické diagnózy IBD bude složitější v raných fázích (jen rizikové faktory, iniciální fáze) než v období, kdy už budou přítomny mikroskopické, či dokonce asymptomatické makroskopické změny. Tomu také odpovídají aktuální hodnoty schopnosti predikce. Pro predikce již přítomného zánětu je určen v současné době asi nejpřesnější model, který kombinuje rodinnou zátěž, skóre genetického rizika, fekální kalprotektin, interleukin 6 a CRP. Tento algoritmus dosahoval velmi dobré přesnosti (AUC 0,87) v detekci drobných zánětlivých změn na tenkém střevě (detekovaných kapslovou enteroskopií) u prvostupňových příbuzných pacientů s CD [27]. Naopak model pátrající po časnějších fázích na podkladě kombinace sérologie a dalších 51 proteinových markerů dosahoval přesnosti (vyjádřené pomocí AUC) kolem 0,76 pět let před diagnózou symptomatické CD [25].
Preventivní programy
Na základě těchto poznatků byly založeny nebo upraveny již probíhající prediktivní a preventivní studie (GEM study [20], PREDICTS [28], UK twin study [29], EPIC cohort [30], Dutch TWIN-IBD study [31], Swedish IBD Twin study [32], EARLY cohort, MECONIUM study [33]). Ty lze jednoduše rozdělit na dvě základní skupiny. Retrospektivní studie, kde již víme, kteří pacienti vyvinuli symptomatické IBD, využívající existujících biobank, a dále studie prospektivní, které zařazují osoby v riziku v různém věkovém období. U této druhé skupiny je navíc možné plánovat preventivní programy. Jedním z těchto již probíhajících preventivních programů je studie MELODY, která se snaží odpovědět na otázku, zda velmi raná intervence v podobě diety u těhotných s CD a bez CD ovlivní kojenecké koliky, složení mikrobioty a hodnoty fekálního kalprotektinu u ročních dětí [33].
S použitím těchto získaných dat si lze jistě představit další preventivní programy. Vhodnou strategií může být např. výrazná stupňovitost provedených diagnostických a terapeutických intervencí. V první fázi je třeba definovat pro screening vhodnou skupinu prvostupňových příbuzných. Po genetickém vyšetření (ideálně provedeném ze slin) pomocí již ověřeného panelu rozřadit osoby dle rizika. U rizikové podskupiny poté provést vyšetření dalších fází rozvoje nemoci: testů na slizniční propustnost a vyšetření kalprotektinu. Při pozitivitě pak odebrat sérologická vyšetření a event. vyšetření dalších markerů (např. IL-6 a sedimentaci erytrocytů). Při vypočítaném vysokém riziku těmto jedincům poté nabídnout terapii např. v podobě některé z diet, např. modifikované Crohn’s disease exclusion diet [11] nebo screening v podobě kapslové enteroskopie a MR kolografie.
Závěr
Predikce IBD je zatím velmi nepřesná a rozvoj onemocnění lze odhadovat jen několik málo let před symptomy. To komplikuje výběr skupiny pro preventivní intervence. Predikce je výrazně lepší u CD než u UC. U CD se již podařilo identifikovat některé pochody, které rozvoj příznaků předchází. Lze předpokládat, že s postupným zlepšováním predikce bude možné aplikovat intenzivnější terapeutické modality, které začínají u programů s modifikací životního stylu a diety a budou přecházet až k biologické léčbě.
ORCID autora
O. Hradský ORCID 0000-0001-6193-0488.
doc. MUDr. Ondřej Hradský, Ph.D.
Pediatrická klinika
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
ondrej.hradsky@gmail.com
Práce byla podpořena firmou Sandoz.
Literatura
1. Burisch J, Vardi H, Schwartz D et al. Health-care costs of inflammatory bowel disease in a pan-European, community-based, inception cohort during 5 years of follow-up: a population-based study. Lancet Gastroenterol Hepatol 2020; 5(5): 454–464. doi: 10.1016/S2468-1253(20)30012-1.
2. GBD 2017 Inflammatory Bowel Disease Collaborators. The global, regional, and national burden of inflammatory bowel disease in 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet Gastroenterol Hepatol 2020; 5(1): 17–30. doi: 10.1016/S2468-1253(19)30333-4.
3. Zhao M, Gönczi L, Lakatos PL et al. The burden of inflammatory bowel disease in Europe in 2020. J Crohns Colitis 2021; 15(9): 1573–1587. doi: 10.1093/ecco-jcc/jjab029.
4. Coward S, Clement F, Benchimol EI et al. Past and future burden of inflammatory bowel diseases based on modeling of population-based data. Gastroenterology 2019; 156(5): 1345–1353.e4. doi: 10.1053/j.gastro.2019.01.002.
5. Kaplan GG. The global burden of IBD: from 2015 to 2025. Nat Rev Gastroenterol Hepatol 2015; 12(12): 720–727. doi: 10.1038/nrgastro. 2015.150.
6. Ferrat LA, Vehik K, Sharp SA et al. A combined risk score enhances prediction of type 1 diabetes among susceptible children. Nat Med 2020; 26(8): 1247–1255. doi: 10.1038/s415 91-020-0930-4.
7. Herold KC, Bundy BN, Long SA et al. An anti-CD3 antibody, teplizumab, in relatives at risk for type 1 diabetes. N Engl J Med 2019; 381(7): 603–613. doi: 10.1056/NEJMoa1902226.
8. Torres J, Halfvarson J, Rodriguez-Lago I et al. Results of the seventh scientific workshop of ECCO: precision medicine in IBD-prediction and prevention of inflammatory bowel disease. J Crohns Colitis 2021; 15(9): 1443–1454. doi: 10.1093/ecco-jcc/jjab048.
9. Jostins L, Ripke S, Weersma RK et al. Host-microbe interactions have shaped the genetic architecture of inflammatory bowel disease. Nature 2012; 491(7422): 119–124. doi: 10.1038/nature11582.
10. de Lange KM, Moutsianas L, Lee JC et al. Genome-wide association study implicates immune activation of multiple integrin genes in inflammatory bowel disease. Nat Genet 2017; 49(2): 256–261. doi: 10.1038/ng.3760.
11. Levine A, Wine E, Assa A et al. Crohn‘s disease exclusion diet plus partial enteral nutrition induces sustained remission in a randomized controlled trial. Gastroenterology 2019; 157(2): 440–450.e8. doi: 10.1053/j.gastro.2019.04.021.
12. Khalili H, Hakansson N, Chan SS et al. Adherence to a Mediterranean diet is associated with a lower risk of later-onset Crohn‘s disease: results from two large prospective cohort studies. Gut 2020; 69(9): 1637–1644. doi: 10.1136/gutjnl-2019-319505.
13. Xu L, Lochhead P, Ko Y et al. Systematic review with meta-analysis: breastfeeding and the risk of Crohn‘s disease and ulcerative colitis. Aliment Pharmacol Ther 2017; 46(9): 780–789. doi: 10.1111/apt.14291.
14. Nguyen LH, Örtqvist AK, Cao Y et al. Antibiotic use and the development of inflammatory bowel disease: a national case-control study in Sweden. Lancet Gastroenterol Hepatol 2020; 5(11): 986–995. doi: 10.1016/S24 68-1253(20)30267-3.
15. Papoutsopoulou S, Satsangi J, Campbell BJ et al. Review article: impact of cigarette smoking on intestinal inflammation-direct and indirect mechanisms. Aliment Pharmacol Ther 2020; 51(12): 1268–1285. doi: 10.1111/apt.15774.
16. Khera AV, Chaffin M, Aragam KG et al. Genome-wide polygenic scores for common diseases identify individuals with risk equivalent to monogenic mutations. Nat Genet 2018; 50(9): 1219–1224. doi: 10.1038/s41588-018-0183-z.
17. Moller FT, Andersen V, Wohlfahrt J et al. Familial risk of inflammatory bowel disease: a population-based cohort study 1977–2011. Am J Gastroenterol 2015; 110(4): 564–571. doi: 10.1038/ajg.2015.50.
18. Paramsothy S, Kamm MA, Kaakoush NO et al. Multidonor intensive faecal microbiota transplantation for active ulcerative colitis: a randomised placebo-controlled trial. Lancet 2017; 389(10075): 1218–1228. doi: 10.1016/ S0140-6736(17)30182-4.
19. Torres J, Hu J, Seki A et al. Infants born to moth- ers with IBD present with altered gut microbiome that transfers abnormalities of the adaptive immune system to germ-free mice. Gut 2020; 69(1): 42–51. doi: 10.1136/gutjnl-2018-317855.
20. Turpin W, Lee SH, Garay JAR et al. Increased intestinal permeability is associated with later development of Crohn‘s disease. Gastroenterology 2020; 159(6): 2092–2100.e5. doi: 10.1053/j.gastro.2020.08.005.
21. Israeli E, Grotto I, Gilburd B et al. Anti-Saccharomyces cerevisiae and antineutrophil cytoplasmic antibodies as predictors of inflammatory bowel disease. Gut 2005; 54(9): 1232–1236. doi: 10.1136/gut.2004.060228.
22. Torres J, Petralia F, Sato T et al. Serum biomarkers identify patients who will develop inflammatory bowel diseases up to 5 years before diagnosis. Gastroenterology 2020; 159(1): 96–104. doi: 10.1053/j.gastro.2020.03.007.
23. Melinder C, Hiyoshi A, Hussein O et al. Physical fitness in adolescence and subsequent inflammatory bowel disease risk. Clin Transl Gastroenterol 2015; 6(11): e121. doi: 10.1038/ctg.2015.49.
24. Lochhead P, Khalili H, Ananthakrishnan AN et al. Association between circulating levels of C-reactive protein and interleukin-6 and risk of inflammatory bowel disease. Clin Gastroenterol Hepatol 2016; 14(6): 818–824.e6. doi: 10.1016/j.cgh.2016.01.016.
25. Lee SH, Turpin W, Espin-Garcia O et al. Anti-microbial antibody response is associated with future onset of Crohn‘s disease independent of biomarkers of altered gut barrier function, subclinical inflammation, and genetic risk. Gastroenterology 2021; 161(5): 1540–1551. doi: 10.1053/ j.gastro.2021.07.009.
26. Kim ES, Tarassishin L, Eisele C et al. Longitudinal changes in fecal calprotectin levels among pregnant women with and without inflammatory bowel disease and their babies. Gastroenterology 2021; 160(4): 1118–1130.e3. doi: 10.1053/j.gastro.2020.11.050.
27. Taylor KM, Hanscombe KB, Prescott NJ et al. Genetic and inflammatory biomarkers classify small intestine inflammation in asymptomatic first-degree relatives of patients with Crohn‘s disease. Clin Gastroenterol Hepatol 2020; 18(4): 908–916.e13. doi: 10.1016/j.cgh.2019.05.061.
28. Spencer EA, Helmus D, Telesco S et al. Inflammatory bowel disease clusters within affected sibships in Ashkenazi Jewish multiplex families. Gastroenterology 2020; 159(1): 381–382. doi: 10.1053/j.gastro.2020.03.023.
29. Ng SC, Woodrow S, Patel N et al. Role of genetic and environmental factors in British twins with inflammatory bowel disease. Inflamm Bowel Dis 2012; 18(4): 725–736. doi: 10.1002/ibd.21747.
30. Chan SS, Luben R, Olsen A et al. Body mass index and the risk for Crohn‘s disease and ulcerative colitis: data from a European Prospective Cohort Study (The IBD in EPIC Study). Am J Gastroenterol 2013; 108(4): 575–582. doi: 10.1038/ajg.2012.453.
31. Brand EC, Klaassen MAY, Gacesa R et al. Healthy cotwins share gut microbiome signatures with their inflammatory bowel disease twins and unrelated patients. Gastroenterology 2021; 160(6): 1970–1985. doi: 10.1053/ j.gastro.2021.01.030.
32. Halfvarson J, Bodin L, Tysk C et al. Inflammatory bowel disease in a Swedish twin cohort: a long-term follow-up of concordance and clinical characteristics. Gastroenterology 2003; 124(7): 1767–1773. doi: 10.1016/ s0016-5085(03)00385-8.
33. Peter I, Maldonado-Contreras A, Eisele C et al. A dietary intervention to improve the microbiome composition of pregnant women with Crohn‘s disease and their offspring: the MELODY (Modulating Early Life Microbiome through Dietary Intervention in Pregnancy) trial design. Contemp Clin Trials Commun 2020; 18: 100573. doi: 10.1016/j.conctc.2020.100573.