Hepatogenní diabetes u kandidátů transplantace jater: prevalence, rizikové faktory a potransplantační vývoj – prospektivní studie
Irena Míková1, Denisa Kyselová1, Kateřina Dvořáková1, Monika Dezortová Orcid.org 2, Milan Hájek Orcid.org 2, Věra Lánská3, Julius Špičák Orcid.org 1, Pavel Trunečka1
+ Pracoviště
Souhrn
Úvod: Diabetes mellitus (DM) asociovaný s cirhózou jater (tzv. hepatogenní DM) má od klasického DM 2. typu (T2DM) řadu odlišností, data o jeho prevalenci, rizikových faktorech a vývoji po transplantaci jater (LT) jsou však omezená. Cílem této studie bylo posoudit prevalenci, rizikové faktory a potransplantační vývoj DM diagnostikovaného v rámci předtransplantačního vyšetření u prospektivně sledované kohorty kandidátů LT. Metody: Do studie bylo zařazeno 122 dospělých pacientů, kteří byli v období 5/2015 až 4/2017 zařazeni na čekací listinu (WL) k LT. Přítomnost DM byla hodnocena na základě standardních kritérií včetně orálního glukózového tolerančního testu (OGTT). Výsledky: U 54 pacientů (44,3 %) byl před LT přítomen DM, z nichž u 26 pacientů (21,3 %) byl známý již dlouho před zařazením na WL (klasický T2DM) a u dalších 28 pacientů (23,0 %) byl DM diagnostikován v průběhu předtransplantačního vyšetření na základě patologických hodnot OGTT (hepatogenní DM). U 13 pacientů byl zjištěn de novo DM po LT. Dle multivariantní analýzy měli pacienti s hepatogenním DM oproti klasickému T2DM významně nižší BMI (p = 0,015), nižší lačnou glykemii (p = 0,002) a nižší glykovaný hemoglobin (p = 0,010). Oproti pacientům bez diabetu měli pacienti s hepatogenním DM častější výskyt metabolického syndromu (p = 0,033). Pacienti s hepatogenním DM byli méně často léčeni inzulinem 1 měsíc po LT (32,0 vs. 76,2 %; p = 0,002), 6 měsíců (20,0 vs. 76,2 %; p < 0,001), 1 rok (20,0 vs. 75,0 %; p < 0,001) a 2 roky po LT (23,8 vs. 66,7 %; p = 0,007) než pacienti s klasickým T2DM; oproti skupině bez předtransplantačního DM byli častěji léčeni inzulinem 1 měsíc po LT (32,0 vs. 7,7 %; p = 0,015) a 2 roky po LT (23,8 vs. 9,1 %; p = 0,029). Závěr: Hepatogenní DM je u kandidátů LT častý (23,0 %), u většiny pacientů po LT na rozdíl od klasického T2DM regreduje, nicméně inzulinoterapie je nutná až u jedné čtvrtiny pacientů i 2 roky po LT.
Klíčová slova
hepatogenní diabetes, diabetes mellitus 2. typu, transplantace jater, inzulinoterapie
Úvod
Vztah mezi cirhózou jater a diabetes mellitus (DM) je znám již dlouhou dobu. Odhady prevalence DM u pacientů s jaterním onemocněním jsou velmi variabilní a dosahují od 20 do 70 % v závislosti na stadiu a etiologii jaterního onemocnění a použité metodě hodnocení [1,2], což je významně víc než přibližně 8% prevalence DM v obecné populaci [3]. Prevalence DM je vyšší u pokročilejších stadií jaterního onemocnění a dále v případě cirhózy v důsledku nealkoholové tukové nemoci jater (NAFLD), kryptogenní cirhózy, alkoholové nemoci jater (ALD) a chronické hepatitidy C (HCV) [1,4]. Přítomnost DM je nezávislým rizikovým faktorem nepříznivé prognózy u pacientů s cirhózou [5], DM byl u pacientů s cirhózou asociován s častějším rozvojem ascitu, renální dysfunkce, jaterní encefalopatie, bakteriálních infekcí, se zvýšeným rizikem hepatocelulárního karcinomu (HCC) [6,7] a variceálního krvácení [8]. U diabetiků s jaterní cirhózou může být lačná glykemie a glykovaný hemoglobin (HbA1c) normální v důsledku poruchy metabolizmu glukózy při jaterní dysfunkci a snížené životnosti erytrocytů při hypersplenizmu [1]. K detekci poruchy glukózového metabolizmu může být nezbytné provést orální glukózový toleranční test (OGTT) [6].
U pacientů s cirhózou se může jednat buď o klasický DM 2. typu (T2DM), nebo o tzv. hepatogenní diabetes, který je následkem jaterní insuficience a portální hypertenze [7]. Ačkoli není hepatogenní DM samostatnou nozologickou jednotkou, z klinického hlediska má oproti klasickému T2DM řadu odlišností. Hepatogenní DM je často doprovázen normálními hodnotami lačné glykemie a HbA1c, méně často je vázán na klasické rizikové faktory, jako jsou rodinná anamnéza, věk a body mass index (BMI) [9], a má nižší výskyt mikro- a makrovaskulárních komplikací [9,10].
Patofyziologie hepatogenního diabetu je komplexní a ne zcela objasněná. Porucha glukózové tolerance u cirhózy může vyplývat ze dvou současně se vyskytujících abnormalit. Roli hraje jednak inzulinová rezistence ve svalech a současně neadekvátní odpověď β-buněk v dostatečné míře vylučovat inzulin, která by za normálních okolností mohla nahradit jeho nedostatečný účinek [6,11]. Inzulin je metabolizován a degradován převážně v hepatocytech. Pokles množství funkčních hepatocytů, a tím snížená clearance inzulinu, a dále portosystémové žilní kolaterály vedoucí k poklesu prvního průchodu játry mají za následek vysoké hladiny inzulinu. Hyperinzulinemie může vést k inzulinové rezistenci v důsledku down regulace inzulinových receptorů [7]. Rozlišení hepatogenního DM od T2DM může být obtížné. V jedné studii měli pacienti s hepatogenním DM vyšší lačné inzulinemie a HOMA-inzulin rezistence index (HOMA-IR) než pacienti s T2DM, což by mohlo svědčit pro vyšší stupeň inzulinové rezistence a poruchy jaterní degradace inzulinu s následnou hyperinzulinemií u pacientů s hepatogenním DM [12]. Po úspěšné transplantaci jater (LT) dochází většinou k regresi nebo zmírnění hepatogenního DM, normalizaci glukózové tolerance, korekci chronické hyperinzulinemie a periferní inzulinové rezistence, což svědčí pro přímou vazbu hepatogenního diabetu na poruchu jaterní funkce [13,14].
Až u 30 % příjemců LT byl popsán vznik de novo DM po LT. Na jeho vzniku se významně podílí léčba kalcineurinovými inhibitory (CNI) cyklosporinu a takrolimu, které způsobují poruchu sekrece inzulinu [15].
Cílem této studie bylo posoudit prevalenci, rizikové faktory a potransplantační vývoj diabetu diagnostikovaného v rámci předtransplantačního vyšetření u prospektivní kohorty kandidátů LT.
Soubor pacientů a metodika
Soubor pacientů
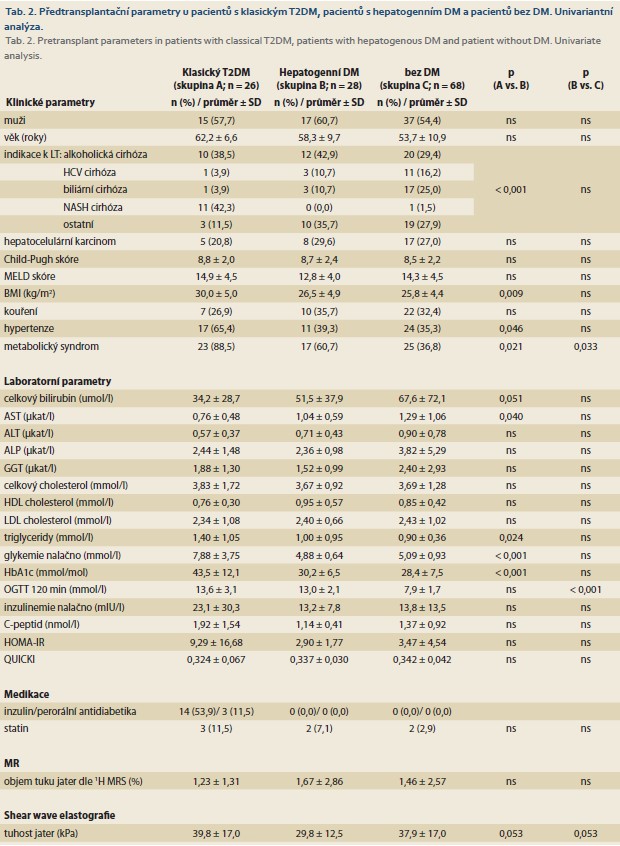
Tato prospektivní studie zahrnula dospělé pacienty, kteří na našem pracovišti v období 5/2015 až 4/2017 podstoupili předtransplantační vyšetření a podepsali informovaný souhlas se studií. Tato práce byla součástí rozsáhlejšího projektu sledování vývoje NAFLD po LT, mezi vyřazovací kritéria patřilo akutní jaterní selhání, jaterní encefalopatie a kontraindikace vyšetření magnetickou rezonancí (MR). Studie zahrnula 122 pacientů zařazených na čekací listinu (WL) k LT, 69 (56,6 %) mužů, s průměrným věkem 56,6 ± 10,3 let. Indikací k LT byla nejčastěji alkoholická cirhóza (34,4 %), biliární cirhóza (17,2 %), HCV cirhóza (12,3 %) a NASH cirhóza (9,8 %). Průměrné Child-Pugh skóre bylo 8,6 ± 2,2, průměrné MELD skóre 14,1 ± 4,4. Vstupní charakteristika souboru je uvedena v tab. 1. Ze 122 pacientů podstoupilo 105 pacientů plánovanou LT, 3 pacienti zemřeli na WL, 14 pacientů bylo z WL vyřazeno. Pacienti byli vyšetřeni před LT v době předtransplantačního vyšetření (V0; n = 122), 6 měsíců po LT (V1; n = 98), 1 rok po LT (V2; n = 96) a 2 roky po LT (V3; n = 83).
U všech pacientů byla navíc hodnocena terapie antidiabetiky 1 měsíc po LT a přežívání 3 a 5 let po LT.
Klinické a laboratorní vyšetření
Při každé kontrole byla zhodnocena klinická a laboratorní data uvedená v tab. 2. Pacientům byla po celonočním lačnění odebrána krev na stanovení glykemie, HbA1c, C-peptidu a inzulinemie. Z hodnot lačné glykemie a lačné inzulinemie byl vypočten HOMA-IR [lačný inzulin (μU/ml) × lačná glykemie (mmol/l) / / 22,5] a QUICKI index [1/log lačný inzulin (μU/ml) + log lačná glykemie (mg/dl) ] [16]. U pacientů, kteří nebyli léčeni inzulinem, byl po celonočním lačnění proveden OGTT s podáním roztoku 75 g glukózy a byla hodnocena glykemie po 120 minutách.
Diabetes mellitus byl definován jako lačná glykemie v plazmě ≥7,0 mmol/l (minimálně při dvou různých měřeních v posledních 6 měsících), koncentrace glukózy v plazmě při OGTT po 120 minutách ≥ 11,1 mmol/l nebo léčba antidiabetiky (inzulinem (INZ) nebo perorálními antidiabetiky (PAD)). DM, který byl u pacientů známý již delší dobu před zahájením předtransplantačního vyšetření, byl definován jako klasický T2DM, zatímco DM diagnostikovaný až v jeho průběhu byl definován jako hepatogenní DM. Vzhledem k tomu, že u většiny pacientů nebylo možné určit dobu trvání cirhózy, byli všichni pacienti s dříve známou diagnózou DM zahrnuti do skupiny s klasickým T2DM. Hypertenze byla definována jako krevní tlak ≥ 130/85 mmHg nebo léčba antihypertenzivy. Metabolický syndrom byl definován jako přítomnost alespoň 3 z 5 následujících faktorů:
1. obvod pasu ≥ 102 cm u mužů a ≥ 88 cm u žen;
2. hypertenze;
3. glykemie nalačno ≥ 5,6 mmo/l nebo přítomnost DM;
4. hypertriglyceridemie ≥ 1,7 mmol/l;
5. HDL cholesterol < 1,0 mmol/l u mužů a < 1,3 mmol/l u žen.
Vyšetření MR a elastografie
Při každé kontrole bylo po alespoň 3hodinovém lačnění stanoveno metodou 1H MR spektroskopie procento objemu tuku v játrech, toto měření bylo prováděno ve třech standardizovaných částech jater. Vyšetření se prováděla na 3T celotělovém tomografu Trio (Siemens, Německo). Při každé kontrole byla pacientům provedena shear wave elastografie s měřením tuhosti jater (kPa).
Statistické hodnocení
Kategorické proměnné jsou udávány v absolutních počtech a procentech, spojité proměnné jako průměr a směrodatná odchylka. Rozdíly veličin mezi skupinami byly hodnoceny podle typu rozložení buď Studentovým t-testem, nebo Kruskal-Wallisovým testem pro spojité veličiny a Fisherovým testem (pokud jsou očekávané počty v buňce < 5) anebo Pearsonovým chí-kvadrát testem pro diskrétní veličiny. K hodnocení rozdílů mezi skupinami pro více proměnných najednou jsme použili logistickou regresi. Za statisticky významnou byla použita hodnota p < 0,05, všechny testy byly oboustranné. Pro statistické hodnocení jsme použili JMP 16.2.0 statistický software, SAS Institute Inc. 2020–2021.
Výsledky
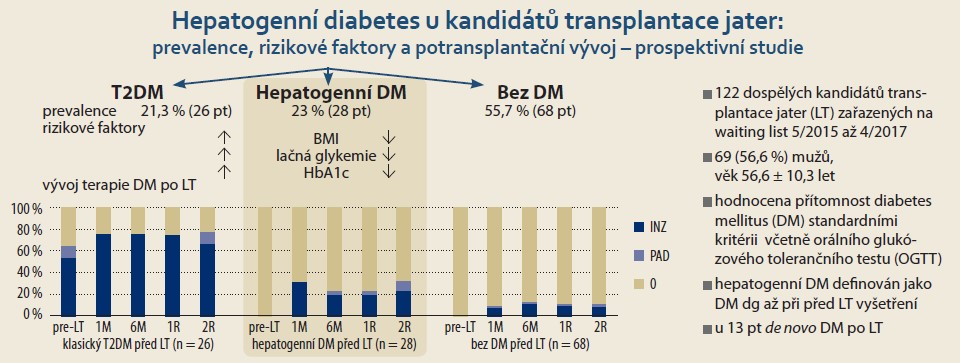
U 54 pacientů souboru (44,3 %) byl před LT přítomen DM, z nichž u 26 pacientů (21,3 %) byl DM známý již dlouho před zařazením na WL k LT (skupina s klasickým T2DM) s průměrnou dobou trvání 8,8 ± 5,1 let, u dalších 28 pacientů (23,0 %) byl DM diagnostikován při V0 na základě patologických hodnot OGTT (skupina s hepatogenním DM). U zbývajících 68 pacientů (55,7 %) nebyl DM přítomen. Před LT bylo 14 pacientů s klasickým DM (53,9 %) léčeno inzulinem a 3 pacienti (11,5 %) PAD, žádný pacient s hepatogenním DM neměl před LT zavedenu léčbu antidiabetiky. Z 68 pacientů bez DM před LT byl u 13 pacientů (19,1 %) zjištěn de novo DM po LT.
NASH cirhóza tvořila 42,3 % indikací u pacientů s klasickým T2DM oproti 0,0 % ve skupině s hepatogenním DM (p < 0,001; tab 2). Pacienti s hepatogenním DM měli oproti pacientům s klasickým T2DM nižší BMI (p = 0,009), nižší výskyt metabolického syndromu (p = 0,021) a hypertenze (p = 0,046), dále u nich byly nižší hladiny lačné glykemie (p < 0,001), HbA1c (p < 0,001), sérových triglyceridů (p = 0,024) a vyšší hladiny aspartátaminotransferázy (AST; p = 0,040). V multivariantní analýze byl hepatogenní DM oproti klasickému T2DM významně spojen s nižším BMI (odds ratio (OR) 0,81; 95% konfidenční interval (CI) 0,68–0,97; p = 0,015), nižší lačnou glykemií (OR 0,38; 95% CI 0,17––0,84; p = 0,002) a nižším HbA1c (OR 0,88; 95% CI 0,78–0,98; p = 0,010). Pacienti s hepatogenním DM měli oproti pacientům bez DM častější výskyt metabolického syndromu (p = 0,033), jiné významné rozdíly v univariantní analýze jsme neprokázali (tab. 2).
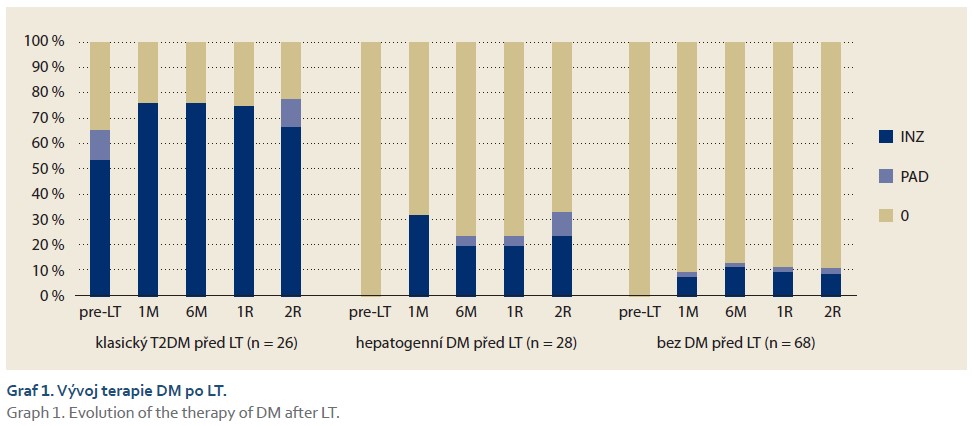
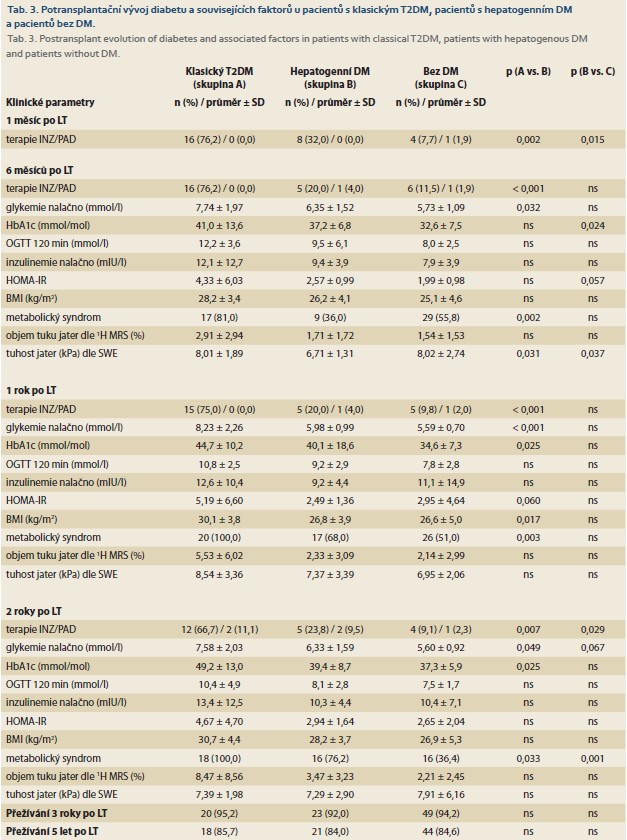
Při srovnání potransplantačního vývoje DM u jednotlivých skupin (tab. 3, graf 1) jsme zjistili, že pacienti s hepatogenním DM byli oproti klasickému T2DM méně často léčeni INZ 1 měsíc po LT (32,0 vs. 76,2 %; p = 0,002), 6 měsíců (20,0 vs. 76,2 %; p < 0,001), 1 rok (20,0 vs. 75,0 %; p < 0,001) a 2 roky po LT (23,8 vs. 66,7 %; p = 0,007). U pacientů s hepatogenním DM byl oproti skupině pacientů bez DM častěji podáván INZ 1 měsíc po LT (32,0 vs. 7,7 %; p = 0,015) a 2 roky po LT (23,8 vs. 9,1 %; p = 0,029).
Při porovnání vývoje dalších potransplantačních parametrů (tab. 3) měli pacienti s hepatogenním DM oproti pacientům s klasickým T2DM nižší lačné glykemie (6M, 1R a 2R po LT), nižší HbA1c (1R a 2R po LT), nižší BMI (1R po LT), nižší výskyt metabolického syndromu (6M, 1R a 2R po LT) a nižší hodnoty tuhosti jater dle shear wave elastografie 6M po LT. Mezi skupinami jsme nenalezli významné rozdíly v HOMA-IR, v objemu jaterního tuku dle 1H MRS a v hodnotách tuhosti jater 1 a 2 roky po LT.
Po LT měli pacienti s hepatogenním DM oproti pacientům bez DM vyšší výskyt metabolického syndromu (2R po LT), vyšší HbA1c (6M po LT) a nižší hodnoty tuhosti jater dle shear wave elastografie 6M po LT, ostatní parametry se mezi skupinami nelišily včetně HOMA IR, objemu jaterního tuku dle 1H MRS a hodnot tuhosti jater dle shear wave elastografie 1 a 2 roky po LT.
Z pacientů, kteří podstoupili LT, bylo naživu 92 pacientů 3 roky po LT a 83 pacientů 5 let po LT, přežívání se mezi skupinami nelišilo (tab. 3).
Diskuze
V naší prospektivně sledované kohortě kandidátů transplantace jater (LT) jsme zjistili vysokou (23 %) prevalenci hepatogenního DM, který byl oproti klasickému T2DM spojen s nižším BMI, nižšími hodnotami lačné glykemie a glykovaného hemoglobinu. Potransplantační vývoj DM byl u většiny pacientů s hepatogenním DM na rozdíl od klasického T2DM příznivý, nicméně přibližně u jedné čtvrtiny pacientů byla i 2 roky po LT nutná inzulinoterapie, což bylo významně častěji než u pacientů bez DM před LT.
Vysoká celková prevalence DM (44,3 %) u našich pacientů na WL k LT je v souladu s daty z literatury, která uvádějí výskyt DM u 20 až 70 % pacientů s cirhózou v závislosti na stadiu a etiologii jaterního onemocnění [1]. Vysoká prevalence DM je typická zejména pro pacienty s nealkoholovou steatohepatitidou (NASH) [17]. Přítomnost T2DM zvyšuje riziko progrese fibrózy u NAFLD [18,19] a virových hepatitid B [20] a C [21].
Vysoká prevalence hepatogenního DM v naší kohortě (23 %) odpovídá údajům z literatury. Dvě studie u pacientů s cirhózou bez předchozí anamnézy DM udávají ještě vyšší prevalenci hepatogenního DM 48,6 % [1] a 55,4 % [8]. V obou těchto studiích [1,8] byl k diagnostice DM podobně jako v naší práci použit OGTT vzhledem k často normálním hodnotám lačné glykemie u těchto pacientů. Přechod z poruchy glukózové tolerance do DM je primárně způsoben progredující dysfunkcí β-buněk. Sekrece inzulinu se zhoršuje spolu s tíží jaterního onemocnění, což svědčí pro významný vliv jaterního selhání na funkci pankreatických ostrůvků [1].
Pacienti s hepatogenním DM měli v naší studii oproti pacientům s T2DM nižší BMI, nižší lačnou glykemii a glykovaný hemoglobin, což odpovídá i výsledkům dalších prací [1,9]. Mezi skupinami jsme neprokázali rozdíly v pokročilosti jaterního onemocnění hodnocené pomocí Child-Pugh nebo MELD skóre. Literární data o odlišnostech T2DM a hepatogenního DM u pacientů s cirhózou jsou velmi omezená, řada odborných společností a autorů navíc tyto dvě kategorie DM u cirhózy nerozlišuje [22,23]. V jedné studii měli pacienti s hepatogenním DM vyšší lačné inzulinemie a HOMA-IR než pacienti s T2DM [12]. V naší práci jsme naopak pozorovali trend k vyšším hodnotám lačné inzulinemie a HOMA-IR u pacientů s T2DM. Inzulinová rezistence je hlavním patofyziologickým mechanizmem T2DM. Na patofyziologii hepatogenního DM se kromě svalové inzulinové rezistence významně podílí i neschopnost β-buněk pankreatu dostatečně vylučovat inzulin, čímž by bylo možné za normálních okolností nahradit defekt v účinnosti inzulinu [6]. Kromě častějšího výskytu metabolického syndromu před LT jsme nenalezli žádné další významné rozdíly mezi pacienty s hepatogenním DM a pacienty bez DM.
Z pacientů bez DM před LT byl u 13 (19,1 %) zjištěn de novo DM po LT. De novo DM po LT je častou komplikací LT, jeho rozvoj byl popsán až u 30 % příjemců LT. Na jeho vzniku se významně podílí léčba CNI, která má negativní vliv na sekreci inzulinu [15,24].
Z naší práce vyplývají významné rozdíly v potransplantačním vývoji DM u pacientů s T2DM a hepatogenním DM. Zatímco ve skupině s T2DM byla u většiny pacientů po LT nutná inzulinoterapie (76,2 % 1M po LT; 76,2 % 6M po LT; 75,0 % 1R po LT a 66,7 % 2R po LT), u pacientů s hepatogenním DM byla potransplantační inzulinoterapie podstatně méně častá (32,0 % 1M po LT; 20,0 % 6M po LT; 20,0 % 1R po LT a 23,8 % 2R po LT), rozdíly mezi skupinami byly významné ve všech sledovaných obdobích. Naše výsledky svědčí pro příznivý potransplantační průběh hepatogenního DM u většiny pacientů v důsledku obnovy jaterní funkce úspěšnou transplantací jater. To odpovídá literárním údajům, která uvádějí vyléčení hepatogenního DM po LT u 67 % pacientů [13,25]. U třetiny pacientů s hepatogenním DM z naší kohorty DM přetrvával i 2 roky po LT, což potvrzuje i jiná studie [25], která tuto skutečnost vysvětluje přetrvávající poruchou funkce β-buněk.
Přítomnost a typ DM před LT neměly v naší práci vliv na přežívání 3 a 5 let po LT. Podobně i v jiné práci zahrnující 2 209 příjemců LT neměla přítomnost DM před LT vliv na přežívání pacientů 1 až 20 let po LT [26]. Zatímco řada studií uvádí, že přítomnost DM je nezávislým faktorem nepříznivé prognózy u pacientů s cirhózou [5–8], po úspěšné LT již negativní vliv DM na prognózu pacientů nemusí být jednoznačný. Doba sledování v naší práci však mohla být příliš krátká k posouzení vlivu DM na mortalitu.
Nález hepatogenního DM na základě patologických hodnot OGTT nevedl u našich pacientů k zahájení terapie antidiabetiky před LT zejména z důvodu již nízkých hodnot lačné glykemie a obav z polékové hypoglykemie nebo toxicity. Problematika indikace a typu vhodné farmakoterapie DM u pacientů se současnou cirhózou je velmi obtížná. Žádné klinické studie necílily na skupinu pacientů se současným DM a cirhózou [7]. Terapii DM u pacientů s cirhózou a jaterním selháním se nevěnuje recentní doporučení Evropské společnosti pro studium diabetu (EASD) a Americké společnosti pro diabetes (ADA) týkající se léčby hyperglykemie u pacientů s T2DM [27] ani doporučení Evropské společnosti pro studium jater (EASL) týkající se léčby dekompenzované cirhózy [28] nebo transplantace jater [29]. Dříve převládal názor, že inzulin by měl být v přítomnosti těžké dysfunkce jater lékem volby. To již nemusí platit v éře nových antidiabetik, která mohou zajistit adekvátní kontrolu glykemie bez současného rizika hypoglykemie. U pacientů s cirhózou lze ponechat terapii metforminem s výjimkou poruchy renální funkce nebo stavů dehydratace nebo tkáňové hypoxie. U pacientů s cirhózou jsou pravděpodobně bezpečné inhibitory dipeptidyl peptidázy-4 (gliptiny) s výjimkou vildagliptinu. Vhodnou terapií může být i terapie agonisty GLP-1 receptoru (GLP-1RA), které však pro častou nauzeu nemusí být vhodné pro pacienty se špatným stavem výživy. U pokročilého jaterního onemocnění by se terapie inzulinem měla co nejdéle odkládat, alternativou může být i kombinovaná terapie bazálním inzulinem a GLP-1RA [17]. Nové klinické studie hodnotící léčbu DM u této specifické populace jsou více než žádoucí.
Domníváme se, že by vzhledem k vysoké prevalenci DM u kandidátů LT mělo být OGTT vyšetření standardní součástí předtransplantačního vyšetření, byť vzhledem k absenci doporučení není zcela jasné, zda a jakým způsobem léčit typicky vysoké postprandiální glykemie při současných nízkých lačných glykemiích typických pro pacienty s hepatogenním DM. Spolupráce se zkušeným diabetologem je zde nezbytná.
Hepatogení diabetes není samostatnou nozologickou jednotkou a tento pojem není v aktuálních doporučeních zmiňován [27,30], nicméně existence DM jako přímého následku ztráty jaterní funkce je v odborné literatuře dobře popsaná [1,25]. Prevalence hepatogenního DM v naší studii mohla být podhodnocena vzhledem k tomu, že do skupiny s hepatogenním DM byli zařazeni pouze pacienti bez předchozí anamnézy DM, u kterých byl DM diagnostikován až na základě patologických hodnot OGTT testu v průběhu předtransplantačního vyšetření. Pacienti s DM známým již několik let, byť se mohl vyvinout až po rozvoji cirhózy, byli zařazeni do skupiny s klasickým T2DM. Naopak u části pacientů ze skupiny s hepatogenním DM se mohlo jednak o dříve nepoznaný T2DM, pro což by mohla svědčit i skutečnost, že ne u všech pacientů došlo k vymizení hepatogenního DM po LT i při dobré funkci jaterního štěpu.
Závěr
Hepatogenní DM je u kandidátů LT častý (23,0 %), oproti klasickému T2DM je spojen s nižším BMI a nižšími hodnotami lačné glykemie a glykovaného hemoglobinu. U většiny pacientů po LT hepatogenní DM na rozdíl od T2DM regreduje, což svědčí pro odlišnosti v jejich patofyziologii, především ve vazbě hepatogenního diabetu na přítomnost poruchy jaterní funkce. Doporučení pro léčbu DM u pacientů se současnou cirhózou a jaterní dysfunkcí nejsou k dispozici, kromě inzulinu je pravděpodobně možné v terapii využít metformin nebo některá nová antidiabetika, což však vyžaduje další hodnocení v klinických studiích.
ORCID autorů
I. Míková ORCID 0000-0001-7928-7558,
D. Kyselová ORCID 0000-0001-6652-653X,
M. Dezortová ORCID 0000-0003-0194-1200,
M. Hájek ORCID 0000-0003-4704-6164,
V. Lánská ORCID 0000-0002-2832-5689,
J. Špičák ORCID 0000-0002-3823-2881,
P. Trunečka ORCID 0000-0002-4753-4419.
Doručeno/Submitted: 27. 7. 2023
Přijato/Accepted: 1. 8. 2023
MUDr. Mgr. Irena Míková, Ph.D.
Klinika hepatogastroenterologie
Institut klinické a experimentální medicíny
Vídeňská 1958/9
140 21 Praha 4
irena.mikova@ikem.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Grancini V, Trombetta M, Lunati ME et al. Contribution of ß-cell dysfunction and insulin resistance to cirrhosis-associated diabetes: Role of severity of liver disease. J Hepatol 2015; 63(6): 1484–1490. doi: 10.1016/j.jhep.2015.08.011.
2. Wlazlo N, Beijers HJBH, Schoon EJ et al. High prevalence of diabetes mellitus in patients with liver cirrhosis. Diabet Med 2010; 27(11): 1308–1311. doi: 10.1111/j.1464-5491.2010.03093.x.
3. Hosseini Z, Whiting SJ, Vatanparast H. Type 2 diabetes prevalence among Canadian adults – dietary habits and sociodemographic risk factors. Appl Physiol Nutr Metab 2019; 44(10): 1099–1104. doi: 10.1139/apnm-2018-0567.
4. Lee WG, Wells CI, McCall JL et al. Prevalence of diabetes in liver cirrhosis: A systematic review and meta-analysis. Diabetes Metab Res Rev 2019; 35(6): e3157. doi: 10.1002/dmrr.3157.
5. Nishida T, Tsuji S, Tsujii M et al. Oral glucose tolerance test predicts prognosis of patients with liver cirrhosis. Am J Gastroenterol 2006; 101(1): 70–75. doi: 10.1111/j.1572-0241.2005.00307.x.
6. Garcia-Compean D, Jaquez-Quintana JO, Gonzalez-Gonzalez JA et al. Liver cirrhosis and diabetes: risk factors, pathophysiology, clinical implications and management. World J Gastroenterol 2009; 15(3): 280–288. doi: 10.3748/wjg.15.280.
7. Elkrief L, Rautou P-E, Sarin S et al. Diabetes mellitus in patients with cirrhosis: clinical implications and management. Liver Int 2016; 36(7): 936–948. doi: 10.1111/liv.13115.
8. Jeon HK, Kim MY, Baik SK et al. Hepatogenous diabetes in cirrhosis is related to portal pressure and variceal hemorrhage. Dig Dis Sci 2013; 58(11): 3335–3341. doi: 10.1007/s10 620-013-2802-y.
9. Holstein A, Hinze S, Thiessen E et al. Clinical implications of hepatogenous diabetes in liver cirrhosis. J Gastroenterol Hepatol 2002; 17(6): 677–681. doi: 10.1046/j.1440-1746.2002.02755.x.
10. Kuriyama S, Miwa Y, Fukushima H et al. Prevalence of diabetes and incidence of angiopathy in patients with chronic viral liver disease. J Clin Biochem Nutr 2007; 40(2): 116–122. doi: 10.3164/jcbn.40.116.
11. Imano E, Kanda T, Nakatani Y et al. Impaired splanchnic and peripheral glucose uptake in liver cirrhosis. J Hepatol 1999; 31(3): 469–473. doi: 10.1016/s0168-8278(99)80039-7.
12. Kim MG, Choi WC. Differential diagnosis of diabetes mellitus caused by liver cirrhosis and other type 2 diabetes mellitus. Korean J Hepatol 2006; 12(4): 524–529.
13. Merli M, Leonetti F, Riggio O et al. Glucose intolerance and insulin resistance in cirrhosis are normalized after liver transplantation. Hepatology 1999; 30(3): 649–654. doi: 10.1002/hep.510300306.
14. Grancini V, Trombetta M, Lunati ME et al. Central role of the ß-cell in driving regression of diabetes after liver transplantation in cirrhotic patients. J Hepatol 2019; 70(5): 954–962. doi: 10.1016/j.jhep.2019.01.015.
15. Pelaez-Jaramillo MJ, Cardenas-Mojica AA, Gaete P V et al. Post-Liver Transplantation Diabetes Mellitus: A Review of Relevance and Approach to Treatment. Diabetes Ther 2018; 9(2): 521–543. doi: 10.1007/s13300-018-03 74-8.
16. Muniyappa R, Lee S, Chen H, Quon MJ. Current approaches for assessing insulin sensitivity and resistance in vivo: advantages, limitations, and appropriate usage. Am J Physiol Endocrinol Metab 2008; 294(1): E15–E26. doi: 10.1152/ajpendo.00645.2007.
17. Brodosi L, Petta S, Petroni ML et al. Management of Diabetes in Candidates for Liver Transplantation and in Transplant Recipients. Transplantation 2022; 106(3): 462–478. doi: 10.1097/TP.0000000000003867.
18. McPherson S, Hardy T, Henderson E et al. Evidence of NAFLD progression from steatosis to fibrosing-steatohepatitis using paired biopsies: Implications for prognosis and clinical management. J Hepatol 2015; 62(5): 1148–1155. doi: 10.1016/j.jhep.2014.11.034.
19. Huang DQ, Wilson LA, Behling C et al. Fibrosis Progression Rate in Biopsy-Proven Nonalcoholic Fatty Liver Disease Among People With Diabetes Versus People Without Diabetes: A Multicenter Study. Gastroenterology 2023; 165(2): 463–472. doi: 10.1053/j.gastro.2023.04.025.
20. Huang YW, Wang TC, Lin SC et al. Increased risk of cirrhosis and its decompensation in chronic hepatitis B patients with newly diagnosed diabetes: a nationwide cohort study. Clin Infect Dis 2013; 57(12): 1695–1702. doi: 10.1093/ cid/cit603.
21. Huang YW, Yang SS, Fu SC et al. Increased risk of cirrhosis and its decompensation in chronic hepatitis C patients with new-onset diabetes: a nationwide cohort study. Hepatology 2014; 60(3): 807–814. doi: 10.1002/hep.27 212.
22. Kumar R, García-Compeán D, Maji T. Hepatogenous diabetes: Knowledge, evidence, and skepticism. World J Hepatol 2022; 14(7): 1291–1306. doi: 10.4254/wjh.v14.i7.1291.
23. Orsi E, Grancini V, Menini S, et al. Hepatogenous diabetes: Is it time to separate it from type 2 diabetes? Liver Int 2017; 37(7): 950–962. doi: 10.1111/liv.13337.
24. Andrade AR, Bittencourt PL, Codes L et al. New Onset Diabetes and Non-Alcoholic Fatty Liver Disease after Liver Transplantation. Ann Hepatol 2017; 16(6): 932–940. doi: 10.5604/01. 3001.0010.5285.
25. Perseghin G, Mazzaferro V, Sereni LP et al. Contribution of reduced insulin sensitivity and secretion to the pathogenesis of hepatogenous diabetes: effect of liver transplantation. Hepatology 2000; 31(3): 694–703. doi: 10.1002/ hep.510310320.
26. Aravinthan AD, Fateen W, Doyle AC et al. The Impact of Preexisting and Post-transplant Diabetes Mellitus on Outcomes Following Liver Transplantation. Transplantation 2019; 103(12): 2523–2530. doi: 10.1097/TP.0000000000002757.
27. Davies MJ, Aroda VR, Collins BS et al. Management of hyperglycaemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 2022; 65(12): 1925–1966. doi: 10.1007/s00125-022-05787-2.
28. EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol 2018; 69(2): 406–460. doi: 10.1016/j.jhep.2018.03.024.
29. EASL Clinical Practice Guidelines: Liver transplantation. J Hepatol 2016; 64(2): 433–485. doi: 10.1016/j.jhep.2015.10.006.
30. Rydén L, Grant PJ, Anker SD et al. ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD: the Task Force on diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and developed in collaboration with the European Association for the Study of Diabetes (EASD). Eur Heart J 2013; 34(39): 3035–3087. doi: 10.1093/eurheartj/eht108.