Fekální mikrobiální transplantace u idiopatických střevních zánětů
Jan Březina1, Lukáš Bajer Orcid.org 1, Julius Špičák Orcid.org 1, Pavel Drastich Orcid.org 1
+ Pracoviště
Souhrn
Etiopatogeneze idiopatických střevních zánětů (IBD) není dosud plně objasněna. Jednu z teorií vzniku IBD představuje neadekvátní reakce slizniční imunity na některé složky střevního mikrobiomu. Možným terapeutickým přístupem, jak změnit složení mikrobiomu, a tím potažmo i ovlivnit průběh IBD, je užití fekální mikrobiální transplantace (FMT). FMT je léčebná metoda spočívající v přenosu stolice od zdravého dárce pacientovi, čímž dochází k obnovení mikrobiální homeostázy střeva po různě dlouhou dobu. FMT je vysoce efektivní v léčbě rekurentní klostridiové kolitidy a v této indikaci se jedná o standardní, klinicky využitelnou metodu. V případě IBD se jedná o experimentální metodu užívanou pouze v klinických studiích. V nejnovějším systematickém přehledu FMT je u ulcerózní kolitidy popisován výrazně variabilní efekt FMT v dosažení remise i klinické odpovědi. Recentně byly publikovány dvě randomizované kontrolované studie, které nepřináší jasné důkazy o účinnosti FMT u nemocných s ulcerózní kolitidou. Nicméně studie u ulcerózní kolitidy naznačují příznivý efekt závislý na vhodném výběru dárce s bohatým a dostatečně diverzifikovaným mikrobiomem, na způsobu aplikace a frekvenci FMT. Data u Crohnovy choroby jsou nedostatečná, zdá se však, že FMT má v této indikaci minimální efekt. FMT je bezpečná metoda s minimem nežádoucích účinků při zachování striktních kritérií vyšetření dárců. Dosavadní studie ukazují jen mírný efekt FMT u ulcerózní kolitidy, nicméně se jedná o slibnou a bezpečnou metodu. Bude třeba dalších dobře navržených studií na dostatečném počtu pacientů k objasnění otázek efektivity, míry navození remise, nutného počtu FMT k navození remise, dlouhodobé bezpečnosti a vhodného způsobu podání FMT.
Klíčová slova
Crohnova choroba, fekální bakteriální transplantace, idiopatické střevní záněty, klostridiová kolitida, mikrobiom, ulcerózní kolitidaÚvod
Lidský mikrobiom obsahuje 10× více buněk, než naše vlastní lidské tělo. Největší zastoupení má v gastrointestinálním traktu, a to jak celkovým počtem, tak i počtem druhů bakterií, který může dosahovat až 40 000 [1], z nichž většinu nejsme zatím schopni ani kultivovat. Nedávné metagenetické analýzy stanovily katalog genů lidské mikrobioty s celkovým počtem 3,3 mil. jedinečných genů, což je přibližně 150× více, než z kolika se skládá lidský genom [2]. Střevní mikrobiota funguje jako samostatný orgán lidského těla. Ovlivňuje štěpení a vstřebávání živin, bariérovou funkci střevní sliznice, metabolizmus, imunitní systém hostitele, produkuje vitamin K, biotin a mastné kyseliny s krátkým řetězcem. Vztah zdravé mikrobioty a hostitele představuje symbiózu. Změny mikrobioty mohou vést k narušení této symbiózy, a tím ke vzniku některých onemocnění. Tento patofyziologický mechanizmus lze popsat na klostridiové kolitidě, ale mezi choroby se vztahem ke střevnímu mikrobiomu patří i idiopatické střevní záněty (IBD), syndrom dráždivého tračníku, jaterní encefalopatie, diabetes 2. typu, metabolický syndrom, nealkoholická steatohepatitida, obezita, ateroskleróza, idiopatická trombocytopenická purpura, roztroušená skleróza, alergie, autizmus a další.
Fekální mikrobiální transplantace (FMT) je léčebná metoda spočívající v přenosu stolice od zdravého dárce pacientovi. Lze jí obnovit mikrobiální homeostázu střeva, a ovlivnit tak výše zmíněná onemocnění. První zmínky o FMT se datují 2 000 let nazpět do staré Číny, kdy Ge Hong popisuje léčbu průjmů a otravy jídlem pomocí FMT [3]. První článek v odborné literatuře o úspěšném použití FMT k léčbě pseudomembranózní kolitidy byl publikován v roce 1958 Eisemanem et al [4]. Od té doby byla publikována řada případů i studií naznačující účinnost FMT v léčbě některých onemocnění. FMT je vysoce efektivní v léčbě rekurentní pseudomembranózní kolitidy. V této indikaci se jedná o standardní, klinicky využitelnou metodu. Principem léčby je napravení „ekologické katastrofy“ způsobené většinou použitím antibiotik s následným přemnožením kmene Clostridium difficile. Proto není překvapivé, že i jednorázové či dvojnásobné podání FMT vede k vysoké frekvenci vyléčení (81–94 %). Ostatní uvedené indikace, vč. IBD, jsou experimentální a jsou předmětem pouze klinických studií.
Vztah mikrobiomu a IBD není natolik objasněn jako u klostridiové kolitidy. I přes intenzivní výzkum není stále uspokojivě vysvětlena přesná etiopatogeneze IBD, nicméně jednou z teorií vzniku IBD je neadekvátní reakce imunitního systému na některé součásti střevního mikrobiomu. Tato souvislost byla doložena studiemi na zvířecích modelech, kdy absence mikrobiomu u geneticky predisponovaných myší zabránila rozvoji IBD. Je prokázáno, že u pacientů s IBD dochází ke snížení diverzity druhů i změnám zastoupení střevní mikroflóry, je však otázkou, zda se jedná o příčinu, nebo následek. Ke zvrácení tohoto stavu, a tím i k potenciální léčbě IBD, se nabízí použití FMT.
Metodologie FMT
Příprava a uchovávání FMT
Zatím nebyl stanoven standardní protokol přípravy FMT. V publikovaných studiích jsou velké rozdíly ve zpracování stolice, použitých rozpouštědlech i způsobu homogenizace a filtrace materiálu. Malý počet subjektů i nedostatek kontrol v těchto studiích znesnadňují vyvození jednoznačných závěrů. Přestože každé pracoviště provádí FMT svým vlastním a často originálním způsobem, lze popsat všeobecně přijímaný základní algoritmus provedení. Nejčastěji se rozpouští 50 g čerstvé stolice ve fyziologickém roztoku o dostatečném objemu (150–500 ml). Jako rozpouštědlo užívají některá pracoviště i vodu nebo mléko. K dokonalému promísení lze užít běžný kuchyňský mixér či tekutinu homogenizovat na způsob shakeování. Takto vzniklý roztok se dvakrát přefiltruje přes obyčejnou sterilní gázu (obr. 1) k odstranění větších zbytků stolice [5]. Výsledný produkt, fekální transplantát (obr. 2), se nejčastěji užívá čerstvý nebo ho lze uchovat hluboce zmražený s glycerolem či lyofilizací k pozdějšímu použití.
V dostupných studiích FMT u klostridiové kolitidy měla voda jako rozpouštědlo vyšší míru vyléčení než fyziologický roztok (98,5 vs. 86 %), avšak relaps onemocnění byl popisován 2× vyšší. Zvyšující se objem FMT vedl k mírně vyšší úspěšnosti léčby za předpokladu dostatečného množství rozpuštěné stolice (hmotnost < 50 g zapříčinila 4× častěji relaps onemocnění) [6]. Hamilton et al prokázali stejnou účinnost zmražené FMT jako čerstvé FMT v léčbě klostridiové kolitidy [7]. Po 12 týdnech zmražení FMT na –80 °C byla pozorována viabilita 80 % bakterií. Pokud bude tato skutečnost prokázána i u ostatních onemocnění, povede k podstatně praktičtějšímu způsobu distribuce a zvýšení dostupnosti FMT v podobě fekálních dárcovských bank, které budou shromažďovat zmraženou či lyofilizovanou stolici od kvalitních dárců. Dalším logickým krokem je příprava kapslí s lyofilizovaným či speciálně emulgovaným fekálním obsahem. K zajištění přesunu adekvátní kvantity mikrobimu bude však nutno aplikovat najednou velké množství kapslí (až 30).
Výběr a vyšetření dárce
Výběr dárce představuje zásadní aspekt úspěšné FMT. Je důležitý jak z hlediska bezpečnosti, tak efektivity FMT. Dárci stolice pro léčbu klostridiové kolitidy jsou obvykle vybírání z příbuzných, partnerů, přátel nebo zdravých dobrovolníků. U jiných indikací (např. autoimunitních) může být příbuzenský vztah na škodu. Každý typ dárce má své výhody i nevýhody. U příbuzných a partnerů může být menší riziko přenosu infekčních nemocí. Na druhou stranu nepříbuzní mají vzhledem k rozdílnému genetickému pozadí a prostředí větší šanci signifikantně změnit mikrobiom příjemce. Největším rizikem FMT je přenos infekce, proto musí být dárci pečlivě vyšetřeni. Potenciální dárci stolice by měli být dotázáni na cestovní historii, sexuální chování, předchozí operace, krevní transfuze a další faktory, které zvyšují riziko přenosných chorob. Dále bychom se měli ptát na výskyt autoimunitních, nádorových a metabolických onemocnění u příbuzných prvního a druhého stupně. Dárci, kteří recentně užívali antibiotika či inhibitory protonové pumpy ovlivňující složení mikrobioty, by měli být vyloučeni. Dalším krokem je podrobné vyšetření vzorků krve a stolice (tab. 1). V systematickém přehledu 317 pacientů s recidivující klostridiovou kolitidou Gough et al popisují mírně vyšší úspěšnost léčby u pacientů léčených FMT od příbuzných dárců (93 %) než od nepříbuzných dárců (84 %). Tento jev nebyl pozorován u jiných chorob. Dále nebyl zaznamenán signifikantní rozdíl u dárců stejného a opačného pohlaví [6]. Zdá se, že profil mikrobiomu dárce u klostridiové kolitidy není důležitý. Dostupná data u ulcerózní kolitidy (UC) však naznačují vyšší úspěšnost léčby při použití stolice od dárce s větší diverzitou střevní mikrobioty. Tato pozorování bude nutné ověřit dalšími dobře navrženými studiemi, nicméně volba ideálního dárce s adekvátním mikrobiomem bude do budoucna jistě stěžejní. U ostatních potenciálních indikací nejsou k výběru dárce v současné době dostupná data.
Způsob podání a příprava příjemce
FMT lze podat nazogastrickou sondou, nazojejunální sondou, při gastroskopii, koloskopii, klyzmatem a perorálně v kapsli. Dostupné studie FMT u klostridiové kolitidy neukazují signifikantní rozdíl mezi podáním nazogastrickou či nazojejunální sondou a koloskopickým podáním [5,6,8–10]. V případě podání FMT nazogastrickou či nazojejunální sondou někteří autoři podávají inhibitory protonové pumpy ke snížení kyselosti žaludečního obsahu, což vede ke zvýšení přežívání dárcovského mikrobiomu. Při nazogastrickém a nazojejunálním podání klesá počet aplikovaných bakterií i o několik řádů, i přesto však přežívá dostatečné množství bakterií k navození potřebného efektu FMT. Nazogastrické podání skýtá riziko aspirace a následného rozvoje purulentní bronchopneumonie, pročež je tato metoda v současnosti opouštěna. Podání za Treitzovu řasu při gastroskopii či pomocí nazojejunální sondy toto riziko eliminuje, je však pro pacienty značně nepohodlné a z dlouhodobého hlediska nepoužitelné. Při koloskopickém podání je pacient připraven osmotickým laxativem, což může napomáhat odstranit stávající mikroflóru a usnadnit tím kolonizaci střeva dárcovským mikrobiomem. FMT je možné při výkonu podat sprejováním do celého tlustého střeva, vzhledem k neúnosnosti častého opakování koloskopie je toto podání vhodné zejména pro klostridiovou kolitidu a první podání FMT v případě IBD. Pro opakované podávání se zdá být vhodné klyzma, k jehož delšímu udržení lze použít loperamid. V období těsně předcházejícím FMT někteří autoři podávají k potlačení mikrobiomu příjemce antibiotika, zejména v léčbě klostridiové kolitidy [11]. Tyto postupy však nejsou ověřeny randomizovanými studiemi a každé centrum si vytváří svůj vlastní protokol.
V roce 2014 publikovali Yougnster et al pilotní práci s FMT v podobě perorálních kapslí k léčbě recidivující klostridiové kolitidy se 70% účinností po prvním podání 15 kapslí a 90% efektivitou po druhém podání stejného počtu kapslí [12]. U ostatních nemocí potenciálně léčitelných FMT není dostatek evidence k vyvození závěrů o účinnosti jednotlivých druhů podání. O způsobu léčby tak rozhoduje zejména anatomická lokalizace daného onemocnění. V případě IBD se zdá nejvhodnějším způsobem jednorázové podání koloskopické a formou klyzmatu.
Komplikace
FMT je při dodržení přísných podmínek vyšetření dárce a vhodné indikaci považována za bezpečnou metodu. V Goughově systematickém přehledu 317 pacientů s recidivující klostridiovou kolitidou byl výskyt nežádoucích účinků 2,5% za dodržení všech pravidel vyšetření dárce [6]. Vzhledem k několika případům aspirace při nazogastrickém podání se od něj většina autorů v současnosti odklání a preferují nazojejunální sondu, případně gastroskopické podání za Treitzovu řasu. Většina pacientů léčená FMT popisuje přechodný průjem nebo zácpu, méně často bolesti a křeče břicha. U IBD pacientů jsou častěji zaznamenávány horečky a krátkodobá elevace zánětlivých parametrů, což nejspíše souvisí s porušenou bariérovou funkcí střevní sliznice. Jak již bylo zmíněno výše, obávaným nežádoucím účinkem FMT je přenos infekčních nemocí. V dostupné literatuře k tomu došlo pouze ve dvou případech, kdy se jednalo o norovirovou enteritidu [13]. Dlouhodobá follow-up studie Brandta et al naznačuje vysokou bezpečnost FMT [14]. Další takové studie budou potřeba k zjištění souvislosti FMT se vznikem pozdních infekcí, zánětů a nádorových onemocnění.
Idiopatické střevní záněty
Jedná se o chronická rekurující zánětlivá onemocnění trávicího traktu provázená průjmy a bolestí břicha. Mezi IBD patří především Crohnova choroba (CD) a UC. I přes intenzivní výzkum není stále uspokojivě objasněna přesná etiopatogeneze těchto onemocnění. Jednou z teorií vzniku IBD je neadekvátní reakce imunitního systému na některé složky střevní mikrobiální flóry u geneticky predisponovaných jedinců [15,16]. Tato souvislost byla dokázána studiemi na zvířecích modelech. Je prokázáno, že u pacientů s IBD dochází ke snížení diverzity druhů i změnám zastoupení střevní mikroflóry. Zejména je přítomna redukce kmene Fermicutes se snížením rodů bifidobacteria a lactobacilus. Fermicutes jsou hlavní producenti mastných kyselin s krátkým řetězcem, mezi něž patří i butyrát, který má imunoregulační vlastnosti [17]. Některé studie prokazují účinnost butyrátových klyzmat v léčbě refrakterních IBD [18,19].
Léčba IBD v posledních desetiletích zaznamenala výrazný rozvoj. K již dlouhodobě užívaným skupinám léků, mezi něž patří steroidy, aminosalicyláty a imunosupresiva, přibyla biologická léčba (BL). Přesto část pacientů na léčbu nereaguje a někteří mají významné nežádoucí účinky plynoucí z užívané terapie. I přes zavedení BL nedosahuje kvalita života mnohých pacientů požadované úrovně [20]. Jeden z dalších možných terapeutických postupů, jak ovlivnit IBD, představuje FMT. Principem účinku FMT u IBD je navození změny stávajícího mikrobiomu, což nejspíše vyžaduje opakované, a nelze vyloučit, že i dlouhodobé, podání FMT.
Ulcerózní kolitida
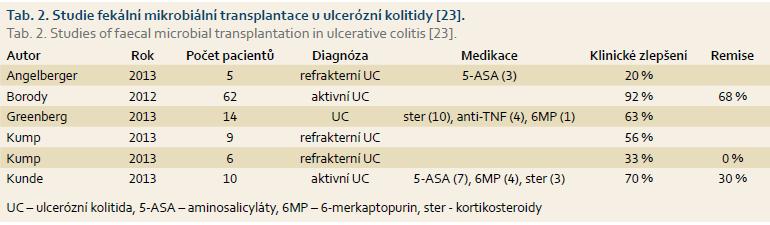
První publikovaný případ léčby UC pomocí FMT pochází z roku 1989 od Benneta et al. Samotný Bennet si léčil pomocí FMT svoji sedm let trvající UC, což vyústilo v jeho dlouhodobé klinické i histologické vyléčení [21]. V systematickém přehledu publikovaných případů z roku 2012 identifikují Anderson et al 18 pacientů s UC bez souběžně probíhající klostridiové kolitidy, kteří byli léčeni pomocí FMT. U 13 z 18 pacientů (72,2 %) došlo k navození remise s možností vysazení zbylých léků [22]. Tento systematický přehled ovšem zahrnuje pouze jednotlivé případy a série případů. Nejnovější systematický přehled FMT u UC z roku 2015 udává velmi variabilní dosažení remise 0–68 % u 106 pacientů v šesti studiích (tab. 2) [23]. Kritéria remise a klinické odpovědi však byla u každé studie odlišná. Výtečný výsledek 92% klinické odpovědi dosáhla studie Borodyho, jednalo se však o retrospektivní studii zatíženou možnou zaujatostí při výběru pacientů. Vermiere et al léčili osm pacientů s medikamentózně refrakterní UC pomocí FMT [24]. Primárního cíle endoskopické remise v osmém týdnu dosáhli dva z osmi pacientů. Při zhodnocení efektivity bylo zjištěno, že respondéři dostali FMT od dárce s bohatou a různorodou mikrobiotou.
V roce 2015 publikovali Moayyedi et al výsledky z první randomizované placebem kontrolované studie fekální bakteriální transplantace u aktivní UC. Pětasedmdesát pacientů s aktivní UC (Mayo skóre > 4) bylo randomizováno do dvou větví studie, první byla léčena 50ml klyzmatem FMT 1× týdně celkově šest týdnů, druhá skupina dostávala placebové klyzma. Studii dokončilo 70 pacientů (36 FMT a 34 placebo). Remise onemocnění dosáhlo v léčené skupině 9 z 36 pacientů (24 %), ve skupině s placebem 2 z 34 (5 %), což byl statisticky signifikantní rozdíl. Sedm z devíti pacientů, kteří dosáhli remise, obdrželo FMT od stejného dárce. Nebyl zaznamenán statisticky signifikantní rozdíl v nežádoucích účincích. Moayyediho studie zahrnovala velmi různorodou skupinu pacientů (48 % pacientů s pankolitidou, 37 % pacientů na léčbě steroidy, 23 % užívalo imunomodulátory a 9 % BL) a 50ml klyzma se zdá být poměrně malé k rozpuštění ideálního množství stolice (50–60 g). Dále lze vytknout zmražení fekálního transplantátu bez kryoprezervace a uchovávání FMT při pouhých –20 °C [25].
V další randomizované kontrolované studii FMT u UC publikované v roce 2015 Rossenovou et al randomizovali 50 pacientů do dvou větví léčených FMT od dárce a FMT vlastními exkrementy (hrající roli placeba) [26]. FMT byla podávána cestou nazojejunální sondy celkově dvakrát, a to 0. a 3. týden. Primární cíle studie byly klinická remise (definovaná jako Simple Clinical Colitis Activity Index (SCCAI) ≤ 2) a endoskopická odpověď (definovaná jako pokles endoskopického Mayo score nejméně o 1). Primárního cíle dosáhlo 7 z 23 pacientů léčených FMT od dárce a 5 z 25 pacientů léčených placebem. Studie neprokázala statisticky signifikantní rozdíl mezi FMT a placebem (p = 0,51). U pacientů reagujících na léčbu bylo ve 12. týdnu studie zjištěno podobné složení mikrobiomu jako u jejich dárců. U pacientů nereagujících nebyla tato změna pozorována. U studie Rossenové lze jako nedostatek shledat pouze dvě dávky FMT v průběhu celé studie a podání nazojejunální sondou, které snižuje přežívání podaných bakterií [26].
Závěry těchto dvou randomizovaných kontrolovaných studií jsou tedy rozporuplné. K vyvození jednoznačných závěrů bude potřeba dalších dobře designovaných studií na dostatečném vzorku pacientů. Z dosavadních dat lze konstatovat mírný až střední efekt FMT u UC a důležitost výběru vhodného dárce. Vzhledem k předpokládanému mechanizmu účinku formou mikrobiálního shiftu se jeví opakované a možná i dlouhodobé podání FMT s velkou výhodou.
Crohnova choroba
Data týkající se léčby CD pomocí FMT jsou velmi omezená. V Andersonově systematickém přehledu je popsáno šest pacientů s CD léčených FMT. Léčba vedla k navození remise v jednom případě (16,6 %) [22]. Gordon et al v roce 2014 publikovali případ pacienta s těžkou CD, který zareagoval na léčbu FMT [27]. K posouzení efektivity a bezpečnosti FMT u pacientů s CD je na www.clinicaltrials.gov registrováno několik studií.
Závěr
Fekální bakterioterapie přestavuje ideální metodu k ovlivnění složení mikrobiomu u střevních zánětlivých onemocnění. U klostridiové kolitidy prokázala svoji vysokou účinnost a zařadila se do standardních doporučených postupů pro rekurentní formu nemoci. Fekální bakterioterapie u UC v nejnovějším systematickém přehledu navozuje remisi a klinickou odpověď ve velmi variabilním rozsahu 0–68 %, resp. 20–90 %. Data k vyvozování závěrů u CD jsou velmi insuficientní, zdá se však, že v této indikaci má FMT minimální efekt.
FMT u pacientů s IBD byla obecně dobře tolerovaná, s minimálními nežádoucími účinky zahrnujícími bolesti břicha, febrilie a přechodný vzestup zánětlivých parametrů, což souvisí nejspíše s porušenou bariérovou funkcí střevní sliznice. Obávaný přenos infekčních nemocí nebyl v recentních studiích s dodržením protokolu vyšetření dárce zaznamenán.
S výjimkou dvou výše zmíněných randomizovaných studií jsou ostatní práce publikované na téma FMT u IBD série případů a nekontrolované, často retrospektivní studie s nízkou kvalitou provedení. Nelze proto vyvozovat jasné závěry stran efektivity FMT v této indikaci. V příštích několika letech lze očekávat větší množství kvalitních dat vzhledem k četným randomizovaným studiím registrovaným na www.clinicaltrials.gov (sedm studií na téma FMT u UC, dvě na téma FMT u CD, tři na téma FMT u IBD). Tyto studie mají za cíl zodpovědět otázky efektivity, míry navození remise, klinické odpovědi, nutného počtu transplantací k navození remise, dlouhodobé bezpečnosti a vhodného způsobu podání FMT. Dále mohou přispět k lepšímu porozumění vztahu mezi mikrobiomem, střevní sliznicí a hostitelem. I přes značnou kontroverzi a rozporuplné výsledky lze FMT považovat za slibnou metodu. Čas a zejména další studie odhalí, zda se jedná o progresivní účinnou metodu nebo jde o jednu ze slepých uliček medicíny.
Studie FACTU
Pod záštitou Pracovní skupiny pro IBD při České gastroenterologické společnosti ČLS JEP je připravena multicentrická, randomizovaná, kontrolovaná a prospektivní studie FACTU (Fekální bakterioterapie u levostranné UC). Ve studii jsou dvě větve o cca 25 pacientech, první bude léčena klyzmatem FMT a druhá standardním mesalazinovým klyzmatem. Mezi zařazovací kritéria patří levostranná kolitida > 15 cm trvající déle než tři měsíce, Mayo skóre 4–9 a endoskopické Mayo skóre ≥ 2. Délka studie je plánována na 12 týdnů. Podávání FMT je plánováno 10× u jednoho pacienta během prvních šesti týdnů studie. Primárním cílem studie je klinická remise definovaná jako Mayo skóre < 2 s žádným subscore > 1. Sekundárními cíli jsou endoskopická remise definovaná jako endoskopické Mayo skóre = 0 a klinická odpověď definovaná jako snížení Mayo skóre ≥ 2. Studie již získala veškerá nutná povolení ke svému zahájení. Její start je plánován na jaro 2016. V případě zájmu o zařazení pacienta do studie kontaktujte dr. Březinu na emailové adrese jan.brezina@ikem.cz.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Doručeno/Submitted: 15. 1.2016
Přijato/Accepted: 29. 1. 2016
MUDr. Jan Březina
Klinika hepatogastroenterologie
Transplantcentrum
IKEM
Vídeňská 1958/9
140 21 Praha 4
jan.brezina@ikem.cz



Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Frank DN, Pace NR. Gastrointestinal microbiology enters the metagenomics era. Curr Opin Gastroenterol 2008; 24 (1): 4–10.
2. Qin J, Li R, Raes J et al. A human gut microbial gene catalogue established by metagenomic sequencing. Nature 2010; 464 (7285): 59–65. doi: 10.1038/nature08821.
3. Zhang F, Luo W, Shi Y et al. Should we standardize the 1,700-year-old fecal microbiota transplantation? Am J Gastroenterol 2012; 107 (11): 1755. doi: 10.1038/ajg.2012.251.
4. Eiseman B, Silen W, Bascom GS et al. Fecal enema as an adjunct in the treatment of pseudomembranous enterocolitis. Surgery 1958; 44 (5): 854–859.
5. van Nood E, Vrieze A, Nieuwdorp M et al. Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med 2013; 368 (5): 407–415. doi: 10.1056/NEJMoa1205037.
6. Gough E, Shaikh H, Manges AR. Systematic review of intestinal microbiota transplantation (fecal bacteriotherapy) for recurrent Clostridium difficile infection. Clin Infect Dis 2011; 53 (10): 994–1002. doi: 10.1093/cid/cir632.
7. Hamilton MJ, Weingarden AR, Sadowsky MJ et al. Standardized frozen preparation for transplantation of fecal microbiota for recurrent Clostridium difficile infection. Am J Gastroenterol 2012; 107 (5): 761–767. doi: 10.1038/ajg.2011.482.
8. Postigo R, Kim JH. Colonoscopic versus nasogastric fecal transplantation for the treat- ment of Clostridium difficile infection: a review and pooled analysis. Infection 2012; 40 (6): 643–648. doi: 10.1007/s15010- 012-0307-9.
9. Persky SE, Brandt LJ. Treatment of recurrent Clostridium difficile-associated diarrhea by administration of donated stool directly through a colonoscope. Am J Gastroenterol 2000; 95 (11): 3283–3285.
10. Yoon SS, Brandt LJ. Treatment of refractory/recurrent C. difficile-associated disease by donated stool transplanted via colonoscopy: a case series of 12 patients. J Clin Gastroenterol 2010; 44 (8): 562–566. doi: 10.1097/MCG.0b013e3181dac035.
11. Angelberger S, Reinisch W, Makristathis A et al. Temporal bacterial community dynamics vary among ulcerative colitis patients after fecal microbiota transplantation. Am J Gastroenterol 2013; 108 (10): 1620–1630. doi: 10.1038/ajg.2013.257.
12. Youngster I, Russell GH, Pindar C et al. Oral, capsulized, frozen fecal microbiota transplantation for relapsing Clostridium difficile infection. Jama 2014; 312 (17): 1772–1778. doi: 10.1001/jama.2014.13875.
13. Schwartz M, Gluck M, Koon S. Norovirus gastroenteritis after fecal microbiota transplantation for treatment of Clostridium difficile infection despite asymptomatic donors and lack of sick contacts. Am J Gastroenterol 2013; 108 (8): 1367. doi: 10.1038/ajg.2013.164.
14. Brandt LJ, Aroniadis OC, Mellow M et al. Long-term follow-up of colonoscopic fecal microbiota transplant for recurrent Clostridium difficile infection. Am J Gastroenterol 2012; 107 (7): 1079–1087. doi: 10.1038/ajg.2012.60.
15. Nagalingam NA, Lynch SV. Role of the microbiota in inflammatory bowel diseases. Inflamm Bowel Dis 2012; 18 (5): 968–984. doi: 10.1002/ibd.21866.
16. DuPont AW, DuPont HL. The intestinal microbiota and chronic disorders of the gut. Nat Rev Gastroenterol Hepatol 2011; 8 (9): 523–531. doi: 10.1038/nrgastro.2011.133.
17. Sartor RB. Microbial influences in inflammatory bowel diseases. Gastroenterology 2008; 134 (2): 577–594. doi: 10.1053/j.gastro.2007.11.059.
18. Vernia P. Butyrate in the treatment of ulcerative colitis. Digest Liver Dis 2007; 1 (Suppl 1): 27–30. doi: 10.1016/S1594-5804 (08) 60008-X.
19. Hamer HM, Jonkers DM, Vanhoutvin SA et al. Effect of butyrate enemas on inflammation and antioxidant status in the colonic mucosa of patients with ulcerative colitis in remission. Clin Nutr 2010; 29 (6): 738–744. doi: 10.1016/j.clnu.2010.04.002.
20. Lix LM, Graff LA, Walker JR et al. Longitudinal study of quality of life and psychological functioning for active, fluctuating, and inactive disease patterns in inflammatory bowel disease. Inflamm Bowel Dis 2008; 14 (11): 1575–1584. doi: 10.1002/ibd.20511.
21. Bennet JD, Brinkman M. Treatment of ulcerative colitis by implantation of normal colonic flora. Lancet 1989; 1 (8630): 164.
22. Anderson JL, Edney RJ, Whelan K. Systematic review: faecal microbiota transplantation in the management of inflammatory bowel disease. Aliment Pharmacol Ther 2012; 36 (6): 503–516. doi: 10.1111/j.1365-2036.2012.05220.x.
23. Rossen NG, MacDonald JK, de Vries EM et al. Fecal microbiota transplantation as novel therapy in gastroenterology: a systematic review. World J Gastroenterol 2015; 21 (17): 5359–5371. doi: 10.3748/wjg.v21.i17.5359.
24. Vermeire S, Joossens M, Verbeke K et al. Donor species richness determines faecal microbiota transplantation success in inflammatory bowel disease. J Crohns Colitis 2015; jjv203. doi: 10.1093/ecco-jcc/jjv203.
25. Moayyedi P, Surette MG, Kim PT et al. Fecal microbiota transplantation induces remission in patients with active ulcerative colitis in a randomized controlled trial. Gastroenterology 2015; 149 (1): 102–109. doi: 10.1053/j.gastro.2015.04.001.
26. Rossen NG, Fuentes S, van der Spek MJ et al. Findings from a randomized controlled trial of fecal transplantation for patients with ulcerative colitis. Gastroenterology 2015; 149 (1): 110–118. doi: 10.1053/j.gastro.2015.03.045.
27. Gordon H, Harbord M. A patient with severe Crohn‘s colitis responds to Faecal Microbiota Transplantation. J Crohn Colitis 2014; 3 (8): 256–257. doi: 10.1016/j.crohns.2013.10.007.