EUS navigovaná drenáž žlučníku: vlastní soubor 66 pacientů za období 2016–2022 z Nemocnice Jablonec nad Nisou
Jiřina Pintová Orcid.org 1, Robert Procházka Orcid.org 1, Michael Man2, Vladimír Nosek Orcid.org 1
+ Pracoviště
Souhrn
Úvod: EUS navigovaná drenáž žlučníku představuje bezpečnou a efektivní endoskopickou metodu léčby u inoperabilních pacientů s těžkou akutní cholecystitidou s hrozícími komplikacemi. Dále je využívána jako záchranná technika pro pacienty s maligní biliární obstrukcí, u nichž selhala konvenční léčba pomocí ERCP nebo drenáže žlučovodu pod EUS kontrolou. Metodika: Cílem zpracování retrospektivního, konsekutivního souboru (listopad 2016 až prosinec 2022) bylo zhodnotit technickou a klinickou úspěšnost a počet periprocedurálních, časných a pozdních komplikací u EUS navigovaných drenáží žlučníku s použitím lumen-apozičního metalického stentu (LAMS) Hot AXIOS. Výsledky: Soubor zahrnuje 66 pacientů, z nich 43 s benigní a 23 s maligní diagnózou. Technická úspěšnost činila 98,5 %, klinická úspěšnost 98,5 %. Vyskytly se dvě periprocedurální komplikace (krvácení a malpozice stentu), dále dvě časné komplikace po výkonu (biliární peritonitida 2. den po drenáži a subhepatální absces 4. den po drenáži), časné komplikace činily 6 %. Pozdní komplikace byly zaznamenány jen nezávažné, a to 4krát částečně nebo úplně zanořený LAMS. V průběhu 12 měsíců se nevyskytla žádná recidiva cholecystitidy. Průměrná doba zavedení stentů z benigní indikace činila 327 dnů, u pacientů s maligní diagnózou 199 dnů. Závěr: Zhodnocením našeho souboru jsme potvrdili vysokou technickou a klinickou úspěšnost EUS navigovaných drenáží žlučníku pomocí stentů Hot AXIOS s nízkým procentem komplikací.
Klíčová slova
EUS navigovaná drenáž žlučníku, cholecystostomie, LAMS

Úvod
Akutní cholecystitida představuje závažnou komplikaci cholecystolitiázy. Její incidence stoupá s věkem. Zlatým standardem jejího řešení je chirurgická cholecystektomie.
U inoperabilních pacientů, ať již trvale z důvodu vysokého věku a komorbidit, nebo dočasně z důvodu aktuálního zdravotního stavu, je od 70. let 20. stol. standardně využívána k dekompresi žlučníku perkutánní drenáž. Perkutánní drenáž (PT-GBD – percutaneous transhepatic gallbladder drainage) je nejrozšířenější nechirurgickou metodou drenáže žlučníku. Vykazuje ale vyšší procento pozdních komplikací pro riziko dislokace nebo obturace drénu s nutností častějších redrenáží a rehospitalizací ve srovnání s endoskopickými metodami [1].
Nevýhody nekomfortní zevní drenáže eliminují endoskopické drenáže, transpapilární a EUS navigovaná. Transpapilární drenáž žlučníku (ETP-GBD – endoscopic transpapillary gallblader drainage) je prováděna cestou ERCP, většinou zároveň s řešenou choledocholitiázou nebo akutní cholangoitidou. Její technický a klinický úspěch je nižší vzhledem k možnosti obturace ductus cysticus kameny, strikturou nebo nádorovou masou [2]. Nezanedbatelné není ani riziko postERCP pankreatitidy. Transpapilární drenáž nedovoluje ani řešení reziduální cholecystolitiázy.
Moderní endoskopickou drenážní metodu představuje EUS navigovaná transmurální drenáž žlučníku (EUS-GBD – endoscopic ultrasound-guided gallbladder drainage). Vzhledem k přímému propojení žlučníku do duodena nebo žaludku je technická i klinická úspěšnost vyšší než u transpapilárního přístupu. Ve srovnání s perkutánní drenáží vykazuje významně méně pozdních komplikací.
Poprvé byla EUS navigovaná drenáž žlučníku provedena v roce 2007 [3]. K drenáži byly zpočátku používány plastové nebo plně potahované metalické biliární stenty, původně určené pro ERCP výkony. Použití těchto instrumentárií je technicky složitější a mohou také vykazovat více komplikací (FCSEMS – biliární leak při použití plastových stentů nebo riziko poranění protilehlé stěny žlučníku při použití plně potahovaných metalických biliárních stentů).
Výrazný posun ve využití EUS navigovaných metod byl v posledním desetiletí způsoben zavedením speciálně konstruovaných lumen apozičních metalických stentů do klinické praxe. Tyto stenty ve tvaru činky mají krátký krček (8, 10 nebo 15 mm), a nehrozí tím poranění protilehlé stěny žlučníku jako u FCSEMS. Šíře krčku stentu dosahující až 15 mm je odolná vůči obturaci kameny nebo jiným obsahem žlučníku. Silikonový potah na povrchu stentu brání vzniku biliárního leaku.
První generaci LAMS bylo ještě nutno zavádět vícekrokovou Seldingerovou metodou (pomocí punkční jehly, vodiče a cystotomu). Nová generace stentů používaná od roku 2015 má v zaváděcím systému zabudovanou elektrokauterizační jednotku umožňující jednokrokové zavedení stentu (ECE-LAMS – electrocautery-enhanced lumen apposing metal stent), typ Hot AXIOS, Boston Scientific. S použitím těchto jednokrokově zaváděných ECE-LAMS se EUS navigované intervence technicky natolik zjednodušily a zrychlily, že umožňují provádět výkony i u vysoce rizikových pacientů bez nutnosti celkové anestezie.
Dalšími indikacemi k EUS-GBD může být maligní biliární obstrukce při selhání ERCP nebo EUS drenáže žlučovodů a dále převedení zevní, perkutánní drenáže na vnitřní drenáž (tzv. internalizace) u pacientů, kteří nejsou kandidáty cholecystektomie, ale vyžadují pokračující drenáž (např. u vyplňující cholecystolitiázy jako prevence reinfekce).
Kontraindikací k provedení EUS navigované drenáže žlučníku je volná perforace žlučníku a biliární peritonitida, relativní kontraindikací pak velkoobjemový ascites a též významná koagulopatie.
Celkové komplikace udává většina studií v rozmezí 8–18 % [4]. Bezprostředně s EUS-GBD může vzniknout akutní krvácení, volná perforace nebo malpozice stentu, jsou ovšem málo frekventní. Odloženými komplikacemi jsou obturace stentu s recidivou cholecystitidy, migrace stentu, buried syndrom (syndrom přerůstání okrajů stentu sliznicí trávicího traktu), vzácně biliární leak, abdominální absces nebo krvácení z aroze cév stentem [5].
Primárním cílem zpracování našeho souboru bylo ověřit technickou a klinickou úspěšnost EUS navigované drenáže žlučníku pomocí stentů ECE-LAMS a zhodnotit výskyt časných a pozdních komplikací.
Soubor pacientů a metoda
Jedná se o retrospektivní, konsekutivní soubor pacientů z našeho pracoviště za období listopad 2016 až prosinec 2022. Do sledovaného souboru bylo zařazeno 66 pacientů s provedenou EUS navigovanou drenáží žlučníku s použitím ECE-LAMS typu Hot AXIOS.
Klinickou úspěšnost metody jsme hodnotili podle klinické a laboratorní odezvy během 7 dnů po výkonu. Pozdní komplikace jsme sledovali po dobu 30 dnů od zavedení stentu. Soubor byl hodnocen po celou dobu zavedení drenáží z hlediska recidivy akutní cholecystitidy (tzn. v intervalu 4 měsíce až 5 let podle data zavedení). U pacientů z podskupiny „bridging to surgery“ jsme sledovali technickou proveditelnost chirurgické cholecystektomie.
Do souboru byly zařazeny tři skupiny pacientů:
- inoperabilní pacienti s těžkou akutní cholecystitidou s hrozícími komplikacemi;
- pacienti s maligní biliární obstrukcí s akutní cholecystitidou nebo jako záchranný výkon po neúspěšném ERCP nebo EUS drenáži žlučovodů;
- pacienti po perkutánní drenáži k převedení na vnitřní drenáž.
Hodnocený soubor 66 pacientů zahrnoval 43 mužů a 23 žen. Celkový věkový průměr činil 77,2 let, průměr ve skupině mužů byl 75 let (38–96 let) a žen 81 let (56–94 let). Věkové rozdělení souboru po dekádách je uvedeno v tab. 1 a počty výkonů v jednotlivých letech v tab. 2.
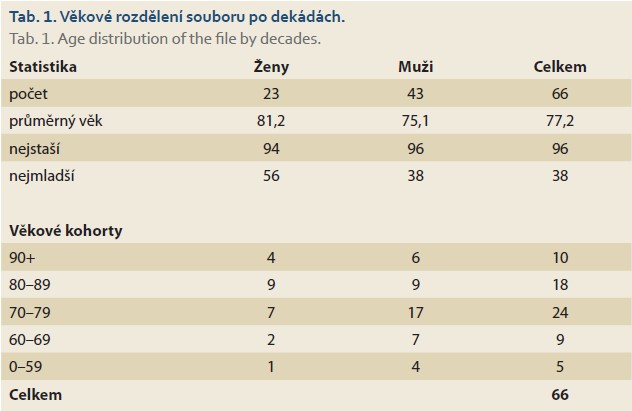
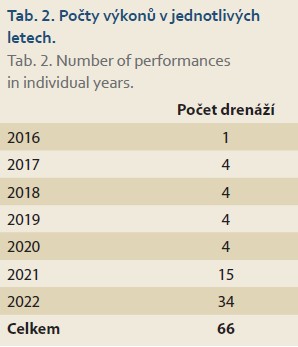
Z benigní indikace bylo provedeno 43 zákroků, z toho 29 drenáží u mužů a 14 drenáží u žen. Z indikace těžké akutní cholecystitidy bylo drénováno 34 pacientů, 1krát byla indikována drenáž u 38letého muže pro perzistující cholecystokutánní píštěl po zevní chirurgické drenáži s fibrózní stenózou d. cysticus po těžké nekrotizující pankreatitidě. Dalších 8 pacientů bylo převáděno ze zevní drenáže na vnitřní, a to z indikace objemné reziduální litiázy nebo po perkutánních redrenážích při recidivující cholecystitidě.
V podskupině „bridge to surgery“ byly provedeny čtyři výkony. U dvou pacientů se jednalo o abscedující purulentní cholecystitidu s pericholecystitidou, jeden pacient s akutní cholecystektomií nesouhlasil.
Čtvrtý výkon jako bridging do operace byl proveden u 77leté pacientky na plné duální antiagregaci po recentně proběhlém akutním infarktu myokardu se zavedeným lékovým stentem.
U 26 pacientů byla drenáž ponechána doživotně, bez endoskopické kontroly vzhledem k vysokému věku a celkovému internímu stavu. U 12 pacientů proběhla plánovaně s odstupem výměna metalické za plastovou stentáž. Elektivní cholecystektomii podstoupili ve sledovaném období tři pacienti a 2krát proběhla po komplikacích spojených s EUS drenáží akutně cholecystektomie (při malpozici stentu a biliární peritonitidě).
Z maligní indikace bylo provedeno 23 výkonů. Celkem 17 drenáží bylo provedeno pro empyém žlučníku při stenóze d. cysticus infiltrujícím tumorem podjaterní krajiny. Další EUS-GBD byly provedeny z těchto důvodů: 3krát po neúspěšném ERCP, 1krát jako „únikový výkon“ recentně po chirurgické GEA s ascitem a při nedostupnosti d. choledochus pro EUS navigovanou drenáž, 1krát jako prevence cholecystitidy při překrytí odstupu d. cysticus plně potahovaným metalickým biliárním stentem a 1krát výměna nehojící se perkutánní drenáže při nerozpoznané malignitě žlučníku.
Celkem byla provedena výměna zevní perkutánní drenáže za vnitřní v obou kohortách v 9 případech (8krát benigní a 1krát maligní). U všech internalizačních výkonů se jednalo o pacienty s perkutánní drenáží z jiných nemocnic.
Všechny výkony byly prováděny na RTG sále lineárním echoendoskopem (GF-UCT 180, Olympus Medical Systems) s UZ jednotkou EU-ME 2 (Olympus Medical Systems) s insuflací oxidem uhličitým pro lepší toleranci výkonu s menší provokací peristaltiky, snížení diskomfortu po delších výkonech a pro výhodu rychlejšího vstřebávání CO2 oproti atmosférickému vzduchu při výkonech rizikových z perforace.
Pokud pacienti před výkonem nebrali širokospektrá ATB z indikace akutní cholecystitidy, byla jim během drenážního výkonu a následně po dobu minimálně 5 dnů podávána. Vedení procedurální sedace záviselo na kardiopulmonální kompenzaci pacienta a délce předpokládaného výkonu. Čtvrtina drenáží byla provedena pouze v analgosedaci (midazolam + sufentanyl) vedené endoskopickým týmem, a to zejména u starších, hůře kompenzovaných pacientů s předpokladem rychlého výkonu při objemném žlučníku. V ostatních případech asistoval anesteziologický tým, který podle stavu pacienta rozhodoval o vedení sedace propofolem nebo endotracheální intubaci. Při benigní indikaci byly výkony vedeny častěji v sedaci propofolem. Při maligní indikaci, kdy byla drenáž častěji spojená s ERCP, pak byla častěji prováděna endotracheální intubace.
Ve všech případech byly použity ECE-LAMS typu Hot AXIOS (Boston Scientific). Výběr velikosti stentu závisel na vzdálenosti mezi drénovanými strukturami. Ve většině případů byl použit stent velikosti 10 × 10 mm. Stent o délce krčku 15 mm byl zaveden pouze 3krát, při interpozitu širším než 10 mm.
Z hlediska lokalizace punkce se jednalo 25krát o zavedení stentu ze žaludku a 41krát z oblasti duodena. Místo punkce záviselo na nejlépe dostupné lokalitě naléhajícího žlučníku a stabilitě pozice při drenáži. Drtivá většina cholecystostomií byla provedena přímou technikou (jen 4krát s pomocí vodiče, a to 3krát při malignitách a 1krát k převedení zevní drenáže při objemné cholecystolitiáze).
Elektrokoagulační jednotka (ERBE ICC 200 EA) byla nastavena v modu čistý řezací proud, výkon 100 W. Stenty byly zaváděny jednokrokově pod EUS kontrolou (distální příruba, flange) (obr. 1, 2) a endoskopickou kontrolou (proximální flange) (obr. 3). Skiaskopicky pak bylo kontrolováno správné rozvinutí obou přírub LAMS a zavedení koaxiálního double pigtail plastového stentu 7 Fr. Koaxiální plastový stent byl zaveden 30krát ze všech 66 drenáží, většina byla zavedena v roce 2022 (25krát).
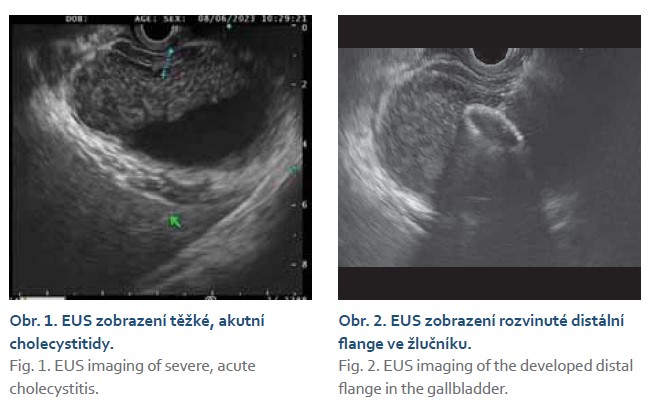
Výsledky
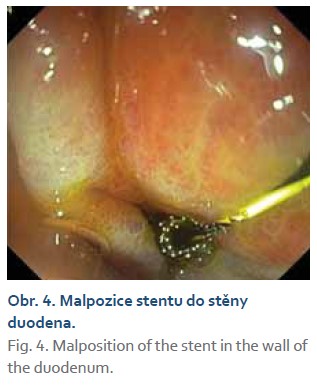
Technická úspěšnost zavedení stentů činila 98,5 %. V jednom případě se vyskytla při zavádění malpozice stentu. U 56letého pacienta s cirhózou jaterní a generalizovanou aterosklerózou (po iktech a rekonstrukčních cévních výkonech) s gangrenózní cholecystitidou došlo během rozvíjení stentu k malpozici proximální flange. Při interpozitu 6,5 mm byl zvolen stent 8 × 8 mm. Proximální konec stentu zůstal sevřen a nerozvinut ve stěně duodena (obr. 4), a proto i přes zavedený vodič nebylo možno „protlačit“ záchranný koaxiální metalický stent do dislokovaného LAMS. Dislokace nastala zřejmě při chybně zvoleném stentu s krátkým krčkem. Byla indikována chirurgická cholecystektomie. Perforační duodenální otvor byl pro chirurgickou suturu nedostupný, proto byl uzavřen perioperačně gastroskopicky OVESCO klipem. Zhojení pak proběhlo bez komplikací. U všech ostatních pacientů byly LAMS zavedeny správně.
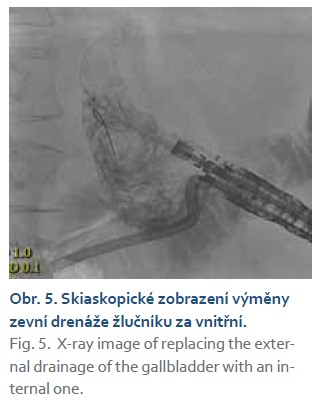
Všechny výměny zevní drenáže za vnitřní byly technicky proveditelné, bez komplikací (obr. 5).
Klinická úspěšnost činila 98,5 %. U jednoho pacienta, 76letého muže s gangrenózní cholecystitidou, se 2. den po výkonu vyvinula biliární peritonitida. Proběhla chirurgická revize s cholecystektomií. Metalický stent byl uložen správně, důvod peritonitidy byl nejasný. Perforační otvor ve žlučníku nebyl prokázán. Pacient se zhojil bez komplikací.
V našem souboru jsme zaznamenali dvě časné komplikace. Periprocedurálně došlo u 56leté pacientky při výměně zevní drenáže za vnitřní k akutnímu krvácení z lumen žlučníku. Krvácení bylo řešeno zavedením koaxiálního metalického stentu (FCSEMS) a intenzivní podpůrnou terapií. Při krvácení po zavedení LAMS zavádíme na základě empirické zkušenosti koaxiální FCSEMS. Krvácení může nastat buď z cév v punkční trajektorii, nebo poraněním protilehlé stěny. FCSMS zavádíme s předpokladem posílení tangenciální tlakové síly na krček LAMS a tamponádu lumen žlučníku. Dále krvácení u pacientky nepokračovalo. Důvodem komplikace bylo krvácení z karcinomu stěny žlučníku, který byl rozpoznán později. U druhého pacienta, 85letého muže, se 4. den po drenáži akutní cholecystitidy vyskytla septická špička, dle CT se nově objevil subhepatální absces, který byl chirurgicky vydrénován. Cholecystektomie nebyla indikována. Pacient se bez komplikací zhojil. Dle CT a gastroskopie z jiné indikace po 3 letech byl stent ve žlučníku a pohřben pod sliznicí duodena.
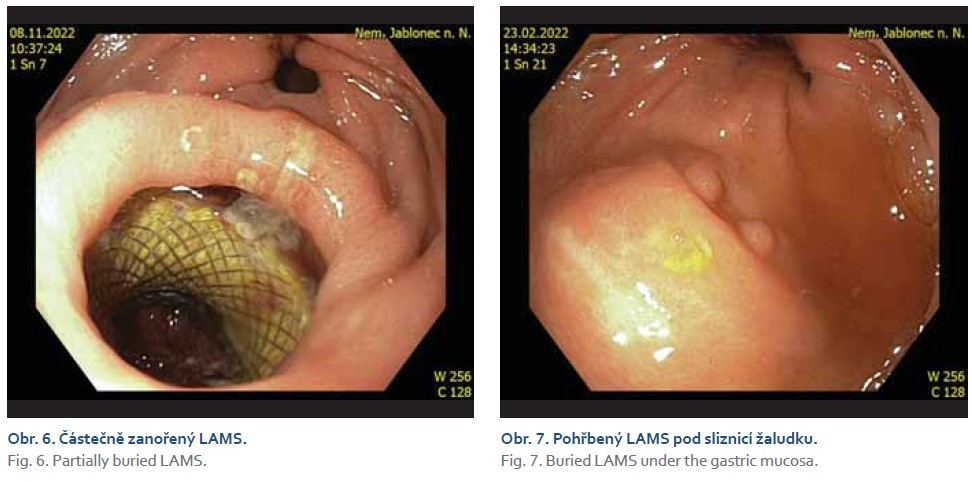
Žádný z pacientů nevyvinul závažnou pozdní komplikaci do 30 dnů od zavedení stentu. Nikdo nezemřel v souvislosti s EUS navigovanou drenáží. Z nezávažných pozdních komplikací, hodnocených za celou dobu sledování, jsme zaznamenali 4krát buried syndrom (syndrom zanořeného stentu pod sliznici). Tento syndrom pohřbeného stentu vznikl 2krát ze žaludeční pozice a 2krát z duodenální. Z každé pozice byl vždy 1krát pohřben úplně a 1krát částečně, u částečného pohřbení byly přítomny koaxiální stenty (obr. 6, 7). Žádný z těchto případů se neprojevil recidivou cholecystitidy. Pohřbené stenty byly verifikovány gastroskopicky buď při plánované výměně drenáže za plastové stenty, nebo s delším časovým odstupem náhodně při endoskopii z jiné indikace.
Soubor pacientů s benigní indikací jsme retrospektivně hodnotili z hlediska recidivy cholecystitidy za celý sledovaný interval. Pouze u jednoho 91letého polymorbidního muže s trvale zavedeným LAMS bez koaxiálního plastového stentu se vyskytla až po 13 měsících od zavedení recidiva cholecystitidy. Pacient byl hospitalizován v jiné nemocnici, první recidiva byla zaléčena konzervativně antibiotiky. Další recidiva za 15 měsíců s podjaterním abscesem si vyžádala chirurgickou cholecystektomii, za 4 týdny po výkonu na celkový rozvrat pacient zemřel. K EUS revizi pacient referován nebyl.
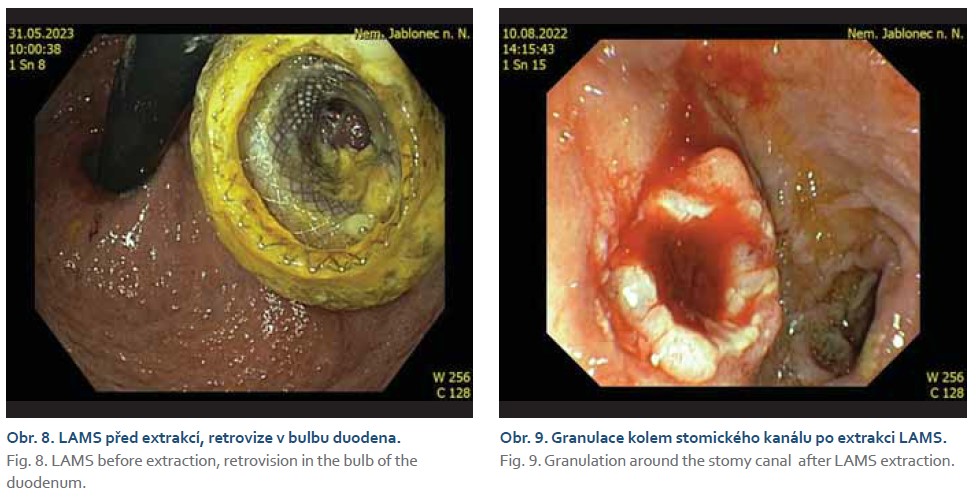
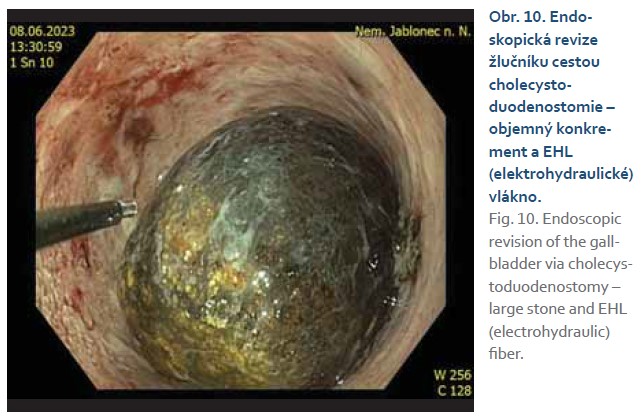
Průměrná doba zavedení všech stentů z benigní indikace činila 327 dní (rozmezí 0–1 915 dní). U 26 starších polymorbidních pacientů byla drenáž ponechána bez výměny doživotně, z nich 14 pacientů žilo do konce sledovaného období. U 11 pacientů byla provedena plánovaná extrakce metalického stentu (obr. 8, 9), průměrná doba ponechání LAMS činila 116 dní (11–483 dní). Výměna za doživotní plastovou stentáž proběhla v 8 případech, 3krát se nezdařilo stenty zavést pro nedostupnou pozici (vždy duodenum). Ve většině případů došlo ke spontánnímu odchodu litiázy. Jednou byla použita elektrohydraulická litotripse (obr. 10). U pacientky na duální antiagregaci byla provedena po 2 měsících výměna za plastovou stentáž a elektivní cholecystektomie je plánována po vysazení medikace za 6–12 měsíců.
U pacientů s maligní diagnózou zůstaly LAMS stenty zavedeny až do data úmrtí, v průměru 199 dní (rozmezí 12–673 dní). Dva pacienti na konci sledovaného období žili. Nikdo nezemřel pro příznaky akutní infekce žlučových cest.
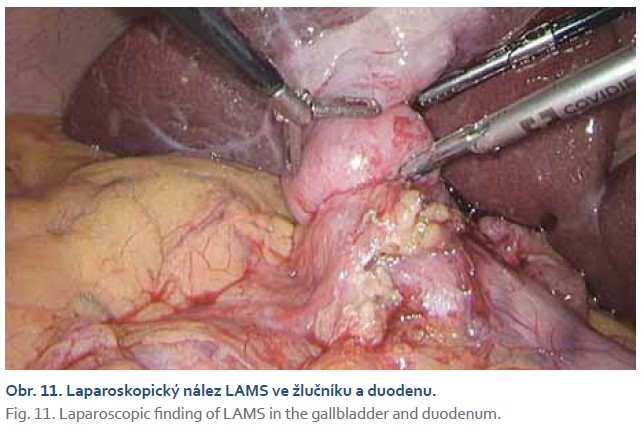
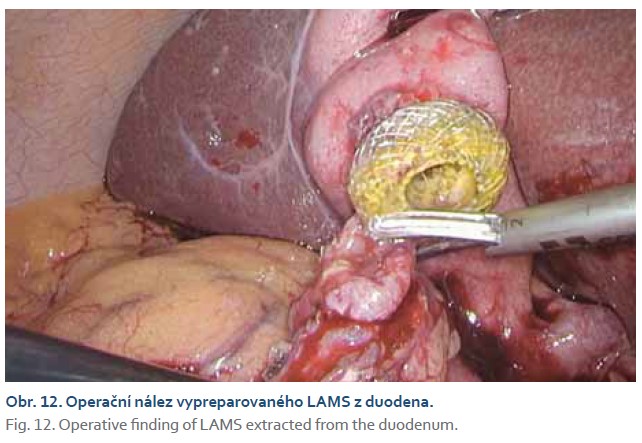
Tři pacienti podstoupili elektivní cholecystektomii bez komplikací (obr. 11, 12). Ve dvou případech byly stenty extrahovány 3 měsíce před výkonem a stomický kanál byl zašlý, bez nutnosti sutury. Jednou byl stent extrahován zároveň při cholecystektomii a kanál byl suturován.
Diskuze
Zhodnocením našeho souboru jsme ověřili vysokou technickou a klinickou úspěšnost EUS navigovaných drenáží žlučníku pomocí ECE-LAMS z benigní a maligní indikace s nízkým počtem nežádoucích komplikací. Technická a klinická úspěšnost činila v našem souboru 98,5 %, resp. 98,5 %. Vyskytly se dvě periprocedurální komplikace (1krát krvácení a 1krát malpozice stentu). Časně po výkonu se vyskytla 1krát peritonitida 2. den po drenáži a 1krát po 4 dnech podjaterní absces, tzn. časné komplikace činily 6 %. Pozdní komplikace byly zaznamenány pouze nezávažné, 4krát buried syndrom. Během 12 měsíců po drenáži se nevyskytla u žádného pacienta recidiva cholecystitidy.
EUS navigovaná cholecystostomie (EUS-GBD) pomocí ECE-LAMS v posledních letech vzhledem k technické jednoduchosti ve srovnání s jinými pankreatobiliárními intervencemi zažívá široké klinické použití. Technicky se jedná o obdobný výkon jako drenáže peripankreatických kolekcí. Je indikována jako alternativa perkutánního přístupu u inoperabilních pacientů s akutní cholecystitidou a jako záchranný výkon při řešení obstrukčního ikteru při maligním procesu. U akutní cholecystitidy zůstává nadále metodou volby laparoskopická cholecystektomie.
Vysokou efektivitu a bezpečnost EUS drenáží pomocí ECE-LAMS Hot AXIOS u akutní cholecystitidy potvrdila již retrospektivní studie ze sedmi terciárních center publikovaná Dollhopfem et al v roce 2017. Studie prokázala vysokou technickou a klinickou úspěšnost 98,7 %, resp. 95,9 %. Zařazeno bylo 75 pacientů. Periprocedurálně vznikly 2 komplikace (perforace a závažné krvácení), odloženě 6 komplikací (3 rekurující cholecystitidy, 2 migrace stentu a 1 Bouveretův syndrom). Všechny komplikace dosahovaly 10,7 % [6]. Tato studie je počtem pacientů a použitím jednotného stentu obdobná našemu souboru a ve výsledcích se výrazněji neliší.
Nejběžnější nechirurgickou metodu drenáže žlučníku představuje perkutánní přístup (PT-GBD). Jedná se stejně jako u EUS-GBD o bezpečnou a efektivní metodu, ale podle recentních studií vykazuje vyšší riziko dlouhodobých komplikací. Ve srovnání s EUS metodou má nevýhodu horší kvality života a nemožnosti řešit cholecystolitiázu. Její výhodou jsou nižší materiálové náklady, možnost provedení pouze v analgosedaci a její široce zvládnutá technika provedení. Perkutánní drenáž žlučníku je spojena s komplikacemi až ve 41 % [7]. Časně vzniká malpozice stentu, krvácení, sepse, biliární leak, pneumothorax, pneumoperitoneum, perforace střevních kliček nebo peritonitida. Odloženě se vyskytují obturace a dislokace drénu s recidivou cholecystitidy a perzistence píštělí.
V 2020 publikovali Teoh et al randomizovanou kontrolovanou studii DRAC 1 porovnávající EUS- GBD a PT-GBD. Do studie bylo zařazeno 80 inoperabilních pacientů s akutní kalkulózní cholecystitidou drénovaných stenty Hot AXIOS. EUS-GBD významně redukovala počet komplikací vzniklých do 1 roku (25 vs. 77 %), vykázala méně reintervencí, neplánovaných rehospitalizací a rekurujících cholecystitid. Technický a klinický úspěch a 30denní mortalita byly u obou metod obdobné [8].
Podboy et al v publikaci z 2021 porovnávali všechny tři drenážní metody v metaanalýze 10 studií, 1 267 pacientů (472 EUS-GBD, 493 PT-GBD a 302 ETP-GBD). EUS-GBD vykazovaly lepší technický a klinický efekt oproti ETP-GBD a méně pozdních komplikací oproti PT-GBD. Pokud je dle metaanalýzy EUS-GBD dostupnou metodou, měla by být při drenáži preferována [9].
Pokud provedeme EUS-GBD jako rescue výkon po selhání ERCP nebo EUS drenáže žlučovodu u pacienta s maligním obstrukčním ikterem při stenóze distálního choledochu, je technická i klinická úspěšnost vysoká. V roce 2021 referovali Issa et al retrospektivní studii 28 pacientů s rescue EUS-GBD s technickou úspěšností 100 %. Klinická úspěšnost, hodnocená jako pokles hladiny bilirubinu o > 50 % za 2 týdny, dosáhla 93 %. Komplikace vznikly u 5 pacientů (3krát impaktovaná potrava, 1krát cholecystitida a 1krát odložené krvácení). V souboru byly použity 26krát LAMS a 2krát FCSMS [10]. Obdobně vysoká technická a klinická úspěšnost z této indikace byla referována v metaanalýze amerických autorů [11].
Z technického hlediska není v provedení drenáže rozdíl oproti benigním indikacím. Výkon může být na nezánětlivém žlučníku bez pericholecystitidy jednodušší. Při malignitě žlučníku nesmí být trajektorie punkce vedena přes nádorovou tkáň. Masivní ascites představuje relativní kontraindikaci, evakuační punkce ascitu před výkonem může zlepšit anatomické poměry. V našem souboru žádný pacient s drenáží při malignitě nevyvinul komplikaci vyžadující endoskopickou revizi.
V našem souboru se vyskytla jedna malpozice stentu s krčkem délky 8 mm. Na základě této zkušenosti používáme k drenáži zánětlivě rozšířené stěny stenty s krčkem minimální délky 10 mm.
Před drenáží se rozhodujeme i o šíři krčku stentu. Pokud je známá cholecystolitiáza, zdá se výhodnější použití stentu s krčkem šíře 15 mm. Snadněji pak při endoskopické revizi pronikneme diagnostickým gastroskopem do žlučníku s jeho revizí a extrakcí cholecystolitiázy košem. K drenáži žlučníku by neměly být používány stenty s krčkem šíře 20 mm [12]. U pacientů, kteří mají předpoklad dožití > 1 rok a z interního hlediska jsou schopni endoskopického výkonu, ale nejsou indikováni k cholecystektomii, je doporučeno za 4–6 týdnů po drenáži extrahovat LAMS s revizí žlučníku, extrakcí litiázy a výměnou za dva DPS jako trvalé jištění cholecystické píštěle.
V dubnu 2023 na ESGE Days v Dublinu prezentoval prof. R. Kunda vlastní soubor 175 pacientů drénovaných pro akutní kalkulózní cholecystitidu. Za 6 týdnů extrahoval LAMS a pouze v 29 případech nedošlo ke spontánnímu odchodu litiázy. Po kompletní clearance žlučníku (EHL a extrakce) a potvrzení průchodnosti d. cysticus nebyly již zaváděny plastové stenty. Pouze v 2,7 % došlo k rekurenci cholecystitidy (řešeno 3krát reEUS-GBD a 2krát elektivní cholecystektomií – CHCE). Dle této studie není rekurence po kompletní clearance žlučníku a jistotě průchodnosti ductus cysticus častější než u permanentně zavedených stentů [13]. Trvalé ponechání LAMS u dlouhodobě žijících nemá zatím data ohledně vzniku eventuální malignity z iritace stěny žlučníku.
V našem souboru jsme provedli u jedenácti pacientů extrakci LAMS a revizi žlučníku (kontrastní skiaskopií a při dostatečné šíři stomie i endoskopicky). Ve většině případů došlo ke spontánnímu odchodu litiázy. Pokud to bylo pozičně možné, zaváděli jsme vždy dva DPS.
Místo punkce lze zvolit z antra nebo bulbu duodena. Každá pozice má svá pro a proti. Duodenum je mobilnější a leží blíže žlučníku než antrum. Teoreticky pak hrozí menší riziko migrace stentu. Transduodenální pozice je méně riziková z hlediska obturace stentu potravou a rizikem reinfekce. Na druhou stranu při malpozici stentu při zavádění z duodenální pozice je pro chirurga obtížnější ošetření perforačního otvoru v duodenu.
Transgastrická punkce je technicky jednodušší, protože antrum naléhá na fundus žlučníku a jeho širší průměr umožňuje snadnější rozvinutí distální flange. Při malpozici stentu a nutnosti chirurgické revize je pro chirurga snadnější uzavřít perforaci ze žaludku [14]. Obdobná situace s obtížným uzávěrem perforace duodena vznikla v našem souboru akutně po malpozici stentu mimo stěnu duodena. Perforace byla vyřešena endoskopicky na operačním sále uzávěrem OVESCO klipem. Ze žaludeční pozice hrozí teoreticky častěji buried syndrom pro retrakci fundu žlučníku při jeho hojení.
V našem souboru jsme zaznamenali jediný typ pozdní komplikace – buried syndrom. Vyskytl se po drenáži rovnoměrně z obou pozic. Dle našich zkušeností volíme punkční pozici preferenčně na základě nejpříhodnějšího naléhání žlučníku, absence vmezeřených cév v punkční trajektorii a v nejstabilnější pozici.
Dle ESGE doporučení z 2022 je po drenáži žlučníku doporučeno dle uvážení endoskopisty zavádět koaxilání DPS jako prevenci komplikací [12]. Profesor Perez-Miranda uvádí tři důvody pro zavedení plastových stentů:
- tlakem na oba konce LAMS stentu zamezují přerůstání sliznice přes příruby LAMS;
- brání okluzi LAMS kameny nebo potravou;
- v případě migrace LAMS udržují funkční cholecystickou píštěl [15].
Obdobně jako u peripankreatických kolekcí nejspíše DPS brání arozi protilehlé stěny kovovým stentem. Od roku 2022 zavádíme na našem pracovišti koaxiální DPS obligátně. U jediné recidivy cholecystitidy v našem souboru za celé sledované období koaxiální stent při drenáži zaveden nebyl.
Pacienti po drenáži z indikace bridging do operace by měli podstoupit CHCE. Doba do CHCE je určována individuálně. Komparativní studie srovnávající elektivní CHCE po EUS-GBD a PT-GBD nevykazuje rozdíl v počtu konverzí na open CHCE nebo v počtu komplikací [16].
Belgičtí autoři prezentovali na ESGE Days v dubnu 2023 v Dublinu soubor 81 pacientů s CHCE po EUS-GBD. Souborem ověřili technickou proveditelnost laparoskopické CHCE po EUS navigované drenáži a procento komplikací. LAMS extrahovali v mediánu 4 dnů před CHCE, v 86 % otvor nijak neuzavírali (ostatní uzavřeli pomocí OVESCO klipu, OTSC® klipu (tzv. systém Over-The-Scope-Clip) nebo OverStitch). Během operace v 68 % provedli suturu fistuly, v 17 % použili stapler a v 15 % bylo spontánně uzavřeno. Cholecystektomii bylo možno provést ve 100 % případů. Z komplikací referovali 2krát podjaterní kolekci řešenou drenáží a ATB a 1krát transsekci d. choledochus s hepatikojejunoanastomózou [13].
Načasování extrakce LAMS před CHCE bude dle našeho názoru ještě předmětem dalších studií. Při intervalu mezi extrakcí LAMS a operací v řádu týdnů dochází ke spontánnímu uzávěru fistuly, a tím zjednodušení operace. Pacient je na druhou stranu bez stentáže vystaven riziku recidivy cholecystitidy, ale vzhledem k vysokému procentu spontánního odchodu cholecystolitiázy nemusí být teoreticky riziko vysoké.
Specifickou skupinu představují pacienti s nutností drenáže při užívané antikoagulační nebo duální antiagregační terapii. V literatuře je uváděna studie, která podporuje preferenci EUS-GBD před PT-GBD [17]. Námi referovaná pacientka na duální antiagregaci podstoupila EUS-GBD bez komplikací.
EUS-GBD by měly být prováděny ve velkoobjemových centrech endoskopistou s pokročilými pankreatobiliárními dovednostmi. Za technické zvládnutí metody EUS-GBD je považováno 25 provedených výkonů [18].
Závěr
Zhodnocením našeho souboru jsme potvrdili vysokou technickou a klinickou úspěšnost EUS navigovaných drenáží žlučníku pomocí stentů Hot AXIOS s nízkým procentem komplikací. Tyto drenáže jsou v posledních letech stále více využívány jako alternativa intervenční radiologie. Významně změnily management péče o inoperabilní pacienty s akutní cholecystitidou. Představují vysoce bezpečnou a efektivní léčebnou metodu, významně redukují riziko rekurující cholecystitidy a umožňují neoperačně řešit cholecystolitiázu. Limitem pro širší použití je materiálová nákladnost stentů. Pro standardizaci postupů jsou nutná další data z prospektivních multicentrických studií.
ORCID autorů
J. Pintová ORCID 0000-0002-1734-274X,
V. Nosek ORCID 0000-0001-8057-4327.
Doručeno/Submitted: 6. 7. 2023
Přijato/Accepted: 28. 7. 2023
MUDr. Jiřina Pintová
Gastroenterologické oddělení
Nemocnice Jablonec nad Nisou, p. o.
Nemocniční 4446/15
466 01 Jablonec nad Nisou
jirina.pintova@nemlib.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Cucchetti A, Binda C, Dajti E et al. Trial sequential analysis of EUS-guided gallbladder drainage versus percutaneous cholecystostomy in patients with acute cholecystitis. Gastrointest Endosc 2022; 95(3): 399–406. doi: 10.1016/j.gie.2021.09.028.
2. Siddiqui A, Kunda R, Tyberg A et al. Three-way comparative study of endoscopic ultrasound-guided transmural gallbladder drainage using lumen-apposing metal stents versus endoscopic transpapillary drainage versus percutaneous cholecystostomy for gallbladder drainage in high-risk surgical patients with acute cholecystitis: Clinical outcomes and success in an International, Multicenter Study. Surg Endosc 2019; 33(4): 1260–1270. doi: 10.1007/s00464-018-6406-7.
3. Baron T H, Topazian M D. Endoscopic transduodenal drainage of the gallbladder: implications for endoluminal treatment of gallbladder disease. Gastroint endosc 2007; 65(4): 735–737. doi: 10.1016/j.gie.2006.07.041.
4. van der Merwe SW, van Wanrooij RLJ, Bronswijk M et al. Therapeutic endoscopic ultrasound: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2022; 54(2): 185–205. doi: 10.1055/a-1717-1391.
5. Irani SS, Sharzehi K, Siddiqui UD. AGA Clinical Practice Update on Role of EUS-Guided Gallbladder Drainage in Acute Cholecystitis: Commentary. Clin Gastroenterol Hepatol 2023; 21(5): 1141–1147. doi: 10.1016/j.cgh.2022.12.039.
6. Dollhopf M, Larghi A, Will U et al. EUS-guided gallbladder drainage in patients with acute cholecystitis and high surgical risk using an electrocautery-enhanced lumenapposing metal stent device. Gastrointest Endosc 2017; 86(4): 636–643. doi: 10.1016/j.gie.2017.02.027.
7. McKay A, Abulfaraj M, Lipschitz J. Short- and long-term outcomes following percutaneous cholecystostomy for acute cholecystitis in high-risk patients. Surg Endosc 2012; 26(5): 1343–1351. doi: 10.1007/s00464-011-2035-0.
8. Teoh AYB, Kitano M, Itoi T et al. Endosonography-guided gallbladder drainage versus percutaneous cholecystostomy in very high-risk surgical patients with acute cholecystitis: an international randomised multicentre controlled superiority trial (DRAC 1). Gut 2020; 69(6): 1085–1091. doi: 10.1136/ gutjnl-2019-319 996.
9. Podboy A, Yuan J, Stave CD et al. Comparison of EUS-guided endoscopic transpapillary and percutaneous gallbladder drainage for acute cholecystitis: a systematic review with network meta-analysis. Gastrointest Endosc 2021; 93(4): 797–804. doi: 10.1016/j.gie.2020.09.040.
10. Issa D, Irani S, Law R et al. Endoscopic ultrasound-guided gallbladder drainage as arescue therapy for unresectable malignant biliary obstruction: a multicenter experience. Endoscopy 2021; 53(8): 827–831. doi: 10.1055/a-1259-0349.
11. Kamal F, Khan MA, Lee-Smith W et al. Efficacy and safety of EUS-guided gallbladder drainage for rescue treatment of malignant biliary obstruction: A systematic review and meta-analysis. Endosc Ultrasound 2023; 12(1): 8–15. doi: 10.4103/EUS-D-21-00206.
12. van Wanrooij RLJ, Bronswijk M, Kunda R et al. Therapeutic endoscopic ultrasound: European Society of Gastrointestinal Endoscopy (ESGE) Technical Review. Endoscopy 2022; 54(3): 310–332. doi: 10.1055/a-1738-6780.
13. ESGE Days 2023. 2023 [online]. Dostupné z: https: //www.esge.com/event-calendar/ esge-days-2023/.
14. Rana S. Endoscopic ultrasound-guided gallbladder drainage: a technical review. Ann Gastroenterol 2021; 34(2): 142–148. doi: 10.20524/aog.2020.0568.
15. Perez-Miranda M. Technical considerations in EUS-guided gallbladder drainage. Endosc Ultrasound 2018; 7(2): 79–82. doi: 10.4103/eus.eus_5_18.
16. Saumoy M, Tyberg A, Brown E et al. Successful cholecystectomy after endoscopic ultrasound gallbladder drainage compared with percutaneous cholecystostomy, can it be done? J Clin Gastroenterol 2019; 53(3): 231–235. doi: 10.1097/MCG.0000000000001036.
17. Sagami R, Hayasaka K, Ujihara T et al. Feasibility of endoscopic ultrasound-guided gallbladder drainage for acute cholecystitis patients receiving antithrombotic therapy. Ann Gastroenterol 2020; 33(4): 391–397. doi: 10.20524/aog.2020.0496.
18. Teoh AY, Perez-Miranda M, Kunda R et al. Outcomes of an international multicenter registry on EUS-guided gallbladder drainage in patients at high risk for cholecystectomy. Endosc Int Open 2019; 7(8): E964–E973. doi: 10.1055/a-0915-2098.