Doporučené postupy chirurgické léčby pacientů s nespecifickými střevními záněty – 1. část: předoperační příprava
Zuzana Šerclová Orcid.org 1, Ondřej Ryska Orcid.org 1, Martin Bortlík Orcid.org 2,3,4, Dana Ďuricová Orcid.org 2, Robert Gürlich5, Pavel Lisý5, Július Örhalmi Orcid.org 6, Pavel Kohout Orcid.org 7, Lucie Prokopová Orcid.org 8, Tomáš Douda Orcid.org 9, Pavel Drastich Orcid.org 10, Aleš Novotný Orcid.org 11, Karel Mareš Orcid.org 12, Olga Shonová Orcid.org 13, Luděk Hrdlička Orcid.org 14,1, Jana Koželuhová Orcid.org 15, Jiří Stehlík Orcid.org 16, Mojmír Kasalický Orcid.org 17,18, Jaroslav Kalvach19, Jiří Bronský Orcid.org 20, Marie Tomanová21, Martin Liberda Orcid.org 22, Přemysl Falt Orcid.org 23, Milan Lukáš Orcid.org 2, Vladimír Zbořil Orcid.org 8, Petra Matějková Orcid.org 24,25
+ Pracoviště
Souhrn
: Péče o pacienty s idiopatickými střevními záněty (IBD) je komplexní. Nejvíce je angažován gastroenterolog a chirurg.
Chirurgická léčba zlepšuje kvalitu života nemocných, její dobré výsledky však závisejí na správné indikaci k operaci, přípravě nemocného a vhodném načasování operace. Cílem pracovní skupiny pro IBD je na základě dostupné literatury vytvořit přehled podmínek pro chirurgickou léčbu, jejího vztahu ke konzervativní léčbě a vhodných operačních postupů při optimální péči o pacienty s IBD. První část přehledu je zaměřena na přípravu nemocného k operaci.: Péče o pacienty s idiopatickými střevními záněty (IBD) je komplexní. Nejvíce je angažován gastroenterolog a chirurg.
Chirurgická léčba zlepšuje kvalitu života nemocných, její dobré výsledky však závisejí na správné indikaci k operaci, přípravě nemocného a vhodném načasování operace. Cílem pracovní skupiny pro IBD je na základě dostupné literatury vytvořit přehled podmínek pro chirurgickou léčbu, jejího vztahu ke konzervativní léčbě a vhodných operačních postupů při optimální péči o pacienty s IBD. První část přehledu je zaměřena na přípravu nemocného k operaci.
Klíčová slova
chirurgická léčba, nespecifické střevní záněty, předoperační přípravaChirurgická léčba je součástí péče o pacienty s idiopatickými střevními záněty (IBD). Během prvního roku trvání Crohnovy nemoci (CN) je pravděpodobnost operace 20– 40 %, do 10 let je operováno 30– 70 % nemocných a po 15 letech od diagnózy 70– 90 % nemocných [1]. V prvních deseti letech trvání choroby je operováno 10– 17 % pacientů s ulcerózní kolitidou (UC) [2].
Chirurgická léčba bezprostředně zlepšuje kvalitu života nemocných, ale souvisí s ní v některých případech trvalá morbidita i riziko mortality [2– 4]. Porozumění možnostem chirurgické léčby vede ke správné indikaci, vhodnému načasování operace a snížení rizika komplikovaného hojení.
Cílem pracovní skupiny pro IBD bylo vytvořit na základě dostupné literatury přehled doporučení pro chirurgickou léčbu, jejího vztahu ke konzervativní léčbě a vhodných operačních postupů při optimální péči o pacienty
s IBD.
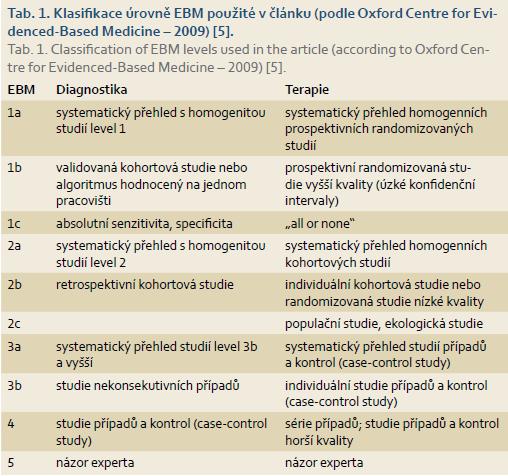
K hodnocení zpracované literatury byla použita klasifikace dle Oxfordského centra pro EBM z roku 2009 (tab. 1,2) [5]. V literatuře existuje jen málo prospektivních randomizovaných studií týkajících se chirurgické léčby IBD, což je dáno tím, že u akutních indikací k operaci není možné takovéto studie provést a elektivně jsou k operaci obvykle indikováni nemocní s komplikovanější chorobou než pacienti pokračující v konzervativní léčbě. Tam, kde nebylo možné dostatečné důkazy nalézt v odborné literatuře, byla použita Delphi metoda [6], při níž experti (členové pracovní skupiny pro IBD a přizvaní chirurgové zabývající se IBD) hlasovali a do doporučení byl použit výsledek při souhlasu 80 % a více účastníků.
1. Požadavky na pracoviště
Operovaní nemocní s IBD vyžadují komplexní péči vzhledem k možným komplikacím vyplývajícím z vlastního onemocnění a jeho mimostřevních projevů, ale i z důvodu nežádoucích účinků konzervativní léčby. Chirurgická léčba by měla probíhat v nemocnicích, kde je zajištěna gastroenterologická péče specializovaná na IBD a kde je dostupná kvalitní a intervenční endoskopie. Úroveň gastroenterologické péče a dodržování doporučených postupů zlepšuje kvalitu léčby [7].
Chirurgické výsledky jsou obecně závislé na chirurgické zkušenosti a na specializaci. Jsou lepší na pracovištích, kde jsou nemocní ošetřováni chirurgem specializovaným nejen ve střevní chirurgii, ale přímo v chirurgii IBD, jež se liší od operování např. pro kolorektální karcinom [8,9]. Centralizace vážně nemocných s IBD vyžadujících hospitalizaci snižuje komplikace a mortalitu i po operaci, což bylo prokázáno na velkých vzorcích pacientů z registrů v USA a Kanadě [10,11]. Významně pozitivní efekt byl pozorován v zařízeních s více než 145 [11], resp. 150 hospitalizacemi za rok [10]. Pacienti s UC by měli mít možnost být operováni na pracovištích s expertem, který má zkušenost s ileopouchanální anastomózou (IPAA), tedy s operací zachovávající střevní kontinuitu. Z kanadského registru hospitalizovaných byla zpracována početná kohorta operovaných pro UC (7 806 nemocných). U nemocných operovaných v nemocnicích s velkým objemem IBD pacientů (12– 53 kolektomií/ rok) byla zaznamenána významně nižší morbidita a mortalita proti ošetřeným v nemocnicích s malým či středním počtem pacientů (pod 3–5/ rok). I podíl nemocných, u kterých byl proveden pouch se zachováním střevní kontinuity, byl v těchto nemocnicích vyšší (46 % vs 17 %, resp. 29 %) [12]. Výsledky IPAA a její funkčnost se zlepšují po odoperování 23– 40 IPAA pod dohledem experta [13]. Z britské analýzy 5 771 restorativních proktokolektomií s pouchem vyplývá, že k lepšímu zachování funkce pouche dochází po zkušenosti s více než 29 operacemi celkem a při provedení více než čtyři IPAA/ rok jedním chirurgem [14]. Závěrem podobné kanadské studie (1 285 ileopouchanálních anastomóz) je, že v centrech s velkým objemem IPAA je hospitalizace kratší a dochází k menšímu počtu reoperací a selhání pouche [15].
Na pracovišti, kde jsou operováni pacienti s IBD, musí být zajištěna stomická péče, což zlepšuje kvalitu života potenciálních stomiků a snižuje náklady na jejich péči [16,17].
Další podmínkou je kvalitní intenzivní péče. Nemocní s IBD jsou častěji v kritickém stavu vyžadujícím pobyt na jednotce intenzivní péče (JIP, ARO) oproti běžné populaci chirurgických pacientů a mortalita do jednoho roku po pobytu na ARO (32 %) je vyšší než u ostatních pacientů [18]. Nutnost přijetí na JIP (ARO) v posledních letech stoupá až na 2,6 % ze všech hospitalizovaných s IBD [19].
V období před operací i po operaci je nezbytná kvalitní metabolická a nutriční péče. Třetina nemocných s IBD má body mass index (BMI) pod 20 a 60 % trpí sarkopenií [20], tedy proteino‑ kalorickou malnutricí přímo ovlivňující pooperační hojení [21].
Nezbytné je též zázemí radiologického oddělení s možností intervencí (drenáž abscesu, vyšetření rozsahu onemocnění) [22] a komplementu.
Podmínky pro chirurgickou léčbu IBD nemocných:
Chirurgická léčba by měla být poskytována v nemocnicích, kde je dostupná gastroenterologická péče dodržující doporučené postupy pro IBD (EBM 3a, doporučení: C).
Nižší morbidita a mortalita je v nemocnicích s vyšší frekvencí hospitalizací pro IBD (EBM 2b, doporučení: B).
Zkušenost chirurga významně ovlivňuje výsledky chirurgické péče u pacientů s CN a především s UC (EBM 2b , doporučení: B).
Na pracovištích, kde jsou operováni nemocní s IBD, je dále nutná dostupnost: stomické péče, nutriční a metabolické péče, intenzivní péče, zázemí radiologie a komplementu (EBM 3b, doporučení: C).
2. Předoperační vyšetření u pacientů s IBD
Předoperační vyšetření u pacientů s IBD zahrnuje běžné interní vyšetření včetně identifikace rizikových faktorů komplikovaného pooperačního hojení, vyšetření nutričního stavu a vyšetření specifická pro pacienty s IBD, která určí lokalizaci a rozsah intraluminálního a extraluminálního postižení.
Interní předoperační vyšetření
Cílem interního, resp. předanestetického vyšetření před operací je posouzení zdravotního stavu a funkčních rezerv orgánových soustav pacienta, případně identifikace dalších rizikových faktorů léčby.
Vyšetření by mělo obsahovat podrobnou anamnézu zaměřenou na IBD, přidružené choroby (ICHS, diabetes), předchozí operační výkony, aktuální symptomatologii (obstrukční příznaky, zvracení, febrilie) a cíleně na trombofilní stavy. Dále by měla být odebrána rodinná anamnéza týkající se IBD, autoimunitních chorob a malignit. Nutná je znalost aktuálního abusu nikotinu, alkoholu a jiných návykových látek. Důležitá je podrobná farmakologická anamnéza včetně dávkování (imunosuprese, kortikoidy, biologická léčba).
Vedle základního klinického vyšetření je požadováno EKG (u asymptomatických pacientů po 40. roce věku) a RTG plic (u asymptomatických pacientů po 60. roce věku) [23].
Běžné hematologické a biochemické vyšetření je u pacientů s IBD rozšířeno o stanovení hladin zánětlivých (C‑ reaktivní protein, leukocytemie) a nutričních parametrů (viz dále). U pacientů s elevací jaterních testů by mělo být doplněno ultrazvukové vyšetření žlučových cest k vyloučení primární sklerozující cholangitidy.
Dle výše uvedených vyšetření je možné identifikovat faktory zvyšující frekvenci pooperačních komplikací, kterými jsou vyšší věk, délka trvání choroby, malnutrice, váhový úbytek nebo elevace zánětlivých parametrů [24– 26]. Dalším rizikovým faktorem je užívaná medikace, která bude popsána dále.
Doporučení: Interní předoperační vyšetření by mělo zahrnovat identifikaci rizikových faktorů ovlivňujících výskyt pooperačních komplikací (EBM 3a, doporučení: B).
Nutriční vyšetření
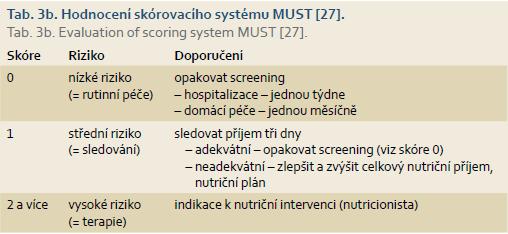
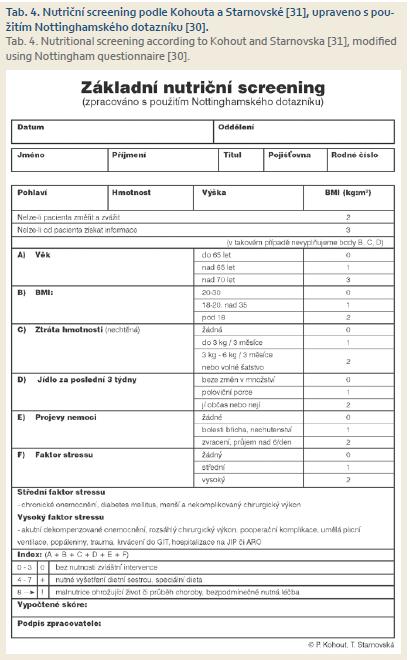
K operaci jsou obvykle indikováni pacienti s IBD až po vyčerpání ostatních terapeutických možností, proto většina z nich trpí předoperačně určitým stupněm malnutrice [20]. Její příčinou je u nemocných s vleklou obstrukcí chronické omezení perorálního příjmu, malabsorpce při luminálním zánětu a alterace syntézy proteinů jako reakce na střevní zánět [21]. Malnutrice v době operace je významným rizikovým faktorem závažných pooperačních komplikací u pacientů s IBD [24,25]. Nutriční screening je proto součástí předoperačního vyšetření u všech nemocných s IBD. Nutriční anamnéza obsahuje BMI, údaje o váhovém úbytku a o omezení perorálního příjmu. Laboratorní vyšetření by mělo obsáhnout základní nutriční parametry – celková bílkovina, albumin, železo, ferritin, transferin vč. saturace, prealbumin. K nutričnímu screeningu je vhodné použít některý z doporučených skórovacích systémů: Malnutrition Universal Screening Tool – MUST (tab. 3a, 3b) [27], Subjektive Global Assesment – SGA [28], Nutritional Risk Screening – NRS2002 [29]. Pro IBD pacienty je vhodný dotazník, který s použitím Nottinghamského dotazníku [30] upravili Kouhout a Stranovská (tab. 4) [31]. Pokud je dle výsledného skóre pacient v riziku malnutrice, následuje podrobné vyšetření a intervence nutričního terapeuta či nutricionisty dle závažnosti. Bezprostředně předoperačně je pak důležitá kontrola účinnosti případné nutriční podpory.
Doporučení: U každého pacienta s IBD je před plánovanou operací nutné zhodnocení stavu výživy, které spočívá v nutričním screeningu. Při zjištění rizika malnutrice je nezbytné podrobné vyšetření její závažnosti s následnou intervencí (EBM 2b, doporučení: B).
3. Zobrazovací a endoskopické vyšetření
3.1. Crohnova nemoc
Pro taktiku operace je důležité znát předoperačně rozsah postižení tenkého střeva, resp. délku nepostižené části, u píštělové formy identifikovat část střeva primárně postiženého, z něhož píštěl vychází, a část střeva či orgánu, do kterého píštěl penetruje (bude ošetřen lokálně). Dále je racionální identifikovat distální rozsah nemoci, jehož příznaky (např. stenóza) mohou být manifestací proximální nemoci skryty, avšak mohou negativně ovlivnit pooperační hojení anastomóz [32,33].
Posouzení stavu rekta a perianální oblasti ovlivňuje indikaci ke kontinenci zachovávajícímu výkonu. Identifikace nitrobřišních abscesových ložisek a jejich případné ošetření drenáží je součástí dobrého načasování střevní resekce. Vyloučení či identifikace malignity tračníku je též nutné pro taktiku operace.
Nejvýtěžnější je endoskopické vyšetření tlustého střeva a terminálního ilea [34]. V případě neprostupné stenózy je nutné dovyšetření orální části tračníku jinou metodou (CT kolografie, event. irrigografie). Před plánovanou resekcí tlustého střeva je nutný podrobný popis rozsahu postižení rekta (výška distálního okraje léze), které má vliv na možnost konstrukce anastomózy.
Důležité je vyšetření per rektum a perianální oblasti (píštěle, abscesy) včetně tonu svěrače.
U každého pacienta by mělo být k dispozici vyšetření celého tenkého střeva. Podle tohoto vyšetření je možné naplánovat chirurgický výkon (resekce, strikturoplastika), event. stanovit rozsah pooperační reziduální choroby. CT (CTE) a MR enterografie (MRE) jsou v současné době metody volby vyšetření tenkého střeva s vysokou přesností detekce stenóz i fistulace (89 %, resp. 83 %) [35]. Tato vyšetření mají rovněž srovnatelně vysokou přesnost (87– 93 %) v identifikaci nitrobřišních abscesů [36,37].
CT navíc nabízí možnost současného ošetření těchto lézí drenáží. Nevýhodou CTE je radiační zátěž, která se vzhledem k častému opakování vyšetření u IBD pacientů může kumulovat [38]. MRE je metoda nákladnější, ne vždy dostupná, jejíž hodnocení je časově náročnější a vyžaduje specializovaného rentgenologa.
Ultrazvukové vyšetření (UZ) je možno použít k vyšetření ileocékální oblasti nebo k ověření nitrobřišního nálezu s odstupem po CT navigované drenáži. Posouzení rozsahu postižení tenkého střeva (především jejuna a orálního ilea) ale bývá pomocí UZ obtížné [39].
V případě relevantní symptomatologie by měla být před operací provedena gastroduodenoskopie k vyloučení postižení orální části zažívacího traktu.
Doporučení: Pacienti s CN by měli mít před plánovaným výkonem kompletní vyšetření tenkého (CTE, MRE) a tlustého střeva (ileokoloskopie s biopsií a popisem rekta, event. CT kolografie) ne starší než šest měsíců (EBM 5, doporučení: B). CTE a MRE mají stejnou diagnostickou výtěžnost a CTE je spojeno s vyšší radiační zátěží (EBM 2a). Vždy je nutné klinicky vyšetřit perianální oblast a zhodnotit stav svěrače.
3.2. Ulcerózní kolitida (UC)
Pro typ operačního výkonu a taktiku operace je předoperačně nutné vyloučit CN (nevhodná ileopouchoanální anastomóza), posoudit aktivitu nemoci (vhodná trojdobá operace při těžké kolitidě a toxickém megakolon), stav rekta (ileorektální anastomóza ve vybraných případech), stav svěračů a diagnostikovat případnou malignitu (omentektomie, lymfadenektomie).
Koloskopie s bioptickým vyšetřením je u pacientů s UC základní metodou k vyloučení premaligních stavů a malignit. Intubace terminálního ilea pomáhá vylou?it CN v?nejasn?ch sitčit CN v nejasných situacích. Při nemožnosti provést pankoloskopii by mělo být doplněno alternativní vyšetření (CT kolografie, MR). Před operací je nutné zhodnotit funkci análního svěrače klinickým vyšetřením nebo anorektální manometrií či endorektální endosonografie (EUS). Alespoň jedno negativní vyšetření tenkého střeva (CTE, MRE) v průběhu choroby může vyloučit CN [40].
Doporučení: Pacienti s UC by měli mít před plánovaným operačním výkonem kompletní koloskopii s biopsií a zhodnocením zánětlivé aktivity v celém tračníku, včetně rekta. Předoperačně musí být vyšetřena funkce svěrače. V případě diagnostických nejasností by mělo být doplněno vyšetření tenkého střeva (CTE, MRE) (EBM 5, doporučení: B).
3.3. Vyšetření u pacientů s perianálním postižením
Pro adekvátní chirurgické ošetření je nutné identifikovat trakty píštělí a hnisavé kolekce, které je možné přehlédnout při vyšetření v celkové anestezii (tedy v prostoru supralevátorovém, případně ischiorektálním). Je třeba zhodnotit průběh píštěle ve vztahu ke svěračům, případně rozsah destrukce svěrače chorobou či předchozí intervencí. S ohledem na možnost definitivního ošetření píštěle je třeba znát aktivitu choroby v rektu i v proximální části střeva [41].
Při akutním zhoršení lokálního nálezu (periproktální absces) je první volbou vyšetření v celkové anestezii (EUA), které je i terapeutickou metodou (incize abscesu, drenáž abscesu a píštěle, discize).
Před plánovaným EUA by měl pacient podstoupit alespoň jedno ze zobrazovacích vyšetření: EUS nebo magnetická rezonance malé pánve (MRP). Přesnost EUS v identifikaci píštěle je udávána 56– 100 %. Ke zlepšení diagnostiky je možné použít injektáž peroxidu vodíku [42,43]. MRP je neinvazivní, ale nákladnou metodou s přesností identifikace píštěle pohybující se mezi 80 a 91 % [44,45]. V metaanalýze čtyř studií (481 pacientů) [46] byla specificita EUS ve srovnání s MR signifikantně nižší (43 vs 69 %). Kombinací EUA a jedné ze zmíněných zobrazovacích metod lze dosáhnout až 100% úspěšnosti v identifikaci píštěle a abscesu [47]. Všechny tři metody (EUS, MRP, EUA) jsou závislé na erudici specialisty. Klasická ani CT fistulografie nejsou vhodné pro nízkou přesnost a radiační zátěž [48,49].
Před plánovanou eradikací píštěle je nezbytné provést kompletní vyšetření tenkého (MRE, CTE) a tlustého střeva (koloskopie) a vyloučit aktivní luminální postižení. Endoskopické vyšetření rekta identifikuje případnou proktitidu či stenózu v oblasti anorekta, které jsou rizikovým faktorem komplikovaného hojení při eradikaci píštělí či vedou častěji k indikaci výkonu s derivací stolice [50].
Doporučení: MRP, EUS a EUA jsou lokální vyšetření fistulující perianální nemoci se srovnatelnou přesností (EBM 2a). Nezbytné EUA v kombinaci s jednou ze zobrazovacích metod (EUS či MRP) zvyšuje identifikaci lézí téměř na 100 % (EBM 2b, doporučení: B). Před eradikací píštěle je nutné vyšetření tenkého a tlustého střeva (endoskopie rekta) (EBM 5, doporučení: C).
4. Předoperační příprava
Cílem předoperační přípravy je eliminace rizikových faktorů a prevence pooperačních komplikací.
4.1. Nutriční příprava
Správně indikovaná předoperační nutriční podpora snižuje efektivně riziko pooperačních komplikací [51]. Vždy je preferována enterální cesta podání před parenterální. U pacientů s lehkou malnutricí je indikován sipping. Jedná se o nejjednodušší a nejlevnější formu přípravy ve formě výživových nápojů (2– 3/ den). Sipping je možné doplnit o přípravky s imunomodulačním účinkem, které se podle některých studií ukázaly jako efektivní v prevenci infekčních a neinfekčních komplikací [52].
Předoperační enterální výživa (EV) je indikována u pacientů s těžkou malnutricí (váhový úbytek větší než 10– 15 % původní hmotnosti za posledních šest měsíců nebo BMI menší než 18,5 kg/ m2 nebo SGA C nebo hladina sérového albuminu nižší než 30 g/ l) nebo u pacientů, u nichž je předpokládána úplná restrikce příjmu potravy po dobu sedmi dnů nebo významné omezení perorálního příjmu (< 60 % doporučeného příjmu) po dobu 10 dnů. Délka přípravy by měla být min. 10–14 dnů, a to i v případě nutnosti odložení operace [53].
Parenterální výživa (PV) je méně výhodná a je indikována pouze u malnutričních pacientů, u kterých není možné dosáhnout enterální cestou dostatečného kalorického příjmu (< 60 %). PV může být podávána po dobu 7– 10 dnů před operací v kombinaci s enterální výživou nebo výjimečně (obstrukce, vysoká střevní píštěl) jako totální parenterální výživa [54].
Indikaci a podávání EV i PN by měl řídit nutricionista. Vhodná je domácí nutriční příprava.
Doporučení: U malnutričních pacientů je indikována předoperační nutriční podpora i za cenu odložení operace (EBM 2b, doporučení: A). Preferována je vždy enterální výživa. Pokud není enterální cestou možné dosáhnout aspoň 60% energetické potřeby, je indikována parenterální nebo kombinovaná výživa (EBM 2b, doporučení: A).
4.2. Předoperační příprava,
tzv. preconditioning
Lepší výsledek velké operace je očekáván u organizmu s vyšší funkční rezervou, tu je možné zvýšit cvičením v několikatýdenním intervalu před operací. Podle výsledků systematického přehledu kontrolovaných i randomizovaných studií je předoperační aerobní trénink bezpečný a pravděpodobně i přínosný [55].
Kouření může zvyšovat riziko pooperačních komplikací. Ukončení kouření minimálně čtyři týdny před operací je výhodné [56]. Naopak, pouze několikadenní nekouření vede u kuřáků k nadprodukci hlenu a riziko pooperačních komplikací zvyšuje [57].
Alkoholizmus je rizikovým faktorem. Přestože je málo důkazů pro efektivitu abstinence u alkoholiků, doporučuje se nepít alkohol alespoň čtyři týdny před operací [58].
Předoperační anémie je nezávislým rizikovým faktorem pooperačních komplikací. Při anémii je vysoká pravděpodobnost podání krevních derivátů v perioperačním období, což rovněž riziko komplikací zvyšuje. Z těchto důvodů by měla být u IBD pacientů s nízkou hladinou železa (saturace transferinu < 16 %, ferritin < 30 µg/ l) podávána nitrožilní substituce s cílem dosáhnout předoperačního hemoglobinu > 100 g/ l u žen a > 110 g/ l u mužů [59].
Doporučení: Aerobní cvičení (několik týdnů), zanechání kouření (čtyři týdny) a vyloučení alkoholu (čtyři týdny) před operací snižuje riziko pooperačních komplikací (EBM 2– 3, doporučení: B). U anemických pacientů je před operací indikována suplementace železa. Podání transfuze před operací zvyšuje výskyt pooperačních komplikací a mělo by být indikováno pouze u středně a těžce anemických pacientů (hemoglobin < 90 g/ l).
4.3. Medikamentózní terapie a příprava k operaci
Chirurgickou léčbu podstoupí v průběhu onemocnění významná část pacientů s CN nebo UC. Medikamentózní terapie v perioperačním období je jedním z diskutovaných faktorů ovlivňujících pooperační hojení a vznik především krátkodobých komplikací.
4.3.1. Kortikosteroidy
Kortikosteroidy a pooperační hojení
Vzhledem k tomu, že chirurgická léčba pacientů s IBD je indikována především u komplikovaného průběhu nemoci a při selhání konzervativní léčby, užívá mnoho nemocných předoperačně kortikosteroidy. V rámci předoperační přípravy je třeba zohlednit jejich vliv na pooperační hojení. V souvislosti s chirurgickou léčbou prokázaly experimentální studie negativní vliv vysokých dávek kortikosteroidů na hojení anastomóz [60].
Řada retrospektivních studií zaměřených na pacienty s UC podstupujících IPAA identifikovala předoperační léčbu kortikosteroidy ve vysokých dávkách jako nezávislý rizikový faktor časných pooperačních komplikací včetně pánevní sepse, a to i u pacientů s pojistnou ileostomií [61]. Za vysokou dávku kortikosteroidů byla považována dávka prednisolonu ≥ 40 mg/ den [61– 65]. Nicméně Lim et al ve své práci ukázali, že už podávání systémových steroidů v dávce 20– 40 mg prednisolonu denně po dobu minimálně jednoho měsíce vedlo ke zvýšení septických komplikací IPAA ve srovnání s nižší nebo nulovou dávkou steroidů [62]. Obdobný výsledek byl pozorován i ve studii Heuschen et al, kde nejen předoperační léčba kortikosteroidy v dávce > 40 mg/ den prednisolonu, ale i dávka 1– 40 mg denně byla spojena s vyšším, i když statisticky nevýznamným rizikem pánevních septických komplikací IPAA (OR 3,78; 95% CI: 1,46– 9,81, resp. OR 2,25; 95% CI: 0,89– 5,68) [61]. Naopak podle retrospektivní analýzy 692 nemocných z Clevelandu je riziko infekčních komplikací při užívání steroidů vyšší pouze u nemocných bez pojistné ileostomie [63]. Pokud však byla ileopouchanální anastomóza chráněna ileostomií, frekvence komplikací se nelišila od skupiny bez kortikoidů.
U CN též několik studií hodnotících výskyt pooperačních komplikací prokázalo, že terapie kortikosteroidy v předoperačním období je nezávislým rizikovým faktorem komplikovaného hojení anastomózy [66– 68].
Rovněž metaanalýza z roku 2008 ukázala, že předoperační léčba kortikosteroidy je u pacientů s IBD spojena se zvýšeným rizikem celkových (OR 1,41; 95% CI: 1,07– 1,87) a infekčních (OR 1,68; 95% CI: 1,24– 2,28) pooperačních komplikací a toto riziko stoupá se zvyšující se dávkou steroidů [69]. Recentní metaanalýza (2015) dále udává, že kortikosteroidy jsou jedním ze čtyř rizikových faktorů nitrobřišních septických komplikací (OR: 1,99; 95% CI: 1,54– 2,57). Autoři nicméně upozorňují, že dostupné studie jsou observační, a tedy úroveň důkazů nižší [70].
Ve velké americké studii zahrnující 16 000 pacientů operovaných pro IBD v letech 2005– 2012 byly porovnány pooperační komplikace u nemocných, kteří užívali kortikosteroidy více než deset dnů před operací s nemocnými bez této léčby. Dávka a cesta podání hodnoceny nebyly. Nemocní s abúzem kortikosteroidů měli významně vyšší frekvenci všech pooperačních komplikací (CN – OR 1,26; 95% CI: 1,12– 1,41; UC – OR 2,41; 95% CI: 1,72– 3,37) a též více infekčních komplikací [71].
Perioperační substituce kortikosteroidy
U nemocných s dlouhodobým či předoperačním užíváním kortikoidů se předpokládá suprese hypotalamicko‑pituitární adrenalinové osy s následnou supresí produkce kortikosteroidů v kůře nadledvin. Kortikosteroidy jsou důležité hormony pro zvládání stresových situací, včetně operačního stresu a protizánětlivé reakce na stres [72]. Proto je většinou doporučována suplementace kortikosteroidů perioperačně z obavy z nedostatku produkce hormonů v době operačního stresu a z následného rozvoje adrenální krize – tedy akutní insuficience kůry nadledvin s možnými fatálními důsledky [73]. Moderní perioperační péče zkoumající důkazy však jasně tato doporučení nepotvrzuje [74]. Většina postupů přesto doporučuje u nemocných užívajících terapeutické dávky kortikosteroidů perioperační podání obvyklé denní dávky a 100 mg hydrocortisonu před začátkem operace a případně dalších 100 mg
à 8 hod [72].
Doporučení: Terapie kortikosteroidy podávaná především ve vysokých dávkách v předoperačním období zvyšuje riziko infekčních a neinfekčních pooperačních komplikací u pacientů s IBD (EBM 2b,
doporučení: B).
Riziko intraabdominálních septických komplikací je vyšší u UC.
Elektivní operace u UC i CN by měla být provedena až po redukci dávky kortikosteroidů (≤ 20 mg prednisolonu/ den) či po jejich vysazení (EBM 3b, doporučení: C). Pokud není možné dávku redukovat či jde o akutní operaci, je doporučována operace s derivací střevního obsahu stomií s anastomózou/ bez anastomózy, tedy vícedobá operace (EBM 4, doporučení: C). U pacientů užívajících kortikosteroidy v předoperačním období se obvykle doporučuje perioperační podání obvyklé dávky a případně substituční dávka 100– 300 mg hydrocortisonu v den operace (EBM 4, dopuručení: D).
4.3.2. Imunosupresiva
Většina dosud publikovaných prací neprokázala nepříznivý vliv imunosupresivní terapie azathioprinem nebo 6‑ mercaptopurinem podávanými v předoperačním období na vznik infekčních nebo neinfekčních pooperačních komplikací, a to jak u pacientů s CN, tak i u pacientů s UC, kteří podstoupili konstrukci IPAA [62,64,75].
V roce 2011 však byla publikována švédská retrospektivní analýza, která zkoumala v kohortě 343 pacientů s CN výskyt nitrobřišních septických komplikací po střevní anastomóze a/ nebo strikturoplastice. Tato studie identifikovala tři nezávislé rizikové faktory vzniku komplikací – přítomnost nitrobřišní infekce před operací (OR 4,9; 95% CI: 1,2– 19,5), kolokolická anastomóza (OR 4,0; 95% CI: 1,1– 14,4) a užívání azathioprinu v předoperačním období (OR 3,7; 95% CI: 1,0– 13,1) [76].
Cyklosporin je obvykle indikován u pacientů s vysokou aktivitou UC jako záchranná terapie před eventuálním operačním výkonem. Nicméně dle dosavadních prací se zdá, že jeho aplikace nevede k významnému zvýšení rizika pooperačních komplikací po provedení akutní kolektomie [65,75,76].
Doporučení: Imunosupresivní terapie azathioprinem a 6‑ mercaptopurinem v předoperačním období se zdá být bezpečná s ohledem na výskyt pooperačních infekčních a neinfekčních komplikací u pacientů s CN i s UC podstupujících konstrukci IPAA a není nutné tuto léčbu před plánovaným operačním výkonem vysazovat (EBM 3, doporučení C). Podání cyklosporinu před provedením kolektomie pravděpodobně nezvyšuje pooperační komplikace u pacientů s UC (EBM 3, doporučení: C).
4.3.3. Biologická léčba
V důsledku zvyšujícího se počtu pacientů s IBD léčených anti‑TNFα léčivy stoupá i počet operovaných osob exponovaných těmto látkám. Na rozdíl od předchozích léků je otázka bezpečnosti biologické léčby stále nejasná. Do současné doby bylo publikováno několik retrospektivních prací zkoumajících účinek anti‑TNFα terapie v perioperačním období, které ale přinesly rozporuplné výsledky. Tato nejednoznačnost pravděpodobně do značné míry vyplývá z heterogenity studií ve smyslu odlišností studované populace, konkomitantní terapie, intervalu od poslední aplikace anti‑TNFα do operace, převážně malé velikosti sledovaného souboru, typu operačních výkonů a definicí pooperačních komplikací.
Ulcerózní kolitida
Terapie infliximabem (IFX) v perioperačním období pravděpodobně nezvyšuje riziko pooperačních komplikaci u pacientů s UC podstupujících subtotální kolektomii nebo proktokolektomii bez IPAA [78,79]. Dosud ne zcela vyjasněnou otázkou však zůstává její vliv na pooperační hojení po konstrukci IPAA. V roce 2007 vyšla studie Mayo kliniky [15] prokazující více než dvojnásobné zvýšení rizika IPAA specifických a celkových infekčních komplikací (OR 2,6; 95% CI: 0,9– 7,5) u pacientů léčených předoperačně IFX. Je však nutno zdůraznit, že 53 % pacientů mělo interval od poslední aplikace anti‑TNFα před operací delší než dva měsíce a 87 % IPAA výkonů v IFX skupině bylo dvojdobých ve srovnání s jen 9 % v neexponované skupině. Navíc pacienti léčení IFX měli těžší průběh kolitidy a vyšší dávky kortikosteroidů a imunosupresiv ve srovnání s kontrolní skupinou [80]. Obdobný nepříznivý výsledek po podávání IFX přinesla i Clevelandská práce srovnávající pacienty s UC léčené (n = 46) a naivní k IFX (n = 46), kteří podstoupili IPAA ve dvou etapách. Jedinci exponovaní biologické léčbě měli významně vyšší výskyt jak celkových komplikací (OR 3,54; 95% CI: 1,51– 8,31), tak i pánevní sepse (OR 13,8; 95% CI: 1,82– 105) a dehiscence anastomózy (OR 7,87; 95% CI: 1,55– 39,8) zvlášť [81]. Podobně jako v předchozí studii [80] téměř polovina pacientů dostala poslední dávku IFX > 3 měsíce před operací [81].
Nizozemská studie [82] taktéž prokázala vyšší výskyt pánevní sepse IPPA (s pojistnou stomií, nebo bez ní) u jedinců léčených IFX (5/ 21; 24 % vs 0/ 12; p < 0,05). Nicméně u pacientů, kteří podstoupili jako první výkon subtotální kolektomii a následně konstrukci IPAA, nebyl pozorován rozdíl ve frekvenci komplikací ve vztahu k terapii IFX. I zde 72 % pacientů s jednodobým a všichni pacienti s dvojdobým výkonem ukončili léčbu IFX > 3 měsíce před konstrukcí IPAA [17].
Kromě výše zmíněných prací několik dalších studií nepotvrdilo vztah mezi podáváním biologické léčby a vznikem infekčních, neinfekčních nebo celkových, časných pooperačních komplikací [83– 87].
V roce 2010 pak byla publikována metaanalýza [22] pěti studií (čtyři s konstrukcí IPAA), která prokázala statisticky významné zvýšení rizika celkových (OR 1,80; 95% CI: 1,12– 2,87) a nesignifikantně vyšší výskyt infekčních (OR 2,24, 95% CI: 0,63– 7,95) pooperačních komplikací u pacientů léčených předoperačně IFX ve srovnání s neléčenými jedinci. Naopak výsledkem další metaanalýzy [88], která hodnotila pooperační komplikace u pacientů s CN i UC (18 studií) a CN (sedm studií) a UC (osm studií, šest s IPAA) zvlášť, byl u pacientů s UC srovnatelný výskyt celkových komplikací (OR 1,10; 95% CI: 0,81– 1,47) a jen mírné, statisticky nevýznamně vyšší riziko infekčních (OR 1,39; 95% CI: 0,68– 2,85) a neinfekčních komplikací (OR 1,40; 95% CI: 0,81– 1,47) v případě předchozí expozice infliximabu.
Crohnova nemoc
Většina studií sledujících pooperační komplikace u pacientů s CN léčených anti‑TNFα preparáty neprokázala statisticky významné zvýšení rizika v souvislosti s perioperační léčbou biologiky [89– 93]. Nicméně dvě retrospektivní studie z pracovišť v USA přinesly nepříznivé výsledky [94,95]. Studie publikovaná v roce 2008 Appau et al [94], srovnávala výskyt pooperačních komplikací po ileokolické resekci ve skupině pacientů s CN exponovaných IFX ≤ 3 měsíce před operací (n = 60) s neexponovanou skupinou (n = 329) a s kohortou pacientů z období před uvedením anti‑TNFα terapie do léčby IBD (n = 69). Výsledkem práce byl signifikantně vyšší výskyt intraabdominálních septických komplikací (OR 2,62; 95% CI: 1,12– 6,13), vzniku abscesů (OR 5,78; 95% CI: 1,69– 19,7) a nutnosti rehospitalizace (OR 2,33, 95% CI: 1,02– 5,33) ve srovnání s oběma kontrolními skupinami [94].
Další retrospektivní studie s poměrně velkým souborem pacientů (150 léčených anti‑TNFα v průběhu dvou měsíců před operací a 175 kontrol) prokázala signifikantně vyšší výskyt chirurgických (OR 1,96; 95% CI: 1,02– 3,77) a celkových infekčních (OR 2,43; 95% CI: 1,18– 5,03) komplikací u pacientů s předchozí biologickou terapií [95].
Dosavadní tři metaanalýzy zaměřené na pooperační komplikace u CN, na rozdíl od UC, přinesly souhlasné výsledky [88,96,97]. První metaanalýza z roku 2012 [96], která zahrnovala osm studií, prokázala signifikantně vyšší výskyt pooperačních infekčních komplikací celkových (OR 1,50; 95% CI: 1,08– 2,08) i mimobřišních (OR 2,07; 95% CI: 1,30– 3,30) u pacientů s předchozí expozicí anti‑TNFα. Tyto výsledky podpořila další metaanalýza sedmi studií [88], která potvrdila přibližně dvojnásobně vyšší riziko infekčních (OR 1,93; 95% CI: 1,28– 2,89) a celkových pooperačních komplikací (OR 2,19; 95% CI: 1,69– 2,84) u pacientů s předoperační anti‑TNFα terapií. Další metaanalýza [97] neprokázala sice statisticky signifikantní, nicméně mírně zvýšené riziko závažných (intraabdominální septické komplikace, krvácení) i nezávažných komplikací při předoperačním podávání anti‑TNFα (OR 1,59; 95% CI: 0,89– 2,86, resp. OR 1,80; 95% CI: 0,87– 3,71).
Otázkou vztahu mezi intervalem od poslední aplikace anti‑TNFα do operace a rizikem pooperačních komplikací se druhotně zabývaly dvě práce [93,98], které neprokázaly vyšší výskyt komplikací při aplikaci biologické léčby v krátkém odstupu od chirurgické léčby (≤ 14 dnů) ve srovnání s delším intervalem.
Doporučení: V současné době není dostatek informací k jednoznačnému posouzení vlivu předoperačně podávané anti‑TNFα terapie na výskyt perioperačních a pooperačních komplikací. Nelze vyloučit zvýšený výskyt infekčních i neinfekčních komplikací u jedinců exponovaných předoperačně anti‑TNFα, bezpečný interval mezi poslední dávkou léku a operací však není znám (EBM 3b, doporučení: C).
U nemocných s UC je vhodné v takových případech volit operaci s protektivní či dočasnou ileostomií (EBM 3b, doporučení: D).
U pacientů s CN se změna taktiky chirurgické léčby obvykle nedoporučuje.
5. Bezprostřední příprava k operaci a perioperační péče
Bezprostřední příprava před plánovanou operací na horní či dolní části gastrointestinálního traktu u pacientů s IBD by se měla řídit principy moderní perioperační péče (enhanced recovery after surgery – ERAS; Fast Track) doporučenými Evropskou společností ERAS (ERAS Society) [56] a Evropskou společností pro enterální a parenterální výživu (European Society of Parenteral and Enteral Nutrition – ESPEN) [53]. Tento typ péče vychází z medicíny založené na důkazech. Principem je snížení operačního stresu a co nejvíce fyziologický průběh perioperačního období s důrazem na dokonalou léčbu pooperační bolesti (stress‑free and pain‑free surgery). Cílem je nižší frekvence pooperačních komplikací a zkrácení délky hospitalizace [99]. Pacienti s IBD jsou většinou ve věkově mladší kategorii, a proto jsou ideální cílovou skupinu pro uplatnění moderních perioperačních postupů vyžadujících aktivní spolupráci nemocného.
Moderní perioperační péče (ERAS) spočívá v již výše uvedeném preconditioningu a orgánové optimalizaci. U elektivních operací IBD pacientů se uplatňuje předoperační úprava medikace (kortikosteroidy), nutriční příprava a vhodné načasování operace s ohledem na aktivitu zánětu. Součástí ERAS protokolu je omezení perioperačního hladovění. Delší předoperační hladovění vede k vyčerpání zásob glykogenu a preferenčnímu odbourávání proteinů, což společně s operačním stresem vede k rozvoji katabolizmu, který je nevýhodný pro pooperační hojení [100]. Podle doporučení ESPEN [53] je preferováno omezení předoperačního lačnění na 6 hod pro tuhou a pouze 2 hod pro tekutou dietu, což je i v souladu s doporučením České společnosti anesteziologie, resuscitace a intenzivní medicíny z roku 2011. Podávání sacharidového koktejlu (PreOp) v režimu 800 ml večer před operací a 400 ml ráno doplní zásoby glykogenu a je efektivní v prevenci pooperační inzulinové rezistence, čímž přispívá k anabolizmu a celkově snižuje operační stres [101].
Nemocní neabsolvují před operací střevní přípravu. Ortográdní střevní příprava vede k dehydrataci a dyskomfortu pacienta, není přínosná ve smyslu redukce pooperační morbidity či mortality, a není proto před elektivní operací zažívacího traktu indikována [102,103].
Antibiotická profylaxe podávaná 60 min před výkonem snižuje siginifikantně výskyt pooperačních komplikací a je indikována u všech střevních výkonů (včetně lokálních výkonů na rektu a větších výkonů v oblasti perinea) [104].
Všichni pacienti s IBD jsou ve zvýšeném riziku výskytu tromboembolické nemoci (TEN) a související mortality [105,106]. Toto riziko může snížit předoperační korekce anémie a malnutrice, redukce dávky steroidů a zkrácení délky anestezie [105]. Podává se tedy adekvátní farmakologická (nízkomolekulární heparin, nefrakcionovaný heparin), případně kombinovaná (pneumatická komprese) profylaxe dle kritérií středního a vysokého rizika TEN [107]. Dle konsenzu z roku 2014 [108] se doporučuje farmakologická profylaxe po celou dobu hospitalizace. U pacientů, kteří mají ještě některé další riziko tromboembolické nemoci (rodinná či osobní anamnéza, trombofilní stav, malignita apod.) je doporučena kombinovaná farmakologická a mechanická profylaxe. I když mají IBD nemocní vyšší riziko TEN i nadále, nejsou dostatečná data k rutinnímu podávání profylaxe po propuštění. Pouze u konkomitantních malignit je doporučeno podání farmakologické profylaxe ještě další čtyři týdny [108].
Preferovány jsou miniinvazivní chirurgické přístupy (laparoskopie, minilaparotomie). Další součástí protokolu je redukce invazivních intervencí.
Rutinně zavedené invazivní vstupy (močový katetr, nazogastrická sonda, centrální žilní katetr, drény) vedou ke zvýšení výskytu nechirurgických pooperačních komplikací (infekce močových cest, pneumonie, katetrová sepse) [109,110], proto je jejich užití omezeno na speciální indikace. Analgezie cestou předoperačně zavedeného epidurálního katetru je preferována, protože snižuje celkovou spotřebu opioidů, umožňuje časnou mobilizaci pacienta a působí prokineticky na zažívací trakt [111]. V celém perioperačním období se dodržuje cílená tekutinová intravenózní terapie. Pooperačně se uplatňuje časné obnovení perorálního příjmu (již v den operace), aktivní prevence nauzey a zvracení, časná mobilizace a omezení opiátů v analgetických režimech a další postupy dodržující správnou klinickou praxi [53,112].
Pozitivní efekt celého ERAS protokolu byl u IBD pacientů prokázán prospektivní randomizovanou studií [113].
Doporučení: Perioperační péče by měla probíhat podle zásad ERAS: předoperační podání sacharidového koktejlu, omezení předoperačního lačnění (6 hod tuhá strava, 2 hod tekutiny) a redukce invazivních vstupů (močový katetr, centrální žilní katetr), vynechání ortográdní střevní přípravy, antibiotická a tromboembolická profylaxe dle zásad správné klinické praxe, účinná opioidy šetřící pooperační analgezie (epidurální) (EBM 1– 2, doporučení: A).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Doručeno/Submitted: 30. 12. 2014
Přijato/Accepted: 30. 1. 2015
MUDr. Zuzana Šerclová
Chirurické oddělení
Nemocnice Hořovice a. s.
K nemocnici 1106/14
268 31 Hořovice
sercl@seznam.cz


Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Aratari A, Papi C, Leandro G et al. Early versus late surgery for ileo‑ caecal Crohn‘s disease. Aliment Pharmacol Ther 2007; 26(10): 1303– 1312.
2. Bernstein CN, Ng SC, Lakatos PL et al. A review of mortality and surgery in ulcerative colitis: milestones of the seriousness of the disease. Inflamm Bowel Dis 2013; 19(9): 2001– 2010. doi: 10.1097/ MIB. 0b013e318281f3bb.
3. Burisch J, Weimers P, Pedersen N et al. Health‑related quality of life improves during one year of medical and surgical treatment in a European population‑based inception cohort of patients with inflammatory bowel disease – an ECCO‑ EpiCom study. J Crohns Colitis 2014; 8(9): 1030– 1042. doi: 10.1016/ j.crohns.2014.01.028.
4. Kaplan GG, McCarthy EP, Ayanian JZ et al. Impact of hospital volume on postoperative morbidity and mortality following a colectomy for ulcerative colitis. Gastroenterology 2008; 134(3): 680– 687. doi: 10.1053/ j.gastro.2008.01.004.
5. CEBM. Oxford Centre for Evidence‑based Medicine – Levels of Evidence (March 2009). Available from: http:/ / www.cebm.net/ oxford‑ centre‑evidence‑based‑ medicine‑ levels‑ evidence‑ march‑ 2009/ .
6. Dalkey N, Helmer O. An experimental application of the delphi method to the use of experts. Management Science 1963; 9(3): 458– 467.
7. Melmed GY, Siegel CA. Quality improvement in inflammatory bowel disease. Gastroenterol Hepatol (NY) 2013; 9(5): 286– 292.
8. Hwang JM, Varma MG. Surgery for inflammatory bowel disease. World J Gastroenterol 2008; 14(17): 2678– 2690.
9. Ananthakrishnan AN, McGinley EL. Weekend hospitalisations and post‑operative complications following urgent surgery for ulcerative colitis and Crohn’s disease. Aliment Pharmacol Ther 2013; 37(9): 895– 904. doi: 10.1111/ apt.12272.
10. Nguyen GC, Steinhart AH. Nationwide patterns of hospitalizations to centers with high volume of admissions for inflammatory bowel disease and their impact on mortality. Inflamm Bowel Dis 2008; 14(12): 1688– 1694. doi: 10.1002/ ibd.20526.
11. Ananthakrishnan AN, McGinley EL, Binion DG. Does it matter where you are hospitalized for inflammatory bowel disease? A nationwide analysis of hospital volume. Am J Gastroenterol 2008; 103(11): 2789– 2798. doi: 10.1111/ j.1572‑ 0241.2008.02054.x.
12. Kaplan GG, McCarthy EP, Ayanian JZ et al. Impact of hospital volume on postoperative morbidity and mortality following a colectomy for ulcerative colitis. Gastroenterology 2008; 134(3): 680– 687. doi: 10.1053/ j.gastro.2008.01.004.
13. Tekkis PP, Fazio VW, Lavery IC et al. Evaluation of the learning curve in ileal pouch‑ anal anastomosis surgery. Ann Surg 2005; 241(2): 262– 268.
14. Burns EM, Bottle A, Aylin P et al. Volume analysis of outcome following restorative proctocolectomy. Br J Surg 2011; 98(3): 408– 417. doi: 10.1002/ bjs.7312.
15. Kennedy ED, Rothwell DM, Cohen Z et al.Increased experience and surgical technique lead to improved outcome after ileal pouch‑ anal anastomosis: a population‑based study. Dis Colon Rectum 2006; 49(7): 958– 965.
16. Allison S, Corman ML. Intestinal stomas in Crohn‘s disease. Surg Clin North Am 2001; 81(1): 185– 195.
17. Danielsen AK, Rosenberg J. Patient education after stoma creation may reduce health‑ care costs. Dan Med J 2014; 61(4): A4659.
18. Marrie RA, Garland A, Peschken CA et al. Increased incidence of critical illness among patients with inflammatory bowel disease: a population‑based study. Clin Gastroenterol Hepatol 2014; 12(12): 2063– 2070. doi: 10.1016/ j.cgh.2014.03.033.
19. Ha C, Maser EA, Kornbluth A. Clinical presentation and outcomes of inflammatory bowel disease patients admitted to the intensive care unit. J Clin Gastroenterol 2013; 47(6): 485– 490. doi: 10.1097/ MCG.0b013e318275d981.
20. Hebuterne X, Filippi J, Schneider SM. Nutrition in adult patients with inflammatory bowel disease. Curr Drug Targets 2014; 15(11): 1030– 1038.
21. Massironi S, Rossi RE, Cavalcoli FA et al.Nutritional deficiencies in inflammatory bowel disease: therapeutic approaches. Clin Nutr 2013; 32(6): 904– 910. doi: 10.1016/ j.clnu.2013.03.020.
22. Panés J, Bouzas R, Chaparro M et al. Systematic review: the use of ultrasonography, computed tomography and magnetic resonance imaging for the diagnosis, assessment of activity and abdominal complications of Crohn‘s disease. Aliment Pharmacol Ther 2011; 34(2): 125– 145. doi: 10.1111/ j.1365‑ 2036.2011.04710.x.
23. Černý V, Cvachovec K, Ševčík P et al. Doporučený postup vyšetření před diagnostickými nebo léčebnými výkony operační a neoperační povahy s požadavkem anesteziologické péče (tzv. předanestetické vyšetření). Česká společnost anesteziologie, resuscitace a intenzivní medicíny 2009. [online]. Dostupné z: http:/ / www.csarim.cz/ Public/ csarim/ doc/ postupy/ MP_CSARIM_Predanest_vysetreni_verze_2_final_190509.pdf.
24. Kanazawa A, Yamana T, Okamoto K
et al. Risk factors for postoperative intra‑ abdominal septic complications after bowel resection in patients with Crohn‘s disease. Dis Colon Rectum 2012; 55(9): 957– 962. doi: 10.1097/ DCR.0b013e3182617716.
25. Alves A, Panis Y, Bouhnik Y et al. Risk factors for intra‑ abdominal septic complications after a first ileocecal resection for Crohn‘s disease: a multivariate analysis in 161 consecutive patients. Dis Colon Rectum 2007; 50(3): 331– 336.
26. Coakley BA, Divino CM. Identifying factors predictive of surgical‑ site infections after colectomy for fulminant ulcerative colitis. Am Surg 2012; 78(4): 481– 484.
27. BAPEN. MUST Calculator. Available from: http:/ / www.bapen.org.uk/ screening‑ for‑ malnutrition/ must‑ calculator.
28. Detsky AS, McLaughlin JR, Baker JP
et al. What is subjective global assessment of nutritional status? JPEN J Parenter Enteral Nutr 1987; 11(1): 8– 13.
29. Kondrup J, Rasmussen HH, Hamberg O
et al. Nutritional risk screening (NRS 2002): a new method based on an analysis of controlled clinical trials. Clin Nutr 2003; 22(3): 321– 336.
30. Barendregt K, Soeters PB, Allison SP et al.
Diagnosis of malnutrition – screening and assessment. In: Sobotka L (ed). Basics in clinical nutrition. Prague: Galen 2000.
31. Kohout P et al. Dokumentace a hodnocení nutričního stavu pacientů. 1. ed. Praha: Forsapi 2011.
32. Regueiro M. The role of endoscopy in the evaluation of fistulizing Crohn‘s disease. Gastrointest Endosc Clin N Am 2002; 12(3): 621– 633.
33. Fallis SA, Murphy P, Sinha R et al. Magnetic resonance enterography in Crohn‘s disease: a comparison with the findings at surgery. Colorectal Dis 2013; 15(10): 1273– 1280. doi: 10.1111/ codi.12361.
35. Lee SS, Kim AY, Yang SK et al. Crohn disease of the small bowel: comparison of CT enterography, MR enterography, and small‑bowel follow‑through as diagnostic techniques. Radiology 2009; 251(3): 751– 761. doi: 10.1148/ radiol.2513081184.
36. Maconi G, Sampietro GM, Parente F et al. Contrast radiology, computed tomography and ultrasonography in detecting internal fistulas and intra‑ abdominal abscesses in Crohn‘s disease: a prospective comparative study. Am J Gastroenterol 2003; 98(7): 1545– 1555.
37. Panés J, Bouzas R, Chaparro M et al. Systematic review: the use of ultrasonography, computed tomography and magnetic resonance imaging for the diagnosis, assessment of activity and abdominal complications of Crohn‘s disease. Aliment Pharmacol Ther 2011; 34(2): 125– 145. doi: 10.1111/ j.1365‑ 2036.2011.04710.x.
38. Kroeker KI, Lam S, Birchall I et al.
Patients with IBD are exposed to high levels of ionizing radiation through CT scan diagnostic imaging: a five‑year study. J Clin Gastroenterol 2011; 45(1): 34– 39. doi: 10.1097/ MCG.0b013e3181e5d1c5.
39. Strobel D, Goertz RS, Bernatik T. Diagnostics in inflammatory bowel disease: ultrasound. World J Gastroenterol 2011; 17(27): 3192– 3197. doi: 10.3748/ wjg.v17.i27.3192.
40. Fazio VW, Tekkis PP, Remzi F et al. Quantification of risk for pouch failure after ileal pouch anal anastomosis surgery. Ann Surg 2003; 238(4): 605– 614.
41. Ardizzone S, Maconi G, Cassinotti A et al.
Imaging of perianal Crohn‘s disease. Dig Liver Dis 2007; 39(10): 970– 978.
42. Sloots CE, Felt‑ Bersma RJ, Poen AC et al. Assessment and classification of fistula‑ in‑ano in patients with Crohn’s disease by hydrogen peroxide enhanced transanal ultrasound. Int J Colorectal Dis 2001; 16(5): 292– 297.
43. Van Bodegraven AA, Sloots CE, Felt‑ Bersma RJ et al. Endosonographic evidence of persistence of Crohn‘s disease‑associated fistulas after infliximab treatment, irrespective of clinical response. Dis Colon Rectum 2002; 45(1): 39– 45.
44. Schaefer O, Lohrmann C, Langer M. Assessment of anal fistulas with high‑resolution subtraction MR‑ fistulography: comparison with surgical findings. J Magn Reson Imaging 2004; 19(1): 91– 98.
45. Buchanan GN, Halligan S, Bartram CI
et al. Clinical examination, endosonography, and MR imaging in preoperative assessment of fistula in ano: comparison with outcome‑based reference standard. Radiology 2004; 233(3): 674– 681.
46. Siddiqui MR, Ashrafian H, Tozer P et al.
A diagnostic accuracy meta‑analysis of endoanal ultrasound and MRI for perianal fistula assessment. Dis Colon Rectum 2012; 55(5): 576– 585. doi: 10.1097/ DCR. 0b013e318249d26c.
47. Schwartz DA, Wiersema MJ, Dudiak KM et al. A comparison of endoscopic ultrasound, magnetic resonance imaging, and exam under anesthesia for evaluation of Crohn’s perianal fistulas. Gastroenterology 2001; 121(5): 1064– 1072.
48. Yousem DM, Fishman EK, Jones B. Crohn disease: perirectal and perianal findings at CT. Radiology 1988; 167(2): 331– 334.
49. Kuijpers HC, Schulpen T. Fistulography for fistula‑ in‑ano. Is it useful? Dis Colon Rectum 1985; 28(2): 103– 104.
50. Mizrahi N, Wexner SD, Zmora O et al. Endorectal advancement flap: are there predictors of failure? Dis Colon Rectum 2002; 45(12): 1616– 1621.
51. Jie B, Jiang ZM, Nolan MT et al.
Impact of preoperative nutritional support on clinical outcome in abdominal surgical patients at nutritional risk. Nutrition 2012; 28(10): 1022– 1027. doi: 10.1016/ j.nut.2012.01.017.
52. Zhang Y, Gu Y, Guo T et al. Perioperative immunonutrition for gastrointestinal cancer: a systematic review of randomized controlled trials. Surg Oncol 2012; 21(2): 87– 95. doi: 10.1016/ j.suronc.2012.01.002.
53. Weimann A, Braga M, Harsanyi L et al. ESPEN Guidelines on Enteral Nutrition: Surgery including organ transplantation. Clin Nutr 2006; 25(2): 224– 244.
54. Braga M, Ljungqvist O et al. ESPEN Guidelines on Parenteral Nutrition: surgery. Clin Nutr 2009; 28(4): 378– 386. doi: 10.1016/ j.clnu.2009.04.002.
55. O‘Doherty AF, West M, Jack S et al. Preoperative aerobic exercise training in elective intra‑ cavity surgery: a systematic review. Br J Anaesth 2013; 110(5): 679– 689. doi: 10.1093/ bja/ aes514.
56. Gustafsson UO, Scott MJ, Schwenk W et al. Guidelines for perioperative care in elective colonic surgery: Enhanced Recovery After Surgery (ERAS) Society recommendations. World J Surg 2013; 37(2): 259– 284. doi: 10.1007/ s00268‑ 012‑ 1772‑ 0.
57. Kotani N, Hashimoto H, Sessler DI et al. Smoking decreases alveolar macrophage function during anesthesia and surgery. Anestesiology 2000; 92(5): 1268– 1277.
58. Tonnesen H, Rosenberg J, Nielsen HJ et al. Effect of preoperative abstinence on poor postoperative outcome in alcohol misusers: randomised controlled trial. BMJ 1999; 318(7194): 1311– 1316.
59. Dunne JR, Malone D, Tracy JK et al.
Perioperative anemia: an independent risk factor for infection, mortality, and resource utilization in surgery. J Surg Res 2002; 102(2): 237– 244.
60. Aszodi A, Ponsky JL. Effects of corticosteroid on the healing bowel anastomosis. Am Surg 1984; 50(10): 546– 548.
61. Heuschen UA, Hinz U, Allemeyer EH et al. Risk factors for ileoanal J pouch‑related septic complications in ulcerative colitis and familial adenomatous polyposis. Ann Surg 2002; 235(2): 207– 216.
62. Lim M, Sagar P, Abdulgader A et al. The impact of preoperative immunomodulation on pouch‑related septic complications after ileal pouch‑ anal anastomosis. Dis Colon Rectum 2007; 50(7): 943– 951.
63. Ziv Y, Church JM, Fazio VW et al. Effect of systemic steroids on ileal pouch‑ anal anastomosis in patients with ulcerative colitis. Dis Colon Rectum 1996; 39(5): 504– 508.
64. Mahadevan U, Loftus EV Jr, Tremaine WJ et al. Azathioprine or 6‑ mercaptopurine before colectomy for ulcerative colitis is not associated with increased postoperative complications. Inflamm Bowel Dis 2002; 8(5): 311– 316.
65. Beddy D, Dozois EJ, Pemberton JH.
Perioperative complications in inflammatory bowel disease. Inflamm Bowel Dis 2011; 17(7): 1610– 1619. doi: 10.1002/ ibd.
21504.
66. Alves A, Panis Y, Bouhnik Y et al. Risk factors for intra‑ abdominal septic complications after a first ileocecal resection for Crohn‘s disease: a multivariate analysis in 161 consecutive patients. Dis Colon Rectum 2007; 50(3): 331– 336.
67. Post S, Betzler M, von Ditfurth B et al. Risks of intestinal anastomoses in Crohn‘s disease. Ann Surg 1991; 213(1): 37– 42.
68. Yamamoto T, Allan RN, Keighley MR. Risk factors for intra‑ abdominal sepsis after surgery in Crohn‘s disease. Dis Colon Rectum 2000; 43(8): 1141– 1145.
69. Subramanian V, Saxena S, Kang JY et al. Preoperative steroid use and risk of postoperative complications in patients with inflammatory bowel disease undergoing abdominal surgery. Am J Gastroenterol 2008; 103(9): 2373– 2381. doi: 10.1111/ j.1572‑ 0241.2008.01942.x.
70. Huang W, Tang Y, Nong L et al. Risk factors for postoperative intra‑ abdominal septic complications after surgery in Crohn‘s disease: a meta‑analysis of observational studies. J Crohns Colitis 2015.
[In press].
71. Nguyen GC, Elnahas A, Jackson TD. The impact of preoperative steroid use on short‑term outcomes following surgery for inflammatory bowel disease. J Crohns Colitis 2014; 8(12): 1661– 1667. doi: 10.1016/ j.crohns.2014.07.007.
72. Wakim JH, Sledge KC. Anesthetic implications for patients receiving exogenous corticosteroids. AANA J 2006; 74(2): 133– 139.
73. Marik PE, Varon J. Requirement of perioperative stress doses of corticosteroids: a systematic review of the literature. Arch Surg 2008; 143(12): 1222– 1226. doi: 10.1001/ archsurg.143.12.1222.
74. Kehlet H. Clinical course and hypothalamic‑ pituitary‑adrenocortical function in glucocorticoid‑treated surgical patients. Copenhagen, Denmark: FADL Forlag 1976.
75. Subramanian V, Pollok RC, Kang JY et al. Systematic review of postoperative complications in patients with inflammatory bowel disease treated with immunomodulators. Br J Surg 2006; 93(7): 793– 799.
76. Myrelid P, Olaison G, Sjödahl R et al. Thiopurine therapy is associated with postoperative intra‑ abdominal septic complications in abdominal surgery for Crohn‘s disease. Dis Colon Rectum 2009; 52(8): 1387– 1394. doi: 10.1007/ DCR.0b013e3181a7ba96.
77. Hyde GM, Jewell DP, Kettlewell MG et al.
Cyclosporin for severe ulcerative colitis does not increase the rate of perioperative complications. Dis Colon Rectum 2001; 44(10): 1436– 1440.
78. Bregnbak D, Mortensen C, Bendtsen F.
Infliximab and complications after colectomy in patients with ulcerative colitis. J Crohns Colitis 2012; 6(3): 281– 286. doi: 10.1016/ j.crohns.2011.08.014.
79. Norgard BM, Nielsen J, Qvist N et al. Pre‑operative use of anti‑TNF‑α agents and the risk of post‑operative complications in patients with ulcerative colitis – a nationwide cohort study. Aliment Pharmacol Ther 2012; 35(11): 1301– 1309. doi: 10.1111/ j.1365‑ 2036.2012.05099.x.
80. Selvasekar CR, Cima RR, Larson DW et al.
Effect of infliximab on short‑term complications in patients undergoing operation for chronic ulcerative colitis. J Am Coll Surg 2007; 204(5): 956– 962.
81. Mor IJ, Vogel JD, da Luz Moreira A
et al. Infliximab in ulcerative colitis is associated with an increased risk of postoperative complications after restorative proctocolectomy. Dis Colon Rectum 2008; 51(8): 1202– 1207. doi: 10.1007/ s10350‑ 008‑ 9364‑ 7.
82. Eshuis EJ, Al Saady RL, Stokkers PC
et al. Previous infliximab therapy and postoperative complications after proctocolectomy with ileum pouch anal anastomosis. J Crohns Colitis 2013; 7(2): 142– 149. doi: 10.1016/ j.crohns.2012.03.013.
83. Coquet‑ Reinier B, Berdah SV, Grimaud JC et al. Preoperative infliximab treatment and postoperative complications after laparoscopic restorative proctocolectomy with ileal pouch‑ anal anastomosis: a case‑ matched study. Surg Endosc 2010; 24(8): 1866– 1871. doi: 10.1007/ s00464‑ 009‑ 0861‑ 0.
84. Ferrante M, D‘Hoore A, Vermeire S et al.
Corticosteroids but not infliximab increase short‑term postoperative infectious complications in patients with ulcerative colitis. Inflamm Bowel Dis 2009; 15(7): 1062– 1070. doi: 10.1002/ ibd.
20863.
85. Gainsbury ML, Chu DI, Howard LA et al.
Preoperative infliximab is not associated with an increased risk of short‑term postoperative complications after restorative proctocolectomy and ileal pouch‑ anal anastomosis. J Gastrointest Surg 2011; 15(3): 397– 403. doi: 10.1007/ s11605‑ 010‑
1385‑ 6.
86. Schluender SJ, Ippoliti A, Dubinsky M
et al. Does infliximab influence surgical morbidity of ileal pouch‑ anal anastomosis in patients with ulcerative colitis? Dis Colon Rectum 2007; 50(11): 1747– 1753.
87. Yang Z, Wu Q, Wu K et al. Meta‑analysis: pre‑operative infliximab treatment and short‑term post‑operative complications in patients with ulcerative colitis. Aliment Pharmacol Ther 2010; 31(4): 486– 492. doi: 10.1111/ j.1365‑ 2036.2009.04204.x.
88. Narula N, Charleton D, Marshall JK. Meta‑analysis: peri‑ operative anti‑TNFα treatment and post‑operative complications in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2013; 37(11): 1057– 1064. doi: 10.1111/ apt.12313.
89. Colombel JF, Loftus EV Jr, Tremaine WJ et al. Early postoperative complications are not increased in patients with Crohn‘s disease treated perioperatively with infliximab or immunosuppressive therapy. Am J Gastroenterol 2004; 99(5): 878– 883.
90. Kasparek MS, Bruckmeier A, Beigel F et al. Infliximab does not affect postoperative complication rates in Crohn‘s patients undergoing abdominal surgery. Inflamm Bowel Dis 2012; 18(7): 1207– 1213. doi: 10.1002/ ibd.21860.
91. Marchal L, D‘Haens G, Van Assche G et al. The risk of post‑operative complications associated with infliximab therapy for Crohn‘s disease: a controlled cohort study. Aliment Pharmacol Ther 2004; 19(7): 749– 754.
92. Nasir BS, Dozois EJ, Cima RR et al.
Perioperative anti‑tumor necrosis factor therapy does not increase the rate of early postoperative complications in Crohn‘s disease. J Gastrointest Surg 2010; 14(12): 1859– 1865. doi: 10.1007/ s11605‑
010‑ 1341‑ 5.
93. Norgard BM, Nielsen J, Qvist N et al. Pre‑operative use of anti‑TNF‑α agents and the risk of post‑operative complications in patients with Crohn‘s disease – a nationwide cohort study. Aliment Pharmacol Ther 2013; 37(2): 214– 224. doi: 10.1111/ apt.12159.
94. Appau KA, Fazio VW, Shen B et al. Use of infliximab within 3 months of ileocolonic resection is associated with adverse postoperative outcomes in Crohn‘s patients. J Gastrointest Surg 2008; 12(10): 1738– 1744. doi: 10.1007/ s11605‑ 008‑ 0646‑ 0.
95. Syed A, Cross RK, Flasar MH. Anti‑tumor necrosis factor therapy is associated with infections after abdominal surgery in Crohn‘s disease patients. Am J Gastroenterol 2013; 108(4): 583– 593. doi: 10.1038/ ajg.2012.464.
96. Kopylov U, Ben‑ Horin S, Zmora O et al. Anti‑tumor necrosis factor and postoperative complications in Crohn‘s disease: systematic review and meta‑analysis. Inflamm Bowel Dis 2012; 18(12): 2404– 2413. doi: 10.1002/ ibd.22954.
97. Rosenfeld G, Qian H, Bressler B. The risks of post‑operative complications following pre‑operative infliximab therapy for Crohn‘s disease in patients undergoing abdominal surgery: a systematic review and meta‑analysis. J Crohns Colitis 2013; 7(11): 868– 877. doi: 10.1016/ j.crohns.2013.01.019.
98. Waterman M, Xu W, Dinani A et al. Preoperative biological therapy and short‑term outcomes of abdominal surgery in patients with inflammatory bowel disease. Gut 2013; 62(3): 387– 394. doi: 10.1136/ gutjnl‑ 2011‑ 301495.
99. Kehlet H. Organizing postoperative accelerated recovery programs. Reg Anesth 1996; 21 (6 Suppl): 149– 151.
100. Svanfeldt M, Thorell A, Hausel J et al. Effect of „preoperative“ oral carbohydrate treatment on insulin action – a randomised cross‑ over unblinded study in healthy subjects. Clin Nutr 2005; 24(5): 815– 821.
101. Ljungqvist O, Nygren J, Thorell A.
Modulation of post‑operative insulin resistance by pre‑operative carbohydrate loading. Proc Nutr Soc 2002; 61(3):
329– 336.
102. Jung B, Lannerstad O, Pahlman L et al.
Preoperative mechanical preparation of the colon: the patient’s experience. BMC Surg 2007; 7: 5.
103. Güenaga KF, Matos D, Wille‑ Jorgensen P. Mechanical bowel preparation for elective colorectal surgery. Cochrane Database Syst Rev 2011; (9): CD001544. doi: 10.1002/ 14651858.CD001544.pub4.
104. Nelson RL, Glenny AM, Song F. Antimicrobial prophylaxis for colorectal surgery. Cochrane Database Syst Rev 2009; (1): CD001181. doi: 10.1002/ 14651858.CD001181.pub3.
105. Merrill A, Millham F. Increased risk of postoperative deep vein thrombosis and pulmonary embolism in patients with inflammatory bowel disease: a study of National Surgical Quality Improvement Program patients. Arch Surg 2012; 147(2): 120– 124. doi: 10.1001/ archsurg.2011.297.
106. Wallaert JB, De Martino RR, Marsicovetere PS et al. Venous thromboembolism after surgery for inflammatory bowel disease: are there modifiable risk factors? Data from ACS NSQIP. Dis Colon Rectum 2012; 55(11): 1138– 1144. doi: 10.1097/ DCR.0b013e3182698f60.
107. Gumulec J, Penka M, Bezděk R et al.
Prevence žilní trombózy a plicní embolizace v chirurgii, v cévní chirurgii a v urologické chirurgii. Doporučení pro klinickou praxi. Sekce pro trombózu a hemostázu České hematologické společnosti ČLS JEP 2006. [online]. Dostupné z: http:/ / www.thrombosis.cz/ sources/ Guidelines‑ Chirurgie‑ prevence‑ TEN‑ STH‑
V06.pdf.
108. Nguyen GC, Bernstein CN, Bitton A et al.
Consensus statements on the risk, prevention, and treatment of venous thromboembolism in inflammatory bowel disease: Canadian Association of Gastroenterology. Gastroenterology 2014; 146(3): 835– 848. doi: 10.1053/ j.gastro.2014.01.042.
109. Cheatham ML, Chapman WC, Key SP et al. A meta‑analysis of selective versus routine nasogastric decompression after elective laparotomy. Ann Surg 1995; 221(5): 469– 476.
110. Wald HL, Ma A, Bratzler DW et al. Indwelling urinary catheter use in the postoperative period: analysis of the national surgical infection prevention project data. Arch Surg 2008; 143(6): 551– 557. doi: 10.1001/ archsurg.143.6.551.
111. Jorgensen H, Wetterslev J, Moiniche S
et al. Epidural local anaesthetics versus opioid‑based analgesic regimens on postoperative gastrointestinal paralysis, PONV and pain after abdominal surgery. Cochrane Database Syst Rev 2000; (4): CD001893.
112. Fearon KC, Ljungqvist O, Von Meyenfeldt M et al. Enhanced recovery after surgery: a consensus review of clinical care for patients undergoing colonic resection. Clin Nutr 2005; 24(3): 466– 477.
113. Serclova Z, Dytrych P, Marvan J et al. Fast‑ track in open intestinal surgery: prospective randomized study (Clinical Trials Gov Identifier no. NCT00123456). Clin Nutr 2009; 28(6): 618– 624. doi: 10.1016/ j.clnu.2009.05.009.