Doporučené postupy chirurgické léčby pacientů s idiopatickými střevními záněty – 3. část: ulcerózní kolitida, indikace k operaci
Zuzana Šerclová Orcid.org 1, Ondřej Ryska Orcid.org 1, Martin Bortlík Orcid.org 2,3,4, Dana Ďuricová Orcid.org 2, Robert Gürlich5, Pavel Lisý5, Július Örhalmi Orcid.org 6, Pavel Kohout Orcid.org 7, Lucie Prokopová Orcid.org 8, Vladimír Zbořil Orcid.org 8, Tomáš Douda Orcid.org 9, Pavel Drastich Orcid.org 10, Aleš Novotný Orcid.org 11, Petra Matějková Orcid.org 12,13, Karel Mareš Orcid.org 14, Olga Shonová Orcid.org 15, Luděk Hrdlička Orcid.org 16,1, Jana Koželuhová Orcid.org 17, Jiří Stehlík Orcid.org 18, Mojmír Kasalický Orcid.org 19,20, Jaroslav Kalvach21, Jiří Bronský Orcid.org 22, Marie Tomanová23, Martin Liberda Orcid.org 24, Přemysl Falt Orcid.org 25, Milan Lukáš Orcid.org 2
+ Pracoviště
Souhrn
Ulcerózní kolitida je primárně léčena konzervativně. Chirurgická léčba spočívá v odstranění tlustého střeva s uchováním střevní kontinuity nebo bez něj. Třetí část doporučených postupů chirurgické léčby pacientů s idiopatickými střevními záněty se zabývá indikacemi k akutní a elektivní operaci. Doporučení byla zpracována Pracovní skupinou pro IBD při České gastroenterologické společnosti a Sekcí IBD chirurgie při České chirurgické společnosti.
Klíčová slova
chirurgická léčba, doporučený postup, indikace, ulcerózní kolitidaÚvod
Ulcerózní kolitida (UC) je primárně léčena konzervativně. Chirurgická léčba spočívá v odstranění tlustého střeva s uchováním střevní kontinuity, nebo bez něj.
S rozšířením nových možností konzervativní léčby se frekvence operačního řešení pravděpodobně mírně snižuje [1]. Po 10 letech trvání choroby je operováno 10–20 % nemocných. Chirurgická léčba je častější u nemocných s rozsáhlejším postižením tlustého střeva a s atakami akutní těžké kolitidy (ATK).
Pooperační mortalita po elektivních operacích je pod 1 %, po akutních výkonech je signifikantně vyšší, pohybuje se kolem 5 % [2]. Celkové přežití nemocných s pokročilou formou UC (nutnost hospitalizace v době diagnózy, opakovaná léčba kortikoidy, podání imunosupresiv) je po elektivní operaci vyšší než při pokračování konzervativní léčby, a to zejména u pacientů 50letých a starších [3]. Správná indikace k operaci, její dobré načasování a volba výkonu jsou pro nemocné s UC zcela zásadní. Proto členové Pracovní skupiny pro IBD při České gastroenterologické společnosti a Sekce IBD chirurgie při České chirurgické společnosti zpracovali dostupnou literaturu a vytvořili doporučené postupy chirurgické léčby UC, které navazují na 1. část: předoperační příprava [4] a 2. část: Crohnova nemoc [5]. K hodnocení zpracované literatury a doporučení pro praxi byla použita klasifikace dle Oxfordského centra pro EBM (evidence-based medicine) z roku 2009 [6]. Tam, kde nebylo možné dostatečné důkazy získat, byla použita Delphi metoda [7], při které experti (členové Pracovní skupiny pro IBD a přizvaní chirurgové, členové IBD sekce) hlasovali, a do doporučení byl použit výsledek při souhlasu 80 % a více účastníků. Doporučené postupy vycházejí z konsenzu Evropské společnosti pro Crohnovu chorobu a ulcerózní kolitidu (ECCO) [8–10]. V této části jsou zpracovány indikace k operaci.
1. Akutní indikace k operaci
1.1 ATK a toxické megakolon
ATK postihuje 12–25 % nemocných s UC, ve 30 % je prvním projevem onemocnění [9,10]. Je definována jako střevní zánět, který se projevuje více než šesti krvavými průjmy za den a alespoň jedním z příznaků systémového zánětu (toxicity) (tab. 1) [11,12]. Tato kritéria sice vychází z originálního popisu z roku 1955 [11], jsou ale používána i v současných Evropských doporučených postupech [8–10]. Klinické zhoršení odpovídající zánětu prostupujícímu střevní stěnou bylo dříve označováno jako fulminantní či toxická kolitida. Toxické megakolon je extrémní a život ohrožující progrese ATK, k níž dochází asi u 5 % hospitalizovaných nemocných [13]. Rozšíření tračníku je způsobeno poškozením myenterických plexů a relaxačním efektem zánětlivých mediátorů při penetraci zánětu stěnou střevní se vznikem paralytického ileu tlustého střeva [13]. Toxické megakolon je charakterizováno dilatací příčného tračníku nad 6 cm v příčném rozměru na nativním snímku břicha a alespoň jedním z následujících kritérií: teplota nad 38,6 °C, ≥ 120 pulzů/min, leukocytóza ≥ 10,5 × 109/l, anémie; a jedním z následujících projevů: dehydratace, mentální změny, iontová dybalance a hypotenze [14]. Dalšími klinickými příznaky jsou distenze břišní dutiny, bolest břicha a snížení střevní motility až zástava střevní pasáže.
Nemocní s ATK vyžadují hospitalizaci a dle stavu intenzivní péči a sledování zkušeným gastroenterologem a specializovaným kolorektálním chirurgem [9].
Ke stanovení diagnózy a průběhu onemocnění je nezbytný vstupní nativní snímek břicha, při kterém se hodnotí nejen dilatace tračníku, ale i tenkého střeva a žaludku, jež se považují za rizikové faktory rozvoje toxického megakolon a následného orgánového selhání. V práci zabývající se rentgenovými nálezy bylo hodnoceno 45 pacientů s ATK, 53 % mělo dilataci tenkého střeva, u 29 % z nich se rozvinulo toxické megakolon s orgánovým selháním. U nemocných bez dilatace tenkého střeva k těmto komplikacím nedošlo [15]. CT vyšetření má význam pro diagnostiku u pacientů bez známé UC, může určit rozsah postižení tračníku, případně odhalí klinicky diskrétní komplikaci, např. krytou perforaci. Nezbytné je při podezření na perforační příhodu [16].
Běžné biochemické vyšetření je součástí základního vyšetření. Ke stanovení závažnosti je nutný krevní obraz, mineralogram, urea, kreatinin, celková bílkovina, albumin, jaterní testy, CRP, event. prokalcitonin. Sérové hladiny CRP nad 35 mg/l a prokalcitoninu nad 0,55 ng/l jsou u ATK v korelaci s endoskopickým nálezem [17]. Mikrobiologické vyšetření stolice a stanovení toxinu Clostridium difficile má význam diferenciálně diagnostický a terapeutický. Pacienti s konkomitantní klostridiovou infekcí mají 4× vyšší mortalitu, jsou hospitalizováni déle a 7× častěji dospějí ke kolektomii než nemocní bez této infekce [18].
Flexibilní sigmoideoskopie bez insuflace vzduchu nebo s použitím oxidu uhličitého je vhodným postupem, protože umožňuje potvrdit diagnózu a vyloučit kolitidu jiné etiologie (cytomegalovirus, kvasinky, jiné infekční kolitidy). Již na začátku hospitalizace je třeba provést testy, které jsou nezbytné před nasazením imunosupresivní a biologické léčby, aby se další terapie neodkládala (Quantiferron, virové testy, RTG plic, cholesterolemie, magnezemie).
Doporučení: Pacienti s více než šesti průjmovitými stolicemi/ den s příměsí krve a jedním z příznaků: tělesná teplota > 37,8 ˚C, tachykardie > 90/ min, hemoglobin < 105 g/ l, sedimentace erytrocytů > 30 mm/hod (CRP > 30 mg/ l), mají ATK a musí být hospitalizováni a intenzivně léčeni (EBM 5) (tab. 1). Toxické megakolon je charakterizováno dilatací příčného tračníku na 6 cm v příčném rozměru na nativním snímku břicha a alespoň jedním z následujících kritérií: teplota nad 38,6 °C, ≥ 120 pulzů/ min, leukocytóza ≥ 10,5 × 109/ l, anémie; a jedním z následujících projevů:dehydratace, mentální změny, iontová dysbalance a hypotenze (EBM 3b).
Doporučená vyšetření jsou shrnuta v tab. 2.
Léčba ATK spočívá v podpůrné léčbě, konzervativní medikamentózní léčbě a při jejím selhání ve včasné chirurgické intervenci [19,9].
1.1.1 Podpůrná léčba
1. Nezbytná je korekce vnitřního prostředí a hydratace nemocných. Hypokalemie a hypomagnezemie přispívají k dilataci tračníku.
2. Nutriční podpora je preferována perorální či enterální cestou, pokud je tolerována, protože nebyl prokázán žádný příznivý efekt střevního klidu [20]. Parenterální výživa se používá jako doplňková či totální při netoleranci enterálního příjmu.
3. Korekce anémie dle krevního obrazu.
4. Profylaxe tromboembolické nemoci je důrazně doporučována u všech hospitalizovaných, protože jsou ve zvýšeném riziku jejího vzniku i v riziku fatálních následků [21,22].
5. Pro význam rutinního užití antibiotik neexistují vědecké důkazy. Za racionální se považuje antibiotická léčba infekční či hrozící chirurgické komplikace. Dostupné jsou však jen tři malé studie.
6. Je třeba se vyvarovat použití opiátů a dalších léků ovlivňujících střevní motilitu.
7. Opakovaná klinická hodnocení gastroenterologem a kolorektálním chirurgem jsou nutná, i když je nemocný v péči intenzivisty.
1.1.2 Konzervativní léčba
První volba
První volbou u ATK je léčba kortikosteroidy. Doporučovaná dávka je 60 mg metylprednisolonu denně nebo 3–4× denně 100 mg hydrokortizonu, další zvýšení dávky nepřináší efekt [9,23].
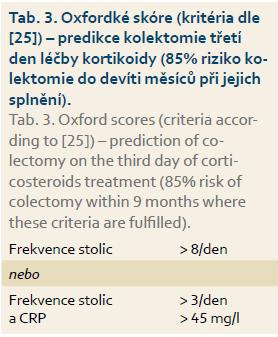
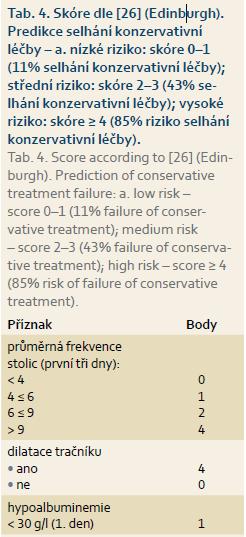
Dle metaanalýzy studií zahrnující 1 991 pacientů léčených kortikoidy byla pro neúčinnost provedena kolektomie v 26–28 %, častěji u nemocných s větším rozsahem kolitidy, vyšší frekvencí stolic, tachykardií, vyšší teplotou, hladinou CRP a s progredujícím radiologickým nálezem [23]. Léčba kortikoidy by neměla být zbytečně protrahovaná, a proto musí být její efekt každý den znovu zvážen. Při neúčinnosti intravenózních kortikoidů po 3–5denním podání je dalším postupem buď léčba chirurgická, nebo tzv. záchranná konzervativní terapie. Dle retrospektivní analýzy 80 nemocných s ATK předoperačně léčených steroidy byla významně vyšší frekvence pooperačních komplikací u pacientů, kteří byli léčeni konzervativně déle, oproti nemocným indikovaným k operaci po kratším podávání kortikosteroidů (medián 8 vs. 5 dnů) [24]. Z prospektivního sledování 49 nemocných s ATK vyplynulo, že kompletní odpověď na kortikoidy během prvních 3–5 dnů vedla pouze k 5% nutnosti kolektomie v mediánu 9 měsíců, ale u pacientů rezistentních k léčbě nebo s neúplnou odpovědí byla nutná kolektomie v 85 % [25]. Z této práce vycházejí Travisova kritéria (Oxfordské skóre) predikce nutnosti kolektomie třetí den léčby kortikoidy (tab. 3). Nezávislé rizikové faktory selhání konzervativní léčby (definovaného jako nutnost kolektomie do 60 dnů) byly indentifikovány ve studii z Edinburghu multivariantní analýzou – průměrná frekvence stolic během prvních tří dnů, dilatace tračníku a hypoalbuminemie první den. Z nich byl sestaven skórovací systém hodnotící riziko selhání konzervativní léčby během prvních tří dnů (tab. 4) [26].
Záchranná léčba
1. Cyklosporin byl používán jako první v léčbě ATK refrakterní ke kortikoidům. Jeho efektivita byla ověřena ve dvou malých placebem kontrolovaných studiích [27]. Dávka 2 mg/kg/den je stejně efektivní jako dávka 4 mg/ /kg/den a je spojena s nižší toxicitou [28]. Nevýhodou záchranné léčby cyklosporinem je relativně vysoká frekvence pozdních kolektomií [9]. Dalším lékem stejné skupiny je takrolimus, ten však není v našich podmínkách k dispozici.
2. Infliximab byl účinný v léčbě ATK refrakterní ke kortikoidům. Největší placebem kontrolovaná studie zahrnovala 44 nemocných. Pacienti léčení infliximabem podstoupili méně často kolektomii do 90 dnů, ale tři měsíce po zařazení nebyl rozdíl v klinické a endoskopické remisi oproti placebu. Nižší účinnost byla u těžší kolitidy [29].
V posledních letech se ukazuje, že efektivita infliximabu je ovlivněna farmakokinetickými vlastnostmi. U ATK může snížit účinnost hypoalbuminemie [30,31] a ztráty stolicí [32], proto cílené dávkování a vyšší dávka jsou účinnější. Akcelerované podání infliximabu, indukce třemi dávkami během 24 dnů (15 nemocných), vedla k signifikantně nižší frekvenci kolektomie (6,7 vs. 40 %) než u standardně zahájené léčby (0–2–6 týdnů) u 35 nemocných [31]. Bezpečnost a dlouhodobý význam zvyšování dávky a zkracování intervalu bude však třeba ještě ověřit.
Účinnost záchranné léčby ATK po selhání terapie kortikoidy porovnávala evropská multicentrická randomizovaná prospektivní studie CYSIF, která neprokázala významný rozdíl mezi podáním cyklosporinu a infliximabu ve standardním dávkování [33,34]. K selhání léčby do tří měsíců došlo u 60 %, resp. 57 % pacientů, srovnatelný byl i výskyt závažných nežádoucích účinků (16 vs. 25 %). Kolektomii podstoupilo 17 % nemocných léčených cyklosporinem a 21 % pacientů léčených infliximabem. V průběhu pěti let se kolektomii vyhnulo 61 % pacientů léčených cyklosporinem a 65 % léčených infliximabem. Dlouhodobou efektivitu léčby cyklosporinem či infliximabem u nemocných s UC se selháním kortikoterapie a bez nutnosti akutní operace bude porovnávat i britská multicentrická studie CONSTRUCT, jejíž výsledky dosud nebyly publikovány [35].
Sekvenční léčba (druhá řada záchranné léčby)
U nemocných s ATK, u nichž po selhání kortikoterapie byla nasazena záchranná léčba, která byla neúčinná, se dosud běžně nedoporučuje pokračování v konzervativní léčbě v obavě ze závažných nežádoucích účinků konzervativní léčby a z vysoké frekvence komplikací po odkládané kolektomii [8–10]. Recentně publikovaný systematický přehled 10 studií různé kvality se zabýval 314 nemocnými s ATK, u kterých selhala záchranná léčba infliximabem, cyklosporinem či takrolimem a v léčbě se pokračovalo druhou řadou záchranné léčby, jiným z výše uvedených tří léčiv (sekvenční léčba). Ke změně léčby došlo nejdéle do tří měsíců od první záchranné terapie. Celkem u 62,5 % (95% CI 57,0–67,8) došlo ke krátkodobé odpovědi a u 38,9 % (95% CI 33,5–44,3) k remisi. Kolektomii podstoupilo 28,3 % nemocných (95% CI 21,7–34,5) do tří měsíců a 42,3 % (95% CI 36,0–48,6) do 12 měsíců. Nežádoucími účinky trpělo 23,0 % nemocných (95% CI 17,7–28,3) a mortalita byla 1 % (95% CI 0–2,1) [36]. K ověření vhodnosti sekvenčního postupu bude třeba více dat, nicméně tato možnost by mohla být zvažována u parciálních respondérů na první řadu záchranné léčby, u kterých je subakutní operace nevhodná.
1.1.3 Chirurgická léčba
Nejčastější indikací k operaci ATK je selhání či nedostatečná účinnost konzervativní léčby. Na správném zhodnocení účinnosti léčby a načasování operace závisí morbidita a mortalita nemocných. V systematickém přehledu studií z roku 2009, který analyzoval výsledky chirurgické léčby ATK v 29 retrospektivních studiích publikovaných v letech 1975–2007, bylo zahrnuto 1 257 akutně operovaných nemocných. Z práce vyplynulo, že došlo ke snížení počtu indikací k operaci pro toxické megakolon (71 % v letech 1975–1984 vs. 22 % v období 1995–2005) a naopak k vyššímu počtu indikací z důvodu selhání konzervativní léčby (16,5 % v letech 1975–1984 vs. 58,1 % v letech 1995–2007). Pooperační mortalita klesla z 10 na 1,8 %, i když morbidita zůstává i v posledních 30 letech vysoká (40 %). Dominují infekční a tromboembolické komplikace, ve studiích však není použita jednotná klasifikace [37]. Populačně zaměřené studie ukazují vyšší mortalitu. Z nové metaanalýzy publikací z let 1990–2015 zahrnující 67 000 pacientů vyplynul významný rozdíl v mortalitě mezi pacienty operovanými elektivně (0,7 %; 95% CI 0,6–0,9) a akutně (5,3 %; 95% CI 3,8–7,4) [38]. V dánské populační studii byla mortalita po akutní operaci 5,2 % a byla signifikantně nižší na pracovištích s vysokým objemem operovaných pacientů (rozdíl v mortalitě 3,1 %; 95% CI 1,6–4,6) [39]. Ve skotské populační studii zaznamenali autoři mortalitu po akutní operaci dokonce 13,6 % [40]. V americké práci analyzující 7 108 pacientů hospitalizovaných pro UC dosahuje mortalita po akutní operaci 5,4 %. Morbidita a mortalita po elektivních operacích je významně nižší opět na pracovištích s vysokým objemem pacientů (> 12 kolektomií/rok) [41]. Nižší mortality se dosahuje v nemocnicích s vysokým počtem všech hospitalizací IBD nemocných (> 150/rok) [42]. Mortalitu a morbiditu negativně ovlivňuje délka pobytu v nemocnici před kolektomií, tedy pozdní indikace k operaci. V již uvedené americké studii měli významně vyšší riziko úmrtí nemocní, kteří byli operováni až po šesti dnech (OR 2,12; 95% CI 1,13–3,97) [41]. Podobně bylo prokázáno vyšší riziko komplikací u protrahované léčby kortikoidy (8 vs. 5 dnů) [24]. Komplikovaněji stonají nemocní ve vyšším věku a s rozsáhlejším střevním postižením [38,39].
Při zvažování pokračování konzervativní léčby je třeba pomýšlet nejen na zvýšenou pooperační morbiditu po jejím protrahovaném podání, ale též na rizika závažných nežádoucích účinků, která ji doprovázejí [43–46]. Je-li zhodnocena neúčinnost záchranné léčby včas, není následná operace pravděpodobně zatížena vyšší frekvencí komplikací než po časnější operaci již po selhání kortikoterapie. Toto potvrzuje australská studie, dle které bylo léčeno pro steroidy rezistentní ATK 116 nemocných v letech 1996–2012. Kortikorezistence byla hodnocena po pěti dnech aplikace. Celkem 19 (18 %) nemocných bylo indikováno ihned k operaci, 89 (82 %) k záchranné léčbě (cyklosporin, infliximab), jejíž selhání bylo hodnoceno po sedmi dnech, a 30 (34 %) nemocných bylo následně operováno v mediánu 12denní celkové hospitalizace. Frekvence pooperačních komplikací se v obou skupinách významně nelišila, z celé skupiny zemřel pouze jeden pacient (0,6 %) [46].
I když další řada záchranné terapie (sekvenční léčba) není doporučována, recentní zkušenosti ukazují, že je možné pokračovat v konzervativní léčbě u nemocných, kteří odpověděli částečně. U nich by tak mohla být provedena méně zatěžující elektivní operace po řádné přípravě.
ATK se systémovými příznaky toxicity – sepse a toxické megakolon – vyžadují intenzivní sledování a hodnocení stavu kolorektálním chirurgem. U toxického megakolon hrozí perforace tračníku v 16–36 %, při které byla udávána ve starších studiích mortalita 27–57 % [19]. V novějších retrospektivních souborech nemocných je mortalita mnohem nižší a blíží se 0 %, což svědčí o časnější indikaci k operaci a dokonalejší intenzivní péči. V práci z roku 2009 bylo identifikováno 14 (15,7 %) nemocných s peroperačním nálezem perforace ze souboru 89 případů s ATK, z nichž nikdo nezemřel, nicméně perforace byla prediktorem pooperačních komplikací [47]. Ve francouzské retrospektivní studii bylo s perforací operováno jen 6 (3,6 %) ze 164 s ATK, morbidita po urgentní operaci byla 37 % a mortalita 0,6 % [48]. U nemocných s imunospresivní léčbou je třeba počítat s tím, že příznaky perforace mohou být nevýrazné a významný počet perforačních příhod se objeví až peroperačně [47]. Intenzivní léčba (JIP, ARO) a včasná operace je indikována u pacientů, u kterých systémová toxicita vede k orgánovému a multiorgánovému selhání. V italském retrospektivním souboru 180 nemocných s ATK dospělo 6,1 % k multiorgánovému selhání. Ze souboru zemřelo 12 nemocných, 75 % z nich na multiorgánové selhání. Autoři předpokládají, že promptní intenzivní péče a emergentní operace sníží tuto mortalitu, protože podání kortikoidů a záchranné léčby je v tomto stavu kontraindikováno [49].
1.1.4 Operační výkon
V posledních desetiletích je preferována subtotální kolektomie s terminální ileostomií oproti dříve uváděné proktokolektomii s ileostomií [50]. Proktokolektomie je delší a náročnější operace vyžadující disekci v malé pánvi s rizikem krvácení, poranění pelvických nervových pletení, s vyšší frekvencí adhezí a pooperačního ileu [16,50,51]. Následná rekonstrukční operace (ileální pouch) je po operaci v malé pánvi komplikovaná, nebo dokonce nemožná. Dalším důvodem k ponechání rekta u ATK je potvrzení diagnózy z definitivního histologického vyšetření preparátu, která se může od UC až v polovině případů lišit [48]. Pro akutní indikaci k operaci u UC je tedy nejvhodnější operací subtotální kolektomie s terminální ileostomií, což je při zkušenosti rychlá operace s malým rizikem peroperační perforace a s možností správné chirurgické taktiky v další době.
1.2 Masivní krvácení
I když příměs krve ve stolici je u UC charakteristickým znakem, k masivnímu krvácení dochází zřídka (v 0–6 %) [50]. Přesto 10 % urgentních kolektomií u nemocných s UC je z této indikace [52]. K život ohrožujícímu krvácení u UC dochází výhradně u extenzivního postižení tračníku – u pankolitidy, častěji u ATK a mladších pacientů, kteří častěji trpí extenzivním zánětem [51]. Chirurgická léčba spočívá v urgentní subtotální kolektomii s terminální ileostomií. Endoskopické ošetření krvácení není u pankolitidy vhodné stejně jako radiologická embolizace [50–53]. Komplikací po subtotální kolektomii je ve 12 % krvácení z rekta, které je možné řešit lokální léčbou nebo se doporučuje tamponáda s adrenalinem [50] a odložená proktektomie.
1.3 Perforace tračníku
K perforaci dochází asi u 2 % nemocných s UC, obvykle v souvislosti s ATK [50]. Steroidy a imunosupresiva mohou zastřít dramatické příznaky peritonitidy. Malá nepoznaná perforace byla ve starších souborech příčinou úmrtí nemocných [54]. U nemocných s UC je častější perforace po diagnostické či terapeutické koloskopii než u jiných nemocných. Rizikovými faktory jsou těžký aktivní zánět, kortikoterapie, vyšší věk, ženské pohlaví, komorbidity a provedení dilatace striktury [55]. Terapií je opět urgentní subtotální kolektomie s ileostomií.
2 Elektivní indikace k operaci
2.1 Chronická refrakterní UC
Cílem konzervativní i chirurgické léčby je dobrá kvalita života nemocných s UC. Indikací k chirurgické intervenci je rezistence ke správně vedené konzervativní léčbě, její nesnášenlivost nebo nežádoucí účinky [56]. Zvážení indikace k elektivní operaci by mělo vyplývat z konsenzu mezi pacientem, gastroenterologem a chirurgem.
Vhodnými kandidáty elektivní operace jsou pacienti po částečně nebo dočasně úspěšné záchranné léčbě ATK, u nichž lze očekávat opakování ATK či není reálná možnost konzervativního udržení remise. Operace by měla být zvažována u nemocných s prokazatelnou kortikodependencí (> 20 % pacientů) [10–12,57]. Racionální posouzení chirurgického výkonu vyžadují nemocní, kteří na konzervativní léčbu odpovídají jen částečně a z operace mohou dlouhodobě profitovat [58]. Indikací mohou být některé mimostřevní projevy, pokud nereagují na léčbu medikamentózní (episkleritida, nodózní erytém a enteropatická artritida I. stupně) [56,59,60]. Specifickou indikací pro dětské pacienty je růstová retardace přes komplexní konzervativní léčbu [61].
2.2 Kolorektální karcinom a dysplazie
Kolorektální karcinom (KRK) se vyskytuje u pacientů s UC častěji než u běžné populace. Kumulativní riziko vzniku KRK narůstá s délkou onemocnění; je 2% po 10 letech, 8% po 20 letech a 18% po 30 letech trvání choroby [62], i když v populačních studiích je zaznamenána nižší incidence (0,06–0,2 %/rok) [63,64], KRK se vyskytuje u pacientů s IBD o 10–15 let dříve než v běžné populaci. V metaanalýze studií byl zaznamenán průměrný věk nemocných s KRK a IBD 43,2 let [62], v populační studii 50,9 let oproti 62,2 let v běžné populaci [63]. V době diagnózy jsou častější pokročilá stadia KRK s horším pětiletým přežitím [65–67]. Rizikovými faktory pro vznik KRK u UC jsou extenzivní kolitida, primární sklerotizující cholangitida (PSC), délka trvání nemoci, UC od mladého věku, rodinná anamnéza KRK a nález dysplazie při endoskopii [63,66–70]. Kolektomie je účinnou prevencí vzniku KRK [69]. Stenóza tračníku je podezřelá z přítomnosti KRK. V souboru 70 nemocných se stenózou byl prokázán karcinom ve 24 %, který byl v 76 % pokročilý [71]. Negativní biopsie nevylučuje přítomnost karcinomu pro zjizvený zánětlivý terén a plazivý růst karcinomu [72]. Stenóza tračníku je indikací ke kolektomii.
Dysplazie (neinvazivní intraepiteliální neoplazie) je významným markerem rizika vzniku KRK u UC. Dysplazie se klasifikuje jako neurčitá, low-grade (LGD) a high-grade dysplazie (HGD) [70,73). V případě nálezu HGD a dysplastické ploché léze je pravděpodobnost vzniku KRK 42–67 % [64]. Při nálezu LGD je riziko KRK nižší, přesto dle metaanalýzy z roku 2007 je 9× vyšší než bez dyplazie [74]. V britské studii bylo prokázáno, že riziko vzniku HGD a KRK je zvýšené u pacientů s nálezem LGD v nepolypoidní i endoskopicky neviditelné lézi, u nemocných s předchozí diagnózou neurčité dysplazie a s z dyplastickou lézí větší než 1 cm (6–8× oproti pacientům bez dysplazie), při diagnóze HGD pak stoupá na více než 30násobek [75]. Některé prospektivní studie trend k progresi plochých lézí s LGD neprokázaly [76,77].
Pokud lze lézi odstranit endoskopicky (technikou polypektomie, slizniční resekce či submukozní disekce) a bioptické vyšetření vzorků odebraných v bezprostředním okolí vyloučí dysplastické změny, je zpravidla možné další endoskopické sledování. Záchyt dysplazie zvyšuje využití endoskopu s vysokým rozlišením a zejména provedení chromodiagnostiky pomocí indigokarmínu nebo metylenové modři [70,73,78].
2.2.1 Indikace k operaci
Pokud nelze dysplastickou lézi kompletně odstranit nebo v případě nálezu dysplazie v okolí odstraněné léze, je indikována preventivní kolektomie. V současné době není jednoznačná shoda na dalším postupu u nemocných s nálezem LGD v makroskopicky intaktní sliznici (endoskopicky neviditelná LGD); variantou chirurgického řešení je endoskopické sledování s odběrem mnohočetných biopsií v odstupu tří měsíců od prvního záchytu dysplazie [69].
Nemocní s KRK a multifokálními dysplaziemi jsou absolutně indikování k operaci, která by měla být provedena podle onkochirurgických zásad, tedy s lymfadenektomií [8,73]. Pro riziko synchronních dysplazií či karcinomu je doporučeným výkonem proktokolektomie, obvykle s J-pouchem, a v případě karcinomu rekta abdominoperineální amputace rekta [79]. Limitovaná resekce tračníku je u pacientů s dysplaziemi nebo KRK vzniklými na podkladě UC kontraindikována vzhledem k vysokému riziku synchronního i metachronního karcinomu [80,81].
Mukosektomie a ručně šitá anastomóza pouch-anální není výhodnější z onkologického hlediska, což vyplývá z metaanalýzy 21 studií zahrnující 4 183 pacientů s ileopouch-anální anastomózou (IPAA). U pacientů po staplerové IPAA byl prokázán pouze trend k vyššímu výskytu dysplazií v oblasti tranzitorní zóny [82]. Skupinou pacientů, u kterých je mukosektomie doporučována, jsou nemocní s HGD nebo karcinomem dolní třetiny rekta.
V selektovaných případech, jako jsou polymorbidní nemocní, nemocní s metastatickým postižením nebo ženy plánující graviditu, může být indikována subtotální kolektomie s ileo-rektální anastomózou. Podmínkou je lokalizace HGD nebo KRK proximálně od rekta a relativně zdravé rektum nevyžadující intenzivní imunosupresivní léčbu [8,73]. V rektu je však zvýšené riziko vzniku KRK – 8,7 % do 25 let trvání nemoci vs. 1,8 % po proktektomii a ileálním pouchi [83].
Pokud dojde k náhodnému nálezu KRK nebo HGD v preparátu po subtotální kolektomii prováděné v rámci trojdobého výkonu, je nutné vzhledem k vysokému riziku synchronní neoplazie provést proktektomii ať již s IPAA nebo terminální ileostomií do tří měsíců od původní operace. U nemocných s UC a KRK je indikována adjuvantní a neoadjuvantní onkologická léčba stejně jako u nemocných bez UC. Nemocní s pouchem indikovaní k radiaci pro karcinom rekta mají horší funkční výsledky a častěji u nich dojde k selhání pouche (16 vs. 7 %) [84]. Těžké průjmy mohou zhoršit toleranci chemoterapie [84,85].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Přijato/ Accepted: 14. 6. 2016
MUDr. Zuzana Šerclová
Chirurgické oddělení
Nemocnice Hořovice, a. s.
K Nemocnici 1106/ 14
268 31 Hořovice
sercl@seznam.cz


Literatura
1. Jeuring SF, Bours PH, Zeegers MP et al. Disease outcome of ulcerative colitis in an era of changing treatment strategies: results from the Dutch population- -based IBDSL Cohort. J Crohns Colitis 2015; 9 (10): 837–845. doi: 10.1093/ecco-jcc/ jjv129.
2. Bernstein CN, Ng SC, Lakatos PL et al. epidemiology and natural history task force of the International organization of the study of inflammatory bowel disease. A review of mortality and surgery in ulcerative colitis: milestones of the seriousness of the disease. Inflamm Bowel Dis 2013; 19 (9): 2001–2010. doi: 10.1097/MIB. 0b013e318281f3bb.
3. Bewtra M, Newcomb CW, Wu Q et al. Mortality associated with medical therapy versus elective colectomy in ulcerative colitis: a cohort study. Ann Intern Med 2015; 163 (4): 262–270. doi: 10.7326/M14- 0960.
4. Šerclová Z, Ryska O, Bortlík M et al. Doporučené postupy chirurgické léčby pacientů s nespecifickými střevními záněty – 1. část: předoperační příprava. Gastroent Hepatol 2015; 69 (1): 12–24. doi: 10.14735/ amgh201512.
5. Šerclová Z, Ryska O, Bortlík M et al. Doporučené postupy chirurgické léčby pacientů s nespecifickými střevními záněty – 2. část: Crohnova nemoc. Gastroent Hepatol 2015; 69 (3): 223–238. doi: 10.14735/amgh2015223.
6.CEBM. Oxford Centre for Evidence- -based Medicine – Levels of Evidence (March 2009). [online]. Available from: http: //www.cebm.net/oxford-centre-evidence-based-medicine-levels-evidence-march-2009/.
7. Dalkey N, Helmer O. An experimental application of the Delphi method to the use of experts. Management Science 1963; 9 (3): 458–467.
8. Øresland T, Bemelman WA, Sampietro GM et al. European Crohn᾿s and Colitis Organisation (ECCO). European evidence based consensus on surgery for ulcerative colitis. J Crohns Colitis 2015; 9 (1): 4–25. doi: 10.1016/j.crohns.2014.08.012.
9. Dignass A, Eliakim R, Magro F et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 1: definitions and diagnosis. J Crohns Colitis 2012; 6 (10): 965–990. doi: 10.1016/j.crohns.2012.09. 003.
10. Dignass A, Lindsay JO, Sturm A et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 2: current management. J Crohns Colitis 2012; 6 (10): 991–1030. doi: 10.1016/j.crohns.2012.09.002.
11. Truelove SC, Witts LJ. Cortisone in ulcerative colitis; final report on a therapeutic trial. Br Med J 1955; 2 (4947): 1041–1048.
12. Silverberg MS, Satsangi J, Ahmad T et al. Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: report of a Working Party of the 2005 Montreal World Congress of Gastroenterology. Can J Gastroenterol 2005; 19 (Suppl A): 5A–36A.
13. Gan SI, Beck PL. A new look at toxic megacolon: an update and review of incidence, etiology, pathogenesis, and management. Am J Gastroenterol 2003; 98 (11): 2363–2371.
14. Jalan KN, Sircus W, Card WI et al. An experience of ulcerative colitis. I. Toxic dilation in 55 cases. Gastroenterology 1969; 57 (1): 68–82.
15. Latella G, Vernia P, Viscido A et al. GI distension in severe ulcerative colitis. Am J Gastroenterol 2002; 97: 1169–1175.
16. Strong SA. Management of acute colitis and toxic megacolon. Clin Colon Rectal Surg 2010; 23 (4): 274–284. doi: 10.1055/ s-0030-1268254.
17. Koido S, Ohkusa T, Takakura K et al. Clinical significance of serum procalcitonin in patients with ulcerative colitis. World J Gastroenterol 2013; 19 (45): 8335–8341. doi: 10.3748/wjg.v19.i45.8335.
18. Ananthakrishnan AN, McGinley EL, Binion DG. Excess hospitalisation burden associated with Clostridium difficile in patients with inflammatory bowel disease. Gut 2008; 57 (2): 205–210.
19. Bitton A, Buie D, Enns R et al. Treatment of hospitalized adult patients with severe ulcerative colitis: Toronto consensus statements. Am J Gastroenterol 2012; 107 (2): 179–194. doi: 10.1038/ajg.2011.386.
20. Gonzalez-Huix F, Fernandez-Banares F, Esteve-Comas M et al. Enteral versus parenteral nutrition as adjunct therapy in acute ulcerative colitis. Am J Gastroenterol 1993; 88 (2): 227–232.
21. Kohoutova D, Moravkova P, Kruzliak P et al. Thromboembolic complications in inflammatory bowel disease. J Thromb Thrombolysis 2015; 39 (4): 489–498. doi: 10. 1007/s11239-014-1129-7.
22. Nguyen GC, Bernstein CN, Bitton A et al. Consensus statements on the risk, prevention, and treatment of venous throm- boembolism in inflammatory bowel dis- ease: Canadian Association of Gastroenterology. Gastroenterology 2014; 146 (3): 835–848. doi: 10.1053/j.gastro.2014.01. 042.
23. Turner D, Walsh CM, Steinhart AH et al. Response to corticosteroids in severe ulcerative colitis: a systematic review of the literature and a meta-regression. Clin Gastroenterol Hepatol 2007; 5 (1): 103–110.
24. Randall J, Singh B, Warren BF et al. Delayed surgery for acute severe colitis is associated with increased risk of postoperative complications. Br J Surg 2010; 97 (3): 404–409. doi: 10.1002/bjs.6874.
25. Travis SP, Farrant JM, Ricketts C et al. Predicting outcome in severe ulcerative colitis. Gut 1996; 38 (6): 905–910.
26. Ho GT, Mowat C, Goddard CJ et al. Predicting the outcome of severe ulcerative colitis: development of a novel risk score to aid early selection of patients for second-line medical therapy or surgery. Aliment Pharmacol Ther 2004; 19 (10): 1079–1087.
27. Shibolet O, Regushevskaya E, Brezis M et al. Cyclosporine A for induction of remission in severe ulcerative colitis. Cochrane Database Syst Rev 2005; (1): CD004277.
28. Van Assche G, D᾿Haens G, Noman M et al. Randomized, double-blind comparison of 4 mg/kg versus 2 mg/kg intravenous cyclosporine in severe ulcerative colitis. Gastroenterology 2003; 125 (4): 1025–1031.
29. Järnerot G, Hertervig E, Friis-Liby I et al. Infliximab as rescue therapy in severe to moderately severe ulcerative colitis: a randomized, placebo-controlled study. Gastroenterology 2005; 128 (7): 1805–1811.
30. Arias MT, Vande Casteele N, Ver- meire S et al. A panel to predict long-term outcome of infliximab therapy for patients with ulcerative colitis. Clin Gastroenterol Hepatol 2015; 13 (3): 531–538. doi: 10. 1016/j.cgh.2014.07.055.
31. Gibson DJ, Heetun ZS, Redmond CE et al. An accelerated infliximab induction regimen reduces the need for early colectomy in patients with acute severe ulcerative colitis. Clin Gastroenterol Hepatol 2015; 13 (2): 330–335.e1. doi: 0.1016/j.cgh.2014.07.041.
32. Brandse JF, van den Brink GR, Wildenberg ME et al. Loss of infliximab into feces is associated with lack of response to therapy in patients with severe ulcerative colitis. Gastroenterology 2015; 149 (2): 350–355. doi: 10.1053/j.gastro.2015.04.016.
33. Laharie D, Bourreille A, Branche J et al. Ciclosporin versus infliximab in patients with severe ulcerative colitis refractory to intravenous steroids: a parallel, open-label randomised controlled trial. Lancet 2012; 380 (9857): 1909–1915. doi: 10.1016/S0140-6736 (12) 61084-8.
34. Laharie D, Bourreille A, Branche J et al. 829 long-term outcomes in a cohort of patients with acute severe ulcerative colitis refractory to intravenous steroids treated with cyclosporine or infliximab. Gastroenterology 2015; 148 (4 Suppl 1): S–163. doi: 10.1016/S0016-5085 (15) 30546-1.
35. Seagrove AC, Alam MF, Alrubaiy L et al. Randomised controlled trial. Comparison of infliximab and ciclosporin in steroid resistant ulcerative colitis: trial design and protocol (CONSTRUCT). BMJ Open 2014; 4 (4): e005091. doi: 10.1136/bmjopen- 2014-005091.
36. Narula N, Fine M, Colombel JF et al. Systematic review: sequential rescue therapy in severe ulcerative colitis: do the benefits outweigh the risks? Inflamm Bowel Dis 2015; 21 (7): 1683–1694. doi: 10.1097/MIB.0000000000000350.
37. Teeuwen PH, Stommel MW, Bremers AJ et al. Colectomy in patients with acute colitis: a systematic review. J Gastrointest Surg 2009; 13 (4): 676–686. doi: 10.1007/s11605-008-0792-4.
38. Singh S, Al-Darmaki A, Frolkis AD et al. Postoperative mortality among patients with inflammatory bowel diseases: a systematic review and meta-analysis of population-based studies. Gastroenterology 2015; 149 (4): 928–937. doi: 10.1053/j.gastro.2015.06.001.
39. Tøttrup A, Erichsen R, Sværke C et al. Thirty-day mortality after elective and emergency total colectomy in Danish patients with inflammatory bowel disease: a population-based nationwide cohort study. BMJ Open 2012; 2 (2): e000823. doi: 10.1136/bmjopen-2012-000823.
40. Roberts SE, Williams JG, Yeates D et al. Mortality in patients with and without colectomy admitted to hospital for ulcerative colitis and Crohn᾿s disease: record linkage studies. BMJ 2007; 335 (7628): 1033.
41. Kaplan GG, McCarthy EP, Ayanian JZ et al. Impact of hospital volume on postoperative morbidity and mortality following a colectomy for ulcerative colitis. Gastroenterology 2008; 134 (3): 680–687. doi: 10.1053/j.gastro.2008.01.004.
42. Ananthakrishnan AN, McGinley EL, Binion DG. Does it matter where you are hospitalized for inflammatory bowel disease? A nationwide analysis of hospital volume. Am J Gastroenterol 2008; 103 (11): 2789–2798. doi: 10.1111/j.1572-0241. 2008.02054.x.
43. Ferrante M, D᾿Hoore A, Vermeire S et al. Corticosteroids but not infliximab increase short-term postoperative infectious complications in patients with ulcerative colitis. Inflamm Bowel Dis 2009; 15 (7): 1062–1070. doi: 10.1002/ibd.20863.
44. Aberra FN, Lewis JD, Hass D et al. Corticosteroids and immunomodulators: postoperative infectious complication risk in inflammatory bowel disease patients. Gastroenterology 2003; 125 (2): 320–327.
45. Sternthal MB, Murphy SJ, George J et al. Adverse events associated with the use of cyclosporine in patients with inflammatory bowel disease. Am J Gastroenterol 2008; 103 (4): 937–943. doi: 10.1111/j.1572-0241.2007.01718.x.
46. Powar MP, Martin P, Croft AR et al. Surgical outcomes in steroid refraktory acute severe ulcerative colitis: the impact of rescue therapy. Colorectal Dis 2013; 15 (3): 374–379. doi: 10.1111/j.1463-1318. 2012.03188.x.
47. Stewart D, Chao A, Kodner I et al. Subtotal colectomy for toxic and fulminant colitis in the era of immunosuppressive therapy. Colorectal Dis 2009; 11 (2): 184–190. doi: 10.1111/j.1463-1318.2008.01579.x.
48. Alves A, Panis Y, Bouhnik Y et al. Subtotal colectomy for severe acute colitis: a 20-year experience of a tertiary care center with an aggressive and early surgical policy. J Am Coll Surg 2003; 197 (3): 379–385.
49. Caprilli R, Latella G, Vernia P et al. Multiple organ dysfunction in ulcerative colitis. Am J Gastroenterol 2000; 95 (5): 1258–1262.
50. Berg DF, Bahadursingh AM, Kaminski DL et al. Acute surgical emergencies in inflammatory bowel disease. Am J Surg 2002; 184 (1): 45–51.
51. Fazio VW. Toxic megacolon in ulcerative colitis and Crohn’s colitis. In: Farmer RG (ed). Clinics in gastroenterology. Philadelphia: WB Saunders 1980: 389–407.
52. Robert JH, Sachar DB, Aufses AH et al. Management of severe hemorrhage in ulcerative colitis. Am J Surg 1990; 159 (6): 550–555.
53. Sachar DB. Management of acute, severe ulcerative colitis. J Dig Dis 2012; 13 (2): 65–68. doi: 10.1111/j.1751-2980.2011. 00560.x.
54. Greenstein AJ, Barth JA, Sachar DB et al. Free colonic perforation without dilatation in ulcerative colitis. Am J Surg 1986; 152 (3): 272–275.
55. Makkar R, Bo S. Colonoscopic perforation in inflammatory bowel disease. Gastroenterol Hepatol (NY) 2013; 9 (9): 573–583.
56. Ross H, Steele SR, Varma M et al. Practice parameters for the surgical treatment of ulcerative colitis. Dis Colon Rectum 2014; 57 (1): 5–22. doi: 10.1097/DCR.000000 0000000030.
57. Bianchi Porro G, Cassinotti A, Ferrara E et al. Review article: the management of steroid dependency in ulcerative colitis. Aliment Pharmacol Ther 2007; 26 (6): 779–794.
58. Mowat C, Cole A, Windsor A et al. IBD Section of the British Society of Gastroenterology. Guidelines for the management of inflammatory bowel disease in adults. Gut 2011; 60 (5): 571–607. doi: 10.1136/ gut.2010.224154.
59. Thomas PD, Keat AC, Forbes A et al. Extraintestinal manifestations of ulcerative colitis following restorative proctocolectomy. Eur J Gastroenterol Hepatol 1999; 11 (9): 1001–1005.
60. Ott C, Schölmerich J. Extraintestinal manifestations and complications in IBD. Nat Rev Gastroenterol Hepatol 2013; 10 (10): 585–595. doi: 10.1038/nrgastro.2013. 117.
61. Heuschkel R, Salvestrini C, Beattie RM et al. Guidelines for the management of growth failure in childhood inflammatory bowel disease. Inflamm Bowel Dis 2008; 14 (6): 839–849.
62. Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut 2001; 48 (4): 526–535.
63. Lakatos L, Mester G, Erdelyi Z et al. Risk factors for ulcerative colitis-associated colorectal cancer in a Hungarian cohort of patients with ulcerative colitis: results of a population-based study. Inflamm Bowel Dis 2006; 12 (3): 205–211.
64. Bernstein CN, Blanchard JF, Kliewer E et al. Cancer risk in patients with inflammatory bowel disease: a population-based study. Cancer 2001; 91 (4): 854–862.
65. Watanabe T, Konishi T, Kishimoto J et al. Ulcerative colitis-associated colorectal cancer shows a poorer survival than sporadic colorectal cancer: a nationwide Japanese study. Inflamm Bowel Dis 2011; 17 (3): 802–808. doi: 10.1002/ibd.21365.
66. Delaunoit T, Limburg PJ, Goldberg RM et al. Colorectal cancer prognosis among patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2006; 4 (3): 335–342.
67. Ording AG, Horváth-Puhó E, Erichsen R et al. Five-year mortality in colorectal cancer patients with ulcerative colitis or Crohn᾿s disease: a nationwide population-based cohort study. Inflamm Bowel Dis 2013; 19 (4): 800–805. doi: 10.1097/MIB. 0b013e3182802af7
68. Soetikno RM, Lin OS, Heidenreich PA et al. Increased risk of colorectal neoplasia in patients with primary sclerosing cholangitis and ulcerative colitis: a meta-analysis. Gastrointest Endosc 2002; 56 (1): 48–54.
69. Annese V, Beaugerie L, Egan L et al. European Crohn᾿s and Colitis Organisation (ECCO). European evidence-based consensus: inflammatory bowel disease and malignancies. J Crohns Colitis 2015; 9 (11): 945–965. doi: 10.1093/ecco-jcc/jjv141.
70. Magro F, Langner C, Driessen A et al. European Society of Pathology (ESP); European Crohn᾿s and Colitis Organisation (ECCO). European consensus on the histopathology of inflammatory bowel disease. J Crohns Colitis 2013; 7 (10): 827–851. doi: 10.1016/j.crohns.2013.06.001.
71. Gumaste V, Sachar DB, Greenstein AJ. Benign and malignant colorectal strictures in ulcerative colitis. Gut 1992; 33 (7): 938–941.
72. Reiser JR, Waye JD, Janowitz HD et al. Adenocarcinoma in strictures of ulcerative colitis without antecedent dysplasia by colonoscopy. Am J Gastroenterol 1994; 89 (1): 119–122.
73. Farraye FA, Odze RD, Eaden J et al. AGA institute medical position panel on diagnosis and management of colorectal neoplasia in inflammatory bowel disease. AGA medical position statement on the diagnosis and management of colorectal neoplasia in inflammatory bowel disease. Gastroenterology 2010; 138 (2): 738–745. doi: 10.1053/j.gastro.2009.12.037.
74. Thomas T, Abrams KA, Robinson RJ et al. Meta-analysis: cancer risk of low-grade dysplasia in chronic ulcerative colitis. Aliment Pharmacol Ther 2007; 25 (6): 657–668.
75. Choi CH, Ignjatovic-Wilson A, Askari A et al. Low-grade dysplasia in ulcerative colitis: risk factors for developing high-grade dysplasia or colorectal cancer. Am J Gastroenterol 2015; 110 (10): 1461–1471. doi: 10.1038/ajg.2015.248.
76. Befrits R, Ljung T, Jaramillo E et al. Low-grade dysplasia in extensive, long-standing inflammatory bowel disease: a follow-up study. Dis Colon Rectum 2002; 45 (5): 615–620.
77. Lim CH, Dixon MF, Vail A et al. Ten year follow up of ulcerative colitis patients with and without low grade dysplasia. Gut 2003; 52 (8): 1127–1132.
78. Rutter MD, Saunders BP, Wilkinson KH et al. Thirty-year analysis of a colonoscopic surveillance program for neoplasia in ulcerative colitis. Gastroenterology 2006; 130 (4): 1030–1038.
79. Holm T, Ljung A, Haggmark T et al. Extended abdominoperineal resection with gluteus maximus flap reconstruction of the pelvic floor for rectal cancer. Br J Surg 2007; 94 (2): 232–238.
80. Rogler G. Chronic ulcerative colitis and colorectal cancer. Cancer Lett 2014; 345 (2): 235–241. doi: 10.1016/j.canlet. 2013.07.032.
81. Bernstein CN, Shanahan F, Weinstein WM. Are we telling patients the truth about surveillance colonoscopy in ulcerative colitis? Lancet 1994; 343 (8889): 71–74.
82. Lovegrove RE, Constantinides VA, Heriot AG et al. A comparison of hand-sewn versus stapled ileal pouch anal anastomosis (IPAA) following proctocolectomy: a meta-analysis of 4183 patients. Ann Surg 2006; 244: 18–26.
83. Andersson P, Norblad R, Soderholm JD et al. Ileorectal anastomosis in comparison with ileal pouch anal anastomosis in reconstructive surgery for ulcerative colitis – a single institution experience. J Crohns Colitis 2013; 8 (7): 582–589. doi: 10.1016/j.crohns.2013.11.014.
84. Radice E, Nelson H, Devine RM et al. Ileal pouch-anal anastomosis in patients with colorectal cancer: long-term functional and oncologic outcomes. Dis Colon Rectum 1998; 41: 11–17.
85. Winther KV, Jess T, Langholz E et al. Long-term risk of cancer in ulcerative colitis: a population-based cohort study from Copenhagen County. Clin Gastroenterol Hepatol 2004; 2 (12): 1088–1095.