Diagnostika a endoskopická intervence u raritního MALT lymfomu proximálního jejuna
Tomáš Drašar1, Lenka Nedbalová1, Tomáš Zajíc2, Tomáš Jirásek Orcid.org 2
+ Pracoviště
Souhrn
Extranodální lymfom z marginální zóny slizniční lymfoidní tkáně (MALT lymfom) se řadí mezi primární extranodální non-Hodgkinovy lymfomy s nízkým stupněm malignity, nicméně s rizikem generalizace. B lymfomy bývají někdy asociovány s dalšími chorobnými stavy (například infekce Helicobacter pylori, Campylobacter jejuni či idiopatické střevní záněty). Klinicky se mohou prezentovat různorodě od dyspeptických potíží s malabsorpcí a hubnutím až po ileózní stav či masivní krvácení do trávicího traktu. Diagnostika se opírá o klinický stav, laboratorní výsledky a výsledky zobrazovacích metod, endoskopie má zásadní význam při vizualizaci nádorové masy a odběru bioptovaného materiálu pro stanovení definitivní histopatologické diagnózy. Léčba MALT lymfomů spadá do rukou onkologa, zahrnuje chemoterapii a/nebo radioterapii, v ojedinělých případech je indikován též resekční výkon. V předložené kazuistice prezentujeme starší pacientku, která byla do našeho IBD centra odeslána pro nespecifické bolesti břicha a pozitivní test na okultní krvácení. Při CT vyšetření před endoskopií byla popsána infiltrace oblasti lienální flexury blíže nespecifikovanou masou, následně provedená koloskopie prokázala pouze intaktní sliznici tračníku, včetně terminálního ilea. Teprve při druhém čtení CT scanu byla zpřesněna lokalizace infiltrátu na oblast proximálního jejuna a jeho mezenteria, následující gastroskopické vyšetření odhalilo stenozující exulcerovaný tumor v proximálním jejunu, nepropustný ani pro pediatrický koloskop. Histologické vyšetření bioptované tkáně potvrdilo diagnózu MALT lymfomu. Při kontrolním gastroskopickém vyšetření po ukončené onkologické léčbě (chemoterapie v kombinaci s radioterapií) byla nadále přítomna endoskopicky neprůchozí stenóza proximálního jejuna. Klinicky u pacientky doházelo k hubnutí, které bylo do jisté míry způsobeno intermitentní poruchou pasáže při pozření tuhého sousta, proto byl perorální příjem obohacen o vysokokalorický sipping. Další kontrolní CT břicha vykazovalo regresi infiltrátu, ale přetrvávala stenóza proximálního jejuna v délce asi 7 cm. Dle přání pacientky nebyla provedena chirurgická resekce stenotického úseku střeva, ale přistoupili jsme k endoskopické dilataci stenotického úseku jejuna balonkem. Po prvních dvou dilatacích postižené oblasti došlo u pacientky k přechodnému zlepšení tolerance tuhé stravy. Pro restenózu byla provedena třetí endoskopická dilatace s rozvojem komplikací, které zahrnovaly krátkodobou oběhovou nestabilitu s bolestmi břicha a nakonec vyústily v neodkladné chirurgické řešení.
Klíčová slova
stenóza, jejunum, lymfom z B-buněk marginální zóny, perforace střeva, dilatace, MALT
Úvod
MALT lymfom představuje jeden z typů non-Hodgkinova lymfomu, mezi další nejčastější B lymfomy trávicího traktu řadíme Burkittův lymfom, difuzní velkobuněčný B lymfom (DLBCL), folikulární lymfom a lymfom z plášťové zóny [1]. MALT lymfom patří mezi primární extranodální B lymfomy s nízkým stupněm malignity, ale s častou lokální recidivou a s možným rizikem generalizace. Výskyt tohoto nádoru je častější v žaludku (až 60 %) než v ostatních částech zažívacího traktu. Mimo trávicí trakt je možný výskyt MALT lymfomu ve slinných žlázách, plicích, štítné žláze, očních adnexech a kůži, vyskytuje se však jako primární nádor i v lymfatických uzlinách. B lymfomy bývají někdy asociovány s některými chorobnými stavy (např. infekcí Campylobacter jejuni, Helicobacter pylori, Borrelia burgdorferi a Chlamydia psittaci, idiopatickými střevními záněty či u imunokompromitovaných pacientů). Klinicky vedou k nespecifickým projevům vztaženým k primárnímu umístění nádoru ve tkáni, které zahrnují bolesti břicha, změnu frekvence a konzistence stolice, hubnutí, borborygmy a vzácněji ileózní stavy z útlaku trávicí trubice nádorovou masou či masivní krvácení do trávicího traktu z exulcerovaného tumoru. V případě pozitivity Helicobacter pylori nebo Campylobacter jejuni může léčba antibiotiky vést k regresi lymfomu [2]. Při ileózním stavu je nutná chirurgická resekce postiženého úseku střeva. Míra recidivy nádoru po léčbě je vysoká, avšak pětileté přežití MALT lymfomů po terapii se odhaduje na 70 % [3,4].
Kazuistika
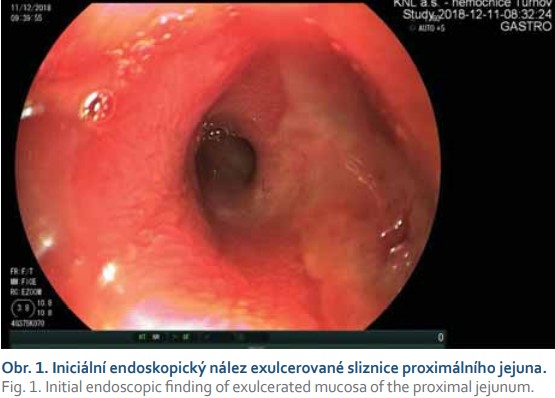
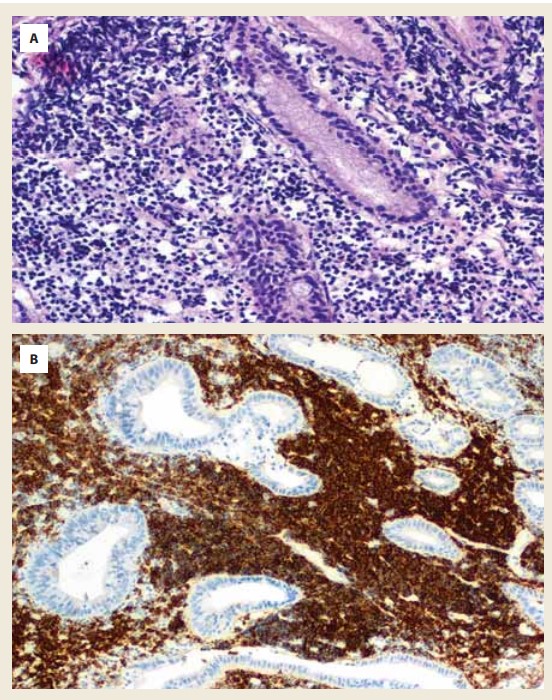
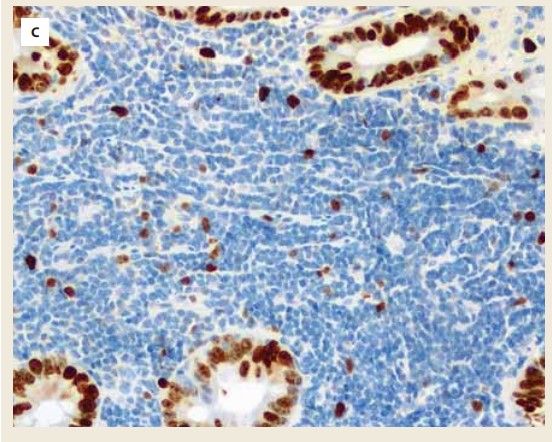
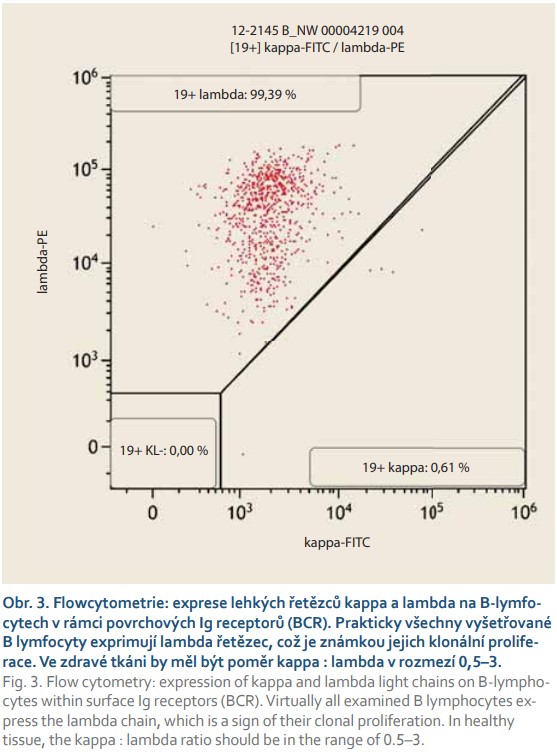
První kontakt s 68letou ženou proběhl v listopadu 2018, kdy byla doporučena k našemu vyšetření z interní ambulance pro difuzní bolesti břicha s maximem v mezogastriu, borborygmy a změnu frekvence stolice. Vstupní laboratorní vyšetření u nemocné vykazovalo pozitivní test na okultní krvácení, ostatní laboratorní parametry (krevní obraz, základní biochemie) byly bez pozoruhodností. Pacientka se chronicky léčila s arteriální hypertenzí a hypercholesterolemií, pravidelně užívala ACE inhibitory a statiny. Pacientka dříve prodělala cholecystektomii pro cholecystolitiázu a operaci benigní cysty pravého ovaria. Před plánovanou koloskopií bylo provedeno CT vyšetření břicha, kde byla popsána infiltrace lienální flexury s pakety uzlin retroperitoneálně. Koloskopické vyšetření vykazovalo intaktní sliznici celého tračníku včetně terminálního ilea. Před indikovanou gastroskopií bylo vyžádáno druhé čtení CT scanu, na jehož základě byl upraven jeho popis se závěrem transmurální stenózy proximálního jejuna za Treitzovým vazem v délce 7 cm a infiltrace jejunálního mezenteria. V diferenciální diagnostice byl na prvním místě zvažován lymfom. Následovalo gastroskopické vyšetření s nutností použití pediatrického koloskopu s intubací proximálního jejuna až ke stenóze, která byla těsná, makroskopicky se známkami ulcerace sliznice (obr. 1). Aborálně do tenkého střeva nebylo možné proniknout pro těsnou stenózu, dále během výkonu bylo odebráno několik bioptických vzorků, které byly odeslány k histologickému vyšetření. Do chronické medikace pacientky byly přidány inhibitory protonové pumpy. Histologické vyšetření prokázalo infiltraci stěny střevní tvořenou malými lymfoidními elementy bez záchytu lymfoepitelových lézí, diferenciálně diagnosticky byl zvažován i zánětlivý původ stenózy (obr. 2). Infekce H. pylori nebyla prokázána. Histologické vyšetření doporučilo získání nových bioptických vzorků k vyšetření tkáně průtokovým cytometrem, toto opakované vyšetření již histologicky stanovilo diagnózu MALT lymfomu a lymfomová skupina ve FN Motol potvrdila diagnózu MALT lymfomu s plazmocytoidní diferenciací v proximálním jejunu. Výsledky imunohistochemického vyšetření a vyšetření průtokovou cytometrií svědčily pro lymfom z marginální zóny při klonální proliferaci B lymfocytů exprimujících lambda řetězce (obr. 3).

Pacientka byla na konci ledna 2019 referována do komplexního onkologického centra naší nemocnice. Šest sérií chemoterapie (RCHOP) absolvovala od března 2019. Podávanou chemoterapii tolerovala bez významných komplikací, porucha pasáže vymizela. Po ukončení chemoterapie v červnu 2019 bylo provedeno re-stagingové CT vyšetření břicha, kde byla patrna výrazná regrese nálezu lymfomu v proximálním jejunu. Kontrolní gastroskopie prokázala trvající cirkulární stenózu proximálního jejuna neprůchozí pro přístroj, sliznice okolo stenózy byla klidná, tužší, ale bez ulcerací. Odebrali jsme sérii bioptických vzorků, histologicky byla potvrzena přetrvávající infiltrace kompatibilní s diagnózou MALT lymfomu. V září 2019 onkolog indikoval pacientku k radioterapii. Ambulantně bylo aplikováno fotonové záření na lymfomem postiženou oblast v dávce 50 Gy. Pacientka držela bezezbytkovou dietu s výživovou podporou vysokokalorickým sippingem. Šest týdnů po ukončení radioterapie následovala kontrolní gastroskopie. Endoskopický nález byl shodný s předchozím vyšetřením. Bioptický vzorek odebraný z okolí stenózy nebyl infiltrován lymfomem, nicméně se jednalo o vyšetření výrazně limitované nereprezentativností dodaného materiálu.
V mezidobí byla pacientka klinicky bez poruchy pasáže, bezezbytkovou stravu tolerovala dobře. Hmotnost a výživové parametry pacientky byly v mezích normy. Po 2 měsících v únoru 2020 se u pacientky objevily bolesti břicha a zanedlouho se přidaly intermitentní poruchy pasáže s následným hubnutím. Pacientce byla nabídnuta chirurgická resekce stenotického úseku střeva, kterou kategoricky odmítala. Po konzultaci s gastroenterologickým pracovištěm FN Královské Vinohrady jsme přistoupili k endoskopické hydraulické dilataci stenózy balonkem, lumen střeva bylo dilatováno na 11 mm, výkon se obešel bez komplikací. Postprocedurálně se klinický stav pacientky upravil, byla bez bolestí břicha, tolerovala tuhou stravu a nadále neztrácela hmotnost. Při kontrolním gastroskopickém vyšetření v květnu 2020 byla nalezena restenóza proximálního jejuna nepropustná pro endoskop. Proto byla znovu provedena balonková dilatace, pro intraprocedurální hemoragii byla však dilatace ukončena na průměru lumen 13,5 mm, za stenotickým úsekem střeva byla patrná klidná sliznice tenkého střeva, dilatace měla jen přechodný efekt.
Při kontrole v poradně v červenci 2020 bylo pro podezření na recidivu lymfomu doplněno CT vyšetření, kde byla patrná stenóza proximálního jejuna, nicméně recidiva nádoru nebyla potvrzena. Z tohoto důvodu byla za etiologii stenózy považována fibrotizace tkáně tenkého střeva po radioterapii. Vzhledem k nedostatečnému efektu navzdory dvěma endoskopickým dilatacím stenózy proximálního jejuna byla pacientce nabídnuta kurativní chirurgická resekce postiženého úseku, ke které se však nadále stavěla odmítavě.
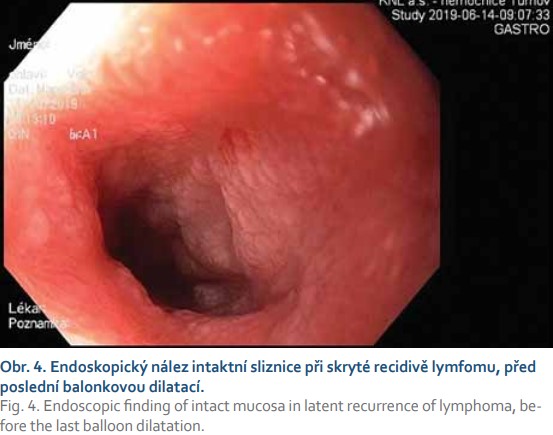
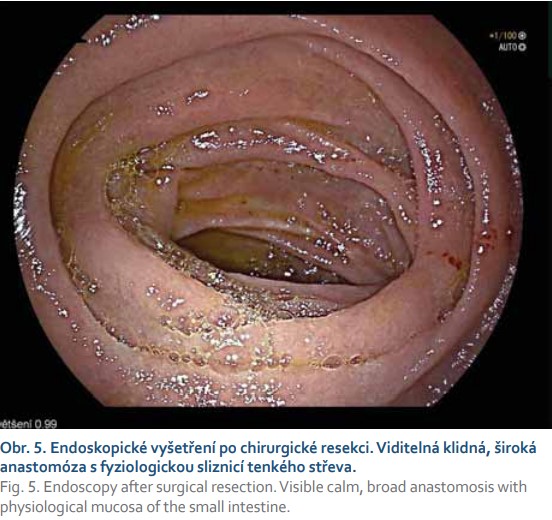
V srpnu 2020 při třetí endoskopické dilataci stenózy bylo dosaženo průměru střevního lumen 15 mm, po dilataci byla endoskopicky sliznice klidná, bez známek krvácení (obr. 4). Bezprostředně po výkonu se u pacientky rozvinula výrazná bolest břicha, následovala hypotenze a tachykardie. Na endoskopickém sále byly podány krystaloidní roztoky, po nichž za krátkou chvíli došlo k oběhové stabilitě. Nativní RTG snímek břicha neprokázal pneumoperitoneum, časné laboratorní vyšetření nesvědčilo pro masivní krvácení. Pacientka byla ponechána na monitorovaném lůžku naší dospávací jednotky, po 4 hodinách monitorace bolest břicha neustoupila. Fyzikální vyšetření následně odhalilo diskrétní známky peritoneálního dráždění. Na kontrolním nativním RTG snímku břicha bylo popsáno pneumoperitoneum, které bylo potvrzeno CT vyšetřením. Pacientka následně podstoupila urgentní chirurgickou revizi dutiny břišní, při níž bylo zjištěno hemoperitoneum způsobené rupturou závěsu střeva. Chirurg provedl resekci 12 cm tenkého střeva a stenotického úseku jejuna s end-to-end anastomózou. Pooperační průběh byl bez komplikací. V resekátu byla histologicky zjištěna přítomnost MALT lymfomu a perforace stěny při sekundární ischemické enteritidě, okraje resekátu nevykazovaly přítomnost nádorové infiltrace. Po operaci byla pacientka následně již bez poruchy pasáže, nebylo nutné u ní pokračovat v bezezbytkové dietě, racionální stravu tolerovala dobře, subjektivně pociťovala pouze borborygmy. Při poslední endoskopické kontrole v lednu 2021 byla anastomóza klidná, volně průchodná pro endoskop, makroskopicky i mikroskopicky bez recidivy lymfomu (obr. 5).
Diskuze
Endoskopické nálezy při MALT lymfomu v žaludku jsou v literatuře velmi dobře popsány. Naopak makroskopický vzhled MALT lymfomu v tenkém střevě je pro svůj raritní výskyt nedostatečně zdokumentován. Podle dostupných studií byly stanoveny tři makroskopické typy MALT lymfomu tenkého střeva: ulcerativní, polypoidní a povrchový [3]. Endoskopická ultrasonografie byla k diagnostice MALT lymfomu tenkého střeva použita jen v několika málo případech. Standardem v diagnostice nadále zůstává bioptický odběr tkáně s histologickou verifikací a přítomností specifického imunofenotypu B buněk (pozitivní pro CD19, CD20 a CD22 a negativní na CD5, CD10 a CD23) [5,6]. Léčba MALT lymfomu tenkého střeva patří do rukou onkologa a obnáší chemoterapii a/nebo radioterapii, avšak doposud nebyl vytvořen standardizovaný postup léčby.
Důkazy o účinnosti eradikace H. pylori v případě pozitivity u duodenálních MALT lymfomů nejsou jednoznačné. Touto problematikou se zabývala jediná studie, která byla publikována v Japonsku. V této studii bylo sledováno celkem šest pacientů s MALT lymfomem duodena, u dvou z nich došlo k regresi nádoru po eradikaci H. pylori. Ze studie vyplývá pravděpodobný vztah v odezvě lymfomu na eradikační terapii H. pylori a možným nepříznivým prognostickým faktorem by mohla být hloubka invaze tumoru a postižení okolních lymfatických uzlin [7].
Dispenzární endoskopický dohled u MALT lymfomů není jasně definován, v našem centru provádíme gastroskopické vyšetření v intervalu 6 měsíců kvůli obavám z časté recidivy lymfomu a tvorby stenózy v anastomóze. U pacientů se systémovými B příznaky (únava, noční pocení, úbytek na hmotnosti), elevací laktátdehydrogenázy a zvětšujícími se lymfatickými uzlinami je nutno pomýšlet na transformaci v difuzní velkobuněčný B lymfom (DLBCL – diffuse-large-B-cell-lymphoma). V takovém případě je nutno provést horní endoskopii s kontrolní biopsií sliznice tenkého střeva a při negativním histologickém nálezu indikovat vyšetření pomocí PET/CT.
Chirurgická léčba lymfomů je nutná u pacientů, kteří mají endoskopicky neřešitelné krvácení z nádorové masy nebo klinické obtíže či ileus způsobený obstrukcí lumen střeva [8]. Náš přístup k endoskopické dilataci stenózy proximálního jejuna při předpokládané remisi nádoru v tomto konkrétním případě byl do jisté míry ovlivněn přáním pacientky vyhnout se chirurgickému zákroku. Zároveň bylo přihlédnuto k obecnému doporučení pro endoskopickou léčbu nenádorových stenóz trávicího traktu. Literární údaje o úspěšnosti endoskopické terapie stenózy po léčbě MALT lymfomu lokalizovaného v tenkém střevě nejsou v současné době k dispozici.
Závěr
Rozpoznat primární lymfom gastrointestinálního traktu není vždy jednoduché, což je způsobeno zejména umístěním primárního nádoru a jeho nespecifickou klinickou prezentací. Primární lymfomy mohou napodobovat jiná onemocnění, např. vředovou chorobu, jiné častější neoplazie nebo idiopatické střevní záněty. Pomýšlet na maligní lymfom bychom měli vždy, když jsou přítomny systémové B příznaky (nevysvětlitelný úbytek hmotnosti, noční pocení, teploty). Při restenóze je u těchto pacientů vždy nutné pomýšlet na recidivu lymfomu i přes fyziologicky vyhlížející sliznici v endoskopickém obraze. Instrumentální zásahy jsou v terénu recidivy tumoru obzvláště rizikové pro jeho křehkost. Proto je nutné pacienta, který prodělal MALT lymfom, vždy po endoskopickém vyšetření bedlivě sledovat a při rozvoji komplikací adekvátně reagovat.
Doručeno/Submitted: 4. 6. 2021
Přijato/Accepted: 12. 7. 2021
MUDr. Tomáš Drašar
IBD Centrum Turnov
Krajská nemocnice Liberec, a. s.
28. října 1000
511 01 Turnov
tomas.drasar@nemlib.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Urban O. Zhoubná onemocnění foregutu. 2021 [online]. Dostupné z: https: //www.sgo-cls.cz/onkologie-horni-casti-traviciho-traktu/duodenum/.
2. Wotherspoon AC, Doglioni C, Diss TC et al. Regression of primary low-grade B-cell gastric lymphoma of mucosa-associated lymphoid tissue type after eradication of Helicobacter pylori. Lancet 1993; 342(8871): 575–577. doi: 10.1016/0140-6736(93)91409-f.
3. El Saghir NS, Jessen K, Mass RE et al. Combination chemotherapy for primary small intestinal lymphoma in the Middle East. Eur J Cancer Clin Oncol 1989; 25(5): 851–856. doi: 10.1016/0277-5379 (89)90131-4.
4. Akbulut H, Soykan I, Yakaryilmaz F et al. Five-year results of the treatment of 23 patients with immunoproliferative small intestinal disease: a Turkish experience. Cancer 1997; 80(1): 8–14. doi: 10.1002/ (sici) 1097-0142 (19970701) 80: <8:: aid-cncr2>3.0.co; 2-t.
5. Zhang Q, Siebert R, Yan M et al. Inactivating mutations and overexpression of BCL10, a caspase recruitment domain-containing gene, in MALT lymphoma with t (1; 14) (p22; q32). Nat Genet 1999; 22(1): 63–68. doi: 10.1038/8767.
6. Khalil MO, Morton LM, Devesa SS et al. Incidence of marginal zone lymphoma in the United States, 2001–2009 with a focus on primary anatomic site. Br J Haematol 2014; 165(1): 67–77. doi: 10.1111/bjh.12730.
7. Nagashima R, Takeda H, Maeda K et al. Regression of duodenal mucosa-associated lymphoid tissue lymphoma after eradication of Helicobacter pylori. Gastroenterology 1996; 111(6): 1674–1678. doi: 10.1016/s0016-5085(96)70032-x.
8. Belada D, Trněný M et al Kooperativní lymfomové skupiny. Diagnostické a léčebné postupy u nemocných s maligními lymfomy. IX. vydání. Hradec Králové 2016.