Desmoidní fibromatóza jako vzácný nádor mezenteria
Lukáš Grochol1, Ivana Cibulková1, Jan Hrudka2, Jan Hajer Orcid.org 1
+ Pracoviště
Souhrn
V následující kazuistice prezentujeme případ 31letého pacienta vyšetřovaného pro podezření na nádor tenkého střeva. Nádory tenkého střeva jsou samy o sobě relativně vzácné a k definitivní diagnóze mnohdy dochází až po chirurgické resekci. Stejně tomu bylo i u našeho pacienta vyšetřovaného pro nález měkkotkáňového útvaru v oblasti tenkého střeva dle zobrazovacích vyšetření. Po vyloučení hormonální aktivity byla provedena diagnostická laparotomie. Histopatologicky byl zjištěn vzácný nádor mezenteria – desmoidní fibromatóza. Jedná se o nádor bez metastatického potenciálu se středně maligním potenciálem pro agresivní růst do okolních struktur a orgánů a velké procento lokálních recidiv.
Klíčová slova
mezenterium, sarkom, esmoidní fibromatóza, nádory tenkého střeva
Úvod
Desmoidní fibromatóza (DF) nebo také agresivní fibromatóza je relativně vzácný mezenchymální nádor charakteristický proliferací fibroblastů a myofibroblastů vycházejících z hluboké svalové fascie, aponeurózy, šlach nebo jizvové tkáně. Jedná se o klonální fibroblastickou proliferaci s benigní morfologií (zejména s absencí nekróz, jaderného polymorfizmu nebo atypických mitóz), bez metastatického potenciálu. Pro infiltrativní růst do okolních struktur a orgánů a vysokou tendenci k lokálním recidivám po radikální excizi se však řadí mezi nádory se středně maligním potenciálem. Řadí se mezi low-grade sarkomy [1,2].
Desmoidní fibromatóza bývá asociována s traumaty, endokrinními faktory nebo familiární adenomatózní polypózou (FAP, Gardnerův syndrom), ale etiologie je stále nejasná. Rozdělujeme ji buď podle mechanizmu vzniku na sporadickou a geneticky asociovanou, nebo podle anatomické lokalizace: extraabdominální fibromatóza (60 %) – hlava a krk, končetiny, trup; fibromatóza břišní stěny (25 %); intraabdominální fibromatóza (8–15 %) – nejčastěji mezenteria, dále retroperitonea nebo omenta. Intraabdominální nádory bývají nejvíce agresivní, zejména svou schopností infiltrovat okolní orgány [1].
Popis případu
Pacient, 31 let, bez interních komorbidit, pouze na terapii inhibitorem protonové pumpy (IPP) pro refluxní chorobu jícnu, byl v březnu 2021 opakovaně vyšetřen na ambulanci Chirurgické kliniky 3. LF UK a FNKV pro bolesti břicha v hypogastriu s iradiací do zad a nechutenství. Přechodně byly přítomny 2–3 řídké stolice denně a zvýšená plynatost, anamnéza stran abdominálního traumatu byla negativní. Při fyzikálním vyšetření dominovala palpační bolestivost v pravém mezo/hypogastriu. Výsledky základních laboratorních odběrů byly bez významných odchylek od normy.
Abdominální sonografie zobrazila ložisko v játrech charakteru hemangiomu, suspektní pravostrannou kaliko-nefrolitiázu bez městnání a ojedinělé lymfatické uzliny ve středním hypogastriu (podle popisu do 6 mm). Pro progresi obtíží a nález nejasného ložiska v pravém hypogastriu na kontrolní sonografii s odstupem 1 týdne bylo doplněno CT vyšetření břicha s nálezem měkkotkáňového útvaru o velikosti 43 × 42 × 39 mm v mezenteriu obsahujícího drobné tukové podíly. Dále byla zobrazena tři ložiska v játrech v.s. benigní etiologie. V diferenciální diagnostice byl iniciálně zvažován především karcinoid. K došetření byl pacient odeslán na gastroenterologii Interní kliniky 3. LF UK a FNKV.
K vyloučení karcinoidu bylo provedeno vyšetření 5-hydroxy-3-indoloctové kyseliny (5-HIO) ze sbírané moči za 24 hodin (dHIO). Pacient byl poučen o nutnosti dodržovat dietu s vynecháním potravin obsahujících serotonin 3 dny před vyšetřením (např. ananas, banány, rajčata, kiwi, švestky, pomeranče, avokádo, lilek, ořechy; dále nepít kofeinové nápoje včetně černého a aromatizovaného čaje, povzbuzující nápoje, ovocné šťávy a sirupy, minerální vody s příchutí nebo alkohol [3]). Týden před vyšetřením hladiny chromograninu A (CgA) byl IPP nahrazen antagonistou histaminového H2 receptoru. Výsledky byly negativní: hladina 5-HIO byla 18,9 μmol/l, dHIO 30,2 μmol/D, CgA 73,7 μg/l. Přítomnost tumoru se somatostatinovými receptory nebyla potvrzena při scintigrafii (99mTc-Tektrotyd). Neuron specifická enoláza nebyla vyšetřena.
Stav pacienta se v době probíhajících vyšetření zlepšil, byl obnoven plný perorální příjem, stolice byly pravidelné, formované, přetrvávaly jen intermitentní bolesti břicha neměnného charakteru.
Neuroendokrinní tumor s hormonální aktivitou nebyl prokázán, proto bylo multidisciplinárním týmem Gastrocentra FNKV a 3. LF UK indikováno doplnění pozitronové emisní tomografie (PET) před diagnostickou laparotomií. Nález na PET potvrdil v mezikličkové lokalizaci nepravidelný solidní útvar s okrajově patrným fokusem lehce zvýšené akumulace deoxyglukózy značené radioaktivním fluorem (FDG) bez známek lymfadenopatie či eventuální diseminace (obr. 1).
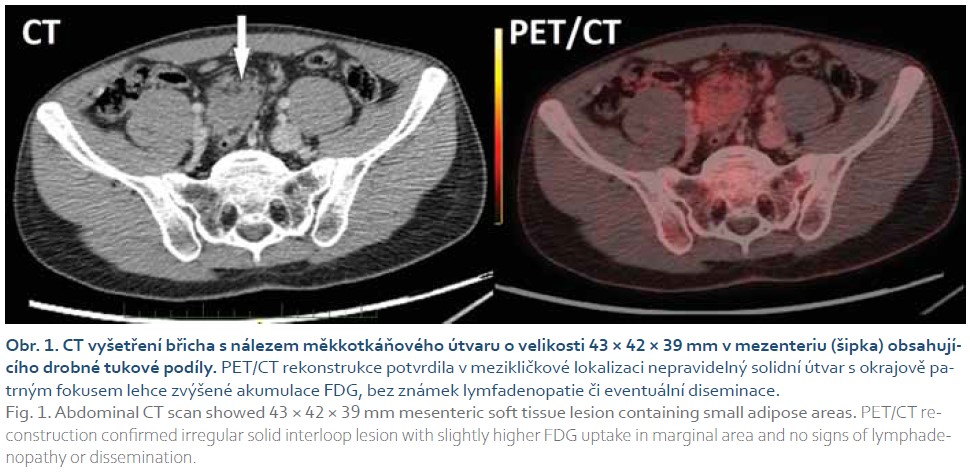
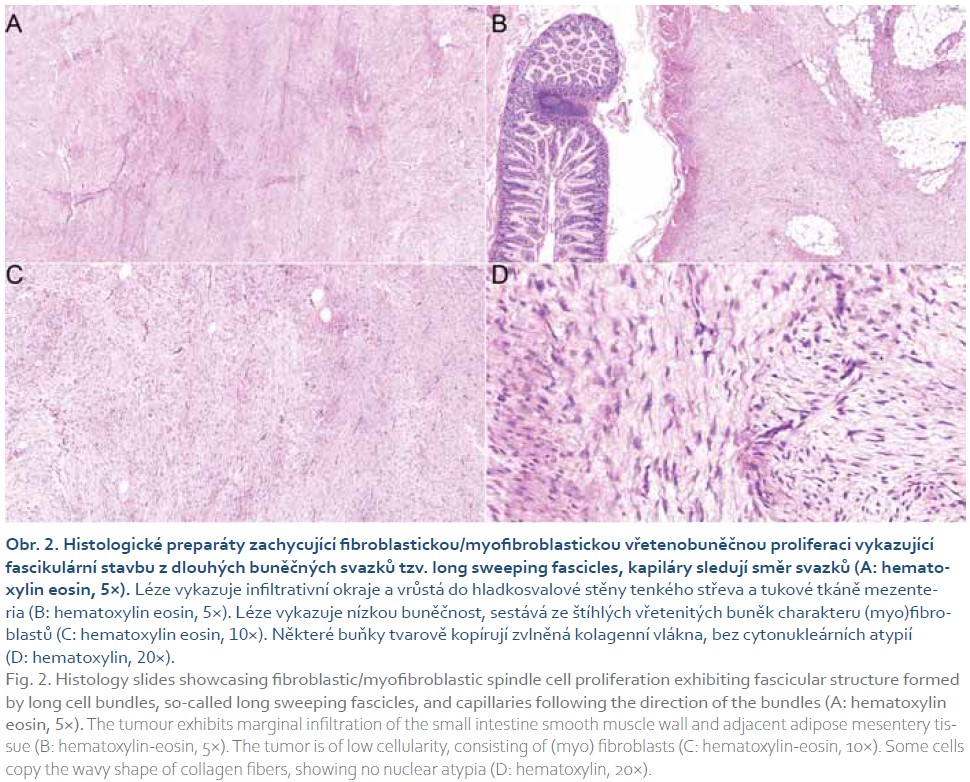
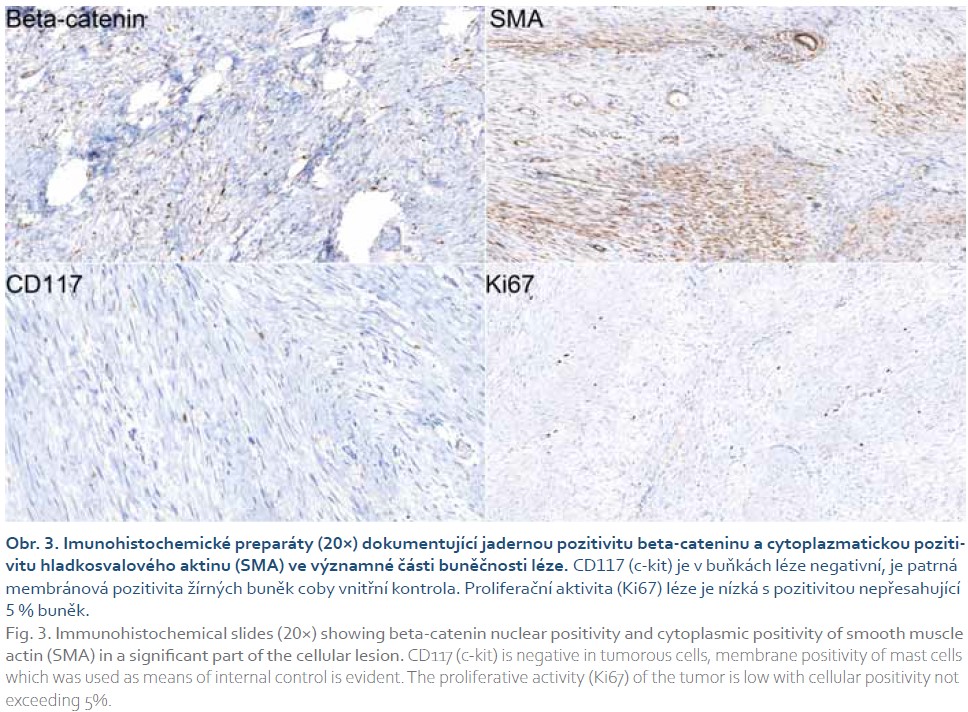
Peroperačně byl nalezen tuhý, hladce opouzdřený bělavý tumor v oblasti terminálního ilea velikosti 55 × 45 × 35 mm, místy infiltrující tenké střevo. Další tumor stejné charakteristiky velikosti 20 × 16 × 7 mm byl odstraněn z oblasti levého ureteru. Histopatologicky byl u obou ložisek popsán mezenchymální tumor s fascikulární stavbou z dlouhých svazků vřetenovitých buněk, část buněk je pozitivní v průkazu hladkosvalového aktinu. Proliferační aktivita nepřesahovala 5 % (obr. 2, 3). Popis nádoru odpovídá desmoidní fibromatóze.
Operační výkon proběhl bez komplikací s příznivým pooperačním vývojem. Vzhledem k možné asociaci s FAP byla doplněna koloskopie s negativním nálezem. S odstupem 6 měsíců bylo provedeno kontrolní CT vyšetření hrudníku, břicha a malé pánve bez nálezu recidivy nádoru.
Jako vedlejší nález na PET/CT byl zobrazen hypodenzní útvar u dorzální stěny v lumen levé komory srdce 18 × 11 mm s vysokou akumulací FDG. Opakovaně byla provedena echokardiografie – v oblasti popisovaného útvaru byl detekován pouze papilární sval. Patologický útvar v levé komoře nebyl prokázán ani na MR vyšetření srdce.
Pacient zůstává v gastroenterologické a onkologické dispenzarizaci.
Diskuze
Maligní nádory tenkého střeva (NTS) představují asi 1–3 % zhoubných tumorů gastrointestinálního traktu (GIT). Incidence maligních NTS je přibližně 2,35 na 100 000 osob [4]. Maligní NTS bývají často asymptomatické a případné nespecifické symptomy jsou pak již projevem pokročilého onemocnění. Nejčastěji se projeví příznaky spojenými s obstrukcí střeva nebo v souvislosti s okultním krvácením [5]. Výpočetní tomografie (CT) břicha zachytí NTS asi v 80 %, v případě provedení enterografie pomocí MR nebo CT je záchyt asi v 85–95 % případů. PET/CT je přínosná u pacientů s adenokarcinomy nebo sarkomy; karcinoidy jsou oproti těmto již méně FDG-avidní [6]. V diferenciální diagnostice musíme na prvním místě zvážit maligní NTS – nejčastější bývají adenokarcinomy (30–40 %), neuroendokrinní tumory (35–44 %), lymfomy (10–20 %) a gastrointestinální stromální nádory (12–18 %) [7].
V diferenciální diagnostice bychom však neměli zapomenout na intraabdominální formu DF, která může na zobrazovacích vyšetřeních NTS připomínat.
Incidence DF je 2–5 případů na 1 milion osob ročně [1]. Představují < 3 % měkkotkáňových tumorů a přibližně 0,03 % všech nádorů. Tyto nádory se vyskytují ve všech věkových skupinách, nejvíce však ve třetím a čtvrtém decenniu [8]. DF bývá častěji popisována u žen (2: 1 až 5: 1) [9], v patogenezi onemocnění je proto zvažován podíl estrogenních hormonálních poruch. V největší studii zaměřené na DF uvedené v literatuře se 130 případy však bylo 55 % mužů [10].
Geneticky asociovaná DF se při FAP vyskytuje v 10–20 % případů, u Gardnerova syndromu je pak popisována ve 2–32 % případů [11]. Mutace genu adenomatózní polypózy tlustého střeva (APC) na dlouhém raménku 5. chromozomu byly popsány jak u FAP, tak u familiárních non-FAP tumorů. Somatické mutace APC genu byly popsány také v 80–90 % u sporadických případů. Dále byly popsány aktivační mutace genu CTNNB1 pro beta-catenin, které vedou k aktivaci fibroblastické proliferace v důsledku akumulace beta-cateninu [12].
Většina pacientů je po dlouhou dobu zcela asymptomatická z důvodu pomalého růstu tumoru. Klinické příznaky jsou pak velmi variabilní s ohledem na lokalizaci a velikost tumoru, nejčastěji se jedná o problémy s pasáží v důsledku mechanického útlaku, méně často pak dochází k útlaku ureteru nebo splenické žíly. V jiných případech může být dominantním příznakem enteroragie vedoucí případně až k perforaci střeva v důsledku ischemie submukózy. Vzácně může dojít k ruptuře aorty, vzniku intraabdominálního abscesu nebo výskyt plynu v portálním žilním řečišti [1,10].
Při diagnostice intraabdominálního tumoru lze použít v první řadě sonografické vyšetření, ale důraz je kladen zejména na CT nebo MR vyšetření k posouzení infiltrace okolních orgánů a vztahu k cévním svazkům. CT se pak využívá zejména ke stagingu. Role zobrazovacích vyšetření v diferenciální diagnostice je již méně významná. V diferenciální diagnostice DF zvažujeme zejména gastrointestinální stromální tumor (GIST), karcinoid, lymfom nebo sklerozující mezenteritidu [13]. MR se využívá zejména při alergii na jodovou kontrastní látku nebo jako metoda volby při extraabdominální DF. V případě intraabdominální DF se pak MR využívá primárně k posouzení případné recidivy [1,14].
Dle doporučených postupů NCCN (National Comprehensive Cancer Network) lze asymptomatické pacienty po bioptické verifikaci nálezu pravidelně sledovat [2]. S ohledem na možnou lokálně agresivní progresi onemocnění je v terapii intraabdominální DF stěžejní chirurgická resekce, nevýhodou je pak významná morbidita zejména při resekci velkého úseku tenkého střeva. Lokální recidiva nastává u 13–68 % nemocných i v případě biopticky negativních resekčních okrajů a v průměru nastane mezi 15 a 24 měsíci. V případě neresekabilního tumoru, nejasných resekčních okrajů nebo v případě recidivy je indikována radioterapie nebo chemoterapie. Odpověď desmoidu na ozáření je pomalá a obecně se u intraabdominální formy nedoporučuje [15]. Cytostatickou nebo cytotoxickou systémovou terapií tamoxifenem, interferonem alfa, imatinibem a nesteroidními antirevmatiky lze zpomalit lokální progresi onemocnění [1,2,15].
Prognóza onemocnění bývá příznivá, ale je ovlivněna zejména mírou recidivy a sekundární morbiditou spojenou s resekcí infiltrovaných orgánů.
Závěr
V diferenciální diagnostice vzácných intraabdominálních nádorů bychom neměli opomenout desmoidní fibromatózu. DF je charakteristická infiltrativním růstem do okolních struktur a orgánů a vysokou tendencí k lokálním recidivám bez metastatického potenciálu. Klinické příznaky jsou nespecifické a nejčastěji jsou spojeny s obstrukcí střeva nebo v souvislosti s okultním krvácením stejně jako nádory trávicí trubice. Etiologie je nejasná, ale DF bývá asociována s FAP, Gardnerovým syndromem, traumaty nebo endokrinními faktory. Tyto nádory se nejčastěji vyskytují ve třetím a čtvrtém decenniu a častěji u žen. V terapii je stěžejní chirurgická resekce, nevýhodou je pak významná morbidita zejména při resekci velkého úseku tenkého střeva.
ORCID autorů
L. Grochol ORCID 0000-0002-0646-1479,
I. Cibulková ORCID 0000-0002-1889-6023,
H. Hrudka ORCID 0000-0002-5649-4586,
J. Hajer ORCID 0000-0003-3780-3088.
Doručeno/Submitted: 12. 1. 2022
Přijato/Accepted: 4. 2. 2022
MUDr. Lukáš Grochol
Divize gastroenterologie a hepatologie
Interní klinika 3. LF UK a FN Královské Vinohrady
Šrobárova 1150
100 34 Praha 10
lukas.grochol@fnkv.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Li Destri G, Ferraro MJ, Calabrini M et al. Desmoid-type fibromatosis of the mesentery: report of a sporadic case with emphasis on differential diagnostic problems. Case Rep Med 2014; 2014: 850180. doi: 10.1155/2014/850180.
2. Efthimiopoulos GA, Chatzifotiou D, Drogouti M et al. Primary asymptomatic desmoid tumor of the mesentery. Am J Case Rep 2015; 16: 160–163. doi: 10.12659/AJCR.892521.
3. Moncer F, Adhoum N, Catak D et al. Electrochemical sensor based on MIP for highly sensitive detection of 5-hydroxyindole-3-acetic acid carcinoid cancer biomarker in human biological fluids. Anal Chim Acta 2021; 1181: 338925. doi: 10.1016/j.aca.2021.338925.
4. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice. [online]. Available from: http://www.svod.cz.
5. Tang SJ, Haber GB. Capsule endoscopy in obscure gastrointestinal bleeding. Gastrointest Endosc Clin N Am 2004; 14(1): 87–100. doi: 10.1016/j.giec.2003.10.011.
6. Pourmand K, Itzkowitz SH. Small bowel neoplasms and polyps. Curr Gastroenterol Rep 2016; 18(5): 23. doi: 10.1007/s11894-016-0497-x.
7. Bilimoria KY, Bentrem DJ, Wayne JD et al. Small bowel cancer in the United States: changes in epidemiology, treatment, and survival over the last 20 years. Ann Surg 2009; 249(1): 63–71. doi: 10.1097/SLA.0b013e31818e4641.
8. Venkat D, Levine E, Wise WE. Abdominal pain and colonic obstruction from an intra-abdominal desmoid tumor. Gastroenterol Hepatol (NY) 2010; 6(10): 662–665.
9. Ferenc T, Sygut J, Kopczyński J et al. Aggressive fibromatosis (desmoid tumors): definition, occurrence, pathology, diagnostic problems, clinical behavior, genetic background. Pol J Pathol 2006; 57(1): 5–15.
10. Burke AP, Sobin LH, Shekitka KM et al. Intra-abdominal fibromatosis. A pathologic analysis of 130 tumors with comparison of clinical subgroups. Am J Surg Pathol 1990; 14(4): 335–341.
11. Clark SK, Neale KF, Landgrebe JC et al. Desmoid tumours complicating familial adenomatous polyposis. Br J Surg 1999; 86(9): 1185–1189. doi: 10.1046/j.1365-2168.1999.01222.x.
12. Cheon SS, Cheah AY, Turley S et al. beta-Catenin stabilization dysregulates mesenchymal cell proliferation, motility, and invasiveness and causes aggressive fibromatosis and hyperplastic cutaneous wounds. Proc Natl Acad Sci U S A 2002; 99(10): 6973–6978. doi: 10.1073/pnas.102657399.
13. Chen CB, Chiou YY, Chen CH et al. Sonographic and computed tomography findings of intra-abdominal desmoid tumor. J Chin Med Assoc 2010; 73(7): 393–395. doi: 10.1016/S1726-4901(10)70084-8.
14. Faria SC, Iyer RB, Rashid A et al. Desmoid tumor of the small bowel and the mesentery. AJR Am J Roentgenol 2004; 183(1): 118. doi: 10.2214/ajr.183.1.1830118.
15. Howard JH, Pollock RE. Intra-abdominal and abdominal wall desmoid fibromatosis. Oncol Ther 2016; 4(1): 57–72. doi: 10.1007/ s40487-016-0017-z.