Biosimilární adalimumab FKB-327 v léčbě idiopatických střevních zánětů
Milan Lukáš1, Martin Vašátko1, Martin Lukáš1, Martin Kolář1, Dana Ďuricová1, Naděžda Machková1, Karin Malíčková1, Veronika Hrubá1
+ Pracoviště
Souhrn
Po roce 2018, ve kterém prošel ochranný patent originálnímu adalimumabu, se objevují nové biosimilární formy tohoto léčiva. Jedním z nich je FKB-327, který se užívá ve všech indikacích originálního léčiva. Byla provedena analýza efektu terapie s biosimilárním adalimumabem FKB-327 na souboru 51 nemocných s idiopatickými střevními záněty, z nichž 42 (82 %) trpělo Crohnovou chorobou a 9 (18 %) ulcerózní kolitidou. Medián doby, po kterou probíhala léčba, byl 37 týdnů a většina nemocných (78 %) z uvedené kohorty pacientů byla naivní na předcházející biologickou léčbu. Významný klinický efekt této terapie byl zaznamenán u 47 nemocných (92 %). Pouze 4 (8 %) nemocní na terapii neodpověděli a museli být převedeni na jinou terapii. Přípravek byl velmi dobře tolerován, u žádného pacienta nemusela být léčba adalimumabem FKB-327 předčasně ukončena pro výskyt nežádoucích účinků.
Klíčová slova
idiopatické střevní záněty, biologická léčba, biosimilární adalimumab FKB-327Úvod
Biologická terapie monoklonálními protilátkami se v průběhu posledních 20 let stala nedílnou součástí léčby všech autoimunitních onemocnění, včetně těžkých a komplikovaných forem idiopatických střevních zánětů (inflammatory bowel diseases – IBD).
Biosimilarní léčiva (biosimilars) představují formu licencovaných biologických léčiv bez významných rozdílů od originálních produktů z hlediska kvality, fyzikálně-chemických vlastností, biologické aktivity, bezpečnosti nebo účinnosti. Indikační kritéria jsou stejná jako u referenčního produktu [1]. Biosimilární přípravky snížily náklady na léčbu a díky tomu významně zvýšily dostupnost biologické terapie pacientům trpícím Crohnovou nemocí (CN) nebo ulcerózní kolitidou (UC). Řada kohortových studií potvrdila, že biosimilární infliximab i adalimumab je srovnatelný s originálním preparátem [2,3].
Adalimumab se používá k léčbě CN od roku 2007 a UC od roku 2012. V říjnu roku 2018 vypršela platnost patentu originální molekuly adalimumabu, což umožnilo dostupnost nových biologicky podobných léků, jako je FKB-327 (Hulio, Fujifilm Kyowa Kirin Biologics) [4]. Na základě zjištění biologické podobnosti ve struktuře a funkci mezi FKB-327 a originálním adalimumabem budou mít pravděpodobně i farmakokinetika a imunogenicita podobné vlastnosti. Malé rozdíly zjištěné mezi FKB-327 a originálním preparátem by neměly mít dopad na bezpečnost nebo účinnost. Na základě fyzikálně-chemické analýzy a biologické charakterizace by měl mít FKB-327 podobné klinické výsledky (ve všech indikacích) jako originální adalimumab.
V roce 2018 byl preparát FKB-327 povolen ve všech indikacích originálního adalimumabu do klinické praxe v zemích EU. Podkladem pro registraci léčiva byly pozitivní výsledky multicentrické, dvojitě slepé, randomizované studie u pacientů s aktivní revmatoidní artritidou porovnávající účinnost a bezpečnost FKB-327 s originálním adalimumabem. Zkušenosti s FKB-327 u nemocných s IBD z klinické praxe jsou pouze ojedinělé.
Cílem této studie bylo retrospektivně zhodnotit efektivitu, tolerabilitu a bezpečnost u pacientů s idiopatickými střevními záněty v průběhu jednoho roku biologické terapie biosimilárním adalimumabem FKB-327.
Soubor pacientů
Datový soubor byl získán z Českého registru IBD pacientů na biologické terapii CREdIT. Byl založen na kombinaci dvou vyhledávacích kritérií, a to pacienti léčení v Klinickém a výzkumném centru pro střevní záněty ISCARE a. s. v Praze, a pacienti, kteří měli v období od ledna 2019 do června 2020 v registru CREdIT alespoň jeden záznam o aplikaci FKB-327.
Z registru byla takto vygenerována data celkem 51 pacientů, u kterých byly doplněny klinické údaje zahrnující klasifikaci nemoci a informace o průběhu a délce trvání biologické léčby se zaměřením na podávání FKB-327. Z laboratorních parametrů byl sledován vývoj sérových hladin C-reaktivního proteinu (CRP, mg/l) a fekálních hladin kalprotektinu (FC, μg/g). Aktivita CN byla hodnocena s pomocí Harvey-Bradshawova indexu, jako index aktivity UC bylo použito parciální Mayo skóre.
Statistická analýza
Data byla analyzována s pomocí statistického programu STATISTICA (Data analysis software system, verze 13, TIBCO Software Inc). K otestování normality rozložení dat byl použit Shapiro-Wilksův test. Normální rozdělení hodnot měřených znaků nebylo prokázáno, k analýzám proto byly dále použity neparametrické testy. K popisu polohy dat byly zvoleny mediány a interkvartilová rozmezí, jako míry rozptylu jsou uváděny interval mezi nejvyšší a nejnižší hodnotou a směrodatná odchylka. K analýze rozptylu kvantitativních dat byl použit Kruskal-Wallisův test. Kvalitativní proměnné byly analyzovány s pomocí chí-kvadrát testu dobré shody. Jako statisticky významná byla určena hodnota p ≤ 0,05.
Výsledky
Ve sledovaném období bylo k léčbě FKB-327 v IBD centru ISCARE indikováno 51 pacientů, 20 mužů a 31 žen, v průměrném věku 38,3 let. Základní demografické a klinické charakteristiky analyzovaného souboru uvádí tab. 1.
Pro 40 pacientů (78 %) byl biosimilární adalimumab FKB3-27 prvním biologickým léčivem v terapii IBD. Sedm nemocných (14 %) bylo na FKB-327 switchováno z nitrožilního infliximabu, dva pacienti (4 %) z jiného adalimumabu a jeden pacient (2 %) z léčby vedolizumabem.
V době provádění této analýzy (červen 2020) bylo aktuálně 47 pacientů léčeno biosimilárním adalimumabem FKB-327. Čtyři pacienti (8 %) z původního souboru byli v průběhu analyzovaného období switchováni z důvodu neodpovídavosti na léčbu FKB-327 na jiný biologický lék: na vedolizumab, infliximab a ustekinumab. Ani jeden pacient ve sledovaném období neukončil léčbu z důvodu výskytu nežádoucí reakce po FKB-327.
Konkomitantní terapie v průběhu léčby FKB-327
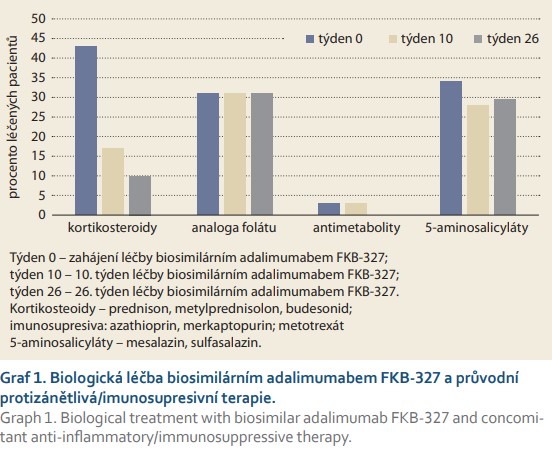
Při zahájení léčby biosimilárním adalimumabem FKB-327 užívalo 47 pacientů (92 %) další protizánětlivá a/nebo imunosupresivní léčiva: 22 (43 %) pacientů bylo léčeno systémovými a/nebo topickými kortikosteroidy, 16 (31 %) pacientů užívalo azathioprin nebo merkaptopurin, 1 pacient byl léčen metotrexátem a 17 (33 %) nemocných užívalo mesalazin, přičemž se vyskytovaly různé kombinace těchto medikamentů. V průběhu prvních 26 týdnů léčby FKB-327 došlo k významné redukci potřeby podávání kortikosteroidů, kdežto podíl pacientů s ko-medikací azathioprinem a mesalazinem se nezměnil (graf 1).
Klinická aktivita nemoci v průběhu léčby FKB-327
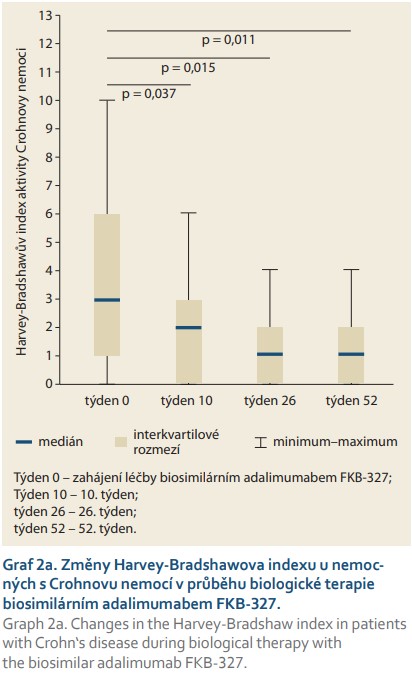
Jako ukazatel klinické aktivity CN byl sledován Harvey-Bradshawův index, skóre < 5 značí remisi onemocnění, 5–7 mírnou aktivitu, 8–16 střední aktivitu a > 16 závažnou aktivitu CN. V průběhu 52 týdnů terapie FKB-327 došlo ve sledované kohortě k signifikantnímu poklesu HBI skóre (graf 2a).
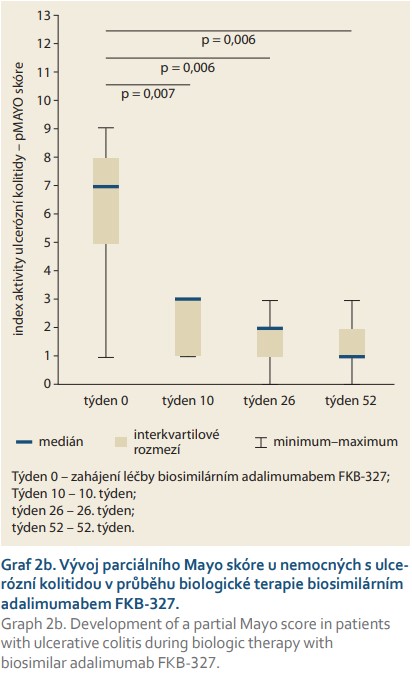
Aktivita UC byla posuzována pomocí parciálního Mayo (pMayo) skóre, 2–4 body značí mírné onemocnění, 5–6 bodů středně aktivní onemocnění a 7–9 bodů těžkou formu UC. Rovněž u pacientů s UC došlo při léčbě FKB-327 k signifikantnímu poklesu klinické aktivity choroby (graf 2b).
Farmakodynamický efekt FKB-327
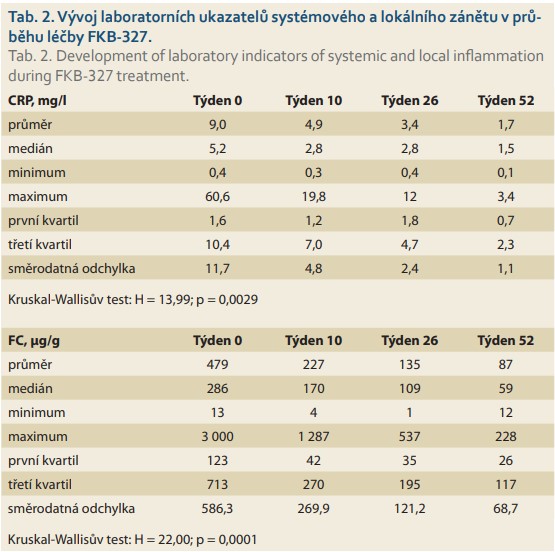
Intenzita systémového zánětu byla charakterizována sérovou hladinou CRP. Mírou zánětlivého poškození střevní sliznice byl fekální kalprotektin. Vývoj těchto laboratorních hodnot v průběhu terapie biosimilárním adalimumabem FKB-327 shrnuje tab. 2, ze které vyplývá, že terapie FKB-327 je sdružena se signifikantním poklesem aktivity systémového i lokálního zánětu.
U žádného nemocného nemusela být kvůli výskytu nežádoucích účinků léčba předčasně ukončena. Podávání biosimilárního adalimumabu FKB-327 bylo velmi dobře tolerováno a výskyt závažných lokálních reakcí v místě vpichu nebo větší bolestivosti po aplikaci léčiva nebyl zaznamenán u žádného pacienta.
Diskuze
Podle našich informací je tato práce jedna z prvních, která se větším souborem nemocných s CN a UC léčených biosimilárním adalimumabem FKB-327 zabývá. Byla potvrzena relativně vysoká klinická účinnost léčiva a příznivý vliv na snížení hodnot zánětlivých biologických parametrů. Lék byl velmi dobře tolerován a z důvodů vedlejších účinků nemusela být terapie předčasně ukončena u žádného pacienta.
Léčba biosimilárním adalimumabem FKB-327 byla spojena s významným klinickým zlepšením již v 10. týdnu a také byl potvrzen konzistentní protizánětlivý účinek dokumentovaný trvalým snížením nebo normalizací klinických parametrů a biochemických markerů aktivity zánětu po celou dobu sledování.
Navíc jsme potvrdili i pozitivní kortikoid-šetřící vliv léčiva, který byl dokumentován redukcí potřeby systémových i topických kortikosteroidů již v 26. týdnu léčby. Vzhledem ke známým nežádoucím účinkům kortikosteroidů při jejich dlouhodobém užívání je tento efekt významným benefitem léčby.
Klinických studií s použitím FKB-327 u imunopatologických chorob není zatím mnoho. V roce 2017 byly publikovány výsledky mezinárodní studie, která porovnávala FKB-327 s originálním adalimumabem u 180 zdravých dobrovolníku. Cílem bylo porovnání farmakokinetických vlastností, bezpečnosti, snášenlivosti a imunogenicity terapie. Studie prokázala farmakokinetickou podobnost, dobrou snášenlivost s nežádoucími účinky srovnatelnými s originálním adalimumabem. Protilátky byly na konci detekovány přibližně u 70 % pacientů ve všech třech skupinách, tudíž i imunogenicita všech preparátů byla srovnatelná [5]. Příznivé výsledky randomizované, dvojitě zaslepené registrační studie porovnávající účinnost, farmakokinetiku, imunogenicitu a bezpečnost FKB-327 s originálním adalimumabem v kombinaci s metotrexátem u pacientů se středně těžkou až těžkou revmatoidní artritidou byla podkladem pro povolení tohoto léčiva do klinické praxe v zemích EU. Celkově bylo zařazeno 730 pacientů, kteří byli randomizováni v poměru 1: 1 do 24. týdne. Poté byli re-randomizováni 2: 1 a nadále byli léčeni stejným preparátem nebo byli switchováni na druhý adalimumab. Ve 24. týdnu byla míra odpovědi (hodnocená pomocí ACR20 score) 74,1 % u FKB-327 a 75,7 % u originálního adalimumabu. V 54. týdnu byla míra odpovědi totožná, a to 54 %. Detekce protilátek byla taktéž srovnatelná (57,7 % u FKB-327 vs. 55,5 % originální adalimumab). Nebyl pozorován žádný negativní efekt při switchování mezi biosimilárním FKB-327 a originálním adalimumabem [6]. Ve dvojitě zaslepené randomizované studii fáze 3, kam bylo zařazeno 728 pacientů, byl porovnáván FKB-327 s originálním adalimumabem u pacientů s revmatoidní artritidou nereagující na léčbu metotrexátem. Následná prodloužená otevřená fáze této studie, ve které pokračovalo 645 pacientů, prokázala dlouhodobou účinnost, bezpečnost a imunogenicitu biosimilárního FKB-327 srovnatelnou s originálním adalimumabem do 76. týdne [6]. Z našeho klinického pracoviště pochází studie hodnotící terapii biosimilárním adalimumabem SB-5 10 týdnů po provedení switche z originálního adalimumabu. Studie prokázala, že u 93 switchovaných pacientů nebyly, ve srovnání se stejným počtem nemocných pokračujících v léčbě originálním léčivem, nalezeny žádné odlišnosti v klinickém průběhu nemoci, v dynamice markerů zánětu ani v sérových hladinách léčiva [7].
Prezentovaná studie prokazuje vysokou efektivitu a rychlý nástup protizánětlivého účinku biosimilárního FKB-327 při léčbě IBD u pacientů, kteří selhali na standardní medikamentózní terapii včetně možnosti časného vysazení kortikosteroidů. Důležité je zjištění, že v průběhu udržovací terapie byla většina nemocných v klinické a biochemické remisi. Naše zkušenosti rovněž potvrzují nízké riziko vzniku vedlejších a nežádoucích účinků léčby a dobrou toleranci pacienty.
Určitým limitem studie je skutečnost, že čtyři pětiny nemocných zařazených k léčbě FKB-327 byly naivní na biologickou léčbu, jinými slovy jednalo se o nemocné, kteří jsou dobře odpovídající na terapii monoklonálními protilátkami. Z vlastních zkušeností i z údajů v literatuře vyplývá, že nemocní, kteří selhali na první nebo druhou linii biologické léčby, mají významně horší odpověď na další biologický preparát. Takoví pacienti však nebyli v tomto souboru zařazeni. I když byl patrný velmi rychlý a setrvalý příznivý vliv na snížení hodnoty fekálního kalprotektinu, přímá data o efektu FKB-327 na dosažení slizničního hodnocení nebyly systematicky zaznamenávány. Rovněž relativně omezený počet nemocných neumožnuje dělat dalekosáhlé a striktní závěry. Nicméně první a omezené zkušenosti z našeho pracoviště s tímto preparátem jsou vysloveně pozitivní.
Rozhodnutí o použití biosimilárního adalimumabu v praxi je plně v kompetenci ošetřujícího lékaře. Je zcela nezbytné pacienta o této léčbě řádně informovat a musí s ní souhlasit. Používání biosimilárního FKB-327 v běžné lékařské praxi by mohlo být jednou z bezpečných cest k dosažení úspory finančních prostředků, a tím i dalšího nárůstu počtu léčených pacientů.
prof. MUDr. Milan Lukáš, CSc.
Klinické a výzkumné centrum pro střevní záněty
Klinické centrum ISCARE a. s. a 1. LF UK v Praze
Českomoravská 19
190 00 Praha 9
milan.lukas@email.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Kolář M, Ďuricová D, Bortlík M et al. Infliximab bio similar (RemsimaTM) in therapy of inflammatory bowel diseases patients: experience from one tertiary IBD centre. Dig Dis 2017; 35 (1–2): 91–100. doi: 10.1159/000453343.
2. Lukáš M, Kolář M, Bortlík M. Biosimilární léčiva v léčbě idiopatických střevních zánětů. In: Tesař V (ed). Biosimilars. Praha: Mladá fronta 2017: 105–122.
3. Lukáš M. První generace bio logických léčiv-anti-TNFa monoklonální protilátky. In: Lukáš M (ed). Pokroky v diagnostice a léčbě idiopatických střevních zánětů. Galén 2019: 137–164.
4. Lukáš M. Biosimilární adalimumab FKB327 (Hulio®). Gastroent Hepatol 2019; 73 (2): 177–178. doi: 10.14735/amgh2019177.
5. Puri A, Niewiarovski A, Arai Y et al. Pharmacokinetics, safety, tolerability and immunogenecity of FKB-327 a new biosimilar medicine of adalimumab / /Humira, in healthy subjects. Br J Clin Pharmacol 2017; 83 (7): 1405–1415. doi: 10.1111/bcp.13245.
6. Genovese MC, Glover J, Matsunga N et al. Efficacy, safety anf immunogenecity in randomized, double blind and open-label extension studies comparing FKB327 an adalimumab bio similar, with adalimumab reference product (Humira-RP) in patients with active rheumatoid arthritis. Arthritis Rheumatol 2017; Suppl 10: 2799.
7. Lukas M, Malickova K, Kolar M et al. Switching from originator adalimumab to the biosimilar SB5 in patients with inflammatory bowel disease: short-term experience from a single tertiary clinical centre. J Crohns Colitis 2020; 14 (7): 915–919. doi: 10.1093/ecco-jcc/jjaa001.