Biologická terapie ulcerózní kolitidy v graviditě
Jana Koželuhová Orcid.org 1
+ Pracoviště
Souhrn
V komentované kazuistice je popsán případ pacientky s ulcerózní kolitidou (UC), která byla v úvodu stonání pro selhání konvenční terapie úspěšně léčena infliximabem. Pro dlouhodobou remisi UC bylo v třetím trimestru gravidity rozhodnuto o ukončení terapie biologikem. Pro relaps UC po porodu jsme indikovali zahájení terapie vedolizumabem (VDZ), na němž bylo dosaženo remise UC, a proto pacientka v následujícím průběhu pokračovala v udržovací léčbě VDZ. Na této terapii došlo k novému otěhotnění, které se vyvíjelo bez komplikací na uvedené léčbě. V práci je hodnocen přínos a možná rizika biologické léčby v graviditě.
Klíčová slova
ulcerózní kolitida, gravidita, infliximab, vedolizumab
Úvod
Ulcerózní kolitida (UC) patří s Crohnovou chorobou (CN) mezi idiopatické střevní záněty (IBD – inflammatory bowel disease). Velký počet pacientek s IBD je v reprodukčním věku, a proto jsou velmi aktuální otázky týkající se nejen fertility, gravidity či porodu, ale také vlivu aktivity onemocnění a dopad podávané terapie na fertilitu, vývoj těhotenství a laktaci [1]. Konvenční medikamentózní léčba, která je podávána ke snížení zánětlivé aktivity a/nebo k udržení remise IBD, jako je mesalazin, kortikosteroidy a thiopuriny, má již dobře prozkoumaná potencionální rizika v graviditě a existují jasná pravidla, jak tyto léky podávat v těhotenství a v laktaci [1]. Od roku 2006 je možné využít v terapii vysoce aktivní, kortikodependentní či kortikorezistentní UC protilátku proti TNFα – infliximab (IFX). Jeho účinnost na dosažení a udržení klinické remise byla potvrzena v kontrolovaných klinických studiích ACT1 a ACT2 (The Active Ulcerative Colitis Trial 1 a 2) i v běžné klinické praxi. Jeho podávání v graviditě je již běžně zavedeným postupem [1–4]. Vedolizumab patří mezi IgG1 protilátky s aktivním prostupem placentární bariérou do krevního oběhu plodu od 14. do 16. gestačního týdne, tento přenos narůstá exponenciálně během druhého trimestru a kulminuje na konci gravidity [1,5]. V dosud publikovaných klinických studiích či postmarketingových sledováních nebyl jednoznačně prokázán negativní vliv na průběh gravidity, vývoj plodu či nežádoucí účinky týkající se matky a novorozence, nicméně chybí spolehlivá evidence o bezpečnosti léčby vedolizumabem (VDZ) v graviditě pro dosud malé počty studovaných pacientek [6–10].
Popis případu
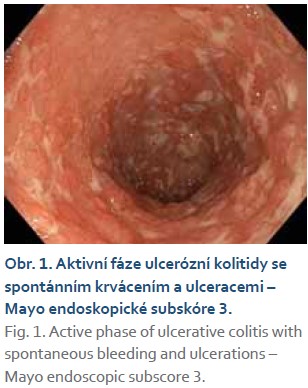
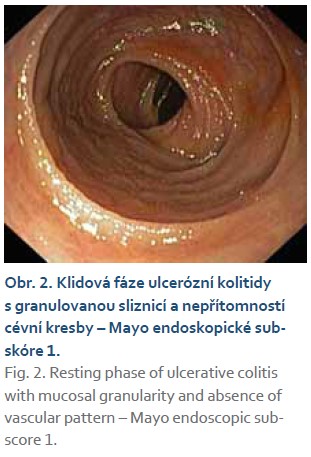
Je prezentován případ mladé ženy narozené v roce 1990, u níž byla v roce 2010 diagnostikována UC postihující extenzivně tlusté střevo. V úvodu stonání pro selhání konvenční terapie byla dosažena remise UC infliximabem (IFX). V průběhu první gravidity koncem roku 2019 byla nemocná na této terapii v dlouhodobé remisi, s příznivým vývojem těhotenství, dle v té době dostupných doporučených postupů byla terapie IFX ukončena na začátku třetího trimestru a ponechána na vysokých dávkách mesalazinu [3,4]. Po porodu v období šestinedělí v dubnu 2020, kdy současně plně kojila, byl stav komplikován těžkým relapsem UC s Mayo 3 endoskopickým subskóre (obr. 1). Z toho důvodu bylo rozhodnuto o zahájení terapie VDZ s přechodným pulzem kortikosteroidů v úvodu akutního vzplanutí UC. Od zahájení terapie VDZ došlo k postupnému zlepšení klinického stavu a kontrola po 4 měsících terapie v srpnu 2020 vykazovala známky klinické remise a dosažení slizničního hojení dle kontrolní endoskopie (obr. 2). Do dubna 2021, tedy přibližně za rok od zahájení terapie VDZ, byla pacientka setrvale v klidové fázi UC a v této době došlo k novému otěhotnění. S ohledem na předchozí komplikovaný průběh UC a brzký relaps UC po vysazení biologika po porodu při předchozí graviditě bylo rozhodnuto pacientku ponechat na terapii VDZ po celou dobu gravidity v běžném dávkování. Na výše uvedené terapii se gravidita vyvíjela zcela bez nežádoucích příhod a poslední infuze s VDZ v dávce 300 mg byla aplikována ve 33. gestačním týdnu. Dne 21. 1. 2022 pacientka porodila v 39. gestačním týdnu vaginální cestou a porod nebyl provázen žádnou komplikací. Pacientka porodila zdravého chlapce s Apgar skóre 10-10-10, s porodní hmotností 3 430 g. Po porodu plně kojila celkem 3 měsíce, bez nežádoucích příhod. Pacientka nadále pokračuje v terapii VDZ v dávce 300 mg v intravenózní infuzi po 8 týdnech bez známek aktivity UC.
Diskuze
Vedolizumab je IgG1 monoklonální protilátka výhradně cílená proti integrinu α4β7, blokující migraci lymfocytů do gastrointestinálního traktu, a tím ovlivňující zánětlivou reakci bez systémové imunomodulace. Podání VDZ u nemocných s UC je indikováno v případě chronicky aktivní UC, středně těžké nebo těžké ataky UC, která je refrakterní na dosavadní konzervativní či anti-TNFα terapii, nebo není-li tato terapie tolerována [11]. Účinnost a bezpečnost VDZ v terapii středně a vysoce aktivní UC byly studovány v projektu GEMINI I [12]. V indukční fázi bylo dosaženo klinické odpovědi u pacientů léčených VDZ v 47 % oproti placebové skupině (25,5 %), výsledek byl statisticky signifikantní. Významným přínosem VDZ je perzistence jeho účinnosti ještě po roce udržovací léčby, kdy remisi vykazovalo 42–45 % pacientů ve skupině s VDZ dle režimu podávání (po dobu 4 nebo 8 týdnů) na rozdíl od placebové skupiny, kde zůstalo v klidové fázi UC pouze 16 % pacientů. Selektivní účinek VDZ na trávicí trubici je spojen s příznivým bezpečnostním profilem s minimálním rizikem nežádoucích účinků zejména infekčních, ale i alergických reakcí či jiných imunopatologických projevů [12]. Dosud publikovaná data týkající se bezpečnosti VDZ v graviditě zatím nenaznačují žádné negativní signály ohledně vlivu této terapie na graviditu nebo vývoj plodu, nicméně celková evidence je zatím limitovaná z důvodu relativně malého počtu sledovaných pacientek [6–10]. Zatím největší soubor gravidit exponovaných VDZ byl prezentován v retrospektivní multicentrické observační studii CONCEIVE, která srovnávala průběh těhotenství a rizika pro novorozence ve skupině gravidit exponovaných VDZ (79 gravidit u 73 pacientek) s anti-TNFα exponovanou skupinou a skupinou IBD pacientek bez imunomodulační terapie (CON IBD) [8]. Pacientky léčené VDZ měly signifikantně nižší počet živě narozených dětí oproti pacientkám bez imunomodulační terapie (78 vs. 89 %; p = 0,038) a numericky nižší počet oproti nemocným exponovaným anti-TNFα (78 vs. 87 %; p > 0,05). Nicméně ve skupině léčených VDZ byla vyšší frekvence pacientek s aktivním onemocněním v době koncepce (VDZ 36 %, anti-TNFα; p = 0,002 a CON IBD 24 %; p = 0,063) a vyloučením těchto nemocných ze statistického vyhodnocení byly počty živě narozených dětí srovnatelné ve všech skupinách. Tento fakt podporuje důrazné doporučení načasování koncepce do doby remise IBD. Současně nebyly zaznamenány statisticky významné rozdíly v počtu spontánních abortů mezi sledovanými skupinami (VDZ 16 %, TNF 13 %, CON IBD 10 %). Gestační věk a porodní hmotnost novorozence a medián Apgar skóre v době porodu byly rovněž mezi sledovanými skupinami srovnatelné. Po korekci výsledků stran aktivity IBD byl podobný počet předčasně narozených dětí (VDZ 8 % vs. anti-TNFα 4 %; p = 0,363 a VDZ 8 % vs. CON IBD 6 %; p = 0,687). U pacientek na VDZ nebyl zjištěn signifikantní rozdíl v počtu kongenitálních anomálií mezi skupinami. V průběhu prvního roku se nevyskytla žádná malignita u dětí, výskyt infekcí byl ve všech skupinách obdobný [8]. Francouzská multicentrická retrospektivní kohortová studie prezentovala soubor 44 těhotných pacientek exponovaných VDZ v graviditě, rezultujících v 38 (86 %) porodů živých novorozenců, 5 (11 %) spontánních abortů a 1 (3 %) interupci z důvodu Downova syndromu plodu [6]. Ve srovnání s kontrolní skupinou anti-TNFα léčených pacien- tek nebyl pozorován signifikantní rozdíl v počtu porodů živých novorozenců a výskytu spontánních abortů nebo interupcí. Podobně procento mateřských komplikací, předčasných porodů, nízké porodní hmotnosti či admise na JIP novorozenců se nelišil mezi skupinami léčenými VDZ a anti-TNFα v graviditě [6]. Obdobné pozitivní výsledky byly pozorovány v recentní prospektivní multicentrické studii z České republiky, která hodnotila vliv expozice VDZ na průběh gravidity (n = 39) a vývoj plodu ve srovnání s anti-TNFα skupinou [9]. Současně nebyly zaznamenány žádné negativní bezpečnostní signály v postnatálním vývoji exponovaných dětí, konkrétně v růstu, psychomotorickém vývoji, výskytu atopií či alergií nebo infekčních komplikací, i když počet sledovaných dětí byl velmi omezený [9]. Díky charakteru struktury VDZ, který patří mezi humanizované IgG1, bylo možné předpokládat, že v průběhu gravidity bude narůstat množství léku, které je transportováno transplacentárně do krevního oběhu plodu. Aktivní přestup placentou probíhá jen v případě IgG1 od 13. do 17. gestačního týdne a kulminuje na konci gravidity. Výsledky klinických studií však ukázaly, že VDZ vykazuje odlišný placentární transport oproti ustekinumabu a anti-TNFα, což vede k nižším hladinám léčiva v pupečníkové krvi, resp. v krvi novorozence ve srovnání s mateřskou krví při porodu [7,9,10]. Podle výsledků prospektivní multicentrické kohortové studie publikované v roce 2021, která sledovala 50 těhotných žen léčených v graviditě VDZ (ve 43 případech [86 %] ukončeno porodem živého novorozence), byl průměrný čas ke clearance VDZ z krve novorozence 3,8 měsíce a v 6. měsíci již nebyla tato protilátka detekována u žádného z novorozenců. Tato data zatím poukazují na rychlejší clearance VDZ z krve kojenců ve srovnání s anti-TNFα preparáty [7]. Do mateřského mléka se vylučuje VDZ ve velmi nízkých koncentracích a je považován za bezpečný lék v době laktace. Navíc kojení neovlivňuje clearance VDZ u exponovaných dětí [1].
Závěr
Prezentovaná kazuistika pacientky s UC potvrdila bezpečnost a účinnost terapie IBD vedolizumabem v průběhu gravidity a během laktace. Je nutné dosažení klidového stadia IBD před koncepcí a tuto remisi udržovat po celou dobu těhotenství s ohledem na redukci zvýšeného rizika spontánních abortů a předčasného porodu. Data o léčbě VDZ v graviditě a laktaci jsou sice limitovaná, ale dosud publikované studie ukazují na efektivitu a bezpečnost VDZ pro matku a plod, bez vysokého rizika nežádoucích událostí.
Doručeno/Submitted: 29. 8. 2022
Přijato/Accepted: 16. 12. 2022
MUDr. Jana Koželuhová, Ph.D.
Gastroenterologické a hepatologické oddělení
I. interní klinika LF UK a FN Plzeň
Alej svobody 80
304 60 Plzeň
kozeluhova@fnplzen.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Torres J, Chaparro M, Julsgaard M et al. European Crohn’s and colitis guidelines on sexuality, trefrility pregnancy and lactation. J Crohns Colitis. In press 2022; jjac115. doi: 10.1093/ecco-jcc/jjac115.
2. Rutgeerts P, Sandborn WJ, Feagan BG et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med 2005; 353(23): 2462–2476. doi: 10.1056/NEJMoa050516.
3. Bortlík M, Ďuricová D, Douda T et al. Doporučení pro podávání biologické léčby pacientům s idiopatickými střevními záněty: čtvrté, aktualizované vydání. Gastroent Hepatol 2019; 73(1): 11–24. doi: 10.14735/amgh201911.
4. Bortlík M, Ďuricová D, Novotný A et al. Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku a medikamentózní léčbu ulcerózní kolitidy: Gastroent Hepatol 2022; 76(1): 13–28. doi: 10.48095/ccgh202213.
5. Mitrova K, Pipek B, Bortlík M et al. Differences in the placental pharmacokinetics of vedolizumab and ustekinumab during pregnancy in women with inflammatory bowel disease: a prospective multicentre study. Therap Adv Gastroenterol 2021; 14: 17562848211032790. doi: 0.1177/17562848211032790.
6. Wils P, Seksik P, Stefanescu C et al. Safety of ustekinumab or vedolizumab in pregnant inflam- matory bowel disease patients: a multicentre cohort study. Aliment Pharmacol Ther 2021; 53(4): 460–470. doi: 10.1111/apt.16192.
7. Julsgaard M, Baumgart DC, Baunwall SM et al. Vedolizumab clearance in neonates, susceptibility to infections and developmental milestones: a prospective multicentre population-based cohort study. Aliment Pharmacol Ther 2021; 54(10): 1320–1329. doi: 10.1111/apt.16 593.
8. Moens A, van der Woude CJ, Julsgaard M et al. Pregnancy outcomes in inflammatory bowel disease patients treated with vedolizumab, anti-TNC or conventional therapy: results of the European CONCEIVE study. Aliment Pharmacol Ther 2020; 51(1): 129–138. doi: 10.1111/apt.15539.
9. Mitrova K, Pipek B, Bortlik M et al. Safety of ustekinumab and vedolizumab during pregnancy – pregnancy, neonatal, and infant outcome: a prospective multicentre study. J Crohns Colitis 2022; 16(12): 1808–1815. doi: 10.1093/ecco-jcc/jjac086.
10. Pipek B, Ďuricová D, Bortlík M et al. Bezpečnost biologické léčby vedolizumabem a ustekinumabem podávané v průběhu gravidity pro idiopatický střevní zánět matek – multicentrická retrospektivně-prospektivní observační studie. Gastroent Hepatol 2022; 76(1): 46–54. doi: 10.48095/ccgh202246.
11. Bortlík M. Vedolizumab – nová antiintegrinová protilátka s vysokou gastrointestinální selektivitou. Gastroent Hepatol 2014; 68(6): 481–484. doi: 10.14735/amgh2014481.
12. Feagan BG, Rutgeerts P, Sands BE et al. Vedolizumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2013; 369(8): 699–710. doi: 10.1056/NEJMoa1215739.