Autoimunitní hepatitida v těhotenství
Petr Husa1
+ Pracoviště
Souhrn
Účel studie: Účelem studie bylo popsat dosavadní zkušenosti s těhotenstvím (9 případů) u 5 pacientek s autoimunitní hepatitidou (AIH).
Materiál a metody: Malý počet případů neumožnil použití statistických metod, pouze popis průběhu těhotenství a období po porodu u jednotlivých pacientek a srovnání s dostupnými literárními údaji.
Výsledky: Z devíti prezentovaných těhotenství skončila jedna gravidita ve 2. měsíci spontánním potratem a ve dvou případech došlo k předčasnému porodu. Před plánovanými osmi graviditami byl vysazen azatioprin a pokračovala léčba prednisonem v monoterapii, v posledním případě došlo k otěhotnění neplánovaně v průběhu kombinované léčby prednisonem a azatioprinem. K udržení remise onemocnění postačovalo ve všech případech 5–20 mg prednisonu denně, v šesti případech bylo možné postupně snížit dávky prednisonu, a to na konečných 5–10 mg denně. Po všech porodech došlo k akutní exacerbaci AIH, která se v sedmi případech projevila pouze vzestupem aktivity alaninaminotransferázy (ALT) v séru, u jedné pacientky došlo k výraznému vzestupu ALT i celkového bilirubinu v séru. K obnovení remise onemocnění bylo nutné přechodné navýšení denních dávek prednisonu a/nebo přidání azatioprinu do kombinace.
Závěry: Gravidita je u pacientek s dobře kompenzovanou AIH možná a její průběh je většinou nekomplikovaný. Akutní exacerbace AIH po porodu jsou velmi časté.
Klíčová slova: autoimunitní hepatitida, těhotenství, kortikosteroidy, prednison, azatioprin.
ÚVOD
Autoimunitní hepatitidy (AIH) jsou chronicky probíhající jaterní onemocnění, pro jejichž vznik je nutná spoluúčast řady faktorů vnitřních (vrozené dispozice, pohlaví, věk) i zevních (viry, léky, alkohol, chemikálie, stres, potrava). Onemocnění většinou postihuje ženy, a to buď mladé v pubertě, nebo starší v období přechodu, což ukazuje na možný vliv hormonální dysbalance. Základem klasifikace AIH je průkaz přítomnosti určitých autoprotilátek, i když se nepředpokládá jejich zásadní význam v patogenezi onemocnění. Podle autoprotilátek se AIH dělí do 3 typů: AIH 1. typu – jde o nejčastější typ AIH. Nacházíme u ní protilátky proti různým jaderným antigenům (ANA) a/nebo hladkému svalu (ASMA). U naprosté většiny nemocných s AIH l. typu nacházíme v séru i protilátky proti asialoglykoproteinovému receptoru (anti-ASGPR), které jsou na rozdíl od předchozích orgánově specifické, a proto jsou pozitivní jen u malé části nemocných s jinými autoimunitními chorobami, než je AIH. AIH 2. typu – je charakterizovaná protilátkami proti mikrosomům jater a ledvin l. typu (liver-kidney microsomes antibodies – LKM-1). Je mnohem vzácnější. AIH 3. typu – pro tento typ je typická přítomnost protilátek proti solubilnímu jaternímu antigenu nebo jaternímu a pankreatickému antigenu (anti-SLA/LP). Klinicky ani odpovědí na léčbu není rozdíl mezi AIH 1. a 3. typu.
Neléčená AIH má velmi špatnou prognózu (do dvou let umírá na dekompenzovanou cirhózu asi 50 % a do čtyř let více než 60 % nemocných). Základem léčby AIH je podávání kortikosteroidů (KS) v monoterapii nebo v kombinaci s azatioprinem (AZA). Tato léčba navozuje klinickou a biochemickou remisi u 60–80 % léčených, a to většinou během 1–3 měsíců. Samotným AZA nelze remisi navodit, tento preparát však umožňuje snížit potřebné dávky KS, protože dlouhodobá léčba vysokými dávkami KS je spojena s výskytem řady nežádoucích projevů léčby. Někteří autoři doporučují léčbu KS s převažujícími lokálními účinky (především budesonid), u kterých jsou nežádoucí systémové projevy potlačeny. Dávkování uvedených léků je přísně individuální, ale ve většině případů se používá jako útočná dávka 40–60 mg prednisonu či prednisolonu v monoterapii nebo 20–40 mg v kombinaci s 50–100 mg AZA. Udržovací dávky jsou potom většinou mnohem nižší (zhruba 5–20 mg prednisonu a 50 mg AZA). U AIH refrakterních na KS se nejčastěji používá cyklosporin A. Imunosupresivní léčba je u AIH záležitostí dlouhodobou, často celoživotní. Měla by trvat nejméně dva roky, s postupným snižováním dávek před vysazením. Pokud dojde po přerušení léčby k biochemickému a histologickému relapsu, což je velmi časté (až v 90 %) je indikována celoživotní imunosuprese (asi u 70 % pacientů). Za úspěšnou se považuje terapie, která udržuje aktivitu alaninaminotransferázy (ALT) pod dvojnásobkem horní hranice normy (kritérium biochemické remise). Není však definitivně vyřešeno, zda je pacient v dlouhodobé klinické a biochemické remisi zcela zbaven rizika přechodu chronické hepatitidy do jaterní cirhózy. Fakt, že v 90. letech 20. století přežívalo 5 let více než 95 % pacientů (bez cirhózy před začátkem léčby), je důsledkem časnějšího a přesnějšího stanovení diagnózy a včasného nasazení imunosupresiv. Transplantace jater je metodou volby v konečných stadiích choroby(1).
Léčba pacientů s AIH má na Klinice infekčních chorob (KICH) Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice Brno více než třicetiletou tradici. U naprosté většiny pacientů se k navození remise onemocnění podávají KS v monoterapii – nejčastěji prednison v počáteční dávce 40 mg denně. V případě akutního manifestace AIH s ikterem a vysokou aktivitou ALT v séru je podáván metylprednisolon intravenózně v dávce 60–80 mg denně. Po dosažení remise onemocnění je přidán AZA v počáteční dávce 50 mg denně. Pokud je pro dosažení remise potřebná vyšší dávka prednisonu než 20 mg denně, dávka AZA se zvyšuje na 100–150 mg denně. V minulosti byla u menšího počtu podávána hned od počátku terapie kombinace prednisonu (většinou 20–40 mg denně) a AZA (50 mg denně). Udržovací dávky obou léků jsou potom přísně individuální, ale nejčastěji jde o 5–20 mg prednisonu denně v monoterapii nebo v kombinaci s 50–150 mg AZA denně.
MATERIÁL A METODY
Do současnosti otěhotnělo během léčby pět pacientek s AIH, z toho dvě ženy dvakrát a jedna třikrát. Až na první případ šlo o plánovaná těhotenství, ke kterým došlo v době klinické i biochemické remise onemocnění. Protože dle údajů uvedených výrobcem nemá být AZA podáván ženám těhotným nebo těm, které mohou v blízké době otěhotnět, bez pečlivého zvážení poměru mezi rizikem pro plod a terapeutickým přínosem pro matku, byl AZA minimálně 3 měsíce před plánovaným otěhotněním vysazen a většinou zvýšena dávka prednisonu. V monoterapii prednisonem bylo pokračováno i během těhotenství a kojení, protože u matek užívajících AZA byla v kolostru a v mateřském mléce prokázána přítomnost merkaptopurinu.
Malý počet případů neumožňuje použití statistických metod, pouze popis průběhu těhotenství a období po porodu u jednotlivých pacientek a srovnání s dostupnými literárními údaji.
VÝSLEDKY
Pacientka 1
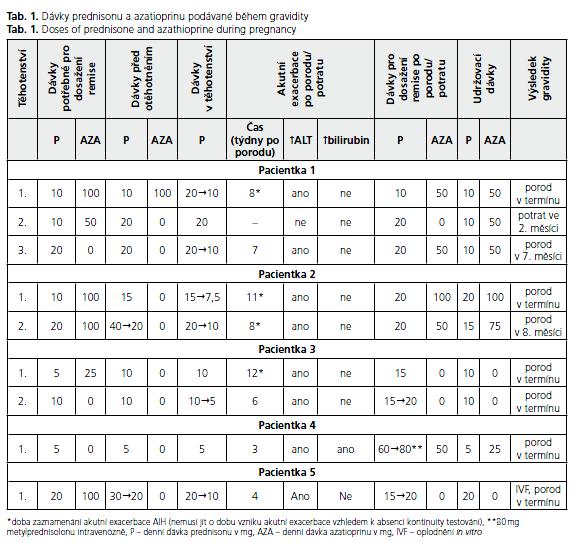
První gravidita u pacientky s AIH byla na KICH FN Brno zaznamenána v roce 2000 o jednoho z monozygotních dvojčat sledovaných pro AIH 3. typu s pozitivitou anti-SLA/LP od jejich 17 let. AIH byla u obou žen odhalena náhodně při podezření na infekční mononukleózu, které se nepotvrdilo. Uvedená pacientka otěhotněla neplánovaně v 25 letech při léčbě prednisonem (10 mg denně) a AZA (100 mg denně), přestože byla mnoho let poučována o tom, že gravidita je u pacientek s AIH možná, ale je nutno ji plánovat a přizpůsobit medikaci. Na kontrolu přišla až po dvou měsících gravidity. Byl vysazen AZA a pacientka byla nadále sledována gynekologem jako rizikové těhotenství. Po vysazení AZA došlo k vzestupu ALT na osminásobek horní hranice normy, proto byl zvýšen prednison na 20 mg denně. Vzhledem k rychlému návratu aktivity ALT k normě byla denní dávka prednisonu postupně snížena na 10 mg. Pacientka porodila v termínu zdravé dítě a přišla na kontrolu až osm týdnů po porodu, kdy aktivita ALT byla 8,58 μkat/l (norma pro ženy je ve FN Brno 0,60 μkat/l). Proto byla znovu zahájena léčba AZA v dávce 50 mg denně, léčba prednisonem pokračovala v dávce 10 mg denně. Tyto dávky postačovaly k navození remise.
Druhá gravidita této pacientka již byla plánovaná a došlo k ní po čtyřech letech od porodu a po předchozím tříměsíčním vysazení AZA. Toto těhotenství však skončilo ve druhém měsíci spontánním potratem, jehož příčina nebyla zjištěna.
Potřetí pacientka otěhotněla již za tři měsíce po potratu. V té době brala 20 mg prednisonu v monoterapii. Tato dávka mohla být během gravidity postupně snížena až na 10 mg denně vzhledem k normální aktivitě ALT (0,29..0,42..0,24 µkat/l). Pacientka předčasně porodila v 7. měsíci těhotenství, ale další vývoj dítěte byl normální. Pacientka byla laboratorně monitorována po porodu zhruba ve čtrnáctidenních intervalech. K vzestupu aktivity ALT došlo mezi 7. až 13. týdnem po porodu (1,09..2,18 μkat/l). Na toto zhoršení bylo reagováno nejprve přidáním AZA (50 mg denně) a následně zvýšením denní dávky prednisonu na 20 mg. Normalizace aktivity ALT bylo dosaženo za další čtyři měsíce. Současná udržovací dávka je 10 mg prednisonu a 50 mg AZA.
Pacientka 2
Sestra předchozí pacientky poprvé plánovaně otěhotněla ve svých 26 letech. Do té doby byla AIH udržována v remisi kombinaci 10 mg prednisonu a 100 mg AZA denně. Tři měsíce před otěhotněním byl AZA vysazen a zvýšena dávka prednisonu na 15 mg denně. V průběhu těhotenství došlo k poklesu ALT (1,47...0,40...0,17 µkat/l), proto byla dávka prednisonu dále snížena až na 7,5 mg denně. Porod proběhl v termínu a bez komplikací a ještě za 14 dní po porodu byla aktivita ALT normální. Při vyšetření za 11 týdnů po porodu došlo k velmi výraznému vzestupu aktivity ALT až na 31,98 μkat/l (hladina bilirubinu v séru byla normální), proto byla denní dávka prednisonu zvýšena na 20 mg a přidán AZA v dávce 100 mg denně. Toto zvýšení dávky imunosupresiv vedlo k normalizaci aktivity ALT během čtyř týdnů a léčba pokračovala stejnými dávkami obou léků i v dalším období.
Ke druhému otěhotnění došlo za čtyři roky po porodu. AZA byl vysazen zhruba tři měsíce před otěhotněním a dávka prednisonu zvýšena na 40 mg denně a následně postupně snížena na 20 mg denně. V průběhu těhotenství došlo opět k normalizaci aktivity ALT (1,07...0,22..0,19), což umožnilo snížit dávku prednisonu na 10 mg denně. Pacientka porodila druhé dítě asi jeden měsíc před termínem, ale bez komplikací. Na kontrolu přišla až za osm týdnů po porodu. Byl zaznamenán vzestup aktivity ALT až na 12,28 μkat/l (bilirubin byl opět normální), a proto byla denní dávka prednisonu navýšena na 20 mg a znovu zahájena léčba AZA v dávce 50 mg denně. Za pět týdnů došlo k poklesu ALT na 0, 76 μkat/l. V současnosti je pacientka udržována v biochemické remisi 15 mg prednisonu a 75 mg AZA denně.
Pacientka 3
U této pacientky byla AIH 1. typu (ASMA a ANA pozitivní) diagnostikována v 15 letech, kdy byla hospitalizována pro výraznou elevaci ALT (25,98 μkat/l) k vyloučení akutní virové hepatitidy. Nyní je pacientce 30 let a má dvě zdravé děti. Udržovací dávku imunosupresiv před prvním těhotenstvím představovalo 5 mg prednisonu a 25 mg AZA denně. Půl roku před plánovaným otěhotněním byl AZA vysazen a denní dávka prednisonu byla zvýšena na 10 mg denně. Při této dávce prednisonu byla aktivita ALT po celou dobu těhotenství normální (0,20–0,35 μkat/l). Za tři měsíce po porodu stoupla aktivita ALT na 1,10 μkat/l, proto byl prednison navýšen na 15 mg denně. Za další dva měsíce byla dávka prednisonu snížena na 10 mg denně vzhledem k normalizaci ALT. Vzhledem k přání pacientky mít v dohledné době další dítě bylo pokračováno v monoterapii prednisonem v uvedené dávce.
Ke druhému otěhotnění došlo zhruba za dva roky po předchozím porodu. K udržení normální aktivity ALT (0,18–0,31 μkat/l) postačovalo 5 mg prednisonu denně. Za 6 týdnů po porodu došlo k mírnému nárůstu aktivity ALT nad normu (0,65 μkat/l) , proto byla dávka prednisonu zvýšena na 10 mg denně. Nárůst ALT však nadále pokračoval až na 4,1 μkat/l, proto byla dávka prednisonu zvýšena postupně na 15 a 20 mg denně. K normalizaci ALT došlo za osm měsíců po porodu a následně byla denní dávka prednisonu postupně snížena na 10 mg denně, což je dávka zatím postačující k udržení klinické i biochemické remise onemocnění.
Pacientka 4
AIH 1. typu (s pozitivitou ANA) byla u této pacientky, které jen nyní 35 let, diagnostikována náhodně ve 22 letech, kdy byla hospitalizována pro výrazný ikterus (celkový bilirubin v séru byl vyšší než 200 μmol/l) s podezřením na akutní virovou hepatitidu. Prednison byl podán v iniciální dávce 20 mg denně, během jednoho měsíce bylo dosaženo remise a denní dávka prednisonu mohla být postupně snížena na udržovacích 5 mg denně. Touto dávkou prednisonu byla pacientka léčena před otěhotněním a po celou dobu těhotenství, které probíhalo zcela bez komplikací a s normální aktivitou ALT (0,34 až 0,52 μkat/l). Za tři týdny po nekomplikovaném porodu začala pacientka žloutnout (celkový bilirubin byl v séru až 230 μmol/l a došlo k vzestupu aktivity ALT až na 14,32 μkat/l). Ve snaze dosáhnout remise AIH byla dávka prednisonu postupně zvyšována až na 60 mg denně, ale bez efektu, proto byla pacientka hospitalizována. Během hospitalizace dostávala 14 dní 80 mg metylprednisolonu denně intravenózně, což vedlo k poklesu sérového bilirubinu až na 56,6 mmol/l a aktivity ALT na 10,77 μkat/l. Pacientka byla následně propuštěna do domácí léčby. Od 9. týdne po porodu byl přidán AZA v dávce 50 mg denně a dávka prednisonu se postupně snižovala. Normalizace ALT bylo dosaženo 12. týden po porodu a udržovací dávka prednisonu byla v té době 5 mg denně a AZA 25 mg denně. V současnosti se pacientka snaží znovu otěhotnět, proto byl AZA vysazen a denní dávka prednisonu zvýšena na 10 mg.
Pacientka 5
U této 26leté pacientky byla diagnóza AIH stanovena náhodně v 19 letech v souvislosti s nálezem zvýšené aktivity ALT při užívání hormonální antikoncepce. Po čtyřech letech byla předána do péče KICH FN Brno. V té době byla pacientka v remisi navozené 20mg prednisonu a 100 mg AZA denně. Vzhledem k plánovanému těhotenství byla v následujících 10 měsících denní dávka AZA postupně snižována, až byl tento lék zcela vysazen. Přechodně bylo nutné zvýšit denní dávku prednisonu na 30 mg denně a s postupným návratem na udržovací dávku 20 mg denně. Pacientce se nedařilo asi 11 roku otěhotnět přirozenou cestou, proto po této době podstoupila oplodnění in vitro. V průběhu těhotenství došlo k rychlému poklesu aktivity ALT z původních 0,78 μkat/l až na 0,28 μkat/l, proto mohla být denní dávka prednisonu postupně snížena na 10 mg. Porod byl v termínu a bez komplikací. Za čtyři týdny po porodu začala postupně stoupat aktivita ALT v séru (0,94..1,30..1,56..3,05 µkat/l), proto byla denní dávka prednisonu zvýšena na 15 mg a následně na současných 20 mg denně. Nyní je pacientka 4 měsíce po porodu a biochemickou remisi AIH se zatím nepodařilo obnovit.
DISKUSE
Díky imunosupresivní terapii žijí ženy s AIH déle a kvalitněji, a protože se často jedná o mladé ženy, mají zájem a možnost otěhotnět(2,3). Názory na průběh AIH v těhotenství nejsou dosud jednotné. Původně se předpokládalo, že přítomnost AIH u nastávající matky je spojena se zvýšenou morbiditou a mortalitou plodu. V 70. letech 20. století bylo ve velké australské studii popsáno 15 spontánních abortů a 9 perinatálních úmrtí ve spojitosti se 128 těhotenstvími žen s AIH(4). Podle naprosté většiny literárních údajů z posledních zhruba 10 let se prokázalo, že léčbou dobře kompenzované ženy s AIH mohou otěhotnět a absolvovat celé těhotenství bez problémů a bezpečně porodit zdravé děti(2,3,5,6). Těhotenství totiž indukuje stav tolerance imunitního systému matky, což vede většinou k poklesu aktivity jaterních enzymů(6). Jednoznačně je hepatology doporučováno, aby imunosupresivní léčba pokračovala i během těhotenství, i když jsou v literatuře popsány případy přetrvávání remise onemocnění během těhotenství i po vysazení imunosupresiv. Po náhlém ukončení podávání imunosupresiv jsou časté těžké akutní exacerbace (flare-up) hepatitidy, jaterní selhání nebo dokonce úmrtí pacientek. Někdy dochází k nevýraznému vzestupu sérového bilirubinu a aktivity alkalické fosfatázy (ALP) v séru, ale tyto změny obvykle po porodu rychle odeznívají a jde ve většině případů o projevy těhotenské cholestázy. V individuálních případech může být problémem rozhodnout, zda ke zhoršení jaterního procesu došlo pouhým vlivem těhotenství, nebo jde o důsledek přerušení imunosupresivní léčby. V každém případě je nutná pečlivé monitorování klinického stavu a laboratorních parametrů během těhotenství(2,3).
Z devíti prezentovaných těhotenství skončila jedna gravidita ve 2. měsíci spontánním potratem, jehož příčina nebyla zjištěna. Ve dvou případech došlo k předčasnému porodu v sedmém, respektive osmém měsíci gravidity. Podle výpovědi pacientek probíhá další vývoj těchto nedonošených dětí normálně. Potíže s otěhotněním měla pouze pacientka 5, která nakonec podstoupila oplodnění in vitro. K udržení biochemické remise AIH postačovaly od počátku těhotenství ve všech případech relativně nízké dávky prednisonu, konkrétně 5–20 mg denně. Během osmi těhotenství, která skončila porodem, bylo možné snížit dávky prednisonu v šesti případech, a to na konečných 5–10 mg denně. Deváté těhotenství, které skončilo ve 2. měsíci potratem, není možné z tohoto pohledu hodnotit (tab. 1).
Kritické období AIH nastává po porodu, kdy dojde k "odbrždění" autoimunitní reaktivity namířené proti jaterním buňkám, což se může projevit závažnou reaktivací hepatitidy během několika málo týdnů až měsíců po porodu. Na to je nutné reagovat zvýšením dávek imunosupresiv(2,3,5,6). Ve velké skandinávské studii byla reaktivace AIH po porodu zaznamenána u 30 % žen(7). V německé multicentrické studii došlo k akutní exacerbaci AIH po porodu u 52 % žen(8). Během těhotenství nebo krátce po porodu může také dojít k první klinické a laboratorní manifestaci AIH(2,9). V italské multicentrické studii sledující prospektivně nejméně dva roky 73 žen s AIH 1. typu se AIH poprvé manifestovala u 6 % žen během těhotenství, ale nikterak to nenarušilo průběh ani výsledek těhotenství(9).
Po všech porodech našich pacientek došlo k akutní exacerbaci AIH, která se v sedmi případech projevila pouze vzestupem aktivity ALT v séru (v jednom případě více než na padesátinásobek horní hranice normy), pouze u pacientky 4 došlo jak k vzestupu ALT (na více než dvacetinásobek horní hranice normy), tak k elevaci celkového bilirubinu v séru na více než desetinásobek horní hranice normy. U této pacientky – jako u jediné z referovaných – byla i první manifestace AIH provázena výrazným ikterem. K opětovnému dosažení biochemické remise onemocnění po porodu bylo použito zvýšení denní dávky prednisonu v monoterapii ve třech případech, zvýšení dávky prednisonu a přidání AZA ve 4 případech a v posledním případě byla ponechána stávající denní dávka prednisonu a přidán AZA. Časový odstup elevace aktivity ALT v séru od porodu lze ve většině případů pouze odhadnout, protože ani jedna z pacientek nebydlí v Brně a množství povinností spojených s péčí o novorozence jim často zabránilo docházet na kontroly dle instrukcí daných ošetřujícím lékařem před porodem. Dokumentovány jsou akutní exacerbace AIH v období 3–12 týdnů po porodu, ale pravděpodobnější je, že aktivita ALT začala stoupat již dříve. Nejzávažnější průběh měla akutní exacerbace AIH po porodu u pacientky 4, která musela být hospitalizována a léčena metylprednisolonem intravenózně. Jediné těhotenství, které skončilo potratem, nebylo provázeno akutní exacerbací AIH, pravděpodobně vzhledem ke jeho krátkému trvání.
Léčba AZA během těhotenství zůstává kontroverzním tématem, i když v současnosti převažuje v literatuře názor, že tento lék je v graviditě bezpečný(6,7,10,11), protože placenta vytváří bariéru AZA a jeho metabolitům. Toto bylo nejlépe prokázáno v Nizozemí u tří žen s Crohnovou chorobou a AIH, které byly léčeny po celé těhotenství AZA. Thiopurinové metabolity – 6-thioguaninové nukleotidy (6-TGN) a 6-metylmerkaptopurin (6-MMP) byly monitorovány v červených krvinkách matky a novorozence ihned po jeho narození. Koncentrace 6-TGN byly poněkud nižší v erytrocytech dítěte než matky. U novorozence se navíc nedal prokázat 6-MMP(11). Rovněž použití cyklosporinu se v současnosti nepovažuje v těhotenství za kontraindikované(10,12). Retrospektivně byl zhodnocen průběh 38 těhotenství u žen užívajících cyklosporin A nebo takrolimus po transplantaci jater provedené pro konečná stadia AIH v americkém Mount Sinai Medical Centre. Ve čtyřech případech došlo ke spontánnímu abortu během prvního trimestru těhotenství a v deseti případech bylo v tomto období těhotenství ukončeno pro zhoršení jaterních funkcí. U pacientek, které spontánně potratily nebo u nich bylo těhotenství z výše uvedené příčiny ukončeno, byl interval mezi transplantací jater a těhotenstvím signifikantně kratší než u žen, které porodily zdravé děti (24,4 ± 24,3 měsíce versus 47,8 ± 28,7 měsíce, p = 0,02). Podle těchto výsledků mají těhotenství plánovaná nejméně po dvou letech po provedení transplantace jater při stabilní funkce štěpu výborné výsledky, co se týče zdraví matky i novorozence. Komplikace spojené s těhotenstvím byly přitom častější u žen, které rodily v letech 1992–1997 než v letech 1998–2000, což ukazuje na zdokonalení péče o tyto pacientky během sledovaného období. Velká literární rešerše pomocí databáze MEDLINE zahrnuje celkem 58 těhotných žen, u nichž byl popsán průběh AIH v těhotenství v letech 1966–2004. Celkem bylo v 17 kazuistikách prezentováno 101 těhotenství – u 5 pacientek došlo během těhotenství ke zlepšení klinického stavu, 45 bylo ve stabilizovaném stavu po celé těhotenství, v 47 případech došlo k akutní exacerbaci AIH během těhotenství nebo po porodu a ve 4 případech nebyl klinický obraz během těhotenství dokumentován. Došlo ke dvěma úmrtím matky, perinatální mortalita byla 4 % a odumřelo 19 plodů. Většina žen byla léčena prednisonem v monoterapii, ale kombinace s azatioprinem byla užita u významného počtu nemocných(13).
Osm z devíti referovaných těhotenství pacientek s AIH bylo plánovaných a k otěhotnění došlo nejméně za tři měsíce po vysazení AZA z důvodů uvedených v úvodu. Kojila pouze pacientka 3 – první dítě déle než jeden rok a druhé dítě zhruba půl roku. Ukončení kojení u druhého dítěte jí bylo doporučeno vzhledem k vysoké hladině cholesterolu v séru (maximálně 9,7 mmol/l), která přetrvávala od začátku posledního trimestru a byla provázena výrazným vzestupem sérové aktivity gama-glutamyltransferázy (GGT) až na 7,24 μkat/l (norma ve FN Brno je pro ženy do 0,60 μkat/l). Po skončení laktace došlo k normalizaci cholesterolu i aktivity GGT, což ukazuje velmi pravděpodobně, že k elevaci těchto parametrů vedly hormonální změny spojené s laktací. Ostatním ženám nebylo kojení neonatology a pediatry doporučeno z obavy z možných nežádoucích účinků KS na dítě.
ZÁVĚR
Prezentované zkušenosti ukazují, že gravidita je u pacientek s dobře kompenzovanou AIH možná a její průběh je většinou nekomplikovaný. K udržení klinické a biochemické remise onemocnění postačují díky fyziologické imunosupresi spojené s těhotenstvím v naprosté většině případů nižší dávky prednisonu, než které bylo nutné podávat mimo období gravidity. Akutní exacerbace AIH, projevující se většinou pouze elevací sérové aktivity ALT jsou po porodu pravidlem. K obnovení remise onemocnění je nutné přechodné navýšení denních dávek prednisonu nebo přidání AZA do kombinace.
Literatura
- 1. Alvarez F, Berg PA, Bianchi FB, et al. International Autoimmune Hepatitis Group Report: review of criteria for diagnosis of autoimmune hepatitis. J Hepatol 1999; 31: 929–938.
- 2. Van Dyke RW. The liver in pregnancy. In: Boyer TD, Wright TL, Manns MP. Zakim and Boyer’s Hepatology. A Textbook of Liver Disease. 5th edition. Philadelphia: Saunders Elsevier 2006; 1003–1029.
- 3. Maroo S, Wolf JL. The liver in pregnancy. In: Friedman LS, Keeffe EB. Handbook of Liver Disease. Second Edition. Philadelphia: Churchill Livingstone 2004; 269–282.
- 4. Steven MM, Buckley JD, Mackay IR. Pregnancy in chronic active hepatitis. Q J Med 1979; 48: 519.
- 5. Colle I, Hautekeete M. Remission of autoimmune hepatitis during pregnancy: a report of two cases. Liver 1999; 19: 55–57.
- 6. Buchel E, van Steenbergen W, Nevens F, Fevery J. Improvement of autoimmune hepatitis during pregnancy followed by flare up after delivery. Amer J Gastroenterol 2002; 97: 3160–3165.
- 7. Werner M, Bjornsson E, Prytz H, Lindgren S, Almer S, Broome U, et al. Autoimmune hepatitis among fertile women: Strategies during pregnancy and breastfeeding. Scand J Gastroenterol 2007; 42: 986–991.
- 8. Schramm C, Herkel J, Beuers U, Kanzler S, Galle PR, Lohse AW. Pregnancy in autoimmune hepatitis: Outcome and risk factors. Amer J Gastroenterol 2006; 101: 556–560.
- 9. Floreani A, Niro G, Rizzotto ER, Antoniazzi S, Ferrara F, et al. Type I autoimmune hepatitis: clinical course and outcome in an Italian multicentre study. Aliment Pharmacol Therapeut 2006; 24: 1051–1057.
- 10. Czaja AJ. Autoimmune liver disease. Curr Opin Gastroen 2002; 18: 334–344.
- 11. de Boer NKH, Jarbandhan SVA, de Graaf P, Mulder CJJ, van Elurg RM, van Bodegraven AA. Azathioprine use during pregnancy: Unexpected intrauterine exposure to metabolites. Amer J Gastroenterol 2006; 101: 1390–1392.
- 12. Nagy S, Bush MC, Berkowitz R, Fishbein TM, Gomez- Lobo V. Pregnancy outcome in liver transplants recipients. Obstet Gynecol 2003; 102: 121–128.
- 13. Candia L, Marquez J, Espinoza LR. Autoimmune hepatitis and pregnancy: A rheumatologist’s dilemma. Semin Arthritis Rheum 2005; 35: 49–56.
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené