Asociácia nealkoholovej tukovej choroby pečene s kardiálnym štrukturálnym postihnutím
Katarína Demková1, Tibor Varga ml.2, Ján Tokarčík1
+ Pracoviště
Souhrn
Nealkoholová tuková choroba pečene zahŕňa spektrum patologických stavov od jednoduchej steatózy pečene cez nealkoholovú steatohepatitídu, fibrózu až po cirhózu pečene. Pacienti s nealkoholovou tukovou chorobou pečene majú vyšší výskyt koronárnej choroby srdca, kardiovaskulárnych príhod na podklade aterosklerózy, ischemických aj hemoragických cievnych mozgových príhod, tromboembolických príhod, porúch prevodového systému, dysfunkcie ľavej komory a tiež mortality na kardiovaskulárne ochorenia. Nealkoholová tuková choroba pečene je asociovaná aj so štrukturálnymi abnormalitami myokardu a chlopní. Nealkoholová steatohepatitída sa vyvinie cca u 8–20 % obéznych pacientov s jednoduchou steatózou pečene. Ochorenie má tendenciu k progresii a môže byť liečebne zle ovplyvniteľné. Nealkoholová steatohepatitída zvyšuje riziko mortality na kardiovaskulárne ochorenia 2,1-krát a riziko mortality z akýchkoľvek príčin 2,3-krát. Zápalový proces v pečeni môže predstavovať hlavný determinant systémových komplikácií u osôb s nealkoholovou tukovou chorobou pečene, preto by jeho hodnotenie mohlo byť užitočné na posúdenie kardiovaskulárneho rizika. Vzhľadom na dokumentovanú asociáciu medzi závažnosťou steatózy pečene hodnotenej ultrasonograficky a koronárnou, resp. karotickou aterosklerózou, ultrasonografické vyšetrenie pečene môže byť nápomocné pri identifikácii osôb s vysokým kardiovaskulárnym rizikom. Uvedená kazuistika potvrdzuje dôležitosť vykonania echokardiografického skríningu štrukturálnych a funkčných porúch srdca u pacientov s chronickou nealkoholovou steatohepatitídou za účelom zahájenia včasnej liečby a zlepšenia ich prognózy.
Klíčová slova
nealkoholová tuková choroba jater, ultrasonografie, echokardiografie, screening
Úvod
Nealkoholická steatohepatitída (NASH – non-alcoholic steatohepatitis) patrí k najčastejším metabolickým ochoreniam pečene. Je charakteristická hromadením tukov v podobe tukových kvapôčok vo viac ako 5 % hepatocytov inak normálnej pečene a zároveň známkami zápalu a poškodenia hepatocytov – tzv. balooning, rozpadu (cytolýzy) hepatocytov, a môže, ale nemusí byť prítomná fibróza pečene [1]. Druhou podmienkou k určeniu diagnózy NASH je úplná abstinencia alebo maximálna konzumácia alkoholu 20 g denne, teda vylúčený alkoholický pôvod zmien [2].
Rozlišujeme primárnu steatohepatitídu, ktorá je spojená s obezitou, inzulínovou rezistenciou, diabetes mellitus 2. typu, hyperlipidémiou, a sekundárne steatohepatitídy, alkoholovej alebo liekovej (amiodarón, perhexilín) genézy, pri chronickej hepatitíde C, po jejuno-ileovom bypasse, pri Wilsonovej chorobe [3].
V patogenéze NASH zohráva rozhodujúcu úlohu ukladanie tuku do hepatocytov, steatóza pečene, ktorú charakterizuje pečeňová inzulínová rezistencia. Stukovatenie pečene sa v patogenéze NASH označuje ako prvý úder. Ten senzibilizuje pečeň na druhý úder, ktorý je charakterizovaný oxidačným stresom s tvorbou reaktívnych radikálov, nasledujúcou nekroinflamáciou a fibrogenézou. Ako tretí úder sa označuje neadekvátna proliferácia hepatocytov. Replikácia zrelých hepatocytov je pri oxidačnom strese inhibovaná, čoho dôsledkom je nadmerný rast pečeňových progenitorových buniek – ovalocytov, ktoré sa zrejme zúčastňujú na hepatokarcinogenéze. Pôsobenie patofyziologických mechanizmov pri NASH je zvyčajne kontinuálne a vývoj je chronický [3].
Pečeň obsahuje najväčšie množstvo makrofágov a veľké množstvo cytokínov (najmä TNFα, IL-6, CRP) a chemokínov, ktoré sa môžu v prípade NASH chronicky uvoľňovať do systémovej cirkulácie, čo podporuje chronický zápal, vedie k poškodzovaniu ciev a abnormalitám koagulačného systému s väčšou náchylnosťou na trombózu [4].
Popis vlastného prípadu
Kazuistika opisuje prípad 57-ročnej pacientky bez internistického predchorobia, s negatívnou rodinnou anamnézou, ktorá bola poukázaná na interné vyšetrenie za účelom diferenciálnej diagnostiky hmotnostného úbytku. Pacientka v priebehu posledného roka necielene schudla približne 10 kg. Subjektívne udávala nechutenstvo, bolesti v epigastriu, pocit globu v hrdle, niekedy aj so záchvatmi dýchavice v ľahu, v dôsledku čoho prijímala málo stravy. Lieky vrátane nesteroidných antireumatík neužívala, fajčila 4–5 cigariet denne. Abúzus alkoholu pacientka negovala a bol vylúčený aj rodinnými príslušníkmi. V kontexte sociálnej anamnézy pacientka pracuje ako vodič z povolania v cestovinárskom závode.
V objektívnom náleze sme zistili prítomnosť obezity (BMI 32, obvod pása 104 cm), krvný tlak 155/90 mmHg, hepar 2+, 2. stupeň tvrdosti podľa Naegeliho.
V laboratórnom skríningu bola preukázaná elevácia hepatálnych a cholestatických enzýmov (tab. 1), ľahká hypoproteinémia (56,7 g/l), normálna hladina sérového albumínu (33,4 g/l), euglykémia (4,02 mmol/l), hraničná leukocytóza (10,54 × 109), normálny počet trombocytov (357 × 109), makrocytóza erytrocytov pri deficite folátu a vitamínu B12, bez anémie. Vylúčená bola prítomnosť vírusových aj autoimunitných hepatitíd, imunoprofil (IgA, IgG, IgM) aj hladina ferritínu boli v norme. Z markerov subklinického zápalu bola zvýšená hladina fibrinogénu a hsCRP (tab. 2).

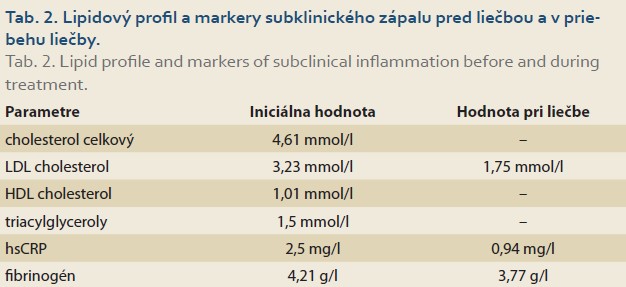
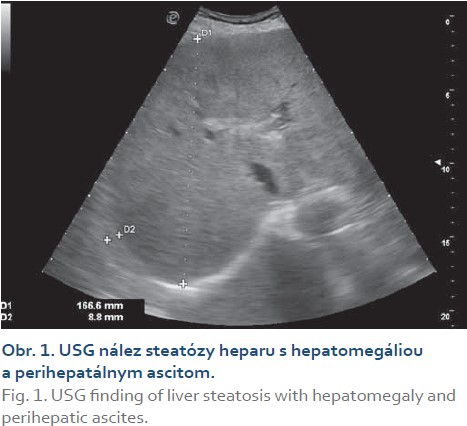
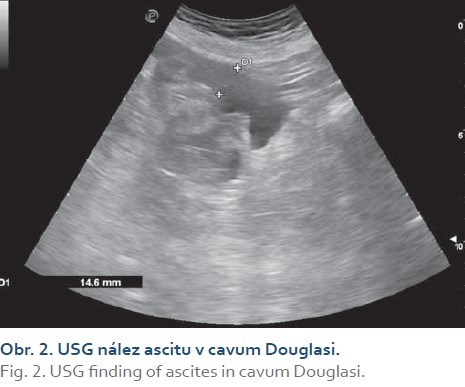
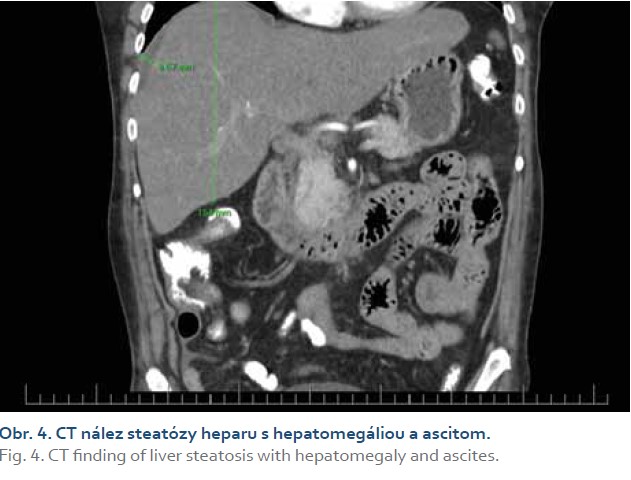
Realizovali sme USG abdomenu s nálezom steatózy heparu s hepatomegáliou (obr. 1), cholecystopatie s cholecystolitiázou, bez prítomnosti dilatácie žlčových ciest. Slezina bola normálnej veľkosti, bez hílových varixov. Navyše bolo prítomné aj minimálne množstvo ascitu perihepatálne, ako aj v oblasti cavum Douglasi (obr. 2). S prihliadnutím na objektívnu nedostupnosť MR a elastografie v regióne sme využitím dopplerovského vyšetrenia prítomnosť portálnej hypertenzie nepotvrdili (pacientka bez nálezu splenomegálie a splenických hílových varixov, šírka a prietok vena portae v medziach normy). Meraním indexu rezistencie na arteria hepatica sme zistili nešpecifický nález suponujúci diagnózu chronickej steatohepatitídy (obr. 3). Neinvazívne markery fibrózy pečene (Fibrosis-4 Index, FIB4 = 2,05; AST to Platelet Ratio Index, APRI = 0,484) nepotvrdili prítomnosť fibrózy pečene. Doplnené CT vyšetrenie abdomenu potvrdilo sonografický záver (obr. 4). Cestou gastroenterológa si pacientka doplnila gastrofibroskopické vyšetrenie s nálezom antrumgastritídy s histologickým obrazom foveolárnej hyperplázie. Ezofageálne ani gastrické varixy, ako ani iné známky portálnej gastropatie prítomné neboli. ORL vyšetrenie verifikovalo nález laryngitídy pri gastroezofageálnej refluxovej chorobe. Gynekologické vyšetrenie odhalilo iba drobný myóm u postmenopauzálnej pacientky a vylúčilo gynekologické malignity. Cestou obvodného lekára si pacientka doplnila RTG vyšetrenie hrudníka a vyšetrenie stolice na okultné krvácanie s negatívnym výsledkom.
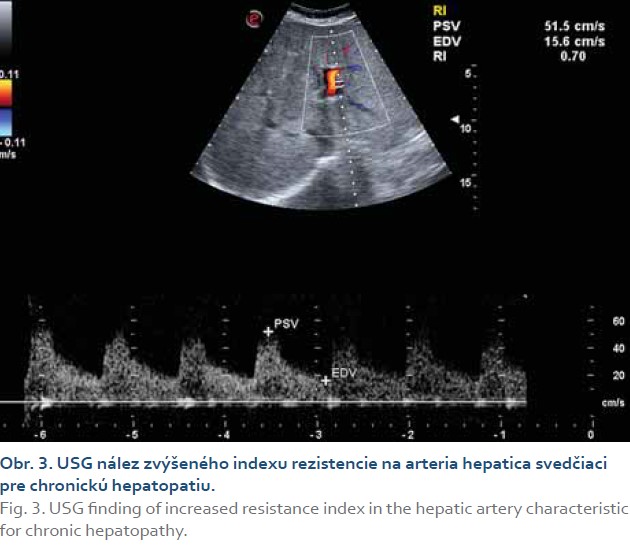
Prípad z gastroenterologického hľadiska interpretujeme ako chronickú nealkoholovú steatohepatitídu, morbus Ménétrier a gastroezofageálnu refluxovú chorobu s laryngitídou. Chudnutie a nechutenstvo pripisujeme antrumgastritíde a gastroezofageálnemu refluxu. Vzhľadom na prítomnosť artériovej hypertenzie 1. stupňa ESC/ESH, zníženej hladiny HDL cholesterolu (tab. 2) a širšieho obvodu pása, pacientke podľa kritérií National Program Expert Panel and Adult Treatment Panel III (NCEP/ATP III) diagnostikujeme metabolický syndróm.
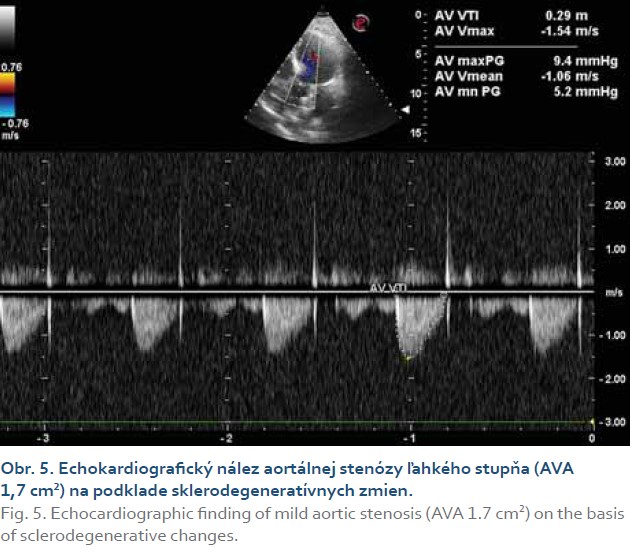
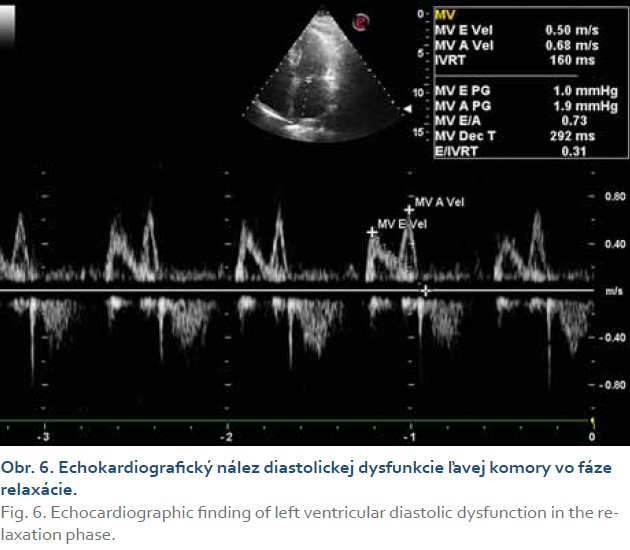
Vzhľadom na zvýšenú incidenciu kardiovaskulárnych komplikácií u pacientov so steatohepatitídou sme doplnili echokardiografické vyšetrenie s nálezom sklerodegeneratívnych zmien aortálnej chlopne, aortálnej stenózy ľahkého stupňa (aortic valve area, AVA = 1,7 cm2) (obr. 5), zachovanej systolickej funkcie ľavej komory (EF ĽK nad 60 %), diastolickej dysfunkcie ľavej komory typu I (obr. 6), bez hypertrofie a porúch kinetiky stien ľavej komory. Pravé srdcové oddiely boli bez dilatácie, bez chlopňových chýb a perikardiálneho výpotku. Podľa tabuliek SCORE sme pacientku objektívne stratifikovali do pásma vysokého kardiovaskulárneho rizika (VKVR). Verifikovaním aortálnej stenózy sme u našej pacientky s chronickou steatohepatitídou a metabolickým syndrómom potvrdili prítomnosť štrukturálneho postihnutia srdca.
Zahájili sme liečbu inhibítormi protónovej pumpy, koenzýmom Q10, vitamínmi skupiny B, vysokou dávkou silymarínu. Pre zabránenie progresie nálezu na aortálnej chlopni sme do liečby pridali statín s cieľom dosiahnutia hladiny LDL cholesterolu pod 1,8 mmol/l podľa odporúčaní ESC/EAS z roku 2019 a pre VKVR. Pre diagnózu artériovej hypertenzie a diastolickej dysfunkcie ľavej komory sme do liečby pridali nízku dávku indapamidu. Po 4 mesiacoch liečby sme u pacientky pozorovali ústup subjektívnych ťažkostí, normalizáciu laboratórnych parametrov (tab. 1, 2) a ústup ascitu. Uvedený prípad potvrdzuje dôležitosť realizácie echokardiografického skríningu štrukturálnych a funkčných porúch srdca u pacientov s chronickou nealkoholovou steatohepatitídou a metabolickým syndrómom za účelom zahájenia včasnej liečby a zlepšenia ich prognózy.
Diskusia
Nealkoholová tuková choroba pečene (NAFLD – non-alcoholic fatty liver disease) zahŕňa spektrum patologických stavov od jednoduchej steatózy pečene cez nealkoholovú steatohepatitídu, rôzny stupeň fibrózy pečene až po cirhózu pečene s jej komplikáciami [1]. Má silný vzťah s diabetom a metabolickým syndrómom a je asociovaná tiež so zvýšeným rizikom fatálnych aj nefatálnych kardiovaskulárnych príhod. Pacienti s NAFLD majú vyšší výskyt koronárnej choroby srdca, kardiovaskulárnych príhod na podklade aterosklerózy, ischemických aj hemoragických cievnych mozgových príhod, tromboembolických príhod, porúch prevodového systému, dysfunkcie ľavej komory a tiež mortality na kardiovaskulárne ochorenia. Prítomnosť ochorenia pečene je prediktorom kardiovaskulárnych príhod bez ohľadu na tradičné rizikové faktory. Je tiež možné, že NAFLD a kardiovaskulárne ochorenia majú spoločnú dedičnú predispozíciu, ktorá ďalej ovplyvňuje kardiovaskulárne riziko u týchto pacientov [5].
V observačnej štúdii Targhera et al, ktorá sledovala 2 103 diabetikov v priemere 6,5 roka, bolo pozorovaných 219 prípadov nefatálnej ischemickej choroby srdca (infarkt myokardu, resp. revaskularizačné zákroky) a 121 prípadov úmrtí z kardiovaskulárnych príčin, s vyššou frekvenciou výskytu u pacientov s NAFLD. Táto asociácia nebola ovplyvnená ani adjustáciou na mnohopočetné rizikové faktory (hazard ratio, HR 1,96 [1,4–2,7]; p < 0,001) [6].
NAFLD je asociovaná aj so štrukturálnymi abnormalitami myokardu a chlopní. V štúdii kolektívu Mantovani, Zoppini, Targher et al [7] sa u pacientov s NAFLD zistila vyššia prevalencia hypertrofie ľavej komory v porovnaní s pacientmi bez NAFLD (82 vs. 18 %; p = 0,01) a táto asociácia zostala signifikantná aj po úprave na viaceré tradičné rizikové faktory. Okrem toho sa u pacientov s NAFLD zistila vyššia (trojnásobná) prevalencia diastolickej dysfunkcie ľavej komory [8].
Údaje zo štúdie CARDIA (Coronary Artery Risk Development in Young Adults), v ktorej sa na hodnotenie prítomnosti steatózy pečene u 2 713 pacientov používala počítačová tomografia, potvrdili zníženú rýchlosť včasnej diastolickej relaxácie (e‘) (10,8 ± 2,6 vs. 11,9 ± 2,8 cm/s; p < 0,0001) a vyšší plniaci tlak ľavej komory (pomer E/e‘: 7,7 ± 2,6 vs. 7,0 ± 2,3; p < 0,0001) u pacientov s NAFLD v porovnaní s pacientmi bez NAFLD [9].
V prierezovej štúdii Study of Health in Pomerania (SHIP) bola preukázaná vyššia prevalencia sklerózy aortálnej chlopne u pacientov s NAFLD v porovnaní s pacientmi bez NAFLD (36,8 % vs. 28,4 %; p < 0,001) [10]. Asociácia medzi NAFLD a aortosklerózou bola pozorovaná aj u pacientov s diabetom (po adjustácii – odds ratio, OR 3,04; 95% CI 1,3–7,3; p = 0,01) [11].
V štúdii autorov Valbusa, Agnoletti, Scala et al [12] bolo u starších pacientov s NAFLD, ktorí boli hospitalizovaní pre akútne srdcové zlyhanie, preukázané zvýšené riziko mortality (adjustované-HR 1,82; 95% konfidenčného intervalu 1,22–2,81; p < 0,005).
Tieto údaje potvrdzujú nielen aditívny vplyv NAFLD na kardiovaskulárne príhody, ale tiež podporujú aj možnú úlohu NAFLD ako rizikového faktora pre rozvoj štrukturálnych ochorení srdca, ako je dysfunkcia chlopní, hypertrofia myokardu a následne pre rozvoj srdcového zlyhávania [5].
Prítomnosť systémového mikrovaskulárneho poškodenia spolu s endotelovou dysfunkciou v dôsledku pretrvávajúceho zápalu a oxidačného stresu by mohli byť jedny z hlavných mechanizmov, ktoré zvyšujú kardiovaskulárne riziko v populácii pacientov s NAFLD [13]. Preto by hodnotenie prítomnosti steatohepatitídy mohlo byť užitočné na posúdenie kardiovaskulárneho rizika. U pacientov s NAFLD býva prítomnosť zjavnej steatohepatitídy pri biopsii asociovaná s kardiálnymi abnormalitami, ako je zväčšenie ľavej predsiene a zväčšená hmota ľavej komory v porovnaní s osobami bez NAFLD [14]. Vzhľadom na dokumentovanú asociáciu medzi závažnosťou steatózy pečene hodnotenej ultrasonograficky a koronárnou/karotickou aterosklerózou, ultrasonografické vyšetrenie pečene môže byť nápomocné pri identifikácii osôb s vysokým kardiovaskulárnym rizikom [15]. Keďže prevalencia NAFLD vo svetovej populácii stúpa a NAFLD je spojená s vyšším kardiovaskulárnym rizikom a mortalitou, je nutné vyhľadávanie pacientov s NAFLD. Najspoľahlivejšou je kombinácia skríningových laboratórnych a zobrazovacích metód – vyšetrenia aktivity hepatálnych enzýmov s ultrasonografiou pečene a následným doplnením echokardiografického vyšetrenia [16].
ORCID autorov
K. Demková ORCID 0000-0002-0812-2585,
T. Varga ORCID 0000-0002-9803-174X,
J. Tokarčík ORCID 0000-0002-4264-2648.
Doručené/Submitted: 19. 3. 2022
Prijaté/Accepted: 24. 4. 2022
MUDr. Katarína Demková, PhD.
IV. interná klinika
LF UPJŠ a UN L. Pasteura Košice
Rastislavova 43
041 90 Košice
katarina.demkova@upjs.sk
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Češka R. Interna. Praha: Triton 2020.
2. Ehrmann J. Ikterus – diferenciální diagnostika. Praha: Grada Publishing a. s. 2003.
3. Hrušovský Š. Praktická hepatológia. Bratislava: Vydavateľstvo zdravotníckej literatúry HERBA, spol. s. r. o. 2015.
4. Vonghia L, Magrone T, Verrijken A et al. Peripheral and hepatic vein cytokine levels in correlation with non-alcoholic fatty liver disease (NAFLD) – related metabolic, histological, and haemodynamic features. PLoS One 2015; 10(11): e0143380. doi: 10.1371/journal.pone.0143380.
5. Tana C, Ballestri S, Ricci F et al. Cardiovascular risk in non-alcoholic fatty liver disease: mechanisms and therapeutic implications. Int J Environ Res Public Health 2019; 16(17): 3104. doi: 10.3390/ijerph16173104.
6. Targher G, Bertolini L, Rodella S et al. Nonalcoholic fatty liver disease is independently associated with an increased incidence of cardiovascular events in type 2 diabetic patients. Diabetes Care 2007; 30(8): 2119–2121. doi: 10.2337/dc07-0349.
7. Mantovani A, Zoppini G, Targher G et al. Non-alcoholic fatty liver disease is independently associated with left ventricular hypertrophy in hypertensive type 2 diabetic individuals. J Endocrinol Investig 2012; 35(2): 215–218. doi: 10.1007/BF03345421.
8. Mantovani A, Pernigo M, Bergamini C et al. Nonalcoholic fatty liver disease is independently associated with early left ventricular diastolic dysfunction in patients with type 2 diabetes. PLoS One 2015; 10(8): 1–13. doi: 10.1371/journal.pone.0135329.
9. VanWagner LB, Wilcox JE, Colangelo LA et al. Association of nonalcoholic fatty liver disease with subclinical myocardial remodeling and dysfunction: a population-based study. Hepatology 2015; 62(3): 773–783. doi: 10.1002/hep.27869.
10. Markus MR, Baumeister SE, Stritzke J et al. Hepatic steatosis is associated with aortic valve sclerosis in the general population: The Study of Health in Pomerania (SHIP). Arterioscler Thromb Vasc Biol 2013; 33(7): 1690–1695. doi: 10.1161/ATVBAHA.112.300556.
11. Bonapace S, Valbusa F, Bertolini L et al. Nonalcoholic fatty liver disease is associated with aortic valve sclerosis in patients with type 2 diabetes mellitus. PLoS One 2014; 9(2): e88371. doi: 10.1371/journal.pone.0088371.
12. Valbusa F, Agnoletti D, Scala L et al. Non-alcoholic fatty liver disease and increased risk of all-cause mortality in elderly patients admitted for acute heart failure. Int J Cardiol 2018; 265: 162–168. doi: 10.1016/j.ijcard.2018.04.129.
13. Pereira ENGDS, Silvares RR, Flores EEI et al. Hepatic microvascular dysfunction and increased advanced glycation end products are components of non-alcoholic fatty liver disease. PLoS One 2017; 12(6): e0179654. doi: 10.1371/journal.pone.0179654.
14. Simon TG, Bamira DG, Chung RT et al. Nonalcoholic steatohepatitis (NASH) is associated with cardiac remodeling and dysfunction. Obesity 2017; 25(8): 1313–1316. doi: 10.1002/oby.21879.
15. Ballestri S, Romagnoli D, Nascimbeni F et al. Role of ultrasound in the diagnosis and treatment of nonalcoholic fatty liver disease and its complications. Expert Rev Gastroenterol Hepatol 2015; 9(5): 603–627. doi: 10.1586/ 17474124.2015.1007955.
16. Fedelešová M, Kupčová V, Szántová M et al. Možnosti použitia neinvazívnych metód pri nealkoholovej tukovej chorobe pečene. Gastroent Hepatol 2017; 71(4): 325–332. doi: 10.14735/amgh2017325.