Antimitochondriální protilátky vyskytující se u nemocných s primární biliární cirhózou - cílové antigenní struktury a diagnostika
Miloslav Hlubinka Orcid.org , Petr Husa1
+ Pracoviště
Souhrn
Článek podává stručný přehled cílových antigenních struktur antimitochondriálních protilátek vyskytujících se při primární biliární cirhóze (anti-M2, M4, M8 a M9). Funkcí těchto struktur (jde převážně o enzymy nebo multienzymatické komplexy) je katalýza některých reakcí buněčného metabolismu - převážně procesů probíhajících v mitochondriích. Specifickou kapitolou jsou přirozeně se vyskytující antimitochondriální protilátky jejichž hladiny se při primární biliární cirhóze spíše snižují. Diagnostika se v současnosti provádí nejčastěji kombinací metody nepřímé imunofluorescence s enzymoimunoanalýzou nebo Western blotingem. Protilátky anti-M2 jsou patognomickým markerem primární biliární cirhózy ostatní protilátky mají spíše prognostický význam. Lze předpokládat významnější zapojení moderních metod (např. měření inhibice enzymatické aktivity) do diagnostiky těchto typů antimitochondriálních protilátek.
Klíčová slova: antimitochondriální protilátky - primární biliární cirhóza.
ÚVOD
Stanovení antimitochondriálních protilátek (AMA - z anglického „antimitochondrial antibodies") má už delší dobu své nezastupitelné místo zejména v diagnostice primární biliární cirhózy. Kromě této nejčastější asociace, patřící zejména do oblasti gastroenterologie, se objevují i některé méně obvyklé a ještě donedávna málo prozkoumané typy AMA, se kterými se můžeme setkat v sérech pacientů s dalšími chorobami.
Antimitochondriální protilátky byly poprvé popsány v roce 1958 (1) . Celkově je známo devět základních typů antimitochondriálních autoprotilátek (majících ještě v některých případech i další podtypy). Běžný typ značení je anti-Ml až anti-M9. V německy mluvících zemích se dříve občas používalo i dělení na deset podtypů - šlo ale jen o drobnou modifikaci - dva subtypy protilátek anti-M5 byly klasifikovány zvláš».
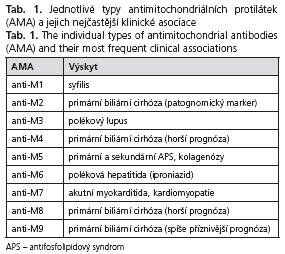
Tabulka 1 obsahuje základní přehled jednotlivých typů AMA a jejich klinických asociací. Z diagnostického hlediska jsou zatím zdaleka nejvýznamnější tzv. PBC-related (primary biliary cirrhosis-related) protilátky, tedy typy anti-M2, anti-M4, anti-M8 a anti-M9, které se vyskytují zejména u pacientů s primární biliární cirhózou. Proto se přednostní zájem vědců upíná zvláště k cílovým strukturám těchto typů antimitochondriálních protilátek. Lze říci, že některé z nich jsou už vcelku detailně prozkoumány (zejména terčové struktury protilátek anti-M2).
Článek si klade za cíl alespoň trochu přispět k poskytnutí základního přehledu o této zajímavé skupině antigenních epitopů.
MITOCHONDRIE
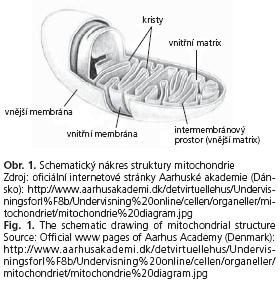
Buněčnou organelou, na které se nachází cílové struktury PBC-related AMA, jsou ve většině případů mitochondrie. Obecně vzato jde o buněčné cytoplazmatické organely původu nejpravděpodobněji endosymbiotického (anaerobní a heterotrofní prokaryontní buňky endosymbioticky přijaly aerobní bakterie). Ontogeneticky vznikají mitochondrie v časné fázi nejčastěji příčným dělením a pučením, později převážně vychlipováním jaderné membrány nebo membrány endoplazmatického retikula. Jejich šířka je asi 0,1-0,5 μm a délka řádově jednotky μm (do 10 μm).
Tvar mitochondrie je při běžném dvojrozměrném zobrazení poněkud zkreslován - v trojrozměrném zobrazení vypadá mitochondrie schematicky podle obrázku 1. Na povrchu je vnější membrána, uvnitř je membrána vnitřní, která vytváří ve většině případů přehrádky zvané kristy (cristae mitochondriales). Účelem je zvětšení povrchu pro maximalizaci energetické produkce. Uvnitř je vnitřní mitochondriální matrix, mezi membránami je vnější mitochondriální matrix. Vlastní membránový skelet u vnitřní i vnější mitochondriální membrány sestává klasicky ze dvou fosfolipidových vrstev (tlouš»ka kolem 6 nm), vnitřní membrána má větší hmotnostní procento membránových proteinů než membrána vnější.
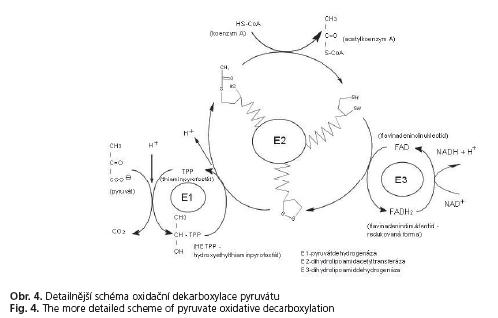
V mitochondriích probíhá několik pro buňku důležitých biochemických procesů - patří sem zejména dýchací řetězec a s ním spojená oxidační fosforylace (lokalizace na vnitřních membránách), dále (β-oxidace mastných kyselin, oxidační dekarboxylace a cyklus trikarboxylových kyselin (Krebsův cyklus) - lokalizace v mitochondriální matrix. Všechny tyto procesy mají na výstupu depozici makroergního adenosintrifosfátu (ATP), který potom slouží buňce jako energetický pool. Jedinou výjimkou je oxidační dekarboxylace, na jejímž výstupu není ATP, ale acetylkoenzym A. Tato látka neslouží jako zásobárna energie (i když má též makroergní vazbu), nýbrž ji organismus používá k různým syntézám. A právě některé multienzymové komplexy, které zajiš»ují oxidační dekarboxylaci, jsou v této souvislosti velmi zajímavé. Jedná se zejména o některé zástupce ze skupiny dehydrogenáz 2-oxokyselin: pyruvátdehydrogenázu, 2-oxoglutarátdehydrogenázu a dehydrogenázu 2-oxokyselin s postranním řetězcem(2). K těmto strukturám můžeme připojit ještě tzv. E3-binding protein (dihydrolipoamiddehydrogenázu vážící protein), sulfitoxidázu a glykogenfosforylázu.
CÍLOVÉ EPITOPY PROTILÁTEK AMA TYPU M2
Všechny antigenní determinanty, proti kterým jsou zaměřeny protilátky anti-M2, patří do skupiny dehydrogenáz 2-oxokyselin (dříve α-ketokyselin). Jedná se o multienzymatické komplexy, jejichž velikost je větší než ribozomy. Patří sem:
1. Pyruvátdehydrogenázový komplex (PDC - pyruvate dehydrogenase complex) - komplex dehydrogenázy kyseliny pyrohroznové - komplex je vázán na vnitřní mitochondriální membránu, podílí se na dehydrogenaci a dekarboxylaci pyruvátu a vzniku molekuly acetylkoenzymu A.
2. 2-oxoglutarátdehydrogenázový komplex (OGDC -2-oxoglutarate dehydrogenase complex) - má stejnou stavbu i funkci, jen substrátem je kyselina 2-oxoglutarová (starší terminologií α-ketoglutarová).
3. Komplex dehydrogenázy 2-oxokyselin s postranním řetězcem (BCOADC - branched-chain 2-oxoacid dehydrogenase complex) - pro tento komplex platí totéž co pro výše zmíněné komplexy s tím, že potenciální substráty jsou tři (2-oxokyseliny odvozené od tří aminokyselin s postranním řetězcem - leucinu, izoleucinu a valinu) - 2-oxoleucin, 2-oxoizoleucin a 2-oxovalin).
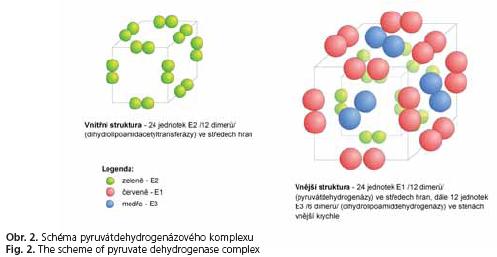
Jako modelový příklad je ideální pyruvátdehydrogenázový komplex (oba další komplexy jsou velmi podobné co do struktury i funkce). Na obrázku 2 je tato i z geometrického hlediska zajímavá struktura zobrazena. Jde o složitý multienzymový komplex s celkem 60 podjednotkami, které jsou uspořádány do tří různých struktur. Jádro celého komplexu tvoří 24 podjednotek dihydrolipoamidacetyltransferázy (enzym E ), uspořádané do struktury s krychlovou rotační symetrií (vždy jeden dimer na každé hraně). Tento komplex je „obalen" další strukturou s krychlovou rotační symetrií. Ve středech hran jsou opět dimery, tentokrát vlastní pyruvátdehydrogenázy - enzym E čili znovu 24 podjednotek. Ve stěnách vnější krychle jsou situovány dimery dihydrolipo-amiddehydrogenázy (celkem tedy 12 podjednotek - enzym E ). Funkcí tohoto komplexu je již zmíněná oxidační dekarboxylace pyruvátu.
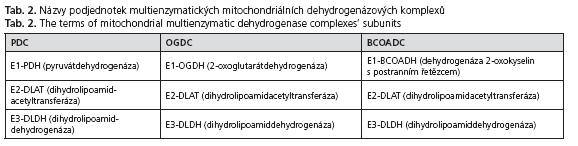
Názvy podjednotek u všech uváděných multienzymatických komplexů jsou uvedeny v tabulce 2. Na obrázku 3 je sumární schéma oxidační dekarboxylace pyruvátu. Detailnější zobrazení oxidační dekarboxylace je pak prezentováno na obrázku 4 - pro představu, v jakém místě jednotlivé enzymy působí.
Pomocí imunoblotingu je možné detekovat pět hlavních determinant, proti kterým jsou zaměřeny protilátky anti-M2 (3-7) . Většinou jde o části jmenovaných mitochondriálních multienzymatických komplexů (všechny asociují s vnitřní membránou):
1. PDC-E2 - tj. dihydrolipoamidacetyltransferáza z PDC komplexu,
2. BCOADC-E2 - tj. dihydrolipoamidacetyltransferáza z BCOADC komplexu,
3. OGDC-E2 - tj. dihydrolipoamidacetyltransferáza z OGDC komplexu,
4. dihydrolipoamiddehydrogenázu vážící protein (E3-binding protein, E3BP),
5. PDC-E1α - tj. vlastní PDH - subjednotka a (eventuálně i subjednotka β).
Tyto struktury se nacházejí ve všech mitochondriích v organismu. Přesto je atak směřován pouze proti dehydrogenázovým komplexům nacházejícím se v buňkách žlučníkového epitelu. Děje se tak zřejmě proto, že během apoptózy se tyto dehydrogenázové komplexy dostanou do cytoplazmy a tam zanikají působením tripeptidu glutathionu. Ve žlučníkovém epitelu se tyto mitochondriální proteiny dostanou též do cytoplazmy, ale zde je působení glutathionu blokováno a autoreaktivní epitopy zůstávají zachovány. Může tedy docházet k prezentaci těchto antigenních struktur a k následné tvorbě antimitochondriálních protilátek(8).
CÍLOVÉ EPITOPY PROTILÁTEK AMA TYPU M4, M8 A M9
Protilátky anti-M2 se z celého souboru AMA vyskytují nejčastěji a jsou patognomickým markerem primární biliární cirhózy. Při tomto onemocnění se mohou objevit (ovšem v menší míře) také další typy AMA - anti-M4, anti-M8 a anti-M9. I tyto další podtypy mají diagnostický význam, zejména z prognostického hlediska.
Anti-M4
Antigenní strukturou, proti které jsou zaměřeny protilátky anti-M4, je zřejmě sulfitoxidáza (enzym intermembránového prostoru) (9) . Sulfitoxidáza zabezpečuje oxidaci siřičitanu na méně toxický síran. Sumárně lze reakci zapsat následovně:
SO32- + H2O -> SO42- + 2H+ + 2e-.
V mitochondriích je siřičitan (sulfit) meziproduktem degradace aminokyseliny cysteinu. Ten se metabolizuje nejprve na pyruvát a sulfit. Pyruvát může být oxidačně dekarboxylován na PDH komplexu (tím se dostáváme opět k anti-M2 cílovým antigenním epitopům) a sulfit je právě za pomoci sulfitoxidázy oxidován na síran (sulfát). Tato degradace probíhá v intermembránovém prostoru. Vzniklé elektrony jsou pak přenášeny přes molybdenový kofaktor sulfitoxidázy a cytochrom b5 až na cytochrom c (10) . Existují však práce, které sulfitoxidázu jako anti-M4 determinantní strukturu zpochybňují(11).
Anti-M8
U anti-M8 zatím není příslušná struktura určena (asociuje s vnější membránou a mikrosomy) (12). I zde se nakonec může prokázat, že buněčná kompartmentace nepřisoudila těmto (zatím ještě neznámým) antigenním strukturám lokalizaci v mitochondriích, viz následně protilátky anti-M9 a jejich zdánlivá asociace s vnější mitochondriální membránou.
Anti-M9
U protilátek anti-M9 je pravděpodobnou determinantní strukturou glykogenfosforyláza. Jde o cytoplazmatický enzym asociující s endoplazmatickým retikulem (v kostní tkáni se sarkoplazmatickým retikulem). Funkcí enzymu je katalýza prvního kroku glykogenolýzy, tedy štěpení glykogenu. Probíhá za účasti anorganického fosfátu (Panorg) a vzniká glukózo-1-fosfát (Glc-1-P) a glykogenový zbytek je zkrácený o jednu jednotku (obr. 5).
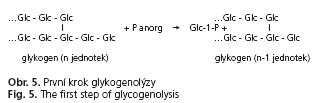
Tento enzym má tři orgánově specifické izoenzymy (jde vždy o dimery) - BB-mozkový (brain), MM-svalový (muscle) a LL-jaterní (liver). MM izoenzym se nachází v kosterním svalstvu, BB v mozku a srdečním svalu a LL v ostatních tkáních (13) . Je tedy zřejmé, že cílovou strukturou je izoenzym LL.
Pokud bychom chtěli být důslední, v tomto případě nejde vlastně ani o antimitochondriální protilátky - glykogenfosforyláza je, jak již bylo uvedeno, cytoplazmatický enzym. Mezi antimitochondriální protilátky je zařazována proto, že při degradaci buňky má tendenci rychle asociovat s vnější mitochondriální membránou(14) . Protilátky anti-M9 pak po degradaci buňky reagují s mitochondriální frakcí a jsou pak zařazovány do skupiny protilátek antimitochondriálních. Stejně jako u anti-M4 však existují práce, které glykogenfosforylázu jako anti-M9 determinantní strukturu zpochybňují(11).
VÝZNAM STANOVENÍ SUBTYPŮ PROTILÁTEK AMA PRO DIAGNOSTIKU
V diagnostice PBC má základní význam stanovení protilátek anti-M2 (jsou přítomny u cca 95 % pacientů s primární biliární cirhózou). Protilátky anti-M4 a anti-M8 se vyskytují pouze současně s anti-M2 a mají spíše prognostický význam (bývají přítomné spíše u pokročilejších stadií onemocnění). Protilátky anti-M9 se vyskytují i samostatně (bez anti-M2) a jsou prognosticky spíše příznivé (za určitých podmínek - současná přítomnost pouze anti-M2 a anti-M9 - mohou znamenat benigní průběh onemocnění). Samotné protilátky anti-M9 se vyskytují zejména v časném stadiu onemocnění. Po terapii kyselinou ursodeoxycholovou (UDCA) mohou současně s normalizací parametrů vymizet, ale po vysazení UDCA se opět objevují(15).
Přirozené AMA-NOMA
V tomto kontextu je důležité se zmínit o tzv. NOMA (Naturally Occurring Mitochondrial Antibodies), neboli přirozeně se vyskytujících AMA. Jako pro všechny přirozeně se vyskytující autoprotilátky platí i pro NOMA, že jsou produkované CD5+ B-lymfocyty (zvanými někdy B1-lymfocyty). Jsou převážně třídy IgM (ale i IgG) a mají nižší aviditu než patologické AMA. Přirozeně se vyskytující AMA mají velké množství antigenních specifit, které jsou individuálně velmi variabilní(16). Nelze pominout ani skutečnost, že při onemocnění primární biliární cirhózou dochází k znatelnému úbytku NOMA(17).
Praktická diagnostika
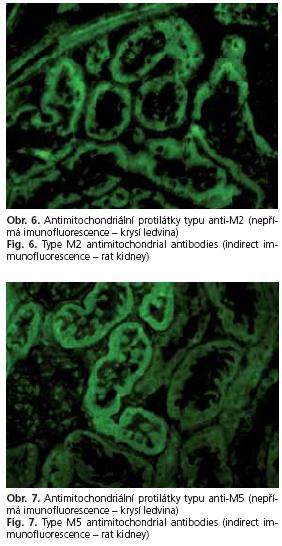
Z hlediska diagnostiky antimitochondriálních protilátek anti-M2, M4, M8 a M9 je situace poměrně přehledná. K základnímu screeningu se používá převážně metoda nepřímé imunofluorescence (jako antigenní substrát slouží nejčastěji krysí nebo opičí ledvina). Touto metodou ovšem detekujeme ze zmíněných autoprotilátek pouze typ anti-M2. Jde o tečkovitou fluorescenci mající stejnou intenzitu ve stěnách proximálních i distálních tubulů (obr. 6). Pro srovnání je uveden i imunofluorescenční nález při výskytu protilátek anti-M5 (obr. 7), objevujících se při některých systémových chorobách pojiva a při primárním i sekundárním antifosfolipidovém syndromu (fluorescence proximálních a distálních tubulů má rozdílnou intenzitu). K přesnější detekci anti-M2 protilátek jsou vhodné komerční soupravy EIA (enzymoimunoanalytické), eventuálně soupravy založené na technice Western blotingu (je záměrné použit vžitý počeštěný výraz s jedním t) nebo jeho modifikacích. Lze samozřejmě použít i další metody - fixaci komplementu, imunodifúzi, radioimunoanalytické metody, ale ty se používají spíš okrajově nebo pro speciální účely. Moderní možností je i metoda založená na inhibici enzymové aktivity(18).
K průkazu protilátek anti-M4 a anti-M8 je nejvhodnější fixace komplementu - nelze totiž použít imunobloting. Ten se naopak používá u protilátek anti-M9. V laboratorní praxi je nejčastější průkaz anti-M2 izotypu IgG jako sérologického markeru PBC pomocí enzymoimunoanalytických metod. Jako antigen se na destičkách používá většinou purifikovaný pyruvát dehydrogenázový komplex (je i komerčně dostupný). Někdy se k témuž účelu používají i firemní sety s hotovými nablotovanými proužky.
ZÁVĚR - VÝHLEDY DIAGNOSTIKY
Další vývoj spěje k tomu, že se i v menších laboratořích začne uplatňovat nejen základní screening AMA pomocí nepřímé imunofluorescence (jako tomu bylo doposud), ale také stanovení jednotlivých typů, zejména anti-M2. Ke kompletnější diagnostice mohou přispět cenově dostupné sety (bud enzymoimunoanalytické, nebo využívající techniku Western blotingu) s purifikovanými nativními, eventuálně i syntetickými antigény pro kompletní sadu AMA. Otevře se tak pole k diagnostikování antimitochondriálních protilátek podobným způsobem, jako tomu je v současnosti například u typizace protilátek proti extrahovatetným nukleárním antigenům. Vzhledem k nejasnostem okolo některých struktur (glykogenfosforyláza, sulfitoxidáza) bude ovšem nutno vyčkat dalšího pokroku v této oblasti. Postupem času může dojít i k tomu, že protilátky anti-M2, 4, 8 a 9 budou tvořit s eventuálně dalšími parametry (důležitými pro diagnostiku a prognostiku primární biliární cirhózy - např. i s individuálními NOMA parametry) určitý diagnostický celek, jehož jednotlivým komponentám bude na základě dlouhodobých zkušeností přisouzena jakási váha. Relativně jednoduchými propočty pak bude možno dojít k určitým hodnotám, které budou standardizovaným způsobem vyjadřovat parametry zmíněného onemocnění, z nichž bude možné s určitou statistickou pravděpodobností usuzovat na stav a prognózu daného pacienta. Ale teprve budoucnost ukáže, zda se dokážou tyto nebo podobné postupy prosadit i v klinické praxi.
LITERATURA
- 1. Mackay IR. Primary biliary cirrhosis showing a high titer of autoantibody; report of a case. N Engl J Med 1958; 258: 185-188.
- 2. Gershwin ME, Mackay IR, Sturgess A, Coppel RL. Identification and specificity of a cDNA encoding the 70 kd mitochondrial antigen recognized in primary biliary cirrhosis. J Immunol 1987; 138: 3525-3531.
- 3. Gershwin ME, Mackay IR, Sturgess A, et al. Identification and specificity of a cDNA encoding the 70kD mitochondrial antigen recognised in primary biliary cirrhosis. Immunol 1987; 138: 3525-3531.
- 4. Surh CD, Danner DJ, Ahmad A, et al. Reactivity of PBC sera with a human fetal liver cDNA clone of branched chain alpha keto-acid dehydrogenase dihydrolipoamide acetyltransferase, the 53kD mito-chondrial autoantigen. Hepatology 1989; 9: 63-68.
- 5. Fussey SPM, Guest JR, James OFW, et al. Identification and analysis of the major M2 autoantigens in primary biliary cirrhosis. Proc Natl Acad Sci USA 1988; 85: 8654-8658.
- 6. Surh CD, Roche TE, Danner DJ, et al. Antimitochondrial autoantibodies in primary biliary cirrhosis recognise cross-reactive epitopes on protein X and dihydrolipoamide acetyltransferase of pyruvate dehydrogenase complex. Hepatology 1989; 10: 127-133.
- 7. Fussey PM, Bassedine MF, Fittes D, et al. The El alpha and beta subunits of the pyruvate dehydrogenase complex are M2 „d" and M2 „e" autoantigens in primary biliary cirrhosis. Clin Sci 1989; 77: 365-368.
- 8. Kaplan MM, Gershwin ME. Primary Biliary Cirrhosis. N Engl J Med 2005; 353: 1261-1274.
- 9. Klein R, Berg PA. Anti-M4 antibodies in primary biliary cirrhosis react with sulphite oxidase, an enzyme of the mitochondrial inter-membrane space. Clin Exp Immunol 1991; 84: 445-448.
- 10. Crompton M, Palmieri F, Capáno M, Quagliariello E. The Transport of Sulphate and Sulphite in Rat Liver Mitochondria. Biochem J1974; 142: 127-137.
- 11. Palmer JM, Yeaman SJ, Bassendine MF, James OF. M4 and M9 autoantigens in primary biliary cirrhosis - a negative study. J Hepatol 1993; 18(2): 251-254.
- 12. Weber P, Brenner J, Stechemesser E, Klein R, Weckenmann U, Kloppel G, Kirchhof M, Fintelmann V, Berg PA. Characterization and clinical relevance of a new complement-fixing antibody anti-M8 in patients with primary biliary-cirrhosis. Hepatol 1986; 4; 553-559.
- 13. Rabitzsch G, Mair J, Leichleitner P, et al. Immunoenzymometric assay of human glycogen phospho-rylase BB in diagnosis of ischemic myocardial injury. Clin Chem 1995; 41: 966-978.
- 14. Klein R, Berg PA. Anti-M9 antibodies in sera from patients with primary biliary cirrhosis recognize an epitope of glycogen phosphorylase. Clin Exp Immunol 1990; 81(1): 65-71.
- 15. Tromm A, May B, Klein CG, Klein R, Fisseler-Eck-hoff A, Griga T. Long-term response of primary biliary cirrhosis (stage I) to therapy with ursodeoxy-cholic acid. Hepatogastroenterol 2005; 63: 753-756.
- 16. Klein R, Berg PA. Demonstration of „naturally occurring mitochondrial antibodies" in family members of patients with primary biliary cirrhosis. Hepatology 1990; 12(2): 335-341.
- 17. Baum H. Mitochondrial antigens, molecular mimicry and autoimmune disease. Biochimica et Biophysi-ca Acta 1995; 1271: 111-121.
- 18. Teoh KL, Rowley MJ, Mackay IR. An automated microassay for enzyme inhibitory effects of M2 antibodies in primary biliary cirrhosis. Liver 1991; 11:287-291.
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené