Current possibilities to predict response to targeted therapy of colorectal cancer
Ondřej Daum Orcid.org 1, Radek Šíma Orcid.org , Jana Němcová Orcid.org , Zdeněk Beneš Orcid.org 2, Michal Michal Orcid.org
+ Affiliation
Summary
SUMMARY
Daum O, Šíma R, Němcová J, Beneš Z, Michal M. Current possibilities to predict response to targeted therapy of colorectal cancer
Recently, selective inhibition of receptor tyrosinkinases was shown to be an effective tool of so-called targeted therapy of tumors. In the gastrointestinal tract, targeted therapy is mainly used for treatment of colorectal carcinoma. From the clinical point of view, one of the currently most important types of targeted therapy of colorectal cancer is administration of antibodies blocking epidermal growth factor receptor (EGFR). However, this therapy is effective only in a subset of patients, and thus recognition of patients suitable for this type of therapy is the major goal of modern diagnostics. Here we review current knowledge in molecular basis of EGFR-targeted therapy, predictive significance of mutational status of KRAS gene, and present proposed guideline recommendations for predictive diagnostics across the European Union.
Key words: cetuximab, carcinoma, colorectal, EGFR, KRAS, molecular biology, panitumumab, prediction, targeted therapy.
ÚVOD
V současné době dochází k výraznému pokroku ve vývoji terapie nádorů cílené na určité molekuly exprimované nádorovými buňkami. Vzhledem ke své vysoké incidenci je kolorektální karcinom (CRC) jednou z nejdůležitějších aplikací této terapie.
Po zjištění úlohy signální kaskády spouštěné aktivací receptoru pro epidermální růstový faktor (EGFR) v progresi kolorektálního karcinomu byly pro jeho léčbu vyvinuty monoklonální protilátky proti tomuto receptoru (anti-EGFR moAb), které by jeho zablokováním měly vést k inhibici signální cesty, a tedy i k inhibici růstu nádorových buněk. Bohužel je tato terapie účinná pouze u části pacientů, a to i v rámci populace pacientů, jejichž nádory exprimují EGFR na buněčné membráně(1). V současné době je proto nejdůležitějším úkolem moderní diagnostiky určit pacienty vhodné pro léčbu anti-EGFR moAb.
Cílem tohoto článku je podat přehled o molekulárním podkladu účinku anti-EGFR protilátek, možnostech prediktivní diagnostiky, zejména významu mutací genu KRAS, a navržených doporučeních pro mutační analýzu KRAS v zemích Evropské unie, podle nichž je prediktivní diagnostika prováděna v Bioptické laboratoři v Plzni(2).
EGFR
EGFR (Epidermal Growth Factor Receptor), synonymně též ErbB (ERythroBlastic leukemia), ErbB1, HER1 (Human Epidermal growth factor Receptor), je transmembránový receptor, který patří do receptorové rodiny HER zahrnující dále receptory HER2 (ErbB2), který hraje významnou roli v progresi karcinomu prsu, HER3 (ErbB3) a HER4 (ErbB4).
Aktivace receptoru vazbou ligandu vede ke spuštění intracelulární signální kaskády, jejímž důsledkem je ovlivnění exprese genů vedoucí, zjednodušeně řečeno, k buněčné proliferaci. Dysregulace této signální dráhy je jedním z mechanismů, kterým nádorové buňky získávají nezávislost na stimulaci růstovými faktory, což může přispívat k nádorové transformaci, proliferaci nádorových buněk a inhibici apoptózy.
Tyto poznatky vedly k vývoji látek blokujících EGFR jako slibných terapeutik pro biologickou léčbu kolorektálního karcinomu. V současné době jsou k dispozici dva druhy terapie cílené na EGFR. Jednak tyrosinkinázové inhibitory zabraňující fosforylaci intracelulární katalytické domény EGFR, mezi něž patří gefitinib a erlotinib používané zejména v terapii plicních karcinomů, jednak anti-EGFR moAb jako cetuximab a panitumumab, které se váží na extracelulární doménu EGFR, a zabraňují tak vazbě ligandu. Právě tyto protilátky jsou v současné době používány v terapii CRC.
KRAS
KRAS, synonymně též K-RAS či K-ras – produkt genu KRAS (Kirsten RAt Sarcoma viral oncogene homolog), je G-protein, který je součástí hlavní signální kaskády EGFR. Účastní se tedy přenosu signálu od aktivovaného receptoru do jádra. V aktivní formě tento G-protein tvoří komplex s GTP, který je za fyziologických podmínek v krátké době díky intrinsické GTPázové aktivitě proteinu transformován na GDP, což vede k inaktivaci tohoto komplexu. Aktivační mutace KRAS vede ke ztrátě této GTPázové aktivity, a tím pádem ke konstitutivní aktivaci proteinu nezávislé na funkčním stavu EGFR (obr. 1). Důsledkem je pak stejné ovlivnění transformace, proliferace nádorových buněk a inhibice apoptózy jako při konstitutivní aktivaci EGFR. Tato mutace se vyskytuje u více než 30 % kolorektálních karcinomů(3–5), přičemž ve více než 90 % případů je lokalizována v kodonech 12 a 13 exonu 1 genu KRAS(5).
PREDIKCE ODPOVĚDI NA TERAPII PROTILÁTKAMI PROTI EGFR
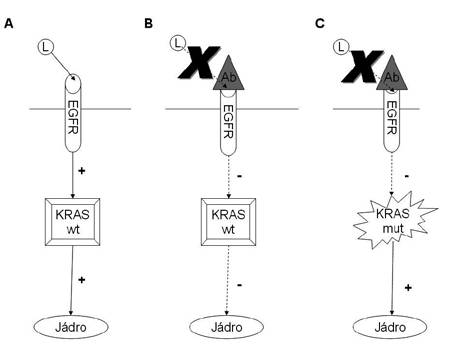
Náklady na léčbu monoklonálními protilátkami proti EGFR a možnost jejích nežádoucích účinků vyžadují zavedení diagnostického algoritmu umožňujícího selekci skupiny pacientů, kteří mohou z této terapie profitovat.
Jako zcela nevyhovující prediktivní marker se ukázala imunohistochemicky detekovaná overexprese EGFR. Klinické studie totiž prokázaly, že jen asi 8–23 % pacientů pozitivně odpovídalo na léčbu anti- EGFR moAb, a to i přes imunohistochemicky prokázanou overexpresi EGFR, jejíž výskyt v různých pracích kolísá od 30 % až do více než 82 % CRC(1,6–8). Na druhou stranu bylo zjištěno, že negativní průkaz imunoexprese EGFR nevylučuje pozitivní odpověď na léčbu cetuximabem(9,10). Je tedy zřejmé, že imunohistochemické vyšetření exprese EGFR by nemělo rozhodovat o terapii CRC. Podobně je tomu i s analýzou amplifikace EGFR metodou fluorescenční in situ hybridizace (FISH), která také nebyla shledána spolehlivým prediktivním markerem anti-EGFR terapie CRC(11). Vzhledem k tomu, že u CRC jsou mutace EGFR přítomny v méně než 1 % případů(12), není ani mutační analýza tohoto genu vhodnou metodou k predikci terapeutické odpovědi.
V současné době je za vyšetření rozhodující o léčbě inhibitory EGFR považována analýza mutací KRAS. Předpoklad, že aktivační mutace tohoto genu je příčinou selhání inhibice signální kaskády EGFR-KRASMAPK inhibitoryEGFR( obr.1), byl potvrzen několika klinickými studiemi(3,4,13–17). Ačkoli většina molekulárně genetických metod je založena na polymerázové řetězové reakci (PCR) a přímém sekvenování DNA, tento postup není zcela vhodný pro mutační analýzu KRAS u CRC, protože kvůli heterogenitě populace nádorových buněk a rozdílným detekčním prahům pro různé druhy mutací může vést k falešně negativním výsledkům. Z tohoto důvodu je přímá sekvenační analýza založená na PCR považována za nedostatečné vyšetření a pro země Evropské unie byly certifikovány dva komerční kity jako standardní diagnostické technologie pro analýzu mutací KRAS u CRC. Jde jednak o KRAS LightMix společnosti TIB Mol Biol, jednak o TheraScreen KRAS Mutation Test Kit společnosti DxS Diagnostic Innovations(2), který je používán v Bioptické laboratoři v Plzni. Toto vyšetření kombinuje technologické principy ARMS a Scorpions a detekuje mutace v podmínkách real-time PCR. Hlavní výhodou tohoto vyšetření je jeho vysoká citlivost, dokáže detekovat mutovaný klon, který tvoří pouhé 1% na pozadí nemutované DNA. Fakt, že část pacientů s nemutovaným KRAS nevykazuje pozitivní odpověď na terapii anti-EGFR moAb, obrací pozornost k dalším intracelulárním signálním molekulám, kupříkladu BRAF a PIK3C, jako dalším možným prediktivním markerům.
DOPORUČENÝ POSTUP PRO ANALÝZU MUTACÍ KRAS V ZEMÍCH EU
Podle doporučení Evropské společnosti patologů (ESP), které je výsledkem dohody dvou pracovních skupin ESP (Skupiny pro nemoci zažívacího traktu a Skupiny pro molekulární patologii) by pro biologickou léčbu CRC monoklonálními protilátkami proti EGFR mělo být vyžadováno vyšetření mutací genu KRAS. Pouze pacienti, v jejichž nádoru nebyla prokázána mutace KRAS, jsou vhodní pro tento druh terapie. Naopak, dosud vyžadované imunohistochemické vyšetření hyperexprese EGFR nemá žádný prediktivní význam a nemělo by být součástí diagnostického postupu.
Molekulárně genetické vyšetření by mělo být rutinně prováděno ihned po vstupní morfologické diagnóze u pacientů s CRC ve II. a III. stadiu dle klasifikace UICC 2002(18), tedy u těch, kteří mají alespoň pT3 anebo pN1. K analýze lze použít parafínové bloky, v nichž invazivní tumor představuje alespoň 70 % plochy vzorku. Je-li splněna tato podmínka, lze použít i materiál z endoskopické biopsie, průkaz však nelze provést v neinvazivní adenomové komponentě polypu. Není-li k dispozici vzorek primárního tumoru, je možné vyšetření provést i ve tkáni pocházející z metastatického ložiska. Samotná analýza by měla být provedena jedním ze dvou certifikovaných diagnostických kitů (KRAS LightMix společnosti TIB Mol Biol, nebo TheraScreen KRAS Mutation Test Kit společnosti DxS Diagnostic Innovations).
ZÁVĚR
Cílená biologická terapie kolorektálního karcinomu látkami blokujícími signální cestu EGFR vyžaduje racionální výběr pacientů, u kterých lze očekávat pozitivní terapeutickou odpověď. Současná doporučení pro země Evropské unie vyžadují rutinní vyšetření mutací genu KRAS u CRC ve II. a III. stadiu, provedené bezprostředně po primární morfologické diagnóze. Molekulárně genetické vyšetření materiálu z primárního nádoru nebo z metastázy by mělo být provedeno jedním z certifikovaných kitů, kterými jsou v současné době KRAS LightMix společnosti TIB Mol Biol, nebo TheraScreen KRAS Mutation Test Kit společnosti DxS Diagnostic Innovations, který je používán v Bioptické laboratoři v Plzni (bližší informace na http://www.biopticka.cz/sluzby/EGFRKRAS.html). Materiál může pocházet jak z resekátu, tak z endoskopické biopsie, každopádně však musí alespoň 70 % jeho hmoty tvořit invazivní komponenta nádoru. Pouze pacienti, v jejichž nádoru nebyla detekována mutace KRAS, jsou vhodní k terapii monoklonálními protilátkami proti EGFR.
LITERATURA
- 1. Saltz LB, Meropol NJ, Loehrer PJ, Sr., Needle MN, Kopit J, Mayer RJ. Phase II trial of cetuximab in patients with refractory colorectal cancer that expresses the epidermal growth factor receptor. J Clin Oncol 2004; 22(7): 1201–1208.
- 2. van Krieken JH, Jung A, Kirchner T, Carneiro F, Seruca R, Bosman FT, Quirke P, Flejou JF, Plato Hansen T, de Hertogh G, Jares P, Langner C, Hoefler G, Ligtenberg M, Tiniakos D, Tejpar S, Bevilacqua G, Ensari A. KRAS mutation testing for predicting response to anti–EGFR therapy for colorectal carcinoma: proposal for an European quality assurance program. Virchows Arch 2008; 453(5): 417–431.
- 3. De Roock W, Piessevaux H, De Schutter J, Janssens M, De Hertogh G, Personeni N, Biesmans B, Van Laethem JL, Peeters M, Humblet Y, Van Cutsem E, Tejpar S. KRAS wild-type state predicts survival and is associated to early radiological response in metastatic colorectal cancer treated with cetuximab. Ann Oncol 2008; 19(3): 508–515.
- 4. Lievre A, Bachet JB, Le Corre D, Boige V, Landi B, Emile JF, Cote JF, Tomasic G, Penna C, Ducreux M, Rougier P, Penault-Llorca F, Laurent-Puig P. KRAS mutation status is predictive of response to cetuximab therapy in colorectal cancer. Cancer Res 2006; 66(8): 3992–3995.
- 5. Edkins S, O‘Meara S, Parker A, Stevens C, Reis M, Jones S, Greenman C, Davies H, Dalgliesh G, Forbes S, Hunter C, Smith R, Stephens P, Goldstraw P, Nicholson A, Chan TL, Velculescu VE, Yuen ST, Leung SY, Stratton MR, Futreal PA. Recurrent KRAS codon 146 mutations in human colorectal cancer. Cancer Biol Ther 2006; 5(8): 928–932.
- 6. Cunningham D, Humblet Y, Siena S, Khayat D, Bleiberg H, Santoro A, Bets D, Mueser M, Harstrick A, Verslype C, Chau I, Van Cutsem E. Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med 2004; 351(4): 337–345.
- 7. Van Cutsem E, Peeters M, Siena S, Humblet Y, Hendlisz A, Neyns B, Canon JL, Van Laethem JL, Maurel J, Richardson G, Wolf M, Amado RG. Open-label phase III trial of panitumumab plus best supportive care compared with best supportive care alone in patients with chemotherapy–refractory metastatic colorectal cancer. J Clin Oncol 2007; 25(13): 1658–1664.
- 8. Plevova P, Sedlakova E, Papezova M, Zapletalova J, Curik R, Kolar Z, Krepelova A. Epidermal growth factor receptor expression in colorectal tumors with and without microsatellite instability. Virchows Arch 2004; 445(1): 99–100.
- 9. Chung KY, Shia J, Kemeny NE, Shah M, Schwartz GK, Tse A, Hamilton A, Pan D, Schrag D, Schwartz L, Klimstra DS, Fridman D, Kelsen DP, Saltz LB. Cetuximab shows activity in colorectal cancer patients with tumors that do not express the epidermal growth factor receptor by immunohistochemistry. J Clin Oncol 2005; 23(9): 1803–1810.
- 10. Saltz L. Epidermal growth factor receptor-negative colorectal cancer: is there truly such an entity? Clin Colorectal Cancer 2005; 5(Suppl 2): S98–S100.
- 11. Italiano A, Follana P, Caroli FX, Badetti JL, Benchimol D, Garnier G, Gugenheim J, Haudebourg J, Keslair F, Lesbats G, Lledo G, Roussel JF, Pedeutour F, Francois E. Cetuximab shows activity in colorectal cancer patients with tumors for which FISH analysis does not detect an increase in EGFR gene copy number. Ann Surg Oncol 2008; 15(2): 649–654.
- 12. Ogino S, Meyerhardt JA, Cantor M, Brahmandam M, Clark JW, Namgyal C, Kawasaki T, Kinsella K, Michelini AL, Enzinger PC, Kulke MH, Ryan DP, Loda M, Fuchs CS. Molecular alterations in tumors and response to combination chemotherapy with gefitinib for advanced colorectal cancer. Clin Cancer Res 2005; 11(18): 6650–6656.
- 13. Benvenuti S, Sartore-Bianchi A, Di Nicolantonio F, Zanon C, Moroni M, Veronese S, Siena S, Bardelli A. Oncogenic activation of the RAS/RAF signaling pathway impairs the response of metastatic colorectal cancers to anti–epidermal growth factor receptor antibody therapies. Cancer Res 2007; 67(6): 2643–2648.
- 14. Di Fiore F, Blanchard F, Charbonnier F, Le Pessot F, Lamy A, Galais MP, Bastit L, Killian A, Sesboue R, Tuech JJ, Queuniet AM, Paillot B, Sabourin JC, Michot F, Michel P, Frebourg T. Clinical relevance of KRAS mutation detection in metastatic colorectal cancer treated by Cetuximab plus chemotherapy. Br J Cancer 2007; 96(8): 1166–1169.
- 15. Lievre A, Bachet JB, Boige V, Cayre A, Le Corre D, Buc E, Ychou M, Bouche O, Landi B, Louvet C, Andre T, Bibeau F, Diebold MD, Rougier P, Ducreux M, Tomasic G, Emile JF, Penault-Llorca F, Laurent-Puig P. KRAS mutations as an independent prognostic factor in patients with advanced colorectal cancer treated with cetuximab. J Clin Oncol 2008; 26(3): 374–379.
- 16. Amado RG, Wolf M, Peeters M, Van Cutsem E, Siena S, Freeman DJ, Juan T, Sikorski R, Suggs S, Radinsky R, Patterson SD, Chang DD. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol 2008; 26(10): 1626–1634.
- 17. Baselga J, Rosen N. Determinants of RASistance to anti-epidermal growth factor receptor agents. J Clin Oncol 2008; 26(10): 1582–1584.
- 18. Sobin LH, Wittekind C. (eds.) TNM classification of malignant tumours. 6th ed. New York: Wiley-Liss 2002.
To read this article in full, please register for free on this website.
Benefits for subscribers
Benefits for logged users